Способ оказания экстренной кардиологической помощи
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способу выбора метода оказания экстренной кардиологической помощи. Способ включает определение: электрокардиосигнала (ЭКС): стандартное отклонение средних значений кардиоциклов (SDANN), отношение волн низкой и высокой частоты (LF/HF), вариабельность интервала QT (varQT) и фракции выброса (ФВ) в течение суток, с расчетом коэффициента К прогноза степени тяжести аритмического синдрома по формуле: К=-4,518+0,02ФВ+0,037SDANN+0,049LF/HF-0,019varQT. Предварительно определяют наличие или отсутствие удлинения интервала QT по выражению: (1), где R1R2 - расстояние между соседними зубцами R на ЭКС, с; k - коэффициент, равный 0,37 для мужчин, 0,39 для женщин и 0,38 для детей. Определяют значение ФВ, по крайней мере, для трех последующих кардиоциклов по выражению: (2), где КДО, КСО - конечный диастолический и систолический объем левого желудочка соответственно, определяемые по формулам: , где КДР, КСР - конечный диастолический и систолический радиус левого желудочка соответственно. Конечный диастолический размер (КДР) определяется по формуле: КДР=(44,5-100⋅tRS)⋅(tQR+tRS)-11⋅tRS, где tQR - время от начала зубца Q до вершины зубца R при отсутствии блокады левой ножки пучка Гиса, а при наличии блокады левой ножки пучка Гиса - до первой вершины раздвоенного зубца R(R1), то есть tQR=tQR1, с; tRS - время от вершины зубца R до конца зубца S - при отсутствии блокад ножек пучка Гиса, а при блокаде левой ножки пучка Гиса вместо tRS - разность временных интервалов от первой вершины раздвоенного зубца R до конца зубца S (R1 S) и от первой вершины раздвоенного зубца R до его второй вершины (R1R2), то есть ; конечный систолический размер (КСР) определяется по формуле: где tQRS - время комплекса QRS, с; tST-Т - время от конца зубца S до конца зубца Т - при отсутствии блокад ножек пучка Гиса, а при блокаде левой ножки пучка Гиса вместо tST-T используют сумму , при блокаде правой ножки пучка Гиса вместо tST-T – сумму . При всех упомянутых видах сердечного ритма осуществляют определение желудочковой тахикардии и экстрасистолии, по крайней мере, для трех последующих кардиоциклов. В случае когда выражение (1) истинно, в трех или более последующих кардиоциклах имеется желудочковая тахикардия и экстрасистолия, и ФВ<50%, что характеризует гемодинамически значимую аритмию, проводят дефибрилляцию; в случае когда выражение (1) истинно, в трех или более последующих кардиоциклах значение ФВ составляет не менее 50%, что характеризует отсутствие гемодинамически значимой аритмии, проводят реваскуляризацию; в случае когда выражение (1) ложно, определяют коэффициент К прогноза степени тяжести аритмического синдрома по вышеприведенной формуле, и если К ≥ 2,5 прогнозируют тяжелый аритмический синдром и проводят реваскуляризацию. Изобретение позволяет расширить функциональные возможности способа прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда. 8 ил.
Реферат
Предлагаемое изобретение относится к медицине и может быть использовано для определения наличия заболеваний из категории внезапной сердечной смерти (ВСС) и оказания экстренной кардиологической помощи. Изобретение служит для представления состояния сердца пациента в реальном времени по данным анализа электрокардиосигнала (ЭКС).
Известен способ диагностики травматического шока (ТШ) [1], заключающийся в том, что регистрируют ЭКС, анализируют ЭКС путем определения частоты сердечных сокращений (ЧСС) и артериального давления (АД), диагностируют наличие ТШ при АД<100 и ЧСС>100, осуществляют формирование отчета.
Недостатками данного способа являются:
- отсутствие возможности определения гемодинамически значимой аритмии (ГЗА);
- отсутствие возможности оказания медицинской/кардиологической помощи.
Известен способ прогнозирования и стратификации степени риска возникновения желудочковых нарушений ритма сердца у больных артериальной гипертонией [2], заключающийся в том, что у больных артериальной гипертонией выполняют запись сигнал-усредненной электрокардиографии высокого разрешения до и после физической нагрузки на тредмиле. Проводят оценку динамики изменений показателя продолжительности фильтрованного комплекса QRS (TotalQRS). На основании данных анализа ЭКС, до и после физической нагрузки, рассчитывают процент увеличения продолжительности фильтрованного комплекса QRS - % TotalQRS по формуле. При значении % TotalQRS больше 30% расценивают вероятность возникновения аритмии как высокую, при значениях от 20% до 29% включительно - как среднюю и при значениях меньше 20% - как низкую. Способ позволяет обеспечить повышение точности прогнозирования аритмий у больных артериальной гипертонией за счет учета динамики изменения электрической негомогенности миокарда при физической нагрузке.
Недостатками данного способа являются:
- отсутствие возможности определения ГЗА;
- невозможность прогноза при инфаркте миокарда;
- невозможность стратификации тяжести аритмического синдрома;
- недостаточная точность и необходимость проведения нагрузочной пробы;
- отсутствие возможности оказания медицинской/кардиологической помощи.
Наиболее близким к предлагаемому изобретению является способ прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда (ИМ) [3], включающий определение параметров ЭКС, таких как стандартное отклонение средних значений кардиоциклов (SDANN), отношение волн низкой и высокой частоты (LF/HF), вариабельность интервала QT(varQT) и фракции выброса (ФВ) в течение суток, расчет прогноза тяжести аритмического синдрома по формуле К=-4,518+0,02 ФВ+0,037SDANN+0,049LF/HF - 0,019 varQT, где К - прогностический коэффициент, при значении К≥1,5 прогнозируют отсутствие аритмического синдрома, при значении 1,5≥К≥2,5 прогнозируют нетяжелый аритмический синдром, при значении К≥2,5 прогнозируют тяжелый аритмический синдром.
Как следует из описания, известный способ прогнозирования степени тяжести аритмического синдрома при ИМ основан на методах электрокардиографии и эхокардиографии, с помощью которых определяют показатели электрической активности сердца и гемодинамики в течение суток. Затем анализируют полученные данные и прогнозируют тяжелый аритмический синдром.
На фигуре 1 приведена схема алгоритма, реализующего известный способ прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда.
На фигуре 2 приведено эхокардиографическое изображение сердца [15].
На фигуре 3 приведены факторы риска ВСС (а) и статистика смертности от рисков ВСС (б) [5, 9, 22, 23].
Как следует из описания, последовательность действий в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ следующая:
- регистрация ЭКС;
- анализ ЭКС;
- проведение эхокардиографии;
- определение ФВ;
- прогнозирование степени тяжести аритмии;
- формирование отчета.
Актуальность известного способа не вызывает сомнений. Пациенты, перенесшие ИМ, относятся к наиболее прогностически неблагоприятной категории, риск развития ВСС у которых при наличии желудочковых нарушений ритма повышается в несколько раз [5, 9, 22, 23]. По определению желудочковая тахикардия (ЖТ) - частый и, в основном, регулярный ритм, характеризующийся наличием на ЭКС трех или более комплексов, исходящих из:
- сократительного миокарда желудочков;
- сети Пуркинье;
- ножек пучка Гиса.
Основными диагностическими методами для выявления ЖТ являются [15]:
- ЭКГ в покое (форма, ширина комплексов, длина интервалов);
- нагрузочные тесты (индукция желудочковых нарушений ритма либо ишемических изменений миокарда в ответ на нагрузку);
- суточное мониторирование ЭКГ (наличие и характер нарушений ритма, эпизодов ишемии, колебания интервала Q-T, альтернация зубца Т, изменение сегмента ST);
- изучение вариабельности сердечного ритма, ЭКГ высокого разрешения (наличие поздних потенциалов желудочков);
- эхокардиография или позитронная эмиссионная компьютерная томография, в том числе с использованием фармакологических нагрузочных стресс-тестов (с целью выявления зон гипокинезии, гибернации, изучения размеров полостей, толщины стенок, сократимости миокарда);
- коронарная ангиография (с целью изучения характера поражения коронарных артерий);
- электрофизиологическое исследование.
Как следует из описания, в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ используются все, за исключением последних двух последних (наиболее трудоемких), вышеперечисленные диагностические способы выявления ЖТ. При этом следует отметить, что регистрация поздних желудочковых потенциалов у пациентов с постинфарктным кардиосклерозом и ФВ<40% указывает на 30-40% риск появления опасных желудочковых аритмий или внезапной смерти. Причиной развития ЖТ в 85% является ишемическое поражение миокарда. Результатом ЖТ часто являются эпизоды потери сознания, коллапсы и ИМ. Bigger J.Т. предложил прогностическую классификацию желудочковых аритмий [21];
- безопасные аритмии - любые экстрасистолы и эпизоды неустойчивой ЖТ, не вызывающие нарушений гемодинамики, у лиц без признаков органического поражения сердца;
- потенциально опасные аритмии - желудочковые аритмии, не вызывающие нарушений гемодинамики, у лиц с органическим поражением сердца;
- опасные для жизни аритмии («злокачественные аритмии») - эпизоды устойчивой ЖТ, желудочковые аритмии, сопровождающиеся нарушениями гемодинамики, или фибрилляция желудочков. У больных с опасными для жизни желудочковыми аритмиями, как правило, имеется выраженное органическое поражение сердца. К опасным для жизни аритмиям относятся:
- трепетание желудочков (тахикардия с мономорфными желудочковыми комплексами, не имеющими изолинии между сокращениями, регулярная - колебания длительности R-R не превышают 30 мс с частотой около 300 сокращений желудочков в 1 мин);
- фибрилляция желудочков - ускоренный (>300 в 1 мин) нерегулярный желудочковый ритм с комплексами различной формы, длины и амплитуды.
Для пациентов с ИБС наиболее неблагоприятным для прогноза является наличие желудочковых нарушений ритма у больных, перенесших ИМ, и у пациентов с застойной СИ (ЗСН) (ФВ ЛЖ<40%). Так, выявление политопных желудочковых экстрасистол или коротких эпизодов ЖТ у пациентов с хронической СИ (ХСН) повышает риск развития ВСС на 33-47%, подавляющее большинство всех случаев которой у данной категории больных обусловлено фатальными желудочковыми тахиаритмиями. Из них 62% составляет устойчивая ЖТ, 8% - первичная фибрилляция желудочков, 13% - приходится на долю «torsades de pointes»(«веретенообразная» ЖТ, развивающая при удлинении интервала Q-T, имеющая графику изменяющих полярность относительно изолинии комплексов QRS с неустойчивым интервалом сцепления). Учитывая, что ЖТ при ИБС ассоциирована с повышенным риском внезапной смерти, одновременной с диагностикой ЖТ и определением ее характера, проводится стратификация риска внезапной кардиальной смерти.
Таким образом, из описания известного способа следует, что последовательность действий в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ не предусматривает возможности определения гемодинамически значимой аритмии, а только прогнозирует степень тяжести ЖТ.
Также из описания известного способа следует, что последовательность действий в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ предусматривает применение суточного мониторинга для определения вариабельности QT-интервалов и стандартных отклонений средних значений длительности кардиоциклов (SDANN).
Холтерский мониторинг ЭКС с постоянной записью накладывает временные ограничения, так как приступить к обработке зарегистрированных ЭКС можно только спустя полный период мониторинга (в случае известного способа - через сутки). При этом проявляющиеся синдромы заболеваний группы ВСС будут зарегистрированы, однако их купирование будет запоздалым, и возможность благоприятного исхода для больного снижается.
По мнению авторов предлагаемого изобретения, определение вариабельности QT-интервалов (varQT) является нецелесообразным, так как varQT и стандартные отклонения средних значений длительности кардиоциклов (SDANN) являются усредненными величинами. Увеличение выборки с последующим усреднением результатов - один из наиболее действенных способов отсеивания случайной составляющей, однако при этом в разряде случайной составляющей может оказаться патологическое отклонение QT-интервалов. Усреднение при увеличении выборки приводит к снижению информативности при выявлении отклонения параметров. Покажем это. Допустим, что у человека среднего возрастает 15 до 50 лет пульс 70 ударов в минуту. Тогда за сутки в известном способе зарегистрируется около 100800 кардиоциклов и будет выборка из такого же числа QT-интервалов. Количество увеличенных QT-интервалов у больного человека составляет около 40-50 в сутки [4, 8, 10]. Это число на 4 порядка меньше, чем сама выборка, и может рассматриваться как статистическая погрешность.
Таким образом, применение суточного мониторинга для определения вариабельности QT-интервалов и стандартных отклонениях средних значений длительности кардиоциклов (SDANN) является трудоемким и нецелесообразным действием в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ.
Другой отличительной особенностью известного способа является использование эхокардиографии для определения фракции выброса. Двухмерная эхокардиография [18] - метод стационарной оценки гемодинамических параметров сердца, таких как размеры полостей сердца, толщина стенок желудочков, состояния клапанного аппарата и подклапанных структур, глобальная и локальная сократимость желудочков, фракция выброса, наличие тромбоза полостей и т.д. На фигуре 2 приведена одновременная запись двухмерного эхокардиографического изображения сердца и М-режима на уровне хорд митрального клапана, а также пример измерения конечного диастолического (КДР) и конечного систолического (КСР) размеров левого желудочка сердца [15]. Ключевыми недостатками эхокардиографии являются: необходимость наличия высококвалифицированного специалиста, от квалификации которого напрямую зависит диагностическая значимость метода; громоздкость и дороговизна необходимого оборудования; отсутствие возможности автономного анализа ЭХОКГ, что делает эхокардиографию неприменимой в автоматизированных скрининг-системах неинвазивной кардиодиагностики. Использование эхокардиографии для определения фракции выброса в известном способе прогнозирования степени тяжести аритмического синдрома при ИМ делает невозможным применение известного способа за пределами стационара.
По мнению авторов предлагаемого изобретения, оценка состояния сердца пациента в реальном времени по данным анализа ЭКС является востребованной услугой, так как риск ВСС остается одной из нерешенных проблем современного здравоохранения. Распространенность летальности от ВСС, произошедшей за пределами стационара, в Европе составляет 38 случаев на 100000 населения [22, 23]. Этому риску подвержены, как люди пожилого возраста с известными болезнями сердца, так и молодые люди, не подозревающие о наличии у них проблем со здоровьем. Отдельной категорией являются люди, подверженные риску для здоровья из-за специфики своей работы, а также спортсмены.
Для снижения рисков жизненно опасных состояний сердца требуется, во-первых, совершенствование способов диагностики состояния сердца и, во-вторых, развитие портативных систем мониторинга состояния сердца в условиях свободной активности.
Из сказанного следует, что своевременная диагностика и оказание экстренной кардиологической помощи для пациентов с заболеваниями группы ВСС имеет первостепенное значение.
Таким образом, по мнению авторов предлагаемого изобретения, недостатками известного способа прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда являются:
- отсутствие возможности определения гемодинамически значимой аритмии;
- большие временные затраты на прогнозирование степени тяжести аритмического синдрома при инфаркте миокарда;
- трудоемкость определения фракции выброса;
- невозможность использования в условиях свободной активности;
- отсутствие возможности оказания медицинской/кардиологической помощи.
Изобретение направлено на расширение функциональных возможностей известного способа прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда и устранение выявленных недостатков.
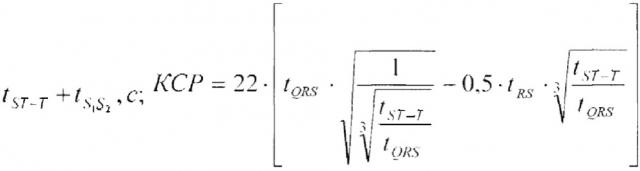
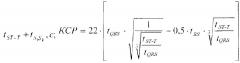
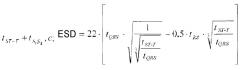
Для этого в известном способе прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда, заключающемся в том, что осуществляют определение параметров ЭКС, таких как стандартное отклонение средних значений кардиоциклов (SDANN), отношение волн низкой и высокой частоты (LF/HF), вариабельность интервала QT(varQT) и фракции выброса (ФВ) в течение суток, расчет прогноза тяжести аритмического синдрома по формуле К=-4,518+0,02 ФВ+0,031 SDANN+0,049LF/HF - 0,019 varQT, где К - прогностический коэффициент, при значении К≥1,5 прогнозируют отсутствие аритмического синдрома, при значении 1,5≥К≥2,5 прогнозируют нетяжелый аритмический синдром, при значении К≥2,5 прогнозируют тяжелый аритмический синдром, дополнительно осуществляют определение гемодинамически значимой аритмии на основании ФВ по формулам:
где RR - расстояние между соседними зубцами R на ЭКС в сек.; k - коэффициент, равный 0,37 для мужчин, 0,39 для женщин и 0,38 для детей; КДО, КСО - конечный диастолический и систолический объем левого желудочка соответственно, определяемые по формулам:
где КДР, КСР - конечный диастолический и систолический радиус левого желудочка соответственно, конечный диастолический размер (КДР) определяется по формуле:
где tQR - время от начала зубца Q до вершины зубца R при отсутствии блокады левой ножки пучка Гиса, а при наличии блокады левой ножки пучка Гиса - до первой вершины раздвоенного зубца R(R1), то есть tQR=tQR.c.; tRS - время от вершины зубца R до конца зубца S - при отсутствии блокад ножек пучка Гиса, а при блокаде левой ножки пучка Гиса вместо tRS - разность временных интервалов от первой вершины раздвоенного зубца R до конца зубца S (R1 S) и от первой вершины раздвоенного зубца R до его второй вершины (R1R2), то есть ;
конечный систолический размер (КСР) определяется по формуле:
где tQRS - время комплекса QRS, с; tST-t время от конца зубца S до конца зубца Т - при отсутствии блокад ножек пучка Гиса, а при блокаде левой ножки пучка Гиса, а при блокаде левой ножки пучка Гиса вместо tST-T - сумма и при блокаде правой ножки пучка Гиса вместо tST-T сумма и далее вычисляют при всех указанных видах сердечного ритма,
определение желудочковой тахикардии для трех последующих кардиоциклов, при значении ФВ<50% для трех последующих кардиоциклов с экстрасистолическими комплексами аритмия признается гемодинамически значимой, и проводят дефибрилляцию, при ФВ≥50% проводят реваскуляризацию.
Суть предлагаемого изобретения заключается в расширении функциональных возможностей известного способа прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда путем обеспечения возможности:
- определения гемодинамически значимой аритмии (ГЗА);
- использования в условиях свободной активности;
- оказания экстренной медицинской/кардиологической помощи.
Предвестником ГЗА служат, как врожденные, так и приобретенные формы удлинения интервала QT на ЭКС, являющиеся предикторами фатальных нарушений ритма, которые, в свою очередь, приводят к внезапной смерти больных.
Авторы считают, что одновременное выполнение двух условий:
1. установление факта удлинения интервала QT на ЭКС,
2. определение ФВ<50% для не менее трех последующих кардиоциклов с экстрасистолическими комплексами, - позволит выявить ГЗА.
Длительность интервала QT зависит от частоты сердечных сокращений и пола пациента. Поэтому используют не абсолютную, а корригированную величину интервала QT (QTc), которую рассчитывают по формуле Базетта [4, 8, 10, 19]: .
Авторами предлагается определение ГЗА осуществлять по результатам анализа ЭКС. Применение только электрокардиографического метода при определении ГЗА является отличительным признаком, позволяющим использовать предлагаемое изобретение в условиях свободной активности.
По мнению авторов предлагаемого изобретения, ГЗА - принципиальное понятие, существенно влияющее на стратегию и тактику лечения и судьбу пациента. Гемодинамическая значимость поражения сосудов сопровождается изменением важных характеристик кровотока - возрастанием или снижением скорости кровотока и дезорганизацией потока крови в зоне поражения. Понятие гемодинамической значимости применимо к любым поражениям сосудов и к любым сосудам, но используется, как правило, по отношению к артериальным стенозам. Для артериальных стенозов принято считать, что стенозы до 50% по диаметру, как правило, гемодинамически не значимые, а стенозы более 50%, как правило, гемодинамически значимые.
ГЗА становятся при пульсе более 160 и менее 40 уд/мин. Это может приводить к ишемии головного мозга и потере сознания. Клиническая картина ГЗА зависит от выраженности гемодинамических нарушений, что в свою очередь обусловлено видом аритмии и характером заболевания сердца. Мерцательная аритмия бывает тахи-, нормо- и брадисистолической формы. Наиболее часто она протекает по типу тахисистолической формы. Субъективные ощущения при ней одинаковы с другими видами пароксизмальной тахикардии (сердцебиение, одышка, быстрая утомляемость).
При ГЗА на ЭКС регистрируются отсутствие зубцов Р и наличие небольших по амплитуде волн; нерегулярность желудочных комплексов нормальной или измененной конфигурации; сопутствующая блокада ножек пучка Гиса, иногда полная атриовентрикулярная блокада (феномен Фредерика). Если в миокарде желудочков протекает какой-либо патологический процесс, это создает электрическую негомогенность мышечных клеток желудочков. Развивается механизм повторного входа волны возбуждения, то есть, если на пути проведения импульса есть какой-то блок, электрически нейтральная рубцовая ткань, например, импульсу его не удается обойти, и происходит повторная стимуляция мышечных клеток, расположенных до уровня блока. Таким образом, возникает гетеротопный очаг возбуждения в желудочках, вызывающий их внеочередное сокращение, называемое экстрасистолой.
Одним из важнейших факторов, определяющих гемодинамическую значимость стеноза, является величина системного артериального давления (АД). Очевидно, что на скорость кровотока в зоне стеноза влияет градиент давления между пре- и постстенотическим участками артерии, который, с одной стороны, зависит от силы сердечных сокращений, с другой - от величины периферического сопротивления. Кратковременное повышение системного АД приводит к существенному изменению гемодинамики в зоне стеноза в виде увеличения линейной скорости кровотока и сосудистого сопротивления.
По мнению авторов предлагаемого изобретения, введенные действия: выявление гемодинамически значимой аритмии для пациентов с заболеваниями группы ВСС, а также проведение дефибрилляции и реваскуляризации с целью оказания экстренной медицинской/кардиологической помощи в реальном масштабе времени имеют первостепенное значение для сохранения жизни пациента. При этом выявление гемодинамически значимой аритмии для пациентов с заболеваниями группы ВСС осуществляется путем анализа ЭКС. Это также является отличительной особенностью предлагаемого изобретения. Авторами предлагается для определения гемодинамических показателей использовать результаты анализа ЭКС. По мнению авторов, электрокардиографический метод сокращает трудоемкость и время по сравнению с эхокардиографическим методом при определении основных гемодинамических показателей сердца [11, 12].
Действительно, вместо суточного Холтерского мониторинга ЭКС авторами предлагается использовать суточные мониторинг ЭКС с сессионной записью, период одной сессии при этом может быть равен тридцати секундам. Другими словами, авторами предлагается так же, как и в известном способе прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда, осуществлять определение параметров ЭКС в течение суток, но в течение ограниченного промежутка времени. По мнению авторов, в течение тридцати секунд можно достоверно определить наличие гемодинамически значимой аритмии для не менее трех последующих кардиоциклов с экстрасистолами. Тридцати секундные интервалы ЭКС содержат необходимую и достаточную информацию для определения ГЗА и позволяют достоверно определить наличие ГЗА для не менее трех последующих кардиоциклов с экстрасистолами. При этом «разбиение» регистрируемого ЭКС на тридцатисекундные интервалы позволит проводить анализ ЭКС сразу по факту регистрации нового участка ЭКС, то есть в реальном масштабе времени.
На фигуре 4 приведена схема алгоритма, реализующего предлагаемый способ оказания экстренной кардиологической помощи.
На фигуре 5 приведены условия и методы оказания экстренной кардиологической помощи.
На фигуре 6 приведен пример проведения дефибрилляции пациенту с желудочковой тахикардией.
На фигуре 7 приведена иллюстрация наружной электроимпульсной терапии [15].
На фигуре 8 приведены современные методы реваскуляризации [15].
Как следует из анализа фигуры 4, предлагаемый способ оказания экстренной кардиологической помощи включает в себя следующие действия:
- регистрация ЭКС;
- анализ ЭКС;
- определение фракции выброса;
- проверка наличия гемодинамически значимой аритмии (ГЗА);
- проверка наличия трепетания желудочков;
- проведение дефибрилляции в случае обнаружения ГЗА и трепетания желудочков;
- прогнозирование степени тяжести аритмического синдрома;
- проведение реваскуляризации в случае отсутствия ГЗА;
- постановка предварительного диагноза;
- формирование отчета.
Опишем введенные действия.
Прежде всего, после регистрации и анализа параметров ЭКС, осуществляется определение ФВ электрокардиографическим методом каждые тридцать секунд. Для этого:
- по формулам (3) определяют КДО, КСО - конечный диастолический и систолический объемы левого желудочка соответственно;
- по формулам (4) и (5) определяют КДР, КСР - конечный диастолический и систолический радиусы левого желудочка соответственно;
- по формуле (2) определяют ФВ.
Затем для выявления гемодинамически значимой аритмии применяются формулы (1), (2). Порядок применения методов оказания экстренной кардиологической помощи в зависимости от результатов анализа ЭКС приведен на фигуре 5. Как следует из анализа фигуры 5, в случае когда выражение (1) истинно, а в трех или более последующих кардиоциклах отмечается снижение ФВ, определяют наличие обширной желудочковой экстрасистолиии гемодинамически значимой аритмии (см. фигуру 6). При трех и более последующих желудочковых экстрасистол наблюдается нарушение работы, приводящее к фибрилляции желудочков. Очевидно, что при этом необходимо проведение дефибрилляции.
В случае когда выражение (1) истинно, а в трех или более последующих кардиоциклах снижения ФВ не обнаружено, то диагностируют наличие гемодинамически незначимой аритмии. При этом дефибрилляция не требуется, и, согласно алгоритму, приведенному на фигуре 4, проводят реваскуляризацию.
В случае если выражение (1) ложно, осуществляют прогнозирование степени тяжести аритмического синдрома и при прогнозировании тяжелого аритмического синдрома проводят реваскуляризацию.
Таким образом, из вышесказанного и из анализа фигур 4 и 5 следует, что проведение дефибрилляции всегда осуществляется при выявлении экстрасистол в трех и более последующих кардиоциклах. При выявлении снижения ФВ в трех и более последующих кардиоциклах и отсутствии при этом экстрасистол проводится реваскуляризация.
Проведение дефибрилляции или электроимпульсной терапии (ЭИТ) при фибрилляции и трепетании желудочков заключается в нанесении дозированного электрического разряда с целью устранения тахиаритмий и восстановления нормального синусового ритма (см. фигуру 7) [15]. Применение этого метода основывается на простом принципе: разряд электрического тока возбуждает одновременно весь миокард, временно подавляя активность любого аритмогенного очага. Во время дефибрилляции происходит одномоментная деполяризация кардиомиоцитов, при этом отсутствуют подавление собственного водителя ритма сердца и препятствия физиологичному возбуждению миокарда. Синусовый узел вновь получает возможность взять под контроль проводящую систему и восстановить нормальный сердечный ритм. Для стимуляции синусового узла достаточно разряда очень небольшой величины. Ранняя дефибрилляция, по мнению многих экспертов, является наиболее важным фактором для успешного восстановления сердечной деятельности при остановке кровообращения, вызванной фибрилляцией желудочков, причем в большинстве случаев достаточно лишь одного разряда очень небольшой величины [6, 7, 20, 24]. Этот разряд безвреден для организма человека. Одним из путей решения проблемы ВСС в нашей стране является оснащение автоматическими наружными дефибрилляторами мест массового посещения с большой проходимостью и обучение персонала различных служб применению дефибрилляторов.
Наиболее часто применяется наружная или трансторакальная (от латинского «trans» - через и «torax» - грудная клетка, то есть чрезгрудная) ЭИТ[15]. При этом два электрода дефибриллятора располагаются на грудной клетке (один над областью сердца, другой - либо на передней поверхности грудной клетки, либо сзади между лопатками, см. фигуру 7). Практически всегда ликвидация тахиаритмий и восстановление синусового ритма происходит при однократном проведении ЭИТ[15].
Другим необходимым действием предлагаемого способа оказания экстренной кардиологической помощи является проведение реваскуляризации.
Проведение реваскуляризации осуществляется в соответствии с Показаниями к реваскуляризации миокарда (Российский согласительный документ) [13] и рекомендациями Европейского общества кардиологов (ESC) и Европейской ассоциации кардиоторакальных хирургов (EACTS) по реваскуляризации миокарда [14]. Последовательность применения современных методов реваскуляризации миокарда представлена на фигуре 8.
Кратко рассмотрим каждый метод, подробное описание которых приведено в [13] и [14].
1. Медикаментозная терапия
Медикаментозная терапия является неинвазивным методом реваскуляризации. Современная медикаментозная терапия весьма эффективна при устранении болевого синдрома и ишемии миокарда, при условии высокого качества препаратов и правильно подобранных дозировок.
2. Нехирургические (эндоваскулярные) методы
К нехирургическим (эндоваскулярным) методам реваскуляризации миокарда относятся тромболизис и транслюминальная баллонная ангиопластика (стентирование).
Тромболизис помогает устранить тромб и восстановить проходимость сосуда полностью. При тромболизисе применяются тромболитики - препараты, способные растворять тромбы, которые вводятся внутривенно со строго установленной скоростью.
Транслюминальная баллонная ангиопластика - это метод устранения стеноза артерии (в том числе коронарной) путем раздувания баллона внутри артерии. Стент находится на сдутом баллоне. Его можно установить сразу при раздувании стеноза (прямое стентирование) или сначала раздуть баллоном (предилятация), а потом на другом баллоне ввести стент и раздуть баллон. Тактика определяется жесткостью атеросклеротической бляшки, анатомией и другими показателями.
3. Миниинвазивная реваскуляризация миокарда
Миниинвазивная реваскуляризация миокарда состоит из:
- операции без искусственного кровообращения (ИК) через минидоступ (MIDCAB), при которых осуществляется прямое шунтирование коронарной артерии. При этом выполняют небольшую торакотомию в 5 межреберье слева от грудины (миниторакотомию), выделяют внутреннюю грудную артерию и накладывают анастомоз с ПМЖВ на работающем сердце с применением стабилизатора;
- операции без ИК через стернотомию (ОРСАВ), при которых осуществляется аортокоронарное шунтирование (АКШ). Эта операция позволяет восстановить кровоток в артериях сердца путем обхода места сужения коронарного сосуда с помощью шунтов, без применения аппарата ИК;
- операции по методу port access, при которых осуществляется минимальное вторжение без вскрытия грудной клетки. Операция заключается в том, что через небольшой прокол («порт») с помощью эндоскопа выделяют внутреннюю грудную артерию (ВГА), затем производят подключение ИК путем пункции периферических сосудов. Восходящую аорту пережимают с помощью баллона, введенного через периферическую артерию, и выполняют кардиоплегию, после чего через минидоступ производят реваскуляризацию миокарда;
- операции с видеоэпдоскопической поддержкой представляют собой операции с использованием видеоэндоскопической техникой для забора ВГА;
- полностью эндоскопическая реваскуляризация миокарда (ТЕСАВ) проводится на работающем сердце. Операция заключается в том, что через «порты» вводят эндоскоп и специальный инструментарий, в том числе министабилизатор миокарда, с помощью которого выполняют маммарокоронарный анастомоз.
4. Трансмиокардиальная лазерная реваскуляризация (ТМЛР)
Данный метод основан на улучшении кровоснабжения миокарда за счет потока крови непосредственно из полости левого желудочка и предназначен для больных с диффузным поражением коронарных артерий, которым невозможно выполнить прямую реваскуляризацию миокарда.
Трансмиокардиальная лазерная реваскуляризация осуществляется из боковой торакотомии без подключения искусственного кровообращения. В области миокарда с низким уровнем кровоснабжения наносится множество точечных каналов, через которые затем кровь поступает в ишемизированную область миокарда.
5. Терапевтический ангиогенез и клеточная терапия
Сущность этого метода заключается в генетическом воздействии на эндотелий, приводящем к его пролиферации и образованию новых сосудов. Воздействие производят путем переноса генетической информации в клетку с помощью переносчиков, в качестве которых используют некоторые вирусы и плазмидные комплексы. В клетке происходит считывание генетической информации и синтез белка, так называемых ангиогенных факторов, важнейшими из которых являются васкулоэндотелиальный фактор роста (VEGF) и фибробластный фактор роста (FGF). Ангиогенные факторы вводят непосредственно в миокард с помощью шприца при выполнении операции АКШ или ТМЛР.
6. Трансплантация сердца
Пересадка (трансплантация) сердца - комплексная операция по полной пересадке донорского сердечного органа. Основным показанием к трансплантации является терминальная фаза сердечной недостаточности при прямой угрозе жизни больного. В настоящее время уровень развития кардиохирургии и кардиореанимации позволяет получать положительный исход операций по пересадке сердца более чем в 70% случаев.
В результате выполнения указанных действий в предложенном способе расширяются функциональные возможности известного способа прогнозирования степени тяжести аритмического синдрома при инфаркте миокарда за счет:
- определения ГЗА;
- использования в условиях свободной активности;
- оказания экстренной медицинской/кардиологической помощи.
Технико-экономический эффект предложенного способа заключается в оказании на догоспитальном этапе экстренной кардиологической помощи в экстремальных ситуациях при наступлении ВСС.
Список использованных источников
1. Патент 2547783 РФ. Способ диагностики травматического шока / О.Н. Бодин, Л.Ю. Кривоногов, Ф.К. Рахматуллов, М.А. Петровский, А.Г. Иванчуков, Ю.В. Михайличенко // Заявл. 16.07.2013; опубл. 10.04.2015. Бюл. №10.
2. Патент 2454171 РФ. Способ прогнозирования и стратификации степени риска возникновения желудочковых нарушений ритма сердца у больных артериальной гипертонией / Рузов В.И., Гимаев Р.Х., Крестьянинов М.В., Халаф X., Рябова Л.Г., Машин Е.В., Скворцов Д.Ю. // Заявл. 03.12.2010; опубл. 27.06.2012. Бюл. №17.
3. Патент 2518133 РФ. Способ прогнозирования тяжести аритмического синдрома при инфаркте миокарда / Логачева И.В., С.Б. Пономарев, Баранцева Н.Г. //Заявл. 14.08.2012; опубл. 10.06.2014. Бюл. №16.
4. Бокерия Л.А. Синдром удлиненного интервала QT - клиника, диагностика, лечение / Л.А. Бокерия, А.Ш. Ревишвили, И.В. Проничева // Анналы аритмологии. - 2005. - Т. 2, №4. - С. 7-17.
5. Бокерия О.Л. Внезапная сердечная смерть и ишемическая болезнь сердца / О.Л. Бокерия, М.Б. Биниашвили // Анналы аритмологии. - 2013. - Т. 10, №2. - С. 69-79.
6. Бокерия О.Л. Автоматические наружные дефибрилляторы / О.Л. Бокерия, Р.З. Какиашвили // Анналы аритмологии. - 2013. - Т. 10, №1. - С. 23-30.
7. Горбунов Б.Б. Метод характеристической энергии для сравнения эффективности монополярных импульсов дефибрилляции / Б.Б. Горбунов // Медицинская техника. - 2009. - №2 (254). - С. 8-13.
8. Долгий QT / Т.Ю. Афанасьева, Ю.В. Ослопова, Ю.Э. Терегулов, В.Н. Ослопов. // Монография - Казань: ИД «МеДДоК», 2013. - 208 с.
9. Осипов А.И. Внезапная сердечная смерть (причины и профилактика) / А.И. Осипов, В.Ф. Байтингер, А.А. Сотников. - Томск, 2004. - 114 с.
10. Пархоменко А.Н. Анализ дисперсии и вариабельности интервала QT ЭКГ: возможности практического применения / А.Н. Пархоменко // Кардиология. - 2001. - №7. - С. 89-93.
11. Патент 2107457 РФ. Способ определения основных функциональных показателей миогемодинамики левого желудочка сердца/ М.Ю. Сафонов // Заявл. 15.04.1997; опубл. 27.03.1998. Бюл. №9.
12. Патент 2264786 РФ. Способ определения основных показателей миогемодинамики сердца / О.Н. Бодин, И.П. Бурукина, А.А. Митин, В.В. Огоньков, А.Н. Митрошин, Л.А. Бондаренко, Л.Е. Рудакова // Заявл. 19.04.2004; опубл. 27.11.2005, Бюл. №33.
13. Показания к реваскуляризации миокарда (Российский согласительный документ). - М: НЦССХ им. А. Н. БакулеваРАМН, 2011. - 162 с.
14. Рекомендации ESC/EACTS по реваскуляризации миокарда 2014 / Российский кардиологический журнал. - 2015. - №2 (118). - С. 5-81.
15. Руководство по кардиологии: Учебное пособие в 3 тт. для вузов / Под ред. Г.И. Сторожакова, А.А. Горбаченкова // М.: ГЭОТАР-Медиа. 2008, - Т. 1. - 672 с.
16. Хирургическое лечение аритмии сердца. /http://heal-cardio.ru/2015/01/20/hirurgicheskoe-lechenie-aritmii-serdca-2/
17. Чазов Е.И. Руководство по нарушениям ритма сердца / Е.И. Чазов, С.П. Голицын // М: ГЭОТАР-Медиа, 2010. – С. 195-206.
18. Шиллер Нелсон Б., Осипов М.А. Клиническая эхокардиография. 2-е изд., М.: Практика, 2005, 344 с.
19. Bazett НС. «An analysis of the time-relations of electrocardiograms». Heart (7): 1920. P. 353-370.
20. Berdowski J., Blom M.T., Bardai A. et al. Impact of onsite or dispatched automated external defibrillator use on survival after out of hospital car