Способ получения растительного лектина ml1 из омелы белой и фармацевтическая композиция на его основе (варианты).
Иллюстрации
Показать всеИзобретения относятся к получению биологически активных препаратов. Предложены способ выделения белка ML1 из омелы белой и фармацевтическая композиция (варианты). Способ предусматривает экстракцию белка из сухих листьев омелы белой в 0,25М растворе NaCl, проведение трех этапов очистки, включая аффинную хроматографию с лактозил-содержащим сорбентом и ионно-обменную хроматографию с катионообменной смолой типа monoS, и концентрирование до 2 мг/мл на мембране с размерами пор от 10 до 30 кДА. Композиция содержит 0,04-0,15 мг/мл белка ML1 и водный изотонический солевой раствор или 0,1-10 мкг/мл белка ML1, 0,1-1 мг/мл ферромагнитных наночастиц и водный изотонический солевой раствор. Изобретения обеспечивают получение лектина ML1 из омелы белой с чистотой не менее 95% и фармацевтической композиции на его основе, обладающей иммуностимулирующим, противоопухолевым действием и стабильностью в течение 2,5 года. 3 н. и 5 з.п. ф-лы, 5 ил., 4 табл., 2 пр.
Реферат
Область техники
Изобретение относится к фармацевтике и касается способа выделения (получения) растительного лектина вискумин (mestletoe lectin I, MLI) из омелы белой (VISCUM ALBUM), а также фармацевтической композиции на его основе, обладающей противоопухолевым и иммуномодулирующим действием.
Уровень техники
Злокачественные опухоли относятся к одним из наиболее тяжелых заболеваний, являются одной из основных причин смерти человека. Ежегодно регистрируется не менее 10 миллионов случаев заболеваний такого рода, значительная часть которых приводит к смерти. Учитывая высокий уровень смертности от онкологических заболеваний (по данным ВОЗ, свыше 7,5 млн. человек в год, что составляет более 13% всех случаев смерти), а также ежегодный прирост заболеваемости, увеличивается потребность в разработке эффективных противораковых препаратов и диагностических средств нового поколения. Накопленные к настоящему времени знания о механизмах злокачественной трансформации, функционировании и молекулярном составе клеток, претерпевших такую трансформацию, а также определенные успехи в исследовании онкомаркеров - молекул, позволяющих различить нормальные и опухолевые клетки, - формируют прочную теоретическую базу для создания агентов, способных к селективному воздействию на раковые клетки.
Экстракты омелы белой на протяжении многих столетий используются в терапевтических целях. С начала этого столетия препараты омелы белой, с тем или иным успехом применяющиеся в терапии рака (, Kaveri S.V. (ed.). Mistletoe: From Mythology to Evidence-Based Medicine. 2015), смогли показать терапевтические эффекты при использовании, в частности, так называемых лектинов омелы белой (вискумин, агглютинин Viscum album, VAA). В настоящее время помимо их цитотоксического действия обсуждается, в частности, неспецифическая стимуляция иммунного ответа, положительные эффекты которого используют для сопутствующей терапии и для долечивания больных с опухолями (, Kaveri S.V. (ed.). Mistletoe: From Mythology to Evidence-Based Medicine. 2015).
В качестве активного начала экстракта омелы белой в настоящее время рассматривают протеин лектина омелы белой (ML) массой 63 кДа, который может быть получен биохимическим путем из экстрактов (Franz Н. Viscaceae lectins. // Advances in lectin research (Franz H., ed.), Berlin, VEB, Verlag volk und Gesundheit, 2, 28-59.). Белок ML состоит из двух ковалентно соединенных дисульфидным мостиком субъединиц, чья А-цепь ответственна за ферментативную инактивацию рибосом, а В-цепь ответственна за связывание углеводов. Биологическая активность согласно известным к настоящему времени данным сводится в основном к лектиновой активности В-цепи.
Гетерогенность растительных препаратов лектина омелы белой является среди прочего результатом посттрансляционной обработки MLI в изоформы MLII и MLIII, так что в препаратах ML в зависимости от методики выделения или продолжительности ферментации обнаруживают разное содержание MLI, MLII и MLIII, которые отличаются по специфичности углеводо связывающего фрагмента (Schumacher U., Pfuller U. From Berlin and Witten to Southampton and Hamburg: 25 Years of Mistletoe Research Cooperation // Mistletoe: From Mythology to Evidence-Based Medicine. - Karger Publishers. 2015. Vol. 4. P. 39-47.).
Доля MLI в составе экстракта омелы белой, как правило, наиболее высока, кроме того этот лектин имеет наибольшую биологическую активность, которая приписывается его способности связывать и активировать лимфоциты, а потому считается наиболее ценным компонентом экстракта и представляет наибольший терапевтический интерес [Urech K., Baumgartner S. Chemical Constituents of Viscum album L.: Implications for the Pharmaceutical Preparation of Mistletoe. // , Kaveri SV (eds): Mistletoe: From Mythology to Evidence-Based Medicine. Transl. Res. Biomed. Basel, Karger, 2015, Vol 4, P. 11-23].
Также в экстракте находятся MLII и MLIII - другие изоформы токсических лектинов. MLI, MLII и MLIII различаются между собой по молекулярной массе, а также углеводной специфичности. MLI специфичен по отношению к галактозе, MLIII - к N-ацетилгалактозамину, а MLII имеет одинаковую аффинность к обоим сахарам. Применение экстрактов омелы в качестве дополнительных препаратов при лечении рака существенно снижает побочное действие химиотерапии.
В настоящее время экстракты омелы белой довольно широко применяются в таких странах Западной Европы, как Швейцария, Германия, Франция, Австрия. Большинство проводимых клинических исследований эффективности экстрактов омелы белой проводятся на фоне текущего лечения пациентов, т.е. в качестве средства дополнительной лекарственной терапии. Это осложняет получение выводов об противоопухолевой эффективности именно экстрактов омелы белой. Тем не менее в качестве показателей эффективности экстрактов омелы белой отмечаются увеличение продолжительности и качества жизни онкологических больных, улучшение переносимости стандартного конвенциального лечения (, Kaveri S. V. (ed.). Mistletoe: From Mythology to Evidence-Based Medicine. 2015). Проведение исследований и оценка полученных результатов осложняются невозможностью стандартизации экстрактов, поскольку последние представляют собой комплексные многокомпонентные смеси, в состав которых входит множество различных веществ, обладающих фармакологической активностью (Urech K., Baumgartner S. Chemical Constituents of Viscum album L.: Implications for the Pharmaceutical Preparation of Mistletoe. // , Kaveri SV (eds): Mistletoe: From Mythology to Evidence-Based Medicine. Transl. Res. Biomed. Basel, Karger, 2015, Vol 4, P. 11-23).
В последние годы основное внимание уделялось исследованию препарата на основе рекомбинантного аналога MLI (препарат Авискумин), благодаря которому могла быть решена проблема стандартизации лекарственных препаратов. Было показано, что рекомбинантный MLI обладает теми же биологическими свойствами, что и природный MLI, содержащийся в экстрактах омелы белой. Это позволило начать клинические испытания Авискумина (Bergmann L., Aamdal S., Marreand S. et al. Phase I trial of rviscumin (INN:aviscumine) given subcutaneously in patients with advanced cancer: a study of the European organisation for Research and Treatment of cancer (EORTC protocol number 13001) // Europ. J. Cancer. - 2009. - Vol. 44. - P. 1657-1662). Однако, у рекомбинантного MLI отсутствуют пострансляционные модификации, характерные для природного белка, что влияет на стабильность белковой молекулы. Отсутствие гликозилированных фрагментов также может негативно сказываться на иммуномодулирующих свойствах MLI. При этом препараты, полученные на основе рекомбинантного вискумина, обладают сроком хранения порядка 1,5 года, что свидетельствует о недостаточной стабильности используемого активного компонента.
Препараты омелы ранее использовались для внутреннего или парентерального применения в различных формах (в виде чая, порошка, капель, инъекций), в основном водных или спиртовых экстрактов, или соков. Однако применение таких форм вызывало множество проблем. Известно, что парентеральное использование препаратов, даже если они имеют существенные иммуностимулирующее и противоопухолевые эффекты, вызывало много нежелательных побочных эффектов и общих аллергических реакции, таких как озноб, высокая температура, головная боль, одышка и др. Кроме того, оральное использование препаратов вызывало скачки давления, головокружение, сужение коронарных сосудов, сердечных аритмий.
При выделении из растительного источника при существующем уровне техники, как правило, получают гетерогенную смесь веществ. Гетерогенность растительных препаратов лектина омелы белой является среди прочего результатом посттрансляционной обработки MLI в изоформы MLII и MLIII, так что в препаратах ML в зависимости от методики выделения или продолжительности ферментации обнаруживают разное содержание MLI, MLII и MLIII.
Из уровня техники известен способ получения вискумина раскрытый в охранном документе DE 4221836. Для выделения галактозил-специфичного лектина (MLI), сушеные листья омелы замачивают на ночь в фосфатном буфере, далее полученную взвесь перемешивают и центрифугируют. После центрифугирования из надосадочной жидкости выделяют лектин путем аффинной хроматографии на лактозил-Sepharose. После прохождения полученный лектин промывают несколько раз. После хроматографии раствор концентрируют с помощью ультрафильтрации. В результате такого способа выделения получают смесь лектинов MLI, MLII и MLIII с преимущественным содержанием MLI (85-90%). Недостатком данного способа является то, что получают лектин MLI из омелы белой с чистотой не более 90%.
Из охранного документа DE 4229876 известно выделение лектинов омелы из растительного сырья путем гомогенизации свежих или высушенных измельченных частей омелы с дистиллированной водой, перемешивании, фильтрации и подкислении полученного экстракта уксусной кислотой. После центрифугирования надосадочную жидкость помещают на подходящую катионообменную колонку, предпочтительно SP-Sephadex. Недостатком данного способа является то, что для экстрагирования лектинов используют агрессивные растворы.
В охранном документе WO 9600239 раскрыто выделение лектина MLI из омелы путем измельчения свежесобранных растений омелы и перемешивании с дистиллированной водой. Водную суспензию фильтруют и доводят pH раствора до <7 добавлением уксусной кислоты. Полученную суспензию центрифугируют, надосадочную жидкость пропускают через катионообменную колонку SP-Sephadex. Собранные фракции промывают буферным раствором. Недостатком данного способа является то, что использование свежесобранного сырья ограничивает применение способа во времени, а также ограничен доступ сырья.
Наиболее близким по совокупности существенных признаков к разработанному способу является способ, раскрытый в документе WO 9711967, который заключается в получении водного экстракта омелы белой, содержащего лектины омелы в соотношении MLI:MLII:MLIII от 0,1-90:90-0.1:0-3, согласно которому все части растения вымачиваются в холодном водном растворе, предпочтительно изотоническом солевом растворе или фосфатном буферном растворе, затем смесь фильтруют, белки из фильтрата высаливают сульфатом аммония, фильтрацию повторяют до удаления низкомолекулярных компонентов, имеющих молекулярную массу менее чем на 1 кД, и экстракт дополнительно разбавляют водой. С целью стандартизации соотношения содержания изомеров лектина в составе, их содержание дополнительно корректируют путем добавления чистых веществ. Недостатком указанного способа является то, что получаемый состав экстракта не однороден по составу и требует корректировки за счет добавления чистых веществ. Полученный состав включает изоформы лектинов омелы, имеющие разную специфичность, а также различный механизм присоединения к клеткам опухоли. Кроме того, содержание полученного лектина MLI из омелы белой составляет не более 90%.
Таким образом, остается актуальным разработка способа производства такого препарата омелы, который оказывал бы значительное иммуностимулирующее и противоопухолевое действие и не вызывал нежелательных побочных эффектов.
С целью подробного исследования терапевтического действия лектина омелы белой MLI представляется необходимым получить его в чистом виде для его использования в качестве активной составной части лекарственных средств при промышленном получении последних.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа получения лектина MLI из омелы белой с чистотой не менее 95% и фармацевтической композиции на его основе.
Поставленная задача решается заявляемым способом выделения белка MLI (mistletoe lectin I) из омелы белой (Viscum album), включающим:
- получение мелкодисперсной суспензии из сухих листьев омелы белой в 0,25 М растворе NaCl, взятом в количестве, достаточном для экстрагирования,
- проведение первого этапа очистки суспензии от примесей, не относящихся к группе белков ML, посредством введения в суспензию сульфата аммония из расчета 60-80 г на 100 мл экстракта, выдерживание полученной суспензии для осаждения растительных белков, включая группу белков ML (с содержанием не менее 95% MLI по белку), с последующим отделением образовавшегося осадка;
- растворение полученного осадка в растворе NaCl, который берут в количестве, достаточном для полного растворения осадка;
- проведение второго этапа очистки для выделения белков группы ML из полученного раствора растительных белков, посредством аффинной хроматографии с использованием в качестве буфера 0,25 М раствора NaCl;
- проведение третьего этапа очистки для выделения белка MLI из раствора смеси белков группы ML с использованием ионно-обменной хроматографии, при этом в качестве сорбента используют катионообменную смолу типа monoS с размером частиц сорбента не более 10 мкм;
- перевод полученной фракции очищенного MLI в фосфатно-солевой буфер с физиологическим значением pH и изотоническим составом с помощью диализа, используя диализные мембраны Slide-A-Lyzer™ Dialysis Cassettes (Thermo Fisher) с отсечкой по молекулярной массе 10-20 кДа или аналоги, или гель-фильтрацией, используя колонку HiTrap Desalting Column (GE Helthcare).
Предпочтительно, проводить выдерживание (инкубацию) суспензии на первом этапе очистки не менее 16 ч.
Поставленная задача также решается способом получения концентрата белка MLI, включающим концентрирование раствора белка MLI, полученного вышеописанным способом до величины 2 мг/мл с допустимой величиной отклонения до 20%. Для этой цели используют концентрирующие системы, включая такие, как Amicon® Ultra производства Millipore с мембраной с низкой сорбирующей способностью (размер пор фильтрующей мембраны от 10 до 30 кДа).
Также поставленная задача решается фармацевтической композицией для инъекционного введения, включающей активный компонент и буфер, где в качестве активного компонента использован лектин MLI, полученный вышеуказанным способом, в качестве буфера - водный изотонический солевой раствор с физиологическим pH, при этом содержание растительного лектина вискумин (MLI) в 1 мл раствора составляет 0,04-0,15 мг.
Предпочтительно, когда фармацевтическая композиция дополнительно содержит вспомогательные вещества (добавки), например, для стабилизации белка, уменьшения сорбции белка, такие как гидрохлорида пиридоксин, и борной кислоты (1-2% вес.), сахара, полиольные спирты, аминокислоты и их производные, поверхностно-активных веществ, например Твин-80 и др., в общепринятом количестве (предпочтительно, чтобы общее количество добавок по массе составляло не более 10% от массы раствора с активным компонентом). При этом для получения водного изотонического солевого раствора используют кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Поставленная задача также решается фармацевтической композицией для инъекционного введения, включающей буфер и активный компонент, где в качестве активного компонента использован концентрат лектин MLI, полученный описанным ранее способом, конъюгированный с ферромагнитными наночастицами (ФНЧ), в качестве буфера - водный изотонический солевой раствор с физиологическим pH, при этом содержание растительного лектина вискумин (MLI) в 1 мл раствора составляет 0,1-10 мкг, ферромагнитных наночастиц - 0,1-1 мг.
Техническим результатом заявленной группы изобретений является то, что разработанный способ выделения позволяет получить лектин MLI с чистотой не менее 95% (примесь изоформ MLII и MLIII - не более 5%), при этом полученная фармацевтическая композиция обладает стабильностью по меньшей мере в течение 2,5 года. Кроме того, применение фармацевтической композиции, содержащей конъюгат растительного лектина и ферромагнитных частиц, позволяет увеличить время нахождения вискумина в ткани без увеличения дозы вводимого препарата, что приводит к снижению побочных эффектов.
Краткое описание чертежей
На фиг. 1 представлены примеры типичных электрофореграмм, полученных при подтверждении заявленного технического результата, касательно чистоты препарата лектина ML, полученного заявленным способом, не менее 95%.
На фиг. 2 представлены результаты анализ препарата лектина MLI, полученного заявленным способом, масс-спектрометрическим методом (MALDI).
На фиг. 3 приведены гистограммы, демонстрирующие изменение экспрессии генов, вовлеченные в реакцию клетки на увеличение количества несвернутых белков в ER, в результате воздействия MLI в концентрациях 1⋅10-7 М (черный), 1⋅10-9 М (серый), 1⋅10-11 M (белый) на клетки CaCo2 и Molt4.
На фиг. 4 представлен график выживаемости B-клеточных лимфом мыши MLA G3 и MLB Н8 при различных концентрациях MLI и конъюгата ФНЧ-MLI. Результаты обработки клеток эквивалентными количествами контрольного препарата ФНЧ свидетельствовали об отсутствии влияния ФНЧ на жизнеспособность клеток в исследуемых количествах конъюгата ФНЧ-MLI.
На фиг. 5 показана динамика изменения отношения интенсивности МРТ сигнала в опухолях к сигналу в мышце при внутриопухолевом введении препаратов, содержащих контрольный препарат ферромагнитных наночастиц (ФНЧ) и ферромагнитных наночастиц, конъюгированных с MLI (ФНЧ- MLI).
Осуществление изобретения
Противоопухолевое действие вискумина обусловлено как его цитотоксическими свойствами, так и способностью неспецифически активировать иммунную систему. Предполагаемый механизм включает непосредственное взаимодействие вискумина с NK-клетками и макрофагами, локализованными в верхних слоях кожи в области введения препарата, приводя к их активации. Активация проявляется в виде индукции цитокинов, а также в изменении профиля экспрессии поверхностных рецепторов клеток. Активированные клетки иммунной системы характеризуются более высоким лизирующим потенциалом и способны преодолевать барьеры, экранирующие опухолевые клетки от иммунной системы.
В отличие от ранее полученных экстрактов омелы белой, разработанный способ позволяет получить высокоочищенный растительный лектин вискумин, содержащий все естественные природные модификации.
Выделение белка ML1 (mistletoe lectin I) из омелы белой (Viscum album), осуществляют в следующей последовательности.
Сначала высушенные листья омелы белой измельчают до пудрообразного состояния, после чего заливают 0,25 М раствором NaCl, взятом в количестве, достаточном для эффективного экстрагирования. При этом, как правило, это количество может варьироваться в пределах от 400 мл до 1 л на 50 г измельченных листьев омелы белой.
Затем полученную мелкодисперсную суспензию из сухих листьев омелы очищают в несколько этапов с получением концентрата лектина ML1 с содержанием не менее 95%.
На первом этапе проводят очистку суспензии от примесей, не относящихся к группе белков ML, посредством введения в суспензию сульфата аммония из расчета 60-80 г на 100 мл экстракта, выдерживание полученной суспензии для осаждения растительных белков, включающих группу белков ML, с последующим отделением образовавшегося осадка. При этом суспензию, как правило, выдерживают не менее 16 ч. А отделение образовавшегося осадка осуществляют известными методами, например, центрифугированием в течение 20-30 мин при 4500-5500 g.
Полученный осадок затем растворяют в растворе 0,5 М NaCl, который берут в количестве, достаточном для полного растворения осадка, например 30-40 мл на 50 г исходных сухих измельченных листьев.
На втором этапе очистки производят выделение белков группы ML из полученного раствора растительных белков, посредством аффинной хроматографии с использованием в качестве буфера 0,25 М раствора NaCl. При этом аффинная хроматография может проводиться может проводиться с использованием лактозил-содержащего сорбента, например лактозил-Sepharose 4 В или α-Lactose-Agarose (Sigma).
На третьем этапе очистки осуществляют выделение белка MLI из раствора смеси белков группы ML с использованием ионно-обменной хроматографии, при этом в качестве сорбента используют катионообменную смолу типа monoS с размером частицсорбента не более 10 мкм. Ионнообменную хроматографию проводят в 15 мМ нитратном буфере при pH 4,0-5,0, целевой белок элюируют в градиенте концентрации от 250 до 500 мМ NaCl. Катионообменная смола типа monoS может быть использована, например, марки Mono S 5/50 GL (GE Healthcare). После проведения третьего этапа очистки концентрация полученного белка (активного компонента) составляет 0,5-2 мг/мл.
Полученную на третьем этапе фракцию очищенного белка MLI переводят в фосфатно-солевой буфер с физиологическим значением pH и изотоническим составом с помощью диализа, используя, например, диализные мембраны типа Slide-A-Lyzer™ Dialysis Cassettes (Thermo Fisher) с отсечкой по молекулярной массе 10-20 кДа. Возможен также вариант применения гель-фильтрации с использованием колонки, например, типа HiTrap Desalting Column (GE Helthcare). Концентрация полученного белка (активного компонента) после введения фосфатно-солевого буфера составляет 0,25-1,5 мг/мл.
Таким образом, полученный заявляемым способом продукт с данной концентрацией (0,25-1,5 мг/мл) может быть использован для терапевтических целей (в качестве противоопухолевого и иммуномодулирующего средства), при этом для инъекционного введения средства пациенту рекомендуется его разведение фосфатно-солевым буфером с физиологическим значением pH и изотоническим составом до значений концентрации активного компонента - 200-800 нг/мл.
При этом фармацевтическим компаниям рекомендуется производство фармацевтической композиции с содержанием активного компонента MLI 0,04-0,15 мг на 1 мл раствора. Для получения водного изотонического солевого раствора могут быть использованы кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Кроме того, фармацевтическая композиция может дополнительно содержать вспомогательные вещества для стабилизации белка, уменьшения сорбции белка и т.д.
Кроме того, для обеспечения пролонгированного действия активного компонента в опухоли фармацевтическая композиция для инъекционного введения может содержать лектин MLI, конъюгированный с ферромагнитными наночастицами с содержанием в 1 мл раствора растительного лектина MLI от 0,1 до 10 мкг, ферромагнитных наночастиц - от 0,1 до 1,0 мг. Способ конъюгирования MLI с ферромагнитными наночастицами представлен в работе (Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека A172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12/ P. 797-801). В процессе получения конъюгата MLI-ФНЧ используют белок MLI с концентрацией 1,6 - 2,4 мг/мл. Для этой цели раствор белка концентрируют с использованием концентрирующей системы с мембраной с низкой сорбирующей способностью, характеризующейся размером пор от 10 до 30 кДа.
Лекарственное средство на основе вискумина может быть использовано для терапии пациентов с метастазирующим или местно распространенным колоректальным раком в качестве самостоятельного средства при невозможности проведения химиотерапии.
Добавление стабилизирующих веществ в растворы белков является наиболее простым способом сохранения их активности. В качестве стабилизирующих добавок могут быть использованы растворы гидрохлорида пиридоксина (5-10% вес.) и борной кислоты (1-2% вес.) (RU 2020154, 1991), сахара, полиольные спирты, аминокислоты и их производные (EP 0821058, 2002), поверхностно-активные вещества, например Твин-80. При этом для получения водного изотонического солевого раствора используют кристаллогидраты натрия гидрофосфат, натрия дигидрофосфат, калия гидрофосфат, калия дигидрофосфат, а также натрия хлорид.
Ниже приведены примеры конкретной реализации изобретения, подробно описывающие каждый этап заявляемого способа, которые иллюстрируют, но не ограничивают объем притязаний.
Выделение вискумина - растительного лектина MLI из сухих листьев омелы белой (Viscum album)
Из 100 г сухих листьев было получено ~14 мг смеси лектинов (MLI, MLII, MLIII) при этом были осуществлены следующие шаги:
1) Для получения 100 г высушенных листьев листья были отделены от веток, которые затем измельчили до порошкообразного состояния. Полученный порошок из листьев омелы белой заливали 800 мл 0,5 М раствора NaCl и перемешивали в течение 1 часа при комнатной температуре, затем в течение 48 часов при 4°C.
2) Полученную суспензию профильтровали через марлю (удобнее под вакуумом). Объем суспензии после фильтрации составил 650-700 мл.
3) Фильтрат центрифугировали при 10000 g в течение 20 мин. Супернатант перенесли в отдельную пробирку, осадок выбросили. Повторили процедуру еще два раза. Суммарный объем супернатанта после трех раундов центрифугирования составил 550-600 мл.
4) Полученную суспензию профильтровали через 0,45 мкм. Объем фильтрата составил примерно 550 мл.
5) Проводили первую стадию очистки целевого белка. К фильтрату (примерно 550 мл) по порциям при перемешивании добавляли твердый сульфат аммония (60 г на 100 мл экстракта). Перемешивали смесь в течение 16 часов при комнатной температуре, затем инкубировали 1 час при комнатной температуре без перемешивания.
6) Суспензию центрифугировали в течение 20 мин при 5000 g. Осторожно сливали надосадочную жидкость (примерно 420 мл). Осадок растворяли в минимальном объеме 0,5 М раствора NaCl (примерно ~60-70 мл). Дважды центрифугировали смесь при 5000 rpm в течение 20 мин для удаления не растворившегося осадка. Объем супернатанта после центрифугирования составлял примерно 60 мл.
7) Профильтровали супернатант через фильтр 0,45 мкм с мембраной, не связывающей вискумин (тип мембраны PVDF или PES). Объем фильтрата составил примерно 60 мл.
8) Для проведения второй стадии очистки целевого белка была подготовлена аффинная колонка (лактозил-Sepharose 4B, связывающая способность не менее 6 мг/мл) объемом на 50 мл (объем смолы 10 мл), которую набивали сорбентом, и промывали 15 объемами раствора 0,5 М NaCl.
9) Весь объем прозрачного супернатанта (около 60 мл) наносили на подготовленную аффинную колонку, после чего собирали проскок, содержащий не связавшиеся белки.
10) Промывали колонку 10 объемами раствора 0,25 М NaCl, сохраняли аликвоту образца для анализа.
11) Промывали колонку 10 объемами раствора 0,25 М NaCl с 20 мМ D-галактозой.
12) Элюировали целевой белок с использованием элюирующего буфера (0,25 М NaCl, 200 мМ D-галактоза). Первый объем, соответствующий объему колонки (~10 мл), не содержал целевой белок. Собирали первый объем в отдельную пробирку. После этого собирали 8 фракций по 2 мл. Измеряли оптическую плотность в каждой из фракции. Объединяли все фракции, содержащие белок (обычно 0,2-0,6 о.е./мл). Суммарный объем элюата, содержащего белок, составил около 12 мл.
13) Промывали колонку 5 объемами 0,25 М NaCl, 400 мМ D-галактозы для удаления всех связавшихся белков. Промывали колонку 5 объемами 50% спирта, хранили под спиртом на 4°C.
14) Проанализировали элюат на SDS-ПААГ по Лэммли на содержание целевого белка.
15) Сконцентрировали элюат после аффинной хроматографии примерно в 3-4 раза, так, чтобы концентрация раствора не превышала 4 о.е./мл при 280 нм (объем около 4 мл).
16) Профильтровали элюат после концентрирования через фильтр 0,45 мкм. Объем фильтрата составил около 4 мл.
17) Для проведения третьего этапа очистки подготовили колонку HiTrap Desalting Column (GE Helthcare) объемом 20 мл (4 последовательно соединенных колонки объемом по 5 мл) для перевода фильтрата в цитратный буфер, уравновесив ее 5 объемами 15 мМ цитратного буфера pH 4,2.
18) Используя уравновешенную цитратным буфером колонку HiTrap Desalting Column (GE Helthcare) объемом 20 мл (4 последовательно соединенных колонки объемом по 5 мл), переводили весь полученный объем фильтрата (около 4 мл) в 15 мМ цитратный буфер pH 4,2 для последующей ион-обменной хроматографии.
19) Собирали белок в цитратном буфере, объем около 6 мл (разбавляли в 1,5-2 раза). Допустимое концентрирование раствора - в 1,5-2 раза.
20) После перевода белка в цитратный буфер профильтровали раствор через фильтр 0,45 мкм. Объем фильтрата составил 3-6 мл.
21) Промывали колонку HiTrap Desalting Column (GE Helthcare) 5 объемами 15 мМ цитратного буфера pH 4,2, затем 5 объемами 20% этанола, хранили при 4°C.
22) Подготовили катион-обменную колонку monoS 5/50 GL (объем сорбента 1 мл, связывающая способность 50 мг/мл) для завершающей очистки целевого белка. Для этого уравновешивали колонку, промыв ее 5 объемами 15 мМ цитратного буфера pH 4,2.
23) Наносили весь профильтрованный раствор белка в цитратном буфере на колонку monoS 5/50 GL.
24) Промывали колонку 8 объемами 15 мМ цитратного буфера pH 4,2.
25) Промывали колонку 12 объемами 15 мМ цитратного буфера pH 4,2 с 300 мМ NaCl.
26) Элюировали связавшиеся белки градиентом концентрации NaCl от 300 до 800 мМ в течение 8 объемов колонки. Собирали фракции по 1,5 мл.
27) Отмывали колонку 5 объемами 15 мМ цитратного буфера pH 4,2 с 1 М NaCl.
28) Промывали колонку 5 объемами 15 мМ цитратного буфера pH 4,2, затем 5 объемами 20% этанола, хранили при 4°C.
29) После ионо-обменной хроматографии в SDS-ПААГ по Лэммли проанализировали фракции, в которых содержался целевой белок и которые соответствовали второй части пика на хроматограмме (фракции 3-4 от начала пика при элюции белка). После объединения фракций суммарный объем раствора очищенного белка составил около 4,5 мл.
30) Готовили фосфатно-солевой буфер для хранения pH 8.0 для разведения полученного белка и последующего хранения раствора.
Состав буфера:
NaCl - 7,5 г/л;
Na2HPO4×2 H2O - 3,4 г/л;
NaH2PO4×2 H2O - 0,16 г/л.
В апирогенную стеклянную мерную емкость вместимостью 2 л наливали 1 л деионизованной воды, вносили взвешенные компоненты: 15 г NaCl, 6,8 г Na2HPO4×2 H2O, 0,32 г NaH2PO4×2 H2O и перемешивали на магнитной мешалке до их полного растворения. Устанавливали в растворе величину pH 8,0±0,02 по pH-метру добавлением 2М раствора NaOH в объеме ~10 мл. Доводили общий объем водой до 2 л.
31) Переводили раствор очищенного белка в фосфатно-солевой буфер для хранения pH 8.0, используя колонку HiTrap Desalting Column (GE Helthcare) или с помощью диализа. Измеряли концентрацию белка спектрофотометрически в полученном растворе при длине волны 280 нм.
Подтверждение получения лектина MLI с чистотой не менее 95%
Подтверждение чистоты и молекулярной массы белка MLI проводили методом электрофоретического разделения в 10%-ом SDS-полиакриламидном геле в невосстанавливающих условиях (без меркаптоэтанола).
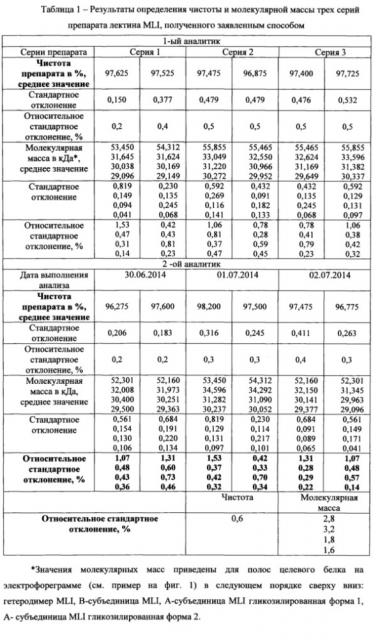
Провели определений %-ого содержания и молекулярной массы белка для трех серий препарата MLI, полученных заявленным способом. Для каждой серии препарата MLI заливали по 2 геля; наносили на каждый гель по 4 испытуемых образца двумя разными аналитиками. Примеры полученных электрофореграмм представлены на фиг. 1 Для определения молекулярной массы использовались маркеры молекулярных масс Precision Plus Protein Unstained Standards (Bio-Rad). Электрофореграммы сканировали, определяли содержание и молекулярную массу целевого белка с помощью программы ImageLab Software (Bio-Rad). С использованием программы Microsoft Excel рассчитали стандартное отклонение и относительное стандартное отклонение. Результаты представлены в таблице 1.
Заключение: Относительное стандартное отклонение, определенное для испытаний, выполненных разными аналитиками, не превышает 3% при определении молекулярной массы, и составляет 0,6% при определении чистоты препарата. Чистота препаратов MLI, полученных заявленным способом, составляет 96,2% и выше.
Сравнение результатов определения молекулярной массы белка MLI, полученных электрофоретическим и масс-спектрометрическими методами.
Анализ препарата масс-спектрометрическим методом (MALDI) показал наличие основного соединения с молекулярной массой около 63 кДа (см. фиг. 2). Масса целевого белка составляет 63-65 кДа.
Среднее значение молекулярной массы, определенной электрофоретическим методом, составляет около 54 кДа для полноразмерного гликозилированного белка. При этом сложение молекулярных масс, полученных для A- и B-субъединиц белка, дает значение около 63 кДа. Аномальная подвижность полноразмерного белка в полиакриламидном геле по отношению к стандартным белкам (маркерам) может объясняться наличием гликозилированных фрагментов.
Пример 1, демонстрирующий возможность использования в качестве активного компонента лектина MLI.
Из полученного указанным выше способом лектина готовили концентрат препарата следующего состава:
| Растительный лектин вискумин (MLI) | 0,1 мг |
| Вспомогательные вещества: | |
| Натрия гидрофосфат, дигидрат | 3,382 мг |
| Натрия дигидрофосфат, дигидрат | 0,156 мг |
| Натрия хлорид | 7,498 мг |
| Вода для инъекций | до 1 мл |
Для этого, используя приготовленный фосфатно-солевой буфер для хранения pH 8.0, разводили полученный раствор очищенного белка до концентрации 0,1 мг/мл.
Концентрат для приготовления раствора для подкожных инъекций представляет собой бесцветный, прозрачный раствор. Для подкожных введений концентрат предварительно разводят.
Раствор для разведения - бесцветный, прозрачный раствор следующего состава (1 мл):
| Натрия гидрофосфат, дигидрат | 3,382 мг |
| Натрия дигидрофосфат, дигидрат | 0,156 мг |
| Натрия хлорид | 7,498 мг |
| Вода для инъекций | до 1 мл |
Пример 2, демонстрирующий возможность использования в качестве активного компонента лектина MLI, конъюгированного с ферромагнитными наночастицами магнетита.
Ферромагнитные наночастицы (ФНЧ), модифицированные ПЭГ, с ковалентно иммобилизованным лектином MLI получали следующим образом. К 3 мл раствора ФНЧ, модифицированных ПЭГ-кислотой (1.67 мг/мл) в буфере MES (pH 6.0), добавляли раствора 1,53 мг EDC и 4,34 мг сульфо-NHS в 1 мл буфере MES (pH 6.0). Активацию карбоксильных групп проводили в течение 15 мин, после чего ФНЧ осаждали центрифугированием и ресуспензировали в буфере MES (pH 6.0) три раза, последний раз ФНЧ ресуспендировали в фосфатно-солевом буфере (pH 8.0) и концентрировали до 250 мкл. Затем к ФНЧ с активированными карбоксильными группами добавляли 3 мл раствора MLI с концентрацией 2 мг/мл и 400 мкл 100 мМ лактозы в 1x PBS, pH 8.0. Инкубировали 2 часа. После этого НЧ осаждали центрифугированием в режиме 18000 g и ресуспендировали в фосфатно-солевом буфере (pH 8.0). Осаждение и ресуспендирование в фосфатно-солевом буфере (pH 8.0) повторили пять раз для элиминирования непровзаимодействовавшего лектина с ФНЧ. (Хуторненко А.А., Герасимов В.М., Сахаров Д.А. Получение и изучение интернализации конъюгата вискумин-ферромагнитных наночастиц с клетками глиобластомы человека А172 // Бюллетень экспериментальной биологии и медицины. 2015. Vol. 160. №12/ P. 797-801).
Исследования иммуномодулирующего и противоопухолевого действия разработанного препарата было проведено на клеточных культурах (исследование in vitro) и на ксенографтных моделях животных.
Исследование цитотоксических свойств исследуемого препарата MLI in vitro
В результате in vitro экспериментов было показано, что цитотоксические свойства разработанного препарата MLI различаются для разных типов клеток. 70%-ное ингибирование роста опухолевых клеток достигается в среднем на концентрациях 0,2 нг/мл по активно действующему веществу (растительному лектину вискумин). Установлено, что образование модифицированной 28S рибосомной РНК в опухолевых клетках - проявление специфической N-гликозидной активности вискумина - детектируется при воздействии препарата уже через 15 мин, что свидетельствует о высокой активности тестируемого препарата.
Для четырех клеточных линий MV3, ТНР-1, Caco2 и MOLT4 методом МТТ была проведена оценка жизнеспособности клеток после взаимодействия с заявляемым препаратом на широком диапазоне доз. Показано, что в случае линии MV3 препарат проявляет токсические свойства уже при концентрации 100-24 M. Так, инкубация тестируемого вещества в данной концентрации с клетками MV3 в течение 72 ч приводит к снижению жизнеспособности до 65%. Для клеточных линий дифференцированных моноцитов ТНР-1 и колоректального рака Caco2 показатели IC50 отличаются, указывая на меньшую чувствительность этих клеток к препарату. Расчетные значения IC50 для клеточных линий MV3, ТНР-1, Caco2 и MOLT4 составили 5×10-12 нМ, 3×10-9 нМ, 1,0×10-6