Система полицистронной экспрессии для бактерий
Иллюстрации
Показать всеНастоящие изобретения относятся к полицистронной экспрессии у грамположительной бактерии и касаются молочнокислой бактерии для экспрессии одного или нескольких экзогенных генов, фармацевтической композиции, содержащей такую молочнокислую бактерию, нуклеиновой кислоты и вектора. Представленная молочнокислая бактерия содержит единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии содержит эндогенный по отношению к указанной молочнокислой бактерии ген (эндогенный ген) и один или несколько экзогенных по отношению к указанной молочнокислой бактерии генов (экзогенные гены), причем указанный эндогенный ген и указанные один или несколько экзогенных генов находятся под транскрипционным контролем промотора, эндогенного по отношению к указанной молочнокислой бактерии. Изобретения обеспечивают высокие уровни экспрессии гетерологичных белков и могут быть использованы в медицине. 6 н.п. и 46 з.п. ф-лы, 23 ил., 8 табл.,16 пр.
Реферат
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к областям биологии и медицины, более конкретно, к молекулярной и клеточной биологии, и относится к рекомбинантной инженерии и экспрессии микроорганизмами продуктов, таких как пептиды, полипептиды или белки. Более конкретно, настоящее изобретение относится к конструкциям полицистронной экспрессии или кассетам для экспрессии микроорганизмами таких продуктов и дополнительно к родственным векторам, трансформированным хозяевам, использованиям и применениям, таким как доставка, в особенности, доставка терапевтического средства, совместно экспрессируемых продуктов субъектам.
Предшествующий уровень техники настоящего изобретения
На сегодняшний день для различных биотехнологических областей применений было разработано большое количество систем экспрессии для рекомбинантных белков. Системы для экспрессии гетерологичных или гомологичных генов были определены у прокариот, дрожжей и грибов и у клеток млекопитающих.
Большинство полученных из дрожжей рекомбинантных белков были экспрессированы при помощи Saccharomyces cerevisiae в качестве системы-хозяина. Несмотря на это, для системы S. cerevisiae было выявлено несколько ограничений. Примерами являются выход продукта, который обычно является низким, и недостаточная секреция (множество белков S. cerevisiae не обнаруживаются в культуральной среде в свободном виде, но наоборот содержатся в периплазматическом пространстве или связаны с клеточной стенкой) (Dominguez et al. Int. Microbiol., 1998, vol. 1(2), 131-142). В результате ограничений выработки у дрожжей появился большой интерес к экспрессии белков в бактериях, которые легко выращивать в недорогостоящем бульоне, и их часто применяют для получения рекомбинантных белков. Среди прокариотических систем наиболее высокие уровни белков обычно получают при помощи рекомбинантной экспрессии у Escherichia coli (E.coli) (Jana & Deb. Appl. Microbiol. Biotechnol., 2005, vol. 67(3), 289-298). Тем не менее, у E.coli наиболее часто применяемые стратегии получения являются внутриклеточными (в периплазме или цитоплазме) и, следовательно, предусматривают дорогостоящие и зачастую проблематичные последующие способы очистки.
Кисломолочные бактерии (LAB) приобретают повышенную важность в качестве хозяев для рекомбинантной экспрессии гетерологичных полипептидов in vitro (например, патент США №5559007), а также экспрессии in vivo или in situ и доставки антигенов и/или терапевтически необходимых полипептидов (например, WO 97/14806). Гетерологичные белки, выработанные у таких грамположительных бактериальных хозяев, могут быть легко секретированы в среду, таким образом, облегчая их очистку, а также их прямую доставку субъектам.
Большинство систем экспрессии могут очень хорошо управлять экспрессией одного отдельного белка (в качестве результата одной отдельной генной последовательности). Тем не менее, в некоторых случаях желательно иметь систему экспрессии, которая способна экспрессировать множество белков или полигенные белковые комплексы, например, in vitro экспрессия антител или белковых комплексов, а также in vivo или in situ экспрессия и доставка двух или более белков, которые оказывают синергический эффект при конкретном заболевании, или in vivo или in situ экспрессия и доставка антител или их функциональных (полигенных) фрагментов. В таких случаях, желательно иметь полимерные гены, которые кодируют необходимые белки или антитела под контролем одного промотора из-за необходимости тесной совместной регуляции полимерных генов.
Два наиболее широкоизвестных подхода получения рекомбинантных белковых комплексов заключаются в выполнении in vitro реконструкции отдельно экспрессированных и очищенных субъединиц или в осуществлении in vivo реконструкции путем совместной экспрессии субъединиц в соответствующем хозяине (Selleck & Tan, "Recombinant protein complex expression in E.coli, Curr. Protoc. Protein Sci., 2008, chapter 5:unit 5, 21). Несмотря на успешное применение реконструкции in vitro этот способ является трудоемким (каждая субъединица должна быть экспрессирована и очищена, а комплекс должен быть дополнительно очищен после реконструкции) и выходы реконструкции часто являются низкими. В отличие от этого, реконструкция in vivo посредством совместной экспрессии обеспечивает преимущества эффективности (только один цикл экспрессии и очистки) и потенциально более высокие выходы и качество необходимого комплекса (рефолдинг и сборка комплекса происходят в присутствии обеспечивающих сворачивание белка ферментов в клеточной среде) (Selleck & Tan 2008, ранее). Реконструкция in vivo была успешно выполнена путем совместного инфицирования бакуловирусом клеток насекомых, экспрессирующих отдельные субъединицы белка (Tirode et al. Mol. Cell, 1999, vol. 3(1), 87-95), и в бактериях из сложных плазмид (Johnston et al. Protein Expr. Purif., 2000, vol. 20(3), 435-443; McNally et al. Proc. Natl. Acad. Sci. USA, 1988, vol. 85(19), 7270-7273) или из специализированных полицистронных плазмид (Henricksen et al. J. Biol. Chem., 1994, vol. 269(15), 1112111132; Ishiai et al. J. Biol. Chem. 1996, vol. 271(34), 20868-20878; Li et al. Proc. Natl. Acad. Sci. USA, 1997, vol. 94(6), 2278-2283).
Основные системы полицистронной экспрессии для получения белковых комплексов в Е.coli были описаны в (Selleck & Tan 2008, ранее; Tan. Protein. Expr. Purif., 2001, vol. 21(1), 224-234; Tan et al. Protein Expr. Purif., 2005, vol. 40(2), 385-395). В таких системах использована концепция трансляционной кассеты, состоящей из кодирующего участка с соответствующими ИНИЦИИРУЮЩИМ и СТОП кодонами и с предшествующими сигналами инициации трансляции, такими как последовательность Шайна-Дальгарно (SD) и трансляционные энхансеры (Tan 2001, Tan et al. 2005, ранее). В транскрибированном в мРНК состоянии трансляционная кассета содержит необходимую и достаточную информацию для запуска механизма трансляции Е.coli и поддержания трансляции мРНК в необходимый полипептид (Selleck & Tan 2008, ранее).
Был описан вектор бицистронной экспрессии для интерлейкина-18 у Е.coli, однако, межгенный участок между двумя генами состоял из синтетического линкера и явно является гено-специфичным, поскольку экспрессия каспазы-4 была значительно выше экспрессии ICE. Smolke et al. ранее показали, что возможен дифференциальный контроль уровней белка, кодируемого двумя или более генами в опероне при помощи последовательностей синтетических межгенных участков (Smolke et al. Appl. Environ. Microbiol., 2000, vol. 66(12), 5399-5405; Smolke & Keasling. Biotechnol. Bioeng., 2002, vol. 80(7), 762-776). Тем не менее, в основе этого подхода лежат случайные комбинации, и он нуждается во введении синтетических последовательностей в клетку-хозяина для экспрессии.
В последние годы возникла потребность в новых и улучшенных системах выработки антител. Системы для экспрессии антител были определены у прокариот, дрожжей и грибов и у клеток млекопитающих. Несмотря на то, что одноцепочечные и однодоменные антитела легче получать от бактерий, полноразмерные антитела обычно характеризуются более высокими показателями сродства связывания и меньшим риском образования нейтрализующего антитела при введении.
Полноразмерные антитела можно получить из бактерий (Mazor et al. Nat. Biotechnol., 2007, vol. 25(5), 563-565; Simmons et al. J. Immunol. Methods, 2002, vol. 263(1-2), 133-147). В большинстве публикаций о рекомбинантной экспрессии у прокариот описано получение фрагментов антител, хотя фактически исключительно от Е.coli. Несмотря на то, что многие сконструированные LAB способны корректировать образование дисульфидной связи, в литературе содержится только ограниченное число примеров подобных антителу молекул, полученных от LAB (Kruger et al. Nature Biotechnology, 2002, vol. 20(7), 702-706; Beninati et al. Nature Biotechnology, 2000, vol. 18(10), 1060-1064; Chancey et al. J. Immunol., 2006, vol. 176(9), 5627-5636; Hultberg et al. BMC Biotechnol., 2007, vol. 7, 58; Yuvaraj et al. Mol. Nutr. Food. Res., 2008, vol. 52(8), 913-920). В таких публикациях описаны только одноцепочечные фрагменты антител, экспрессируемые у видов Lactobacillus, Lactococcus lactis и Streptococcus gordonii, но не полигенные, двухцепочечные фрагменты антител или полноразмерные антитела.
Системы полицистронной экспрессии могут быть очень важны для получения у прокариот эффективного синтеза и экспрессии сложных белков, таких как антитела. С момента одобрения FDA в 1986 году муромонаба-CD3, все еще одного из наиболее сильнодействующих иммунодепрессивных лекарственных средств, пригодных для контроля отторжения трансплантата (Hooks et al. Pharmacotherapy, 1991, vol. 11(1), 26-37), полноразмерные антитела и фрагменты антител становились все более важными и универсальными инструментальными средствами в медицине.
Несмотря на то, что из уровня техники известно несколько примеров систем полицистронной экспрессии в бактериальных клетках, эти примеры весьма ограничены, что подчеркивает необходимость в более эффективной системе введения и экспрессии полимерных генов. Соответственно, имеет место необходимость получения дополнительных последовательностей, которые можно благоприятно применять для экспрессии белков, предпочтительно экспрессии гетерологичного белка и еще более предпочтительно экспрессии множества гетерологичных белков.
В дополнение к изложенному выше, попытка получить более высокие количества рекомбинантного белка как для прямой доставки белка посредством рекомбинантных организмов, так и для массового получения белка и последующей очистки является технологически очень сложной. Существующий подход увеличения получения гетерологичных белков заключается в применении выбранных сильных промоторов (см., например, WO 2008/084115). В соответствии с настоящим подходом, осуществляют протеомный анализ для определения большинства избыточных эндогенных белков, экспрессируемых микроорганизмами. С помощью геномной последовательности можно определить и выделить соответствующие гены и промоторы. Такие сильные промоторы (например, промотор гена hIIA, PhIIA, Lactococcus lactis) можно расположить перед гетерологичным геном и, таким образом, может быть достигнут высокий уровень экспрессии. Тем не менее, уровень экспрессии, который вредит физиологии хозяина, может приводить к затруднению роста хозяина и давать в результате отрицательный отбор. Это, по сути, ограничивает наиболее высокую возможную экспрессию любого заданного гетерологичного белка в клетке-хозяине при экспрессии до определенного конкретного уровня. Это представляет собой особенно серьезное препятствие для разработки расположенных в хромосоме единиц экспрессии.
Проблему отрицательного отбора обычно решают путем обеспечения маркеров отбора. Фактически, положительный или отрицательный отбор, например путем обеспечения генов устойчивости к антибиотику, может предупредить потерю введенного гетерологичного гена. Альтернативно, или в дополнение к применению маркеров отбора, можно использовать индуцируемые системы экспрессии генов, которые предусматривают блокировку размножения хозяина и экспрессию гетерологичного белка, таким образом, предупреждая возможный отрицательный отбор в течение фазы размножения, когда гетерологичный ген не экспрессируется. В этом контексте, в документе ЕР0569604 описана индуцируемая система экспрессии у Streptococcus thermophilus, у которой гетерологичный ген обязательно расположен на 5'-конце по отношению к гену LacZ. Таким образом, экспрессия гетерологичного гена не только является индуцируемой, но и дополнительно сохранение гетерологичного гена также отбирают путем выращивания бактерий в их естественной среде обитания, молоке с лактозой в качестве источника углерода, для чего необходима экспрессия гена LacZ.
Ясно, что описанные выше системы экспрессии гетерологичного гена ограничены в применении. Например, применение маркеров отбора, таких как гены устойчивости к антибиотику, не полностью подходят для применения в пищевой промышленности или в фармацевтических областях применения. Дополнительно, ограничение выращивания в естественной среде обитания или использования источника углерода из естественной среды обитания для роста значительно снижает адаптивность любой системы экспрессии гетерологичного гена. Также, применение индуцируемых систем, в сущности, зависит от условий роста хозяина, так что для обеспечения экспрессии гетерологичного белка необходимы определенные культуральные среды, к которым необходимо добавлять индуцирующий фактор.
Таким образом, в данной области техники также существует потребность в повышении экспрессии гетерологичных белков; и необходимы последовательности, системы клонирования и стратегии, которые могут обеспечивать высокие уровни экспрессии для получения достаточных количеств экспрессированных гетерологичных белков в промышленных и/или терапевтических установках, при этом, в то же время, являться адаптивными и широко применимыми в ряде различных условий. В таких установках также может быть особенно пригодно получение экспрессии множества белков, каждый из которых характеризуется собственной биологической активностью и терапевтическим эффектом.
Сущность настоящего изобретения
Аспекты и варианты осуществления по настоящему изобретению направлены на удовлетворение по меньшей мере некоторых, например, одной или нескольких, обсуждаемых выше потребностей в данной области техники.
Было неожиданно обнаружено, что грамположительные бактерии могут эффективно экспрессировать экзогенные или гетерологичные гены с единиц полицистронной экспрессии, также содержащих эндогенный(е) ген(ы) таких бактерий. Таким образом, грамположительные бактерии могут эффективно экспрессировать экзогенные или гетерологичные гены с единиц полицистронной экспрессии, если такие гены транскрипционно или трансляционно связаны с эндогенным(и) геном(генами) таких бактерий. Неожиданно было обнаружено, что транскрипционное и/или трансляционное связывание эндогенных генов и экзогенных генов в единицах полицистронной экспрессии дает в результате высокие уровни экспрессии экзогенных генов у грамположительных бактерий. В частности, было обнаружено, что уровни экспрессии экзогенных генов, транскрипционно и/или трансляционно связанных с эндогенными генами грамположительных бактерий, по меньшей мере сравнимы и преимущественно выше уровней экспрессии экзогенных генов, которые транскрипционно или трансляционно не связаны с эндогенными генами грамположительных бактерий.
Таким образом, в соответствии с одним аспектом настоящее изобретение относится к грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии содержит один или несколько эндогенных генов и один или несколько экзогенных генов. Единицу полицистронной экспрессии, таким образом, также можно обозначить как содержащую эндогенный ген (например, без ограничения один эндогенный ген) и один или несколько экзогенных генов. Предпочтительно, единица полицистронной экспрессии последовательно содержит один или несколько эндогенных генов и один или несколько экзогенных генов. Такую единицу полицистронной экспрессии, таким образом, можно также обозначить как последовательно содержащую эндогенный ген (например, без ограничения один эндогенный ген) и один или несколько экзогенных генов. Единицу полицистронной экспрессии конфигурируют так, чтобы она затрагивала транскрипцию одного или нескольких эндогенных генов и одного или нескольких экзогенных генов в полицистронной мРНК. Следовательно, настоящую грамположительную бактерию можно, иным образом, обозначить как содержащую один или несколько эндогенных генов, с которыми транскрипционно или трансляционно связаны один или несколько экзогенных генов. Также, следовательно, настоящее изобретение относится к грамположительной бактерии, содержащей один или несколько эндогенных генов, с которыми транскрипционно и/или трансляционно связаны один или несколько экзогенных генов.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии содержит ген, эндогенный по отношению к грамположительной бактерии, и один или несколько генов, экзогенных по отношению к грамположительной бактерии. Предпочтительно, единица полицистронной экспрессии последовательно содержит один или несколько эндогенных генов и один или несколько экзогенных генов. Следовательно, также настоящее изобретение относится к рекомбинантной нуклеиновой кислоте, содержащей единицу полицистронной экспрессии, содержащую один или несколько генов, эндогенных по отношению к грамположительной бактерии, с которой транскрипционно и/или трансляционно связаны один или несколько генов, экзогенных по отношению к грамположительной бактерии.
Предпочтительно, как подразумевают по всему настоящему описанию, указанный один или несколько экзогенных генов могут быть транскрипционно или трансляционно связаны с 3'-концом указанного одного или нескольких эндогенных генов. К удивлению было обнаружено, что такая конфигурация является благоприятной в отношении уровней экспрессии гетерологичного белка, сохранения и/или геномной стабильности единицы полицистронной экспрессии. Кроме того, было обнаружено, что дальнейшее расположение в геноме ниже по ходу транскрипции имеет меньшее значение или не имеет значения.
Транскрипция транскрипционно или трансляционно связанного одного или нескольких эндогенных генов и одного или нескольких экзогенных генов может надлежащим образом регулироваться или контролироваться промотором, способным обеспечивать транскрипцию у грамположительной бактерии, и предпочтительно может регулироваться или контролироваться эндогенным промотором указанной грамположительной бактерии. Следовательно, настоящее изобретение также относится к грамположительной бактерии, содержащей один или несколько эндогенных генов, расположенных в своем естественном хромосомном локусе, с которыми транскрипционно или трансляционно связаны один или несколько экзогенных генов. Предпочтительно, транскрипция таких транскрипционно или трансляционно связанных одного или нескольких эндогенных генов и одного или нескольких экзогенных генов, таким образом, контролируется или регулируется нативным промотором указанных одного или нескольких эндогенных генов. Соответственно, транскрипционное или трансляционное связывание можно осуществить в результате встраивания в хромосому одного или нескольких экзогенных генов в указанный локус, как, например, в результате встраивания в хромосому одного или нескольких экзогенных генов 3' от указанного одного или нескольких эндогенных генов в указанном локусе.
Таким образом, в соответствии с одним аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного одного или нескольких эндогенных генов, причем предпочтительно указанный один или несколько экзогенных генов являются наиболее 3' удаленными генами единицы полицистронной экспрессии.
К удивлению было обнаружено, что встраивание в хромосому экзогенного или гетерологичного гена (или нескольких гетерологичных генов), транскрипционно связанного 3' с нативным геном, который сам по себе может представлять собой полицистронный ген, такой как, например, оперон, дает на выходе стабильную единицу экспрессии, в которой, вопреки ожиданиям, отрицательный отбор по (одному или нескольким) экзогенному гену отсутствует или минимален.
Неожиданно было обнаружено, что описанные в настоящем документе преимущества проявляются все в большей степени, когда экспрессия единицы полицистронной экспрессии находится под воздействием определенных условий, в частности, определенных типов промоторов. Неожиданно было обнаружено, что описываемые в настоящем документе системы полицистронной экспрессии, в которых отрицательный отбор по гетерологичным белкам нельзя устранить традиционными мерами, такими как применение маркеров отбора, или применением индуцируемых систем, могут, тем не менее, стабильно сохраняться и экспрессироваться на высоких уровнях, таким образом являясь широко применимыми в ряде различных условий при отсутствии необходимости в средствах для отбора или индуцирующий факторах. Модули полицистронной экспрессии, которые описаны в настоящем документе, таким образом, позволяют применять не выбираемые эндогенные и/или экзогенные гены.
В соответствии с одним аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием конститутивного промотора.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием промотора гена центрального метаболизма.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием промотора гена "домашнего хозяйства".
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием промотора необходимого гена.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии не находится под влиянием индуцируемого генного промотора.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием промотора рибосомального гена.
В соответствии с другим аспектом настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием промотора гена гликолиза.
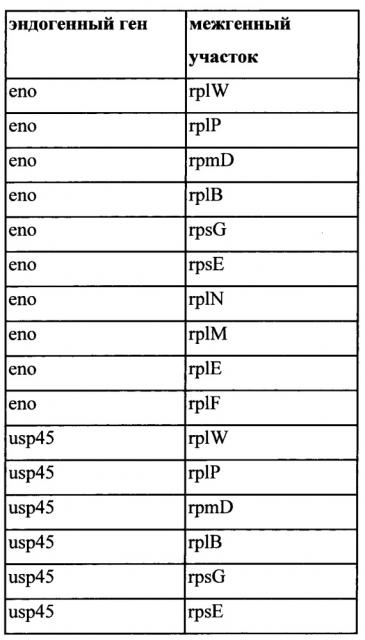
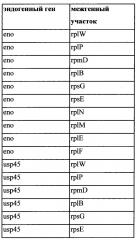
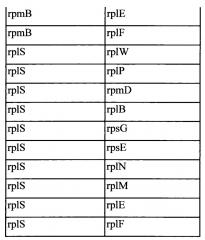
Также, как указано выше, в соответствии с предпочтительным вариантом осуществления описанные выше промоторы представляют собой промоторы эндогенных генов. Также, как дополнительно подробно описано ниже, предпочтительно используемые в настоящем изобретении промоторы представляют собой сильные промоторы. Предпочтительно без ограничения указанный эндогенный промотор можно выбрать из группы, состоящей из промоторов eno, usp45, gapB, pyk, rpmB и rplS. Очень предпочтительно, чтобы транскрипция трансляционно связанного эндогенного гена и одного или нескольких экзогенных генов могла регулироваться или контролироваться нативным промотором (одного из) указанного эндогенного гена.
Следует понимать, что характеристики описываемых в настоящем документе промоторов в соответствии с настоящим изобретением можно комбинировать. Таким образом, в соответствии с вариантами осуществления настоящее изобретение относится к рекомбинантной нуклеиновой кислоте или грамположительной бактерии, содержащей единицу полицистронной экспрессии, причем указанная единица полицистронной экспрессии последовательно содержит эндогенный ген и один или несколько экзогенных генов, транскрипционно связанных с 3'-концом указанного эндогенного гена, причем экспрессия указанной единицы полицистронной экспрессии находится под влиянием, например, (эндогенного) конститутивного промотора гена "домашнего хозяйства", (эндогенного) конститутивного промотора гена центрального метаболизма, (эндогенного) конститутивного промотора необходимого гена, (эндогенного) конститутивного промотора рибосомального гена, (эндогенного) конститутивного промотора гена гликолиза, (эндогенного) промотора гена "домашнего хозяйства" и гена центрального метаболизма, (эндогенного) промотора необходимого гена и гена центрального метаболизма, (эндогенного) промотора необходимого гена, гена "домашнего хозяйства" и гена центрального метаболизма, (эндогенного) промотора необходимого гена и гена "домашнего хозяйства", (эндогенного) конститутивного промотора гена "домашнего хозяйства" и гена центрального метаболизма, (эндогенного) конститутивного промотора гена "домашнего хозяйства", необходимого гена и гена центрального метаболизма, (эндогенного) промотора необходимого гена и рибосомального гена, (эндогенного) промотора необходимого гена и гена гликолиза, (эндогенного) конститутивного промотора необходимого гена и рибосомального гена, (эндогенного) конститутивного промотора необходимого гена и гена гликолиза.
Предпочтительно, как указано по всему настоящему описанию, указанный один или несколько экзогенных генов могут быть транскрипционно или трансляционно связаны с 3'-концом указанного одного или нескольких эндогенных генов, причем один или несколько эндогенных генов присутствуют в своем естественном положении на бактериальной хромосоме. В соответствии с настоящей конфигурацией последовательность на 5'-конце одного или нескольких эндогенных генов (как минимум включающего промотор эндогенных генов) идентична последовательности из штамма дикого типа, и участок, следующий за 3'-концом одного или нескольких экзогенных генов, идентичен последовательности участка 3' от одного или нескольких эндогенных генов, как и в штамме дикого типа.
От экспрессии указанного терапевтического белка в конкретных выбранных микроорганизмах-хозяевах можно получить пользу для множества областей применений, связанных с экспрессией экзогенных белков, таких как, например, для доставки терапевтического белка посредством рекомбинантных организмов. Такие микроорганизмы можно выбрать на основании их колонизирующей способности, как, например, выбранные штаммы, происходящие из микробиоты человека или животных. Микроорганизмы также можно выбирать по их способности усиливать активность любого конкретного доставляемого терапевтического белка, например, по результату взаимодействия их клеточной стенки, поверхности клетки или внутриклеточного содержимого с иммунной системой хозяина, например, посредством взаимодействия с toll-подобными рецепторами, членами семейства Ig, комплементом, цитокинами и др. Конкретные микроорганизмы можно выбирать по их способности выживать в или на конкретных участках доставки с жесткими условиями, таких как внутриопухолевые, кожные, участки с высоким содержанием желчи, участки с низким рН и др. Упоминаемая в настоящем описании грамположительная бактерия предпочтительно может быть молочнокислой бактерией (LAB), более предпочтительно Lactococcus sp., еще более предпочтительно Lactococcus lactis или ее подвидом или штаммом. Альтернативно, указанная LAB предпочтительно может быть Enterococcus sp., более предпочтительно Enterococcus fecium или Enterococcus faecalis или ее подвидом или штаммом.
Во избежание латерального переноса гена в эндогенную микрофлору, экспрессия с включенной в хромосому единицей экспрессии высоко предпочтительна для применения у рекомбинантной микрофлоры в качестве инструментов доставки терапевтических белков в медицинских целях. Также, расположенные в хромосоме единицы экспрессии могут оказаться гораздо более стабильно наследуемыми в поколениях, так что расположенные в хромосоме единицы экспрессии могут быть желательной структурой для получения штаммов, применяемых при массовом получении белка. Как известно из уровня техники, вставку в хромосому осуществляют при помощи векторов типа нокин (KI), которые не реплицируются в зависимости от условий и которые содержат гетерологичный ген между фланкирующими участками, которые делают возможной гомологичную рекомбинацию. В соответствии с традиционным подходом (см., например, WO 2008/084115) KI-плазмиду строят в гомологичном хозяине (KI-плазмиду для L. lactis встраивают в L. lactis). Это особенно полезно для гетерологичной экспрессии, для которой необходима секреция белка, поскольку многие сигнальные последовательности секреции не подходят для применения у других хозяев. Применение сильных промоторов в конструкциях экспрессии, которые предназначены для размещения на бактериальной хромосоме, затрудняется экспрессией гетерологичного гена с промежуточных продуктов KI-плазмиды. Перед гетерологичным геном непосредственно идет сильный промотор, делая так, что экспрессия с KI-плазмиды, несмотря на то, что не предполагается и не необходима, по сути ограничивает применение наиболее сильных промоторов. Во многих случаях KI-плазмида имеет некоторое количество копий, которое является кратным числу хромосом у хозяина, делая так, что при встраивании экспрессия будет в несколько раз ниже. Таким образом, хромосомные единицы экспрессии будут по сути слабее, чем можно было бы достичь на наиболее высоком уровне. Этот недостаток преодолевают с помощью описанного в настоящем документе настоящего изобретения. В соответствии с настоящей методикой, гетерологичные гены будут расположены ниже и они будут транскрипционно и/или трансляционно связаны с (сильно экспрессирующимся) эндогенным геном на бактериальной хромосоме. Согласно такой стратегии присутствие эндогенного (сильного) промотора на KI-плазмиде не является необходимым. Точнее, выше гетерологичного гена расположен 3'-конец без промотора (сильно экспрессируемого) эндогенного гена. Этот тип KI-плазмиды является молчащим и не будет ограничивать применение сильных промоторов.
Транскрипционное или трансляционное связывание одного или нескольких экзогенных генов с одним или несколькими другими генами, как описано в настоящем документе, можно осуществить за счет межгенного участка, активного (т.е., функционального, эфективного) у грамположительной бактерии, предпочтительно за счет эндогенного межгенного участка грамположительной бактерии. Таким образом, дополнительный аспект относится к рекомбинантной нуклеиновой кислоте, содержащей межгенный участок, активный у грамположительной бактерии, предпочтительно эндогенный межгенный участок грамположительной бактерии, функционально связанный с геном, экзогенным по отношению к указанной грамположительной бактерии. Функциональная связь обеспечивает, чтобы транскрипт межгенного участка, присутствующий на мРНК вместе с транскриптом экзогенного гена, был способен предоставить сайт для инициации трансляции экзогенного гена у грамположительной бактерии. Предпочтительно, межгенный участок может быть расположен 5' от экзогенного гена. Нуклеиновая кислота может содержать два или более экзогенных генов в полицистронной структуре, причем каждому экзогенному гену предшествует межгенный участок. Межгенные участки могут быть одинаковыми или отличаться. Например, если межгенные участки отличаются, то они могут соответстовать межгенным участкам, полученным от различных генов одного вида или различных видов, или из одного гена разных видов. Такие нуклеиновые кислоты могут быть пригодны при построении единиц полицистронной экспрессии, содержащих один или несколько экзогенных генов, причем один или несколько других генов транскрипционно или трансляционно связаны с одним или несколькими экзогенными генами посредством межгенного участка. Например, такие нуклеиновые кислоты могут быть пригодны при построении описываемых в настоящем документе единиц полицистронной экспрессии, причем один или несколько эндогенных генов транскрипционно или трансляционно связаны с одним или несколькими экзогенными генами посредством межгенного участка. Предпочтительно первый цистрон единицы полицистронной экспрессии будет представлять собой сильно экспрессирующийся эндогенный ген.
Настоящие рекомбинантные нуклеиновые кислоты могут содержаться на репликоне. Таким образом, один аспект также относится к репликону или вектору, содержащему описываемую в настоящем документе нуклеиновую кислоту. Например, вектор может представлять собой прокариотический вектор экспрессии, предпочтительно прокариотический вектор полицистронной экспрессии. Разработка таких плазмидных систем экспрессии, тем не менее, может быть трудоемкой, поскольку комбинация определенных репликонов и сильных промоторов может быть нестабильной. Также может быть невозможна трансформация выбранных микроорганизмов рекомбинантными плазмидами и стабильное сохранение последней в микроорганизме по причине присутствия естественных плазмид, в частности это невозможно, если нельзя включить маркеры отбора по антибиотику в плазмиду экспрессии, как это может быть в случае применения для доставки терапевтического белка. Эту проблему можно обойти при помощи расположения гетерологичных генов ниже и транскрипционно или трансляционно связанных с (сильно экспрессирующимся) эндогенным геном на бактериальной хромосоме. Поскольку согласно такой стратегии переносимая плазмидой система экспрессии не является необходимой, стратегию можно применять в качестве обычного подхода для генетической инженерии любого типа выбранной микрофлоры. Единственную необходимую штаммоспецифичную информацию можно быстро установить с помощью методики, известной из уровня техники. Высокопроизводительное секвенирование в сочетании с протеомным анализом экспрессирующихся в большом количестве белков быстро даст нуклеотидную последовательность участков, кодирующих присутствующие в большом количестве белки. Таким образом, наиболее предпочтительно, описываемый в настоящем документе вектор можно сконфигурировать так, чтобы он затрагивал гомологичную рекомбинацию у грамположительной бактерии, к примеру, приводил к встраиванию в хромосому экзогенного гена(генов).
Дополнительно, настоящее изобретение относится к применению описываемых в настоящем документе рекомбинантной нуклеиновой кислоты или вектора для полицистронной экспрессии одного или нескольких экзогенных генов или для полицистронной экспрессии одного или нескольких эндогенных генов и одного или нескольких экзогенных генов у грамположительной бактерии. Также настоящее изобретение относится к грамположительной бактерии, содержащей (например, трансформированной с ее помощью) описываемые в настоящем документе рекомбинантную нуклеиновую кислоту или вектор, причем грамположительная бактерия способна к полицистронной экспрессии одного или нескольких экзогенных генов или к полицистронной экспрессии одного или нескольких эндогенных генов и одного