Средства для лечения нарушений, вовлекающих модуляцию рецепторов рианодина
Иллюстрации
Показать всеИзобретение относится к производным 1,4-бензотиазепина
, а также к фармацевтическим композициям и применению. Технический результат: получены новые соединения, которые могут быть использованы для лечения заболеваний и состояний, связанных с RyRs, в частности нарушений сердечной деятельности, костно-мышечных нарушений и нарушений центральной нервной системы (ЦНС). 5 н. и 22 з.п. ф-лы, 11 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к производным 1,4-бензотиазепина и их применению для лечения нарушений и заболеваний, связанных с рецепторами рианодина (RyRs), которые регулируют кальциевый канал, функционирующий в клетках. В изобретении также описаны фармацевтические композиции, содержащие эти соединения, и их применения для лечения заболеваний и состояний, связанных с RyRs, в частности нарушений сердечной деятельности, костно-мышечных нарушений и нарушений центральной нервной системы (ЦНС).
Предпосылки создания изобретения
Саркоплазматический ретикулум (SR) представляет собой структуру в клетках, которая функционирует, в частности, в качестве специализированного внутриклеточного запаса кальция (Са2+). RyRs представляют собой каналы в SR, которые открываются и закрываются для регуляции высвобождения Са2+ из SR во внутриклеточную цитоплазму клетки. Высвобождение Са в цитоплазму из SR повышает концентрацию Са2+ в цитоплазме. Вероятность открытия RyRs относится к вероятности, что RyR открывается в любой данный момент и, следовательно, способен высвобождать Са2+ в цитоплазму из SR.
Существует три типа RyR, все они являются высоко гомологичными: RyR1, RyR2 и RyR3. RyR1 обнаружен главным образом в скелетных мышцах, а также в других тканях, RyR2 обнаружен главным образом в сердце, а также в других тканях, и RyR3 обнаружен в головном мозге, а также в других тканях. RyR представляет собой тетрамер. Часть RyR комплекса образована четырьмя RyR полипептидами в ассоциации с четырьмя FK506 связывающими белками (FKBPs) (калстабины), в особенности FKBP12 (калстабин 1) и FKBP12,6 (калстабин 2). Калстабин 1 связывается с RyR1 и RyR3, тогда как калстабин 2 связывается с RyR2. Калстабины связываются с RyR (одна молекула на RyR субъединицу), стабилизируют RyR функцию, способствуют сопряженному отпиранию между соседними RyRs и предотвращают анормальную активацию (Са2+ утечка) канала путем стабилизации закрытого состояния канала.
Рецептор рианодина 2 и сердечные заболевания
В поперечно-полосатых мышках сердца, RyR2 является основным каналом, высвобождающим Са2+, необходимым для сопряжения возбуждения-сокращения (ЕС) и сокращения мышц. При ЕС сопряжении, деполяризация мембраны сердечной мышечной клетки в фазе ноль действия потенциала активирует потенциалозависимые Са2+ каналы. Поступление Са2+ через открытые потенциалозависимые каналы, в свою очередь, инициирует высвобождение Са2+ из SR через RyR2. Этот процесс известен как Са2+-индуцированное высвобождение Са2+. Затем RyR2-опосредованное Са2+-индуцированное высвобождение Са2+ активирует сократительные белки в сердечной клетке, что приводит к сокращению сердечной мышцы.
Фосфорилирование RyR2 с помощью протеинкиназы А (PKA) является важной частью ответа "бей или беги", который повышает сердечное ЕС связанное усиление путем увеличения количества Са2+, высвобождаемого для данного триггера. Этот путь передачи сигналов обеспечивает механизм, с помощью которого активация симпатической нервной системы (SNS), в ответ на стресс, приводит к повышенному сердечному выбросу. Фосфорилирование RyR2 с помощью РКА приводит к частичной диссоциации калстабин 2 из канала, которая, в свою очередь, приводит к повышенной вероятности открытия и повышенному высвобождению Са2+ из SR во внутриклеточную цитоплазму.
Сердечная недостаточность (HF) характеризуется долгосрочным гиперадренергическим состоянием, при котором уровни катехоламина в сыворотке хронически повышены. Одним из последствий этого хронического гиперадренергического состояния является устойчивое PKA гиперфосфорилирование RyR2, таким образом, что 3-4 из четырех Ser 2808 в каждом гомотетрамерном RyR2 канале хронически фосфорилированы (Marx SO и др. Cell, 2000; 101(4): 365-376). В частности, хроническое PKA гиперфосфорилирование RyR2 связано с истощением канал-стабилизирующей субъединицы калстабин 2 из макромолекулярного комплекса RyR2 канала. Истощение калстабина приводит к диастолической SR Са "утечке" из RyR комплекса, что способствует ослабленной сокращаемости (Marx и др., 2000). Вследствие активации входящих деполяризующих токов, эта диастолическая SR Са2+ "утечка" также связана со смертельными сердечными аритмиями (Lehnart и др., J Clin Invest. 2008; 118(6): 2230-2245). Действительно, мыши, сконструированные с RyR2 с отсутствующим PKA сайтом фосфорилирования, защищены от HF прогрессии после инфаркта миокарда (MI) (Wehrens XH и др. Proc Natl Acad Sci USA. 2006; 103(3): 511-518). Дополнительно, хроническое PKA гиперфосфорилирование RyR2 в HF связано с ремоделированием RyR2 макромолекулярного комплекса, который включает истощение фосфатаз (Marx и др. 2000) РР1 и РР2а (ослабленное дефосфорилирование Ser 2808) и сАМР-специфический тип 4 фосфодиэстераз (PDE4D3) из RyR2 комплекса. Истощение PDE4D3 из RyR2 комплекса вызывает долговременное повышение локальных уровней cAMP (Lehnart SE и др., Cell 2005; 123(1): 25-35). Таким образом, диастолическая SR Са2+ утечка способствует HF прогрессированию и аритмиям. Кроме того, в недавнем отчете было показано, что у «нокин» мышей RyR2-S2808D+/+ (аспарагиновая кислота, заменяющая серии 2808) мимическое конститутивное PKA гиперфосфорилирование RyR2, проявляет истощение калстабин 2 и утечку RyR2. У мышей RyR2-S2808D+/+ развивается зависимая от возраста кардиомиопатия, проявляется повышенное RyR2 окисление и нитрозилирование, уменьшенное содержание SR Са2+ запасов и повышенная диастолическая SR Са2+ утечка. После инфаркта миокарда, у мышей RyR2-S2808D+/+ проявляется повышенная смертность по сравнению с WT однопометными животными. Лечение с помощью S107, производного 1,4-бензотиазепина, которое стабилизирует RyR2-калстабин 2 взаимодействия (WO 2007/024717), ингибирует RyR2-опосредованную диастолическую SR Са утечку и уменьшает HF прогрессирование, как у мышей WT, так и у мышей RyR2-S2808D+/+ (Shan и др., J Clin Invest. 2010 Dec 1; 120(12): 4375-87).
Кроме того, RyR2 содержит около 33 свободных тиольных остатков, придающих ему высокую чувствительность к окислительно-восстановительному состоянию в клетке. Окисление цистеина облегчает RyR открытие и SR Са2+ утечку. Shan и др., 2010, показали, что окисление и нитрозилирование RyR2 и диссоциация стабилизирующей субъединицы калстабин 2 из RyR2 индуцирует SR Са2+ утечку.
Катехоламинергическая полиморфная желудочковая тахикардия (CPVT) представляет собой наследственное нарушение у особей со структурно нормальными сердцами. Более чем 50 индивидуальных RyR2 мутаций были связаны с CPVT. У пациентов с CPVT наблюдается обморок и внезапная сердечная смерть (SCD) от подросткового возраста до совершеннолетия, и к 35 годам смертность составляет вплоть до 50%. У особей с CPVT наблюдаются желудочковые аритмии при нагрузках, но в состоянии покоя аритмии не развиваются. CPVT-ассоциированные RyR2 мутации приводят к "дающим утечку" RyR2 каналам вследствие снижения связывания субъединицы калстабин 2 (Lehnart и др., 2008). Мыши, гетерозиготные по R2474S мутации в RyR2 (RyR2-R2474S мыши), проявляют самопроизвольные генерализированные тонико-клонические пароксизмы (которые развиваются при отсутствии сердечных аритмий), вызванные физической нагрузкой желудочковые аритмии и SCD. Лечение с помощью S107 увеличивает связывание калстабин 2 с мутантным RyR2-R2474S каналом, ингибирует утечку канала, предотвращает сердечные аритмии и повышает судорожный порог (Lehnart и др., 2008).
Рецептор рианодина 1 и заболевания скелетных мышц
Сокращения скелетных мышц активируется SR Са2+, высвобождаемым с помощью RyR1. Деполяризация поперечной (Т)-канальцевой мембраны активирует потенциальный датчик дигидропиридинового рецептора (Cav1.1), который, в свою очередь, активирует RyR1 каналы посредством прямого белок-белкового взаимодействия, вызывая высвобождение SR Са2+ запасов. Са2+ связывается с тропонином С, предоставляя возможность происходить перекрестному связыванию актина-миозина и укорочению саркомера.
В условиях пролонгированного мышечного стресса (например, при беге на марафонные дистанции) или при заболевании, таком как сердечная недостаточность, которые оба характеризуются хронической активацией SNS, функционирование скелетных мышц нарушается, вероятно, вследствие изменения ЕС связывания. В частности, количество Са, высвобождаемое из SR при каждом сокращении мышцы, уменьшается, могут происходить явления аберрантного высвобождения Са2+ и замедляется обратное поглощение Са2+ (Reiken, S. и др. 2003. J. Cell Biol. 160: 919-928). Эти наблюдения свидетельствуют о том, что вредные эффекты хронической активации SNS на скелетные мышцы может быть обусловлена, по меньшей мере частично, дефектами в Са передаче сигналов.
RyR1 макромолекулярный комплекс состоит из тетрамера 560 кДа RyR1 субъединицы, которая образует каркас для белков, которые регулируют функционирование канала, включая PKA и фосфодиэстераза 4D3 (PDE4D3), протеинфосфатаза 1 (РР1) и калстабин 1. A-киназный якорный белок (mAKAP) нацеливает PKA и PDE4D3 на RyR1, в то время как синофилин нацеливает РР1 на канал (Marx и др. 2000; Brillantes и др., Cell, 1994, 77, 513-523; Bellinger и др. J. Clin. Invest. 2008, 118, 445-53). Каталитические и регуляторные субъединицы PKA, РР1, и PDE4D3 регулируют PKA-опосредованное фосфорилирование RyR1 на Ser2843 (Ser2844 у мышей). Было показано, что PKA-опосредованное фосфорилирование RyR1 при Ser2844 повышает чувствительность канала к цитоплазматическому Са, уменьшает связывающую способность калстабин 1 к RyR1 и дестабилизирует закрытое состояние канала (Reiken и др., 2003; Marx, S.O. и др., Science, 1998, 281: 818-821). Описано, что концентрации калстабин 1 в скелетных мышцах составляют приблизительно 200 нМ и что PKA фосфорилирование RyR1 уменьшает связывающую способность калстабин 1 к RyR1 от приблизительно 100-200 нМ до более чем 600 нМ. Таким образом, в физиологических условиях, уменьшение связывающей способности калстабин 1 к RyR1, возникающее вследствие PKA фосфорилирования RyR1 на Ser2843, достаточно для существенного уменьшения количества калстабин 1, присутствующего в RyR1 комплексе. Хроническое PKA гиперфосфорилирование RyR1 Hat Ser2843 (определяемое как PKA фосфорилирование 3 или 4 из 4 PKA Ser2843 сайтов, присутствующих в каждом RyR1 гомотетрамере) приводит к "дающим утечку" каналам (то есть каналы, подверженные открытию в состоянии покоя), что способствует нарушению функций скелетных мышц, которая связана с устойчивыми гиперадренергическими состояниями, такими как происходящие у особей с сердечной недостаточностью (Reiken и др., 2003).
Кроме того, было описано, что регуляция RyR1 посредством посттрансляционных модификаций, отличающихся от фосфорилирования, таких как нитрозилирование свободных сульфгидрильных групп на остатках цистеина (S-нитрозилирование), а также окисление канала повышает активность RyR1 канала. Было показано, что S-нитрозилирование и окисление RyR1 каждый уменьшается связывание калстабин1 связывание с RyR1.
Ранее Bellinger и др. (Proc. Natl. Acad. Sci. 2008, 105(6): 2198-2002) было показано, что при чрезмерных нагрузках у мышей и людей, RyR1 прогрессивно PKA-гиперфосфорилирован, S-нитрозилирован и истощен PDE4D3 и калстабин1, что приводит к "дающим утечку" каналам, которые вызывают снижение способности переносить физическую нагрузку у мышей. Лечение с помощью S107 предотвращает истощение калстабин 1 из RyR1 комплекса, улучшает создание силы и способность переносить физическую нагрузку и уменьшает активность Са2+ "зависимой нейтральной протеазы кальпаин и уровни креатинин-киназы в плазме.
Мышечная дистрофия Дюшенна (DMD) представляет собой одно из основных летальных генетических заболеваний у детей. DMD связана с X хромосомой, поражая 1 из 3,5 тыс. новорожденных особей мужского пола и типично приводит к смерти приблизительно в возрасте ~30 лет от дыхательной или сердечной недостаточности. Мутации в дистрофине, ассоциированные с DMD, приводят к полной потере дистрофинового белка, таким образом разрушая связь между субсарколеммным цитоскелетом и внеклеточным матриксом. Эта связь является необходимой для защиты и стабилизации мышцы от повреждения, вызванного сокращением. В настоящее время, отсутствует лечение DMD и большинство лечений являются паллиативными. Перспективные интервенции в Фазе I/II клинических исследований представляют собой перескакивание экзонов, ингибирование миостатина и повышенную регуляцию утрофина. Тем не менее, существуют проблемы с системной доставкой, поддерживанием перескакивания экзонов и повышенной регуляций утрофина. Дополнительно, в Фазе I/II клинических исследований, инактивация миостатина для повышения размера мышц не проявляет улучшения относительно мышечной силы или функции. Нестабильность сарколеммы вследствие мутаций в дистрофине имеет каскадный эффект. Одним из основных эффектов является повышение цитозольной концентрации Са2+, что приводит к активации Са2+- зависимых протеаз (кальпаинов). Другим эффектом является воспаление и повышение активности iNOS, что может вызывать окисление / нитрозилирование белков, липидов и ДНК. DMD патология мышц является прогрессирующей и значительно превышает нестабильность сарколеммы. Таким образом, патология согласуется с нестабильностью сарколеммы, повышая чувствительность к дальнейшему повреждению. Недавно было показано, что чрезмерное окисление или нитрозилирование RyR1 может разрушать взаимодействие калстабин 1 с RyR1 комплексом, приводя к RyR1 утечке и мышечной слабости на мышиной модели мышечной дистрофии (mdx) и что лечение с помощью S107 улучшает показатели функционирования мышц на этой мышиной модели (Bellinger, А. и др. 2009, Nature Medicine, 15: 325-330).
Возрастная потеря мышечной массы и силы (саркопения) способствует инвалидности и повышает смертность. Andersson, D. и др. (Cell Me tab. 2011 Aug 3; 14(2): 196-207) описали, что RyR1 от старых (24 месяцев) мышей окислена, цистеин-нитрозилирована и истощена на калстабин 1, по сравнению с RyR1 от более молодых (3-6 месяцев) взрослых особей. Ремоделирование этого комплекса RyR1 канала приводит к "дающим утечку" каналам с повышенной вероятностью открытия, что обуславливает внутриклеточную утечку кальция в скелетных мышцах. Лечение старых мышей с помощью S107 стабилизирует связывание калстабин 1 с RyR1, уменьшает внутриклеточную утечку кальция, снижает активные формы кислорода (ROS) и повышает тетаническое высвобождение Са2+, удельную мышечную силу и способность переносить физическую нагрузку.
В опубликованных РСТ международных патентных заявках WO 2005/094457, WO 2006/101496 и WO 2007/024717 описаны производные 1,4-бензотиазепина и их применение для лечения, в частности, сердечных нарушений, нарушений скелетных мышц и когнитивных нарушений.
Опубликованная РСТ международная патентная заявка WO 2008/060332 относится к применению производных 1,4-бензотиазепина для лечения мышечного утомления у субъектов, страдающих от таких патологий, как мышечная дистрофия, или у субъектов, страдающих от мышечного утомления в результате долговременной, длительной и/или энергичной нагрузки, или хронического стресса.
Опубликованная РСТ международная патентная заявка WO 2008/021432 относится к применению производных 1,4-бензотиазепина для лечения и/или предотвращения заболеваний, нарушений и состояний, поражающих нервную систему.
Опубликованная РСТ международная патентная заявка WO 2012/019076 относится к применению производных 1,4-бензотиазепина для лечения и/или предотвращения кардиального ишемического/реперфузионного повреждения. Fauconnier и др., Proc Natl Acad Sci USA, 2011, 108(32): 13258-63 описали, что RyR утечка, опосредованная активацией каспазы-8, приводит к повреждению левого желудочка после миокардиальной ишемии-реперфузии и что лечение с помощью S107 ингибирует SR Са2+ утечку, уменьшает желудочковые аритмии, размер инфаркта и реконструкцию левого желудочка на 15 дней после реперфузии.
Опубликованная РСТ международная патентная заявка WO 2012/019071 относится к применению производных 1,4-бензотиазепина для лечения и/или предотвращения саркопении.
Опубликованная РСТ международная патентная заявка WO 2012/037105 относится к применению производных 1,4-бензотиазепина для лечения и/или предотвращения индуцированных стрессом нарушений и заболеваний нейронов.
Существует потребность в идентификации новых соединений, эффективных для лечения нарушений и заболеваний, связанных с RyRs, включая нарушения и заболевания скелетных мышц и нарушения сердечной деятельности и кардиологические заболевания. Более предпочтительно, существует потребность в идентификации новых средств, которые можно использовать для лечения RyR-ассоциированных нарушений, например, путем репарации утечки в RyR каналах и усиления связывания калстабинов с PKA-фосфорилированными/окисленными/нитрозилированными RyRs и с мутантными RyRs, которые другим способом имеют уменьшенное сродство к или не связываются с калстабинами.
Сущность изобретения
Настоящее изобретение обеспечивает новые производные 1,4-бензотиазепина и их фармацевтически приемлемые соли. В некоторых вариантах осуществления соединения согласно настоящему изобретению представляют собой стабилизаторы рецептора рианодина (RyR) кальциевого канала, в некоторых источниках обозначаемые как "Rycals™." Настоящее изобретение дополнительно обеспечивает способы применения этих соединений для лечения нарушений и заболеваний, связанных с RyRs.
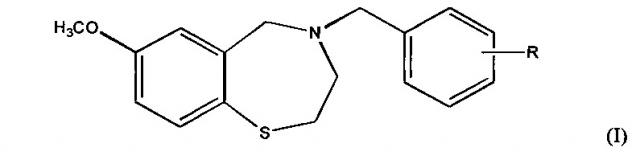
Соединения согласно настоящему изобретению выбирают из производных 1,4-бензотиазепина, описанных в WO 2007/024717. В WO 2007/024717 раскрыты структурно сходные соединения, тем не менее, как более подробно описано в настоящей заявке, было обнаружено, что эти соединения являются очень нестабильными и, следовательно, их терапевтическая активность в качестве лекарственных средств ограничена. Таким образом, задачей, лежащей в основе настоящего изобретения, является обеспечение альтернативных производных 1,4-бензотиазепина, которые являются не только фармакологически активными - но также имеют благоприятные свойства, такие как высокая метаболическая стабильность, и, следовательно, они являются пригодными в качестве лекарственных средств для лечения заболеваний и состояний, связанных с RyR, например, кардиальных нарушений, нарушений скелетных мышц и нарушений центральной нервной системы (ЦНС). Неожиданно было обнаружено, что соединения формулы (I) являются стабильными, а также фармакологически активными, таким образом обеспечивая техническое решение задачи, лежащей в основе настоящего изобретения.
Соединения согласно настоящему изобретению представлены структурой формулы (I):
где R представляет собой COOH;
и его фармацевтически приемлемые соли.
Соединения формулы (I) могут быть представлены в форме соли с фармацевтически приемлемой кислотой или основанием. Такие соли предпочтительно выбирают из группы, включающей соли натрия, калия, магния, гемифумарат, гидрохлорид и гидробромид, с каждой возможностью представляя отдельный вариант осуществления настоящего изобретения. Одна предпочтительная сейчас соль представляет собой натриевую соль. Другая предпочтительная сейчас соль представляет собой гемифумаратную соль.
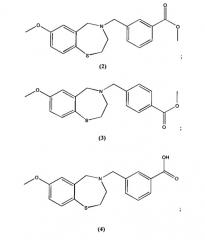
В некоторых специфических вариантах осуществления соединение выбирают из группы, включающей соединение 1, соединение 4 и соединение 6 и его фармацевтически приемлемые соли. Структуры этих соединений представлены в настоящей заявке ниже.
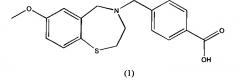
В предпочтительном варианте осуществления соединение представлено структурой соединения (1):
или его фармацевтически приемлемые соли.
В некоторых вариантах осуществления соединение 1 обеспечивается в виде исходного соединения. Тем не менее, в других вариантах осуществления соединение 1 обеспечивается в форме соли с фармацевтически приемлемой кислотой или основанием. Предпочтительно, такую соль выбирают из группы, включающей соли натрия, калия, магния, гемифумарат, гидрохлорид и гидробромид, с каждой возможностью представляя отдельный вариант осуществления настоящего изобретения. Одна предпочтительная сейчас соль представляет собой натриевую соль. Другая предпочтительная сейчас соль представляет собой гемифумаратную соль.
Настоящее изобретение также обеспечивает способы синтеза соединений согласно изобретению и их солей.
Настоящее изобретение также обеспечивает фармацевтические композиции, которые содержат одно или несколько соединений согласно изобретению и по меньшей мере одно вспомогательное вещество или наполнитель, например, заполнители, разбавители, связующие, агенты, вызывающие дезинтеграцию, буферные вещества, красители, эмульсификаторы, средства, улучшающие запах, гелеобразующие вещества, скользящие вещества, консерванты, солюбилизаторы, стабилизаторы, суспендирующие агенты, подсластители, вещества, регулирующие тоничность, смачивающие вещества, эмульсификаторы, диспергирующие вещества, агенты, вызывающие набухание, ретарданты, скользящие вещества, абсорбирующие вещества и средства, повышающие вязкость. Композиции могут быть представлены в дозированной форме в виде капсул, гранул, порошков, растворов, саше, суспензий, или таблеток.
Настоящее изобретение дополнительно обеспечивает способы лечения или предотвращения различных нарушений, заболеваний и состояний, связанных с RyRs, такие как кардиальные, мышечно-скелетные когнитивные, ЦНС и нейромышечные нарушения и заболевания, которые включают введение субъекту, нуждающемуся в таком лечении, количества соединения формулы (I) или его соли, эффективного для предотвращения или лечения нарушения или заболевания, связанного с RyR. Настоящее изобретение также обеспечивает способ предотвращения или лечения утечки в RyR (включая RyR1, RyR2 и RyR3) у субъекта, включающего введение субъекту количества соединения формулы (I) или его соли, эффективного для предотвращения или лечения утечки в RyR.
Дополнительно, настоящее изобретение обеспечивает способ модулирования связывания RyRs и калстабинов у субъекта, включающий введение субъекту количества соединения формулы (I) или его соли, эффективного для модуляции количества RyR-связанного калстабина.
Настоящее изобретение дополнительно относится к применению соединения формулы (I) для приготовления лекарственного средства для лечения и/или предотвращения нарушений, заболеваний и состояний, связанных с RyRs, таких как кардиальные, мышечно-скелетные и когнитивные нарушения и заболевания/нарушения и заболевания ЦНС. В другом варианте осуществления настоящее изобретение относится к применению соединения формулы (I) для приготовления лекарственного средства для предотвращения или лечения утечки в RyR. В другом варианте осуществления настоящее изобретение относится к применению соединения формулы (I) для приготовления лекарственного средства для модуляции количества RyR-связанных калстабинов.
Способы согласно изобретению могут быть практически осуществлены на системах in vitro (например, культивируемые клетки или ткани) или in vivo (например, на животном, отличающемся от человека, или человеке).
В некоторых вариантах осуществления соединения согласно изобретению обеспечиваются в комбинации с терапией перескакивания экзона, например, антисмысловыми олигонуклеотидами (AOs), таким образом, чтобы усилить перескакивание экзона в мРНК, представляющей интерес, например, DMD ген, как в дальнейшем описано в настоящей заявке. Другие характерные особенности и преимущества настоящего изобретения будут понятны со следующих подробных описаний и фигур.
Краткое описание чертежей
Фигура 1A. Иммуноблот с антителом к калстабин 2, показывающий связывание калстабин 2 с PKA-фосфорилированным RyR2 при отсутствии (-) или в присутствии 100 нМ соединения 1. (+): калстабин связывается с не-PKA фосфорилированным RyR2. S36 (US 7,544,678), использовали в качестве положительного контроля.
Фигура 1B. Иммуноблот с антителом к калстабин 2, показывающий связывание калстабин 2 с PKA-фосфорилированным RyR2 при отсутствии (-) или в присутствии 100 нМ соединения 2, соединения 3 или соединения 4. (+): калстабин связывается с не-PKA фосфорилированным RyR2. S36 использовали в качестве положительного контроля.
Фигура 1C. Иммуноблот с антителом к калстабин 1, показывающий связывание калстабин 1 с PKA-фосфорилированным RyR1 при отсутствии (Отриц) или в присутствии указанных концентраций соединения 1 или соединения 4. (Полож): калстабин связывается с не-PKA фосфорилированным RyR1. S36 использовали в качестве положительного контроля.
Фигура 2. Фигура 2A: Иммуноблот с антителом к калстабин 1, который показывает уровни калстабин 1 в иммуноосажденных RyR1 комплексах из лизатов большеберцовой кости у мышей, которым вводили носитель (50:50 ДМСО/PEG), только изопротеренол (ISO) или изопротеренол совместно с указанными концентрациями соединения 1 в осмотических насосах. S36 использовали в качестве контроля при 3,6 мМ. Фигура 2B: определение количества % калстабин 1, который повторно связывается с RyR1.
Фигура 3. Модель хронической сердечной недостаточности у крыс, индуцируемая ишемически-реперфузионным (I/R) повреждением. Для I/R протокола, переднюю нисходящую ветвь (LAD) левой коронарной артерии окклюзировали в течение 1 ч.
Фигура 4. Объемы левого желудочка (LV) и фракции выброса (EF) у крыс, леченных с помощью соединения 1 в дозе 5 мг/кг/д (5 MK) или 10 мг/кг/д (10 MK) в питьевой воде отн. леченных с помощью наполнителя (H2O) и ложнооперированных животных. Хроническую сердечную недостаточность индуцировали путем ишемически-реперфузионного (I/R) повреждения. LAD артерию окклюзировали в течение 1 ч; лечение начинали через 1 неделю после реперфузии и продолжали в течение 3 месяцев. Эхокардиографические параметры получали через 1, 2 или 3 месяца после лечения. Фигура 4A: LV Конечный диастолический объем; Фигура 4B: LV Конечный систолический объем; Фигура 4C: EF. Фигуры 4A и 4B: § P<0,001 отн. ложн.; * P<0,05 отн. наполнителя; † P<0,001 отн. наполнителя. Фигура 4C: § P<0,001 отн. ложн., † P<0,001 отн. наполнителя.
Фигура 5. На фигурах 5A-С представлены вес тела (BW) (5A), размер инфаркта (5B) и вес LV (5C), и на фигуре 5D представлено содержание коллагена у крыс, леченных с помощью соединения 1 в дозе 5 мг/кг/д (5 MK) и 10 мг/кг/д (10 MK) в питьевой воде отн. леченных с помощью наполнителя(H2O) - и ложнооперированных животных. Хроническую сердечную недостаточность индуцировали путем ишемически-реперфузионного (I/R) повреждения. LAD артерию окклюзировали в течение 1 ч; лечение начинали через 1 неделю после реперфузии и продолжали в течение 3 месяцев. Параметры измеряли через 3 месяца после лечения. Фигуры 5A-C: не достоверны. Фигура 5D: ††† P<0,001 отн. ложн.; * P<0,05 отн. наполнителя.
Фигура 6. Инвазивные гемодинамики: Систолическое давление в левом желудочке (LV SP) (6A), dP/dtmax (6B); и dP/dtmin (6C) у крыс, леченных с помощью соединения 1 в дозе 5 мг/кг/д (5 MK) или 10 мг/кг/д (10 MK) в питьевой воде отн. леченных с помощью наполнителя (H2O) и ложнооперированных животных. Хроническую сердечную недостаточность индуцировали путем ишемически-реперфузионного (I/R) повреждения. LAD артерию окклюзировали в течение 1 ч; лечение начинали через 1 неделю после реперфузии и продолжали в течение 3 месяцев. Гемодинамические параметры измеряли через 3 месяца после лечения. Фигура 6A: не достоверны. Фигура 6B: § P<0,05 отн. ложн.; * P<0,05 отн. наполнителя. Фигура 6C: † P<0,01 отн. ложн.; * P<0,05 отн. наполнителя.
Фигура 7. Концентрации соединения 1 в плазме (мкМ) отн. времени суток.
Фигура 8. EF у крыс, леченных с помощью соединения 1 или соединения А в дозе 5 мг/кг/д (5 MK) в питьевой воде отн. леченных с помощью наполнителя (H2O) и ложнооперированных животных. LAD артерию окклюзировали в течение 1 ч; лечение начинали через 1 неделю после реперфузии и продолжали в течение 3 месяцев. Эхокардиографические параметры получали через 1, 2 или 3 месяца после лечения. § P<0,001 отн. ложн.; * P<0,05 отн. наполнителя; † P<0,001 отн. наполнителя.
Фигура 9. Влияние соединения 1 на самопроизвольную физическую активность mdx и WT мышей по сравнению с контролем, леченным с помощью наполнителя (H2O). P<0,001 для активности в дни 1-19 у мышей mdx, которым вводили дозу 10 и 50 мг/кг/сутки (целевая доза) в питьевой воде, по сравнению с контрольным наполнителем.
Фигура 10. Специфическое соотношение сила-частота EDL мышцы. (А) mdx мыши, леченные с помощью соединения 1 (5, 10 и 50 мг/кг/д (целевая доза)), которое вводили в питьевой воде, по сравнению с контролем, леченным с помощью наполнителя (H2O) (n=5). p<0,05, для дозы 50 мг/кг/д, при частотах 150 Гц и выше. (В) WT, C57BL/6, мыши, леченные с помощью соединения 1 (50 мг/кг/д (целевая доза), которое вводили в питьевой воде, по сравнению с контролями, леченными с помощью наполнителя (H2O) (n=4)
Фигура 11. Средний вес тела (12A) и среднее потребление воды (12B) для mdx и WT мышей, леченных с помощью наполнителя (H2O) или соединения 1 (50 мг/кг/д (целевая доза), которое вводили в питьевой воде.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подразумевается, что подробное описание и специфические примеры, в то время как раскрывают различные варианты осуществления изобретения, представлены только с целью иллюстрации, при этом различные изменения и модификации в пределах сущности и объема изобретения станут очевидными для специалистов в данной области техники из этого подробного описания.
Как используется в настоящей заявке и приложенных пунктах формулы изобретения, формы единственного числа включают также формы множественного числа, если из контекста очевидно не следует иначе. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящей заявке, полностью включены в качестве ссылки.
Термин "Rycals™" относится к стабилизаторам кальциевого канала рецептора рианодина, представленным соединениями общей Формулы (I) или (IA), как обеспечивается изобретением, а также специфическими соединениями, обозначенными цифровыми номерами, как обеспечивается изобретением, и в настоящей заявке собирательно обозначается как "соединение(я) согласно изобретению".
Соединения
В некоторых вариантах осуществления соединения согласно настоящему изобретению представлены структурой формулы (IA):
где R представляет собой COOH или его биоизостер, COOR1 или CN; и
R1 представляет собой C1-C4 алкил;
и его фармацевтически приемлемые соли.
В некоторых предпочтительных вариантах осуществления R в Формуле (IA) представляет собой карбоновую кислоту (COOH). В других предпочтительных вариантах осуществления R в Формуле (IA) представляет собой биоизостер карбоновой кислоты, например, тетразол. Альтернативно, биоизостер карбоновой кислоты может представлять собой кислый гетероцикл, такой как 1,2,4-оксадиазол-5(4H)-он, 1,2,4-тиадиазол-5(4H)-он, 1,2,4-оксадиазол-5(4H)-тион, 1,3,4-оксадиазол-2(3H)-тион, 4-метил-1H-1,2,4-триазол-5(4H)-тион, 5-фтороротовую кислоту и другие. Дополнительные биоизостеры карбоновых кислот описаны, например, в Hamada, Y. и др., Bioorg. Med. Chem. Lett. 2006; 16: 4354-4359; Herr, R.J. и др., Bioorg. Med. Chem. 2002; 10: 3379-3393; Olesen, P.H., Curr. Opin. Drug Discov. Devel. 2001; 4: 471; Patani. G.A. и др., J. Chem. Rev. 1996; 96: 3147; Kimura, T. и др. Bioorg. Med. Chem. Lett. 2006; 16: 2380-2386; и Kohara, Y. и др. Bioorg. Med. Chem. Lett. 1995; 5(17): 1903-1908. Содержание каждой из вышеуказанных ссылок включено в настоящую заявку в качестве ссылки.
В одном предпочтительно варианте осуществления соединения согласно настоящему изобретению представлено структурой формулы (IA), где R представляет собой COOH и его фармацевтически приемлемые соли (то есть соединение формулы (I)).
В других предпочтительных вариантах осуществления R в Формуле (IA) находится в положении 4 фенильного кольца (то есть положении 7 бензотиазепинового кольца). Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. Соединения формулы (IA) или (I) могут быть представлены в форме соли с фармацевтически приемлемой кислотой или основанием. Такие соли предпочтительно выбирают из группы, включающей натрия, калия, магния, гемифумарат, гидрохлорид и гидробромид соли, с каждой возможностью представляя отдельный вариант осуществления настоящего изобретения. Одна предпочтительная сейчас соль представляет собой натриевую соль. Другая предпочтительная сейчас соль представляет собой гемифумаратную соль.
В некоторых специфических вариантах осуществления соединение выбирают из группы, включающей соединение 1, соединение 2, соединение 3, соединение 4, соединение 5, соединение 6, соединение 7, соединение 8, соединение 9, соединение 10, соединение 11 и соединение 12 и его фармацевтически приемлемые соли. Эти соединения представлены следующими структурами:
; и
Химические определения
Термин "алкил", как используется в настоящей заявке, относится к линейному или разветвленному, насыщенному углеводороду, который имеет от 1 до 4 атомов углерода ("C1-C4 алкил"). Типичные алкильные группы включают, но не ограничиваясь только ими, метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил. Алкильная группа может быть незамещена или замещена одной или несколькими группами, выбранными из галогена, галоалкила, гидрокси, алкокси, галоалкокси, циклоалкила, арила, гетероциклила, гетероарила, амидо, алкиламидо, диалкиламидо, нитро, амино, циано, N3, оксо, алкиламино, диалкиламино, карбоксила, тио, тиоалкила и тиоарила.
Соединения согласно настоящему изобретению могут существовать в их таутомерной форме. Все такие таутомерные формы рассматриваются в данной заявке как часть настоящего изобретения.
Все стереоизомеры соединений согласно настоящему изобретению (например, те, которые могут существовать благодаря ассиметричным углеродам на различных заместителях), включая энантиомерные формы и диастереомерные формы, также охватываются объемом настоящего изобретения. Индивидуальные стереоизомеры соединения согласно изобретению, например, могут быть по существу свободными от других изомеров (например, в виде чистого или по существу чистого оптического изомера, имеющего удельную активность) или могут быть смешаны, например, в виде рацематов или в виде смесей, обогащенных одним стереоизомером. Хиральные центры согласно настоящему изобретению могут иметь S или R конфигурацию, как определено Рекомендациями ИЮПАК (IUPAC) 1974. Рацемические формы могут быть разделены физическими методами, такими как, например, фракционированная кристаллизация, разделение или кристаллизация производных диастереомеров или разделение с помощью хиральной колоночной хроматографии. Индивидуальные оптические изомеры могут быть получены из рацематов с помощью любого подходящего метода, включая, без ограничений, общепринятые методы, такие как, например, образование соли с оптически активной кислотой или основанием, с последующей кристаллизацией.
Соединения согласно настоящему изобретению, после их получения, предпочтительно выделяют и очищают, получая композицию, содержащую количество по весу, равное или больше чем приблизительно 90% соединения, приблизительно 95% соединения и даже более предпочтительно больше чем приблизительно 99% соединения ("по существу чистое" соединение), которое затем используют или приготавливают в виде фармацевтического препарата, как описано в настоящей заявке. Такие "по существу чистые" соединения согласно настоящему изобретению также рассматриваются в данной заявке как часть настоящего изобретения.
Терапевтическое применение
Настоящее изобретение обеспечивает соединения, которые способны лечить состояния, нарушения и заболевания, связанные с RyRs. Более предпочтительно, настоящее изобретение обеспечивает соединения, которые способны фиксировать утечку в RyR каналах, которые могут представлять собой RyR1, RyR2 и/или RyR3 каналы. В одном варианте осуществления соединения согласно изобретению усиливают ассоциацию и/или ингибируют диссоциацию RyR и калстабина (например, RyR1 и калстабин 1; RyR2 и калстабин 2; и RyR3 и калстабин 1). "Состояния, нарушения и заболевания, связанные с RyRs", обозначают нарушения и заболевания, которые можно лечить и/или предотвращать путем модуляции RyRs и включают, без ограничений, нарушения сердечной деятельности и кардиологические заболевания, мышечное утомление, нарушения и заболевания опорно-двигательного аппарата, нарушения и заболевания ЦНС, когнитивную дисфункцию,