Материал стволовых клеток и способ его получения
Иллюстрации
Показать всеИзобретение относится к клеточным технологиям. Описана линия мезенхимальных стволовых клеток (hb-MSC) для терапевтического применения, задепонированная во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под регистрационным номером Н-154. При этом линия обладает по меньшей мере одной из следующих характеристик: при посеве 0,7×106 клеток во флакон площадью 75 см2 и культивировании в течение по меньшей мере 96 часов: (а) клетки продуцируют по меньшей мере 4,5 мМ лактата в течение 24 часов после замены среды; (b) клетки продуцируют по меньшей мере 150 пг/мл GRO/KC в течение 24 часов после замены среды; (с) клетки продуцируют менее чем 250 пг/мл OPG через 24 часа после замены среды; или (d) клетки продуцируют менее чем 80 пг/мл TGF-β3 через 24 часа после замены среды. Также описаны кондиционированные среды для терапевтического применения, полученные путём культивирования указанной выше линией, и применение данных сред. Изобретение расширяет арсенал терапевтических средств. 9 н. и 53 з.п. ф-лы, 7 ил., 3 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
[01] Композиции и способы, соответствующие вариантам осуществления настоящего изобретения, в целом, относятся к, по меньшей мере, области клеточной биологии, молекулярной биологии и медицины. Более конкретно, варианты осуществления настоящего изобретения относятся к стволовым клеткам, культуральной среде, кодиционированной стволовыми клетками, способам получения культуральной среды, кондиционированной стволовыми клетками, а также способам применения стволовых клеток и культуральных сред, кондиционированных стволовыми клетками.
УРОВЕНЬ ТЕХНИКИ
[02] Мезенхимальные стволовые клетки, или MSC, являются мультипотентными стромальными клетками, которые способны дифференцироваться в мезенхимальные клетки различных типов, например адипоциты, хондроциты и остеоциты. MSC обладают большим потенциалом для самообновления при сохранении их мультипотентности. MSC костного мозга в настоящее время применяются в клинических исследованиях для различных видов терапии. Процедуры выделения, очистки и размножения MSC в культуре хорошо известны в данной области техники.
[03] MSC можно культивировать с использованием бусин, в монослойных (т.е. двумерных) или трехмерных системах. Эти стандартные способы обеспечивают рост MSC в условиях, близко схожих с их физиологическими условиями среды. Было документально подтверждено, что поведение MSC может меняться в условиях in vivo и in vitro. Отличия между разными линиями MSC, как правило, были связаны с различиями в способах выделения и условиях культивирования in vitro. Например, изменения условий культивирования могут повлиять на поведение клеток in vitro, включая воздействие на экспрессию маркеров клеточной поверхности. Экспрессирование специфических маркеров на поверхностях клеток может быть использовано для дифференцировки различных клеточных линий или для подтверждения происхождения клеточной линии.
[04] Все клетки (включая MSC) в процессе культивирования продуцируют биологические продукты. Например, как известно, в процессе культивирования MSC продуцируют более 200 уникальных белков. Конкретные биологические продукты, которые продуцируются MSC в процессе культивирования, могут быть использованы для характеристики этих клеток и выявления отличий между различными MSC. Тем не менее, даже когда используются MSC из одного и того же источника, различия в способах выделения и условиях культивирования in vitro могут влиять на и изменять продуцирование секретируемых биологических продуктов. Разумеется, также известно, что отклонения от идеальных условий культивирования клеток может привести к ухудшению функционирования клеток и гибели культуры.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
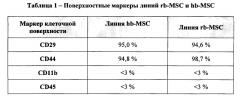
[05] В соответствии с одним аспектом настоящего изобретения представлена уникальная линия мезенхимальных стволовых клеток, полученных из костного мозга крыс линии Вистар, которая имеет одну или более определенных характеристик. Например, когда 0,7×106 клеток высевают во флакон площадью 75 см2 и культивируют в течение по меньшей мере 96 часов, линия мезенхимальных стволовых клеток может: (а) продуцировать по меньшей мере 4,5 мМ лактата в течение 24 часов после замены среды; (b) продуцировать по меньшей мере 150 пг/мл GRO/KC в течение 24 часов после замены среды; (с) клетки продуцируют менее чем 250 пг/мл OPG через 24 часа после замены среды; или (d) клетки продуцируют менее чем 80 пг/мл TGF-β3 через 24 часа после замены среды. В соответствии с другим аспектом, когда 0,7×106 клеток высевают в флакон площадью 75 см2 и культивируют в течение по меньшей мере 150 часов: (е) рН культуральной среды снижается до уровня ниже 7,0 в течение 24 часов после замены культуральной среды; или (f) рН культуральной среды снижается, по меньшей мере, на 0,4 единицы в течение 24 часов после замены культуральной среды по сравнению с рН культуральной среды в отсутствие клеток. Культуральная среда может представлять собой культуральную среду RPMI-1640 в присутствии 5% CO2. Кроме того, те же стволовые клетки могут удваивать свою популяцию по меньшей мере один раз при рН ниже 7,05. Линия стволовых клеток также может характеризоваться положительной экспрессией маркеров CD29 и CD44 и отрицательной экспрессией маркеров CD11b и CD45.
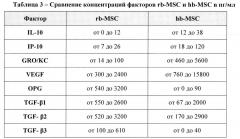
[06] Отдельный аспект настоящего изобретения относится к кондиционированной среде, которая может быть получена за счет поддержания множества уникальных стволовых клеток в культуральной среде в течение определенного периода кондиционирования. В одном аспекте культуральная среда представляет собой RPMI-1640 в присутствии 5% CO2. Клетки могут поддерживаться в культуральной среде в различных условиях, в том числе при атмосферной концентрации CO2 или в гипоксических условиях. В соответствии с аспектами настоящего изобретения период кондиционирования может изменяться. Например, период кондиционирования может составлять по меньшей мере 12 часов, или он может представлять собой период времени, достаточный для того, чтобы кондиционированная среда содержала по меньшей мере 150 пг/мл GRO/KC. В другом аспекте настоящего изобретения кондиционированная среда может содержать по меньшей мере одно из следующего: (а) по меньшей мере 500 пг/мл GRO/KC; (b) по меньшей мере 4000 пг/мл VEGF; (с) менее чем 250 пг/мл OPG; или (d) менее чем 80 пг/мл TGF-β3.
[07] Другой аспект настоящего изобретения относится к композиции, которая содержит уникальную линию стволовых клеток или культуральную среду, кондиционированную уникальными клетками. Композиция может также включать в себя приемлемый носитель. Носитель может включать жидкость, крем, аэрозоль, лосьон, мазь или гидрогель, но не ограничиваясь этим. В некоторых аспектах настоящего изобретения композиция может быть обработана для того, чтобы удалить некоторые или все стволовые клетки. В другом аспекте композиция может включать кондиционированную среду, которая содержит менее чем 250 пг/мл OPG или менее чем 80 пг/мл TGF-β3.
[08] В соответствии с аспектами настоящего изобретения уникальная линия стволовых клеток, кондиционированная среда или композиция могут быть введены субъекту посредством инъекции, имплантирования или с помощью местного нанесения. В соответствии с другими аспектами настоящего изобретения клетки, кондиционированная среда или композиция могут быть нанесены на шовный материал, перевязочный материал, вязаную сетку, имплант, стент, трансплантат, влажную салфетку или периодонтальную прокладку или другие устройства-аппликаторы. Клетки, кондиционированная среда или композиция имеют разнообразные виды применения, включая, например, лечение ожогов, уход за кожей, для ангиогенеза и васкулогенеза, репарацию, косметические средства, воспаление тканей, бактериальные инфекции, лечение ран, при диабете, фармацевтические и офтальмологические виды применения, снижение рубцевания, стимулирование роста волос, для иммунотерапии и иммунокоррекции, трансплантации органов, кожи, костного мозга, для лечения органов или тканей, или для лечения других заболеваний, как человека, так и животных.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[09] Указанные выше и/или другие аспекты настоящего изобретения станут более очевидными из подробного описания примеров вариантов его осуществления со ссылкой на прилагаемые чертежи, на которых:
[10] ФИГ. 1 показывает анализ проточной цитометрии маркеров клеточной поверхности hb-MSC, включая тип маркера и относительный процент маркеров.
[11] ФИГ. 2 показывает окрашенные красителем Гимза хромосомы из hb-MSC при Пассаже №9 (р9).
[12] ФИГ. 3 показывает электрофореграммы PCR-анализа hb-MSC и контроля.
[13] ФИГ. 4 показывает сравнение ран через девять дней после обработки культуральной средой RPMI-1640 и композицией hb-MSC.
[14] ФИГ. 5 показывает относительную скорость закрытия ран, обработанных культуральной средой RPMI-1640 и композицией hb-MSC у мышей.
[15] ФИГ. 6 показывает изменение рН во времени для среды RPMI-1640, среды, кондиционированной rb-MSC, и среды, кондиционированной hb-MSC.
[16] ФИГ. 7 показывает изменение концентрации лактата (мМ) (мМ) в процессе культивирования клеток hb-MSC и rb-MSC.
ПОДРОБНОЕ ОПИСАНИЕ
[17] В дальнейшем в этом документе разные примеры вариантов осуществления настоящего изобретения будут объяснены со ссылкой на прилагаемые чертежи. Аспекты настоящего изобретения могут быть воплощены в различных формах без ограничения вариантами осуществления, изложенными в этом документе. Следует понимать, что любые заголовки или подзаголовки, используемые в данном описании, приводятся только для удобства и никоим образом не ограничивают объем или значение формулы изобретения. И, наконец, следует иметь в виду, что, как используется в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное.
[18] Один вариант осуществления настоящего изобретения относится к новой линии мезенхимальных стволовых клеток (далее в этом документе линия «hb-MSC»). Образец линии hb-MSC задепонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) с регистрационным номером Н-154. Клеточная линия задепонирована под названием MSCR05P09. Экспрессия маркеров клеточной поверхности линии hb-MSC согласуется с экспрессией маркеров мезенхимальной стволовой клетки.
[19] Другой вариант осуществления настоящего изобретения относится к среде, кондиционированной с помощью hb-MSC, и способу ее получения. Кондиционированная среда содержит бесчисленное множество биологических продуктов, небольших молекул и экзосом, способных проявлять множество биологических функций.
[20] Дополнительный вариант осуществления относится к композиции hb-MSC. Композиция hb-MSC может включать: (1) hb-MSC, среду, кондиционированную культурой hb-MSC, или любую их комбинацию; и (2) приемлемый носитель. hb-MSC, среду, кондиционированную культурой hb-MSC, и композицию hb-MSC можно использовать в любом агрегатном состоянии, доставлять с помощью любого метода, известного из уровня техники, и использовать в различных видах применения.
[21] Клетки пассировали in vitro, используя культуральную среду. Пригодная среда включает RPMI-1640, среду Игла, модифицированную по способу Дульбекко (DMEM), среду Хэмса F12, среду Искова, среду МакКоя, но не ограничивается ими, или любую другую среду, которая содержит достаточно питательных веществ для роста клеток. Такую среду можно приготовить или получить из коммерческих источников.
[22] Лишение мезенхимальных клеток предпочтительной для них среды роста, как правило, приводит к снижению или остановке пролиферации клеток, потере адгезии к пластику и/или изменению клеточной морфологии. Одной из важных переменных, связанных с ростом клеток, является рН среды в процессе клеточной пролиферации. Как правило, стволовые клетки не растут (или снижают скорость пролиферации), когда условия в культуре отклоняются от физиологического рН. По этой причине культуральная среда, как правило, действует в качестве буфера при культивировании клеток. Все клетки продуцируют или требуют добавления в воздух небольших количеств CO2 для роста и выживания. В некоторых примерах культуральной среды растворенный CO2 находится в равновесии с ионами бикарбоната, используя реакцию CO2/бикарбонат для создания рН среды. CO2 свободно растворяется в среде и вступает в реакцию с водой с образованием угольной кислоты. По мере того как клетки метаболизируют и продуцируют больше CO2, рН среды уменьшается. Оптимальный диапазон рН от 7,2 до 7,4 может поддерживаться путем добавления к среде бикарбоната натрия (NaHCO3) и регулирования уровня CO2 в атмосфере над средой. Буферная емкость среды определяется по количеству NaHCO3. Обычно, для достижения оптимального рН, к среде, в которой буферная емкость создается добавлением от 1,2 до 2,2 г/л NaHCO3, в атмосферу над средой добавляется 5% дополнительного CO2. В качестве другого примера, чтобы достичь оптимального рН в среде, в которой буферная емкость создается добавлением 3,7 г/л NaHCO3, в атмосферу над средой добавляется 10% дополнительного CO2. Если количество дополнительного CO2 недостаточно, то рН среды не может поддерживаться на надлежащем уровне, что может привести к ухудшению функционирования клеток.
[23] Клеточная культуральная среда может также включать дополнительные компоненты, такие как витамины, факторы роста, гормоны, белки, сахара и/или антиоксиданты, в качестве необходимых для обеспечения конкретной клеточной культуры. Следует иметь в виду, что может быть добавлена сыворотка, такая как эмбриональная бычья сыворотка (FBS). Например, 10% дополнительной FBS может быть добавлено к среде, или может быть добавлена плазма крови в том же количестве, как и животная сыворотка. Альтернативно, клетки могут также поддерживаться и размножаться в культуре при отсутствии дополнительной сыворотки и/или дополнительной плазмы крови. Среда, кондиционированная клетками, также может быть использована вместо или в дополнение к культуральной среде.
[24] Линия hb-MSC может быть выделена из костного мозга крыс линии Вистар. Способ выделения линии hb-MSC, как правило, включает, по меньшей мере: (1) получение Пассажа 1 клеток из первичных клеток костного мозга крысы; (2) посев p1 мезенхимальных стволовых клеток крыс в пригодный культуральный флакон; (3) первый этап инкубации, в котором клетки инкубируют при первой заданной концентрации CO2, в течение первого периода времени инкубации; (4) второй этап инкубации, в котором клетки инкубируют при второй заданной концентрации CO2 в течение второго периода времени инкубации; (5) сбор hb-MSC.
[25] Первичные стволовые клетки костного мозга крыс извлекают из костного мозга большеберцовой или бедренной кости крыс линии Вистар согласно хорошо известным методам. После извлечения клеток клеточный осадок можно ресуспендировать, высевать на пластиковые флаконы для культуры ткани и инкубировать в культуральной среде (например, RPMI-1640, дополненной 10% FBS) при 37°С во влажной атмосфере 5% CO2. Прилипающие клетки, выращенные до приблизительно 70% конфлюэнции, названы Пассажем №1 (p1).
[26] В одном варианте осуществления изобретения первая заданная концентрация CO2 может быть установлена в соответствии с предписанной концентрацией CO2 для буферной емкости среды, которая, как правило, определяется производителем среды. Например, первая заданная концентрация CO2 может составлять 5%, когда для культуры используют среду RPMI-1640. В том же варианте осуществления изобретения вторая заданная концентрация CO2 может быть снижена, по меньшей мере, на 50% от концентрации CO2, предписанной для буферной емкости среды, которая, как правило, определяется производителем среды. Для среды RPMI-1640 предписанная концентрация CO2 составляет 5%. Таким образом, в соответствии с одним вариантом осуществления указанного способа вторая заданная концентрация CO2 должна быть установлена ниже 2,5%. В другом варианте осуществления изобретения вторая заданная концентрация может быть установлена к атмосферной концентрации CO2 (т.е. приблизительно 0,03% CO2). Специалисту в данной области будет понятно, что если вторая заданная концентрация CO2 в культуре увеличивается, то может потребоваться увеличение второго периода времени инкубации (например, может потребоваться один или более дополнительных пассажей) для того, чтобы выделить линию hb-MSC.
[27] В одном варианте осуществления изобретения первый период времени инкубации может составлять от нуля до четырех клеточных пассажей. Следует понимать, что, когда первый период времени инкубации составляет ноль пассажей, то первый этап инкубации пропускается полностью. В другом варианте осуществления первый период времени инкубации является периодом между количеством часов, необходимым для достижения одного удвоения популяции (например, около 20-48 часов) до примерно 700 часов культивирования. В одном варианте осуществления изобретения второй период времени инкубации может составлять от одного до восьми клеточных пассажей. В дополнительном варианте осуществления второй период времени инкубации представляет собой период между количеством часов, необходимым для достижения одного удвоения популяции (например, около 20-48 часов) до примерно 2500 часов культивирования. Например, клетки могут подвергаться четырем пассажам в атмосфере 0,03% CO2 в RPMI-1640 с 10% FBS. Специалисту в данной области будет понятно, что при необходимости концентрацию CO2 можно регулировать в процессе любой стадии инкубации.
[28] «Пассаж» следует понимать как перераспределение клеток, с разбавлением или без разбавления, из одного культурального флакона в другой культуральный флакон, содержащий свежую культуральную среду. Например, один клеточный пассаж может включать: (1) посев клеток на поверхность культурального флакона (например, приблизительно 2,0×106 клеток на 175 см2 площади поверхности); (2) добавление культуральной среды (например, RPMI-1640); (3) установление определенной атмосферы CO2; (4) помещение культурального флакона в термостат с установленной соответствующей температурой (например, 37°С); (5) поддержание клеток в культуральном флаконе в течение заданного периода времени («заданного периода культивирования») (6) смену культуральной среды на свежую, необходимую для роста клеток; и (7) отделение и пересев клеток.
[29] Для каждого пассажа клетки поддерживают в культуральной среде, где предварительно заданный период культивирования находится в диапазоне времени приблизительно 30-700 часов. В одном варианте осуществления изобретения заданный период культивирования составляет менее 96 часов. В другом варианте осуществления изобретения заданный период культивирования находится в диапазоне приблизительно от 96 до 168 часов. В еще одном дополнительном варианте осуществления изобретения предварительно заданный период культивирования составляет более 168 часов. Кроме того, предварительно заданный период культивирования может основываться на контроле конфлюэнции клеток. В одном варианте осуществления изобретения предварительно заданный период культивирования составляет время, необходимое клеткам для достижения приблизительно 50% конфлюэнции. В другом варианте осуществления клетки пассируют после достижения от около 50% до 70% конфлюэнции. В дополнительном варианте осуществления клетки пассируют после достижения приблизительно 70% конфлюэнции.
[30] Линию hb-MSC можно выделить посредством культивирования клеток в любом количестве измерений (D). Например, клетки можно культивировать, используя бусинки (0D), монослои (2D) или 3D подложки. Линию hb-MSC можно также выделить, используя разные системы. Линию hb-MSC можно выделить, используя систему открытых флаконов или систему закрытых флаконов или их комбинацию. В одном варианте осуществления изобретения, линию hb-MSC можно выделить, используя систему закрытых флаконов. В системе закрытых флаконов флакон для культивирования клеток закрыт непроницаемой крышкой, которая может предотвратить доступ дополнительного CO2. В другом варианте осуществления изобретения линию hb-MSC можно выделить, используя открытый флакон в камере для культивирования клеток, что позволяет контролировать концентрацию CO2. В отдельном варианте осуществления линию hb-MSC можно выделить в флаконе, закрытом газопроницаемой мембраной в камере для культивирования клеток, что позволяет контролировать концентрацию CO2.
[31] Специалисту в данной области техники будет понятно, что различные методы культивирования клеток, описанные выше, приведены только в качестве примеров и не могут быть использованы для ограничения объема притязаний. Специалисту в данной области техники также будет понятно, что процедуры, периоды инкубации, периоды культивирования, среды, сыворотки или концентрации CO2 и другие переменные могут требовать изменений с учетом поведения клеток в процессе культивирования.
[32] Другой вариант осуществления настоящего изобретения относится к уникальной линии hb-MSC. Экспрессия маркеров клеточной поверхности может быть использована для подтверждения мезенхимальной природы этой линии. Маркеры клеточной поверхности могут быть идентифицированы с использованием любого подходящего способа, включая, например, проточную цитометрию. Как описано в Примере 4 и показано на Фигуре 1, способ получения hb-MSC не приводит к изменению поверхностных маркеров hb-MSC, что может привести к выводу о том, что hb-MSC демонстрируют поверхностные маркеры, согласующиеся с маркерами мезенхимальных стволовых клеток костного мозга крыс.
[33] На ФИГ. 2 показаны окрашенные красителем Гимза хромосомы из hb-MSC при Пассаже №9 (р9), тогда как на ФИГ. 3 показаны результаты анализа полимеразной цепной реакции (ПЦР). Гены СОХ-1 и VN1R1 были использованы в качестве маркеров для митохондриальных и ядерных ДНК крыс, соответственно. При Пассаже №9 кариотип является нормальным диплоидом (т.е. 2n=42). Как описано в Примере 1 ниже, анализ ПЦР клеточной линии подтвердил, что это крысиные клетки. Специалисту в данной области будет понятно, что клетки могут подвергаться любому количеству пассажей, при условии, что анализ кариотипа подтверждает генетическую стабильность клеток.
[34] Линия hb-MSC существенно отличается от других линий стволовых клеток, полученных от крыс, что может быть подтверждено при помощи ряда различных способов характеризации. Мезенхимальные стволовые клетки крыс, полученные в стандартных условиях, культивируют, чтобы показать различия между обычными мезенхимальными стволовыми клетками крыс и уникальной линией hb-MSC. Линия обычных мезенхимальных стволовых клеток, подготовленная для целей настоящего сравнения, была названа линией rb-MSC. Для получения линии rb-MSC, p1 мезенхимальных клеток крыс пассировали согласно стандартным условиям, известным из уровня техники, как описано в Примере 2.
[35] В Примере 7 (и на Фигуре 6) показано отличие между рН среды линии hb-MSC и линией rb-MSC, что может быть использовано для установления отличий между этими двумя линиями. В другом сравнении линию hb-MSC можно отличить от линии rb-MSC по общей концентрации лактата в культуре. Еще один способ отличить линию hb-MSC от линии rb-MSC состоит в сравнении различных факторов, обнаруживаемых в среде, кондиционированной каждой соответствующей линией, как описано в Примере 8 (и показано в Таблице 3). Конечно, линия hb-MSC может также быть охарактеризована с помощью других способов, известных специалисту в данной области техники.
[36] Варианты осуществления настоящего изобретения также относятся к клеткам или клеточным линиям, отличным от hb-MSC. Клеточные линии могут включать адипоциты, хондроциты, остеоциты и другие клетки. Способы дифференцировки в адипоциты, хондроциты, остеоциты хорошо известны в данной области техники. Способы генетической модификации стволовых клеток также хорошо известны. Линии стволовых клеток, полученные из генетически модифицированных hb-MSC или любых клеточных линий, дифференцированных от генетически модифицированных hb-MSC, также входят в объем настоящего изобретения.
[37] Специалисту в данной области техники будет понятно, что различные способы, характеризующие hb-MSC, представлены только для иллюстративных целей. Варианты осуществления hb-MSC не должны удовлетворять каждому из различных описанных способов характеризации, и некоторые варианты осуществления могут удовлетворять только одному или более способам, раскрытым в настоящем описании.
[38] Один из вариантов осуществления настоящего изобретения относится к культуральной среде, кондиционированной hb-MSC, именуемой далее «hb-MSC кондиционированной средой». В одном варианте осуществления изобретения кондиционированная среда может быть получена путем: (1) посева множества hb-MSC в соответствующий флакон; (2) обеспечения культуральной среды; (3) поддержания hb-MSC в культуральной среде в течение периода кондиционирования; и (4) сбора кондиционированной среды. Период кондиционирования может составлять часы, дни или даже недели, в течение которых питательная среда обогащается биологическими продуктами. При необходимости (например, когда среда кондиционирована таким образом, что биологические продукты, такие как факторы роста, белки и везикулы, достигают желательных уровней в среде), кондиционированная среда может быть собрана. Например, кондиционированная среда может быть собрана после культивирования hb-MSC в течение 3, 6, 24, 30, 48, 54, 72, 96, 120, 144, 168, 192, 216, 240, 264, 288, 312 или 366 часов, или спустя некоторые другие периоды времени. Кондиционированная среда, полученная при культивировании hb-MSC, может быть обработана в стерильных условиях и простерилизована, если это необходимо. Специалисту в данной области будет понятно, что сбор кондиционированной среды до прикрепления клеток к флакону, используемому для культуры, приведет к удалению клеток вместе с питательной средой, что может быть не желательным в зависимости от применения.
[39] В одном варианте осуществления hb-MSC могут быть повторно использованы для кондиционирования дополнительной среды путем добавления культуральной среды к hb-MSC после удаления кондиционированной среды. Специалисту в данной области будет понятно, что количество повторного использования клеток зависит от количества часов, используемых для кондиционирования среды, а также от конфлюэнции клеток. Следует иметь в виду, что hb-MSC среду собирают через различные периоды времени (например, каждые 3, 6, 24, 30, 48, 54, 72, 96, 120, 144, 168, 192, 216, 240, 264, 288, 312 или 366 часов, или какой-либо другой период времени), кондиционированная среда, собранная путем повторного использования hb-MSC в пределах одного пассажа, или среды, собранные от разных пассажей hb-MSC, могут быть объединены с целью получения единой hb-MSC кондиционированной среды.
[40] Среды, кондиционированные любой клеткой, могут включать различные биологические продукты, секретированные, выведенные, выделенные или полученные иным путем в процессе культивирования. Например, кондиционированная среда может включать биологические продукты, такие как факторы роста, противовоспалительные факторы, сигнальные факторы, гормоны, регуляторные факторы, ферменты, везикулы, включая экзосомы или любые другие соединения. Способ культивирования клеток и рН среды может влиять на тип и количество биологических продуктов, выделенных клетками. Кроме того, следует понимать, что концентрация клеток, посеянных изначально, может повлиять на количество биологических продуктов, присутствующих в кондиционированной среде. Также будет понятно, что добавление дополнительной сыворотки будет влиять на исходную концентрацию факторов в среде до кондиционирования, поскольку сыворотка содержит определенные количества различных биологических продуктов. Измерение концентрации этих факторов в среде, кондиционированной hb-MSC, показывает, что эта среда значительно отличается от среды, кондиционированной rb-MSC. Коммерчески доступные анализы могут быть использованы для измерения концентрации факторов, продуцируемых клетками (например, анализы, доступные от EMD Millipore или Eve Technologies). Следует иметь в виду, что точное измерение будет зависеть от пар антител, используемых в анализах, и, таким образом, детектируемая концентрация факторов может изменяться в зависимости от способа анализа или используемой техники измерений. В Примере 8 описано сравнение концентраций факторов линий rb-MSC и hb-MSC в определенные периоды времени.
[41] В одном варианте осуществления кондиционированная среда может быть получена путем поддержания hb-MSC при концентрации CO2, предварительно заданной для буферной емкости среды, которая, как правило, определяется производителем среды. Для сред RPMI-1640 предварительно заданная концентрация CO2 составляет 5%. В другом варианте кондиционированная среда может быть получена путем поддержания hb-MSC при концентрации CO2, сниженной не менее чем на 50% от концентрации CO2, предварительно заданной для буферной емкости среды, которая, как правило, определяется производителем среды. В другом варианте осуществления изобретения кондиционированная среда может быть образована путем поддержания hb-MSC при атмосферной концентрации CO2 (т.е. 0,03% CO2).
[42] В одном варианте осуществления изобретения кондиционированная среда может быть образована путем поддержания hb-MSC при атмосферной концентрации O2 (т.е. 17%). В другом варианте осуществления изобретения кондиционированная среда может быть образована путем поддержания hb-MSC при концентрации O2, сниженной ниже 10%. В другом варианте осуществления кондиционированная среда может быть образована путем поддержания hb-MSC при концентрации O2, сниженной ниже 2%. Использование пониженной концентрации O2 (гипоксические условия) может быть применено, например, для имитации среды костного мозга in vivo.
[43] В некоторых вариантах осуществления кондиционированная среда может быть использована в концентрированном виде. Например, кондиционированная среда может быть сконцентрирована в 1-100 раз с использованием любого известного из уровня техники способа. Требующиеся приемлемые концентрации будут зависеть от применения кондиционированной среды.
[44] В одном варианте осуществления аккуратно собранная кондиционированная среда дополнительно обрабатывается для добавления/удаления и/или концентрирования/разбавления специфических биологических продуктов. Следует выбирать такие способы, используемые для выделения и очистки продукта, чтобы сохранялась оптимальная биологическая активность. Например, желательной может быть очистка фактора роста, регуляторного фактора, пептидного гормона, антитела, экзосомы или любого другого желательного биологического соединения. Такие способы включают гель-хроматографию, ионный обмен, металло-хелатную аффинную хроматографию, высокоэффективную жидкостную хроматографию (ВЭЖХ), хроматографию с гидрофобным взаимодействием или центрифугирование, но не ограничиваются ими. В другом варианте осуществления изобретения экзосомы или любые другие везикулы, присутствующие в кондиционированной среде, могут быть сконцентрированы в кондиционированной среде или удалены из нее.
[45] В другом варианте осуществления изобретения кондиционированная среда может быть лиофилизированной. Лиофилизированная кондиционированная среда может быть восстановлена с использованием любого соответствующего разбавителя, включая, без ограничения, физиологический раствор, забуференный фосфатом физиологический раствор, среду для культивирования клеток, кондиционированную среду для культивирования клеток, воду или их смеси. Кондиционированная среда может быть восстановлена в той же концентрации, что и исходная кондиционированная среда. В отдельном варианте осуществления лиофилизированная кондиционированная среда может быть восстановлена в более концентрированной форме по сравнению с исходной кондиционированной средой с коэффициентом концентрации в интервале от 1 до 100.
[46] Линия hb-MSC может быть использована для кондиционирования широкого спектра культуральных сред. В некоторых вариантах осуществления культуральная среда может быть также обогащенной дополнительной эмбриональной сывороткой и/или плазмой крови. В одном варианте осуществления среда кондиционируется в присутствии 20% FBS. В другом варианте среда кондиционируется в присутствии 10% FBS. В другом варианте среда кондиционируется в присутствии 7% FBS. В другом варианте среда кондиционируется в присутствии 3% FBS. В альтернативном варианте осуществления среда кондиционируется в отсутствие FBS. В других вариантах осуществления после того, как клетки достигли определенного значения конфлюэнции, пониженная концентрация сыворотки или бессывороточная среда могут быть использованы в качестве замены для образования низкосывороточной или бессывороточной кондиционированной среды.
[47] Другие варианты осуществления настоящего изобретения относятся к композиции hb-MSC. Композиция hb-MSC может содержать hb-MSC, hb-MSC кондиционированную среду или их комбинацию. Композиция hb-MSC также может содержать приемлемый носитель. Общее количество hb-MSC кондиционированной среды в композиции hb-MSC может изменяться от 0,00001 до 99,99% по объему.
[48] Варианты осуществления композиции hb-MSC могут содержать hb-MSC кондиционированную среду в комбинации с hb-MSC, rb-MSC или другими клетками, выбранными, исходя из применения/назначения среды. Например, клетки, которые могут быть добавлены к композиции hb-MSC, могут включать аутологичные клетки, аллогенные клетки или ксеногенные клетки.
[49] В другом варианте осуществления изобретения композиция hb-MSC может содержать hb-MSC или hb-MSC кондиционированную среду в комбинации с любой другой кондиционированной средой или любой комбинацией кондиционированной среды в любом желательном соотношении. Композиция hb-MSC может также содержать hb-MSC или hb-MSC кондиционированную среду в комбинации со средой, кондиционированной аутологичными клетками, аллогенными клетками или ксеногенными клетками. В другом примере hb-MSC кондиционированная среда может комбинироваться со средой, кондиционированной мезенхимальными стволовыми клетками человека.
[50] Композиция hb-MSC должна быть свободна от загрязнения бактериями, вирусами, микоплазмами и грибами. В одном варианте осуществления это может быть достигнуто путем стерильных условий обработки в процессе культивирования клеток и обработки. В другом варианте осуществления изобретения композиция hb-MSC содержит фармацевтические консерванты для обеспечения уровня антимикробной активности. В некоторых вариантах осуществления изобретения консерванты могут ограничить вторичные бактериальные, грибковые или амебные инфекции, вызванные загрязнением растворов. В других вариантах осуществления изобретения добавление консервантов продлевает срок годности hb-MSC или hb-MSC кондиционированной среды, предотвращая биодеградацию и поддерживая активность. В неограничивающем примере консерванты могут включать детергенты, окислители, хелатирующие агенты или метаболические ингибиторы, включая пятивалентную сурьму, четвертичные аммониевые и ртутьорганические соединения. Примеры консервантов включают тимеросол, крезолы, формалин, бензалкониумхлорид или бензиловый спирт.
[51] В еще одном дополнительном варианте композиция hb-MSC может быть дополнена противовоспалительными агентами, антибактериальными агентами, анальгетиками, противогрибковыми препаратами, бактерицидами, дезинфицирующими средствами, витаминами, солнцезащитными средствами, антибиотиками, средствами для борьбы со свободными радикалами, антиосаждающими агентами, подщелачивающими или подкисляющими агентами, ароматизаторами, поверхностно-активными веществами, эксципиентами, натуральными продуктами и экстрактами из натуральных продуктов. Добавки могут включать органические небольшие молекулы, металлоорганические соединения, полимеры, неорганические соли, белки, факторы роста, хемокины, ДНК, РНК или ферменты. В других вариантах осуществления изобретения среда может быть дополнена сахарами, белками, инсулином, сигнальными белками или любыми дополнительными небольшими молекулами, в том числе красителями, ароматизаторами, подсластителями. Дополнительные вещества могут также содержать небольшие количества добавок, таких как вещества, усиливающие изотоничность и химическую стабильность.
[52] Специалисту в данной области техники понятно, что приемлемый носитель для композиции hb-MSC может включать, например, жидкость, крем, аэрозоль, лосьон, мазь или гидрогель. Эти носители могут быть основаны на добавлении: водных эксципиентов (включая культуральные среды), неводных эксципиентов, масел, стандартных жировых веществ, обычных гелеобразующих агентов, буферов, загустителей, суспендирующих агентов, эмульгаторов, увлажняющих агентов, смягчительных средств, гидрофильных или липофильных активных веществ. Количества этих разных ингредиентов будет изменяться в зависимости от применения композиция hb-MSC или желательного эффекта. Конечно, любому специалисту в данной области техники будет понятно, что «приемлемый носитель» может включать смесь двух или более носителей и/или других ингредиентов.
[53] Композиция hb-MSC, раскрытая в данном документе, может быть использована для разных целей, включая любые исследования, диагностические, терап