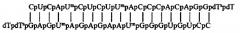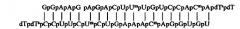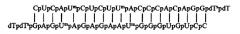Композиция для ингибирования роста и стимуляции апоптоза клеток колоректального рака
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к композиции для ингибирования роста и стимуляции апоптоза клеток злокачественной опухоли колоректального рака путем блокирования функции генов МСМ4 и Livin. Указанная композиция содержит липосому для доставки композиции в клетки-мишени и комбинацию двух дуплексов олигонуклеотидов миРНК. Первый дуплекс предназначен для блокирования генов МСМ4 и содержит препараты малых интерферирующих олигонуклеотидов 5'-C-U-C-A-Umet-C-U-C-U-Umet-A-C-C-C-A-C-A-G-G-dTs-dT-3' в качестве прямой цепи и 5'-C-C-U-G-U-G-G-G-Umet-A-A-G-A-G-A-Umet-G-A-G-dTs-dT-3' в качестве обратной цепи. Второй – для блокирования генов Livin и содержит препараты малых интерферирующих олигонуклеотидов 5'-G-G-A-A-G-A-G-A-C-U-Umet-U-G-U-C-C-A-Cmet-A-dTs-dT-3' в качестве прямой цепи и 5'-U-G-U-G-G-A-Cmet-A-A-A-G-U-C-Umet-C-U-U-C-C-dTs-dT-3' в качестве обратной цепи. Причем Umet - 2'-O-метилуридин-3'-фосфат; Cmet - 2'-O-метилцитидин-3'-фосфат; dTs - 2'-дезокситимидин-3'-фосфоротиоат; dT - 2'-дезокситимидин-3'-фосфат. Изобретение позволяет повысить эффективность ингибирования роста и индукции апоптоза клеток злокачественной опухоли, уменьшив при этом побочные эффекты. 5 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области медицины, в частности к средству терапии онкологических заболеваний, а также транспорта нуклеиновых кислот в клетки.
Одним из основных терапевтических подходов к лечению рака является использование противоопухолевых химиотерапевтических агентов, в частности оксалиплатина, который относится к цитостатическим противоопухолевым химиотерапевтическим лекарственным препаратам. В результате воздействия препарата раковая клетка подвергается апоптозу. Препараты платины, как и многие другие химиотерапевтические лекарственные препараты, обладают высоким уровнем токсичности, в частности для препаратов платины типична высокая нейротоксичность, в результате которой развивается периферическая нейропатия, а также известны случаи развития глухоты, почечной недостаточности, лейкопении, тромбоцитопении, анемии и т.д. Кроме того, зачастую они недостаточно эффективны, обладают существенным мутагенным эффектом, к ним развивается лекарственная устойчивость.
На сегодняшний день рак толстой кишки занимает 3 место по уровню смертности среди всех опухолевых заболеваний. Традиционные подходы для лечения рака не всегда оказываются применимы. Альтернативным и достаточно новым методом лечения опухолевых заболеваний является генная терапия, которая основывается на введении терапевтических нуклеиновых кислот (НК) в опухоль. Разработка препаратов с незначительным спектром побочных действий, но способных обеспечить такой же или более значимый терапевтический эффект представляется одной из первоочередных задач в этой области. В этой связи в последнее десятилетие активно развивается принципиально новое направление по созданию таргетных препаратов, действие которых направлено на регуляцию функциональной активности определенных генов. Как правило, такие препараты представляют собой антитела против конкретных белков или малые молекулы, часто выполняющие функцию ингибиторов. К их недостаткам относится неполная избирательность, что способствует усилению токсического эффекта, особенно в случаи малых молекул. Антитела являются привнесенными в организм компонентами, которые способны проявлять дополнительные активности в результате формирования неспецифических комплексов (перекрестные реакции). Область действия моноклональных антител, применяемых для таргетной терапии, ограничена барьерной функцией клеточной мембраны, что делает невозможным их использование для направленного воздействия на внутриклеточные структуры.
Значительная часть современных таргетных препаратов является малыми молекулами. Их основной недостаток - недостаточная специфичность, что приводит к появлению дополнительных эффектов, обусловливающих токсичность.
В отличие от малых молекул миРНК - природные вещества, функционирующие в клетках человека (и других млекопитающих). Искусственно введенные миРНК не являются инородными для организма веществами. Как природные, так и синтезированные миРНК обладают одной и той же структурой, позволяющей воздействовать именно на те гены, функция которых должна быть ингибирована. Они имеют малые размеры, облегчающие их эффективную доставку в раковую клетку. Их основная функция - блокирование синтеза белка путем инактивации работы гена на ранней стадии и делает невозможным его фенотипическое проявление, что, в свою очередь, благотворно сказывается на организме пациента в целом. Кроме того, для РНК интерференции гена в организм реципиента нужно ввести сравнительно небольшое количество посторонних веществ.
Таргетные препараты, разработанные специально для применения совместно со стандартными химиопрепаратами, в настоящее время отсутствуют. В связи с этим актуально создание новых таргетных препаратов и поиск альтернативных лечебных подходов. Одним из таких подходов является выявление генов, ингибирование которых способно приводить не только к снижению жизнеспособности раковой клетки, но и к усилению чувствительности опухоли к стандартному химиотерапевтическому лечению. Изобретение основано на новых подходах, базирующихся на последних достижениях «постгеномной эры».
Известен способ модулирования функции и/или экспрессии гена-супрессора опухолей в клетках или тканях млекопитающих in vivo или in vitro, включающий взаимодействие указанных клеток или тканей с малыми интерферирующими РНК (миРНК) длиной от 5 до 30 нуклеотидов, специфически распознающими гены-супрессоры опухолей. Ген-супрессор опухолей (антионкоген, опухолевый супрессор) - ген, который обеспечивает мутацию «потеря функции» (супрессии) в ходе развития опухоли (Haber D & Harlow Ed., 1997). Белковые продукты генов-супрессоров называют белками-супрессорами или антионкобелками. Кроме того, антионкогены могут кодировать и микроРНК (RU №2011127196).
Известны генно-инженерные конструкты, экспрессирующие вектора, несущий многофункциональный промотор, соединенный с определенными транскрибируемыми последовательностями, которые при транскрипции продуцируют информационную РНК, кодирующую фермент, который в результате посттрансляционного процессинга превращается из нетоксичного пептида (пролекарство) во внутриклеточный токсин (лекарство), убивающий клетку. Экспрессирующий вектор представляет собой вирусный вектор или невирусный вектор (RU №2476596).
Известно средство индукции апоптоза в клетке-мишени, в котором двухцепочечная молекула РНК способна к мишень-специфической РНК-интерференции. Комплементарные друг другу фрагменты РНК имеют длину 23 нуклеотидных остатка и образуют дуплекс с выступающими 3'-концами длиной от 1 до 5 нуклеотидов (RU №2470073).
Известна фармацевтическая композиция, содержащая дезинтегратор митоза/ингибитор биохимического пути polo-подобной киназы (Plk), в частности ON01910, ON01910-Na или миРНК, направленную на Plk1, и химиотерапевтический агент, представляющий собой нуклеотидный аналог, в эффективном количестве, а также фармацевтически и физиологически приемлемый носитель, для использования в качестве лекарственного средства для предупреждения развития резистентности к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у субъекта, страдающего раком, или для использования в качестве лекарственного средства для лечения рака, резистентного к химиотерапевтическому агенту, представляющему собой нуклеотидный аналог, у нуждающегося в этом пациента. Химиотерапевтический агент представляет собой нуклеотидный аналог, выбран из группы, состоящей из кладрибина, клофарабина, флударабина, меркаптопурина, пентостатина, тиогуанина, капецитабина, цитарабина, децитабина, фторурацила, флоксуридина, сапацитабина и гемцитабина; или химиотерапевтический агент представляет собой нуклеотидный аналог, представляет собой гемцитабин (RU №2476239).
Недостатками указанных известных способов и средств индукции апоптоза клетками злокачественных опухолей является недостаточная эффективность, продолжительный период лечения до получения значимых результатов, высокая вероятность побочных эффектов, характерных для химиотерапевтических препаратов, обусловленных тем, что в прототипе обеспечивают и оценивают снижение количества клеток, что может быть связано со снижением пролиферации, т.е. скорости деления раковых клеток. Блокируя ген, обеспечивают повышение чувствительности к противоопухолевому препарату при использовании тех же терапевтических доз. Это позиционируется как преодоление резистентности. Задача снижения дозы химиопрепаратов не решается. Апоптотическая гибель клеток опухоли применяемыми средствами не обеспечивается в достаточной для лечения мере и не определяется. Использование для ингибирования генов малых молекул может иметь недостаточную специфичность, что приведет к существенным нежелательным неспецифическим эффектам, обусловливающим дополнительную токсичность.
Наиболее близкой к настоящему техническому решению является композиция для индукции апоптоза клеток злокачественной опухоли колоректального рака, содержащая оксалиплатин и комбинацию комплементарных к мРНК клеток злокачественной опухоли миРНК - олигонуклеотидов в виде коротких петлевых миРНК (shRNA) по меньшей мере одной из следующих структур:
(Sense oligo)-CAAGAGA-(Antisense oligo), или (Sense oligo-dtdt)-(Sense oligo)-CAAGAGA-(Antisense oligo-dtdt)-(Antisense oligo), где Sense oligo и Antisense oligo - пары олигонуклеотидов для каждого гена, (Sense oligo-dtdt) и (Antisense oligo-dtdt) - аналогичные последовательности РНК в парах олигонуклеотидов без dtdt, или (Antisense oligo-dtdt)-(Antisense oligo)-CAAGAGA-(Sense deoxyoligo-dtdt)-(Sense deoxyoligo), или CG-(Antisense deoxyoligo-dtdt)-(Antisense deoxyoligo)-CAAGAGA-(Sense deoxyoligo-dtdt)-(Sense deoxyoligo)-TTTTTTGGAAA, где Antisense deoxyoligo и Sense deoxyoligo представляют собой последовательности нуклеотидов с заменой рибонуклеотидов на дезоксирибонуклеотиды, (Antisense deoxyoligo-dtdt) и (Sense deoxyoligo-dtdt) - аналогичные последовательности ДНК в парах олигонуклеотидов без dtdt.
При этом (Sense oligo) и (Antisense oligo) выбираются в соответствии с ингибируемым геном из следующего:
(RU №2551238, прототип).
Недостатком прототипа является иммунотоксичность, обусловленная взаимодействием миРНК - олигонуклеотидов в виде коротких петлевых миРНК (shRNA) с толл-подобными рецепторами (англ. Toll-like receptor, TLR), а также неполная избирательность, увеличивающая токсический эффект.
Технической задачей изобретения является создание эффективного средства ингибирования роста и индукции апоптоза клеток злокачественной опухоли с меньшими побочными эффектами, а также расширение арсенала средств индукции апоптоза клеток злокачественной опухоли колоректального рака.
Технический результат, обеспечивающий решение поставленной задачи, заключается в снижении иммунотоксичности, поскольку разработанная согласно изобретению комбинация модифицированных и немодифицированных нуклеотидов для каждого из олигонуклеотидов уникальна и снижает их сродство к толл-подобным рецепторам (англ. Toll-like receptor, TLR), обеспечивая тем самым пониженную иммуногенность. Применение выбранных в соответствии с заявляемым решением малых интерферирующих РНК (миРНК) для подавления выбранных генов-мишеней является исходной основой технического результата, позволяющего существенно снизить иммунотоксичность средства ингибирования роста и индукции апоптоза клеток злокачественной опухоли с одновременным снижением дозировки химиопрепарата - производного платины и соответственно свести к минимуму его побочное действие при повышении эффективности терапии. Таким образом, создан препарат с меньшими побочными эффектами, но способный обеспечить такой же или больший терапевтический эффект.
Сущность изобретения состоит в том, что композиция для ингибирования роста и стимуляции апоптоза клеток злокачественной опухоли колоректального рака путем блокирования функции генов: МСМ4 и Livin в клетках злокачественной опухоли содержит средство для доставки композиции в клетки-мишени и комбинацию олигонуклеотидов миРНК,
из которых для блокирования генов МСМ4 она содержит препараты малых интерферирующих олигонуклеотидов:
5'-C-U-C-A-Umet-C-U-C-U-Umet-А-С-С-С-A-С-A-G-G-dTs-dT-3' в качестве пассажирской цепи и
5'-C-C-U-G-U-G-G-G-Umet-A-A-G-A-G-A-Umet-G-A-G-dTs-dT-3' в качестве направляющей (взаимодействующей с целевой РНК) цепи,
а для блокирования генов Livin она содержит препараты малых интерферирующих олигонуклеотидов: 5'-G-G-A-A-G-A-G-A-C-U-Umet-U-G-U-C-C-A-Cmet-A-dTs-dT-3' в качестве пассажирской цепи и
5'-U-G-U-G-G-A-Cmet-A-A-A-G-U-C- Umet-C-U-U-C-C-dTs-dT-3' в качестве направляющей (взаимодействующей с целевой РНК) цепи,
где G, С, A, U - рибонуклеотиды;
Umet-2' - O-methyluridine-3'-phosphate(2'-O-метилуридин-3'-фосфат);
Cmet-2' - O-methylcytidine-3'-phosphate(2'-O-метилцитидин-3'-фосфат);
dTs-2' - deoxythymidine-3'-phosphorothioate(2'-дезокситимидин-3'-фосфоротиоат);
dT-2' - deoxythymidine-3'-phosphate(2'-дезокситимидин-3'-фосфат).
При этом препараты малых интерферирующих миРНК-олигонуклеотидов выполнены в виде дуплексов прямой и обратной комплементарных цепей нуклеотидов следующей структуры:
для блокирования генов МСМ4 дуплекс
и для блокирования генов Livin дуплекс
где Gp, Cp, Ар, Up - рибонуклеотиды;
Ump - 2'-O-methyluridine-3'-phosphate (2'-O-метилуридин-3'-фосфат);
Cmp - 2'-Omethylcytidine-3'-phosphate (2'-O-метилцитидин-3'-фосфат);
dTsp - 2'-deoxythymidine-3'-phosphorothioate (2'-дезокситимидин-3'-фосфоротиоат);
dTp - 2'-deoxythymidine-3'-phosphate (2'-дезокситимидин-3'-фосфат).
Предпочтительно, в качестве средства для доставки композиции в клетки-мишени она содержит липосому, представляющую собой поликатионный липид в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту, и нейтральные фосфолипиды (DOPE и PC) в качестве структурообразующих и промотирующих компонент, при соотношениях дуплекс:липосома от 1:2 до 1:12.
Предпочтительно, средство для доставки композиции в клетки-мишени выполнено в форме липидной пленки, состоящей из поликатионного липида и нейтрального фосфолипида, гидратированных в воде с получением эмульсионно-дисперсионной системы, подвергнутой ультразвуковой обработке или экструзии, причем поликатионный липид, DOPE и PC взяты в соотношении 50:45:5 (мольн.).
Предпочтительно, в качестве средства для доставки композиции в клетки-мишени она содержит поликатионный липид в количестве от 25 до 67 мол. % на общее количество липидов в композиции; поликатионный липид выбирается из группы:
-{2,3-dioleyloxy-N-[2(sperminecarboxamido)ethyl]-N,N-dimethyl-1-propanaminium trifluoroacetate}, или DOSPA (Lipofectamine)
- Di-octadecyl-amido-glycyl-spermine, or DOGS, Transfectam.
- 3-β(N-(N',N'-dimethyl,N'-hydroxyethyl aminopropane)carbamoyl) cholesterol iodide (DMHAPC-Chol).
- 3β[N-(N',N'-dimethylaminoethane)-carbamoyl]cholesterol, or DC-Chol.
- 1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид (2X3).
Композиция выполнена в фармацевтической форме, пригодной для парентерального применения с целью индукции апоптоза клеток злокачественной опухоли колоректального рака.
На фиг. 1 изображена последовательность этапов синтеза миРНК, на фиг. 2 - данные об эффективности трансфекции в зависимости от типа вектора и степени его загрузки, на фиг. 3 - данные о зависимость биологического эффекта от дозы препарата.
Изобретение базируется на современном подходе к созданию эффективных противоопухолевых препаратов с низкой токсичностью. Особый интерес представляют современные разработки по использованию РНК-интерференции в сочетании с липосомальными методами доставки малых интерферирующих РНК в клетки. Малые интерферирующие РНК (миРНК) представляют собой короткие двухцепочечные фрагменты РНК (21-23 пар оснований), комплементарные последовательности мРНК белка, синтез которого должен быть заблокирован. Использование миРНК в терапевтических целях основывается на существующих представлениях о механизме действия РНК-индуцируемого комплекса выключения генов (RISC) и эндонуклеазы Dicer.
миРНК - природные вещества, функционирующие в клетках человека (и других млекопитающих). Искусственно введенные миРНК не будут инородными для организма веществами. Как природные, так и синтезированные, миРНК обладают абсолютной специфичностью, позволяющей воздействовать именно на те гены, функция которых должна быть ингибирована. Они имеют малые размеры, облегчающие их эффективную доставку в раковую клетку. Кроме того, миРНК прерывают процесс функционального проявления генов на более ранней стадии, до синтеза белков, количество которых значительно больше, чем матричной РНК. Вследствие этого требуются меньшие количества вводимых в организм больного веществ.
В то же время к проблемам в применении миРНК (как и других нуклеиновых кислот) относится их способность взаимодействовать с толл-подобными рецепторами, что способно вызывать иммунный ответ, а также возможность деградации вследствие действия внутриклеточных ферментов.
В организме человека существуют вне- и внутриклеточные барьеры, которые не позволяют самостоятельно проникать НК к месту их терапевтического действия. Для введения НК могут быть использованы вирусные системы доставки. Однако такие системы обладают рядом недостатков, таких как иммуногенность, мутагенность, ограниченный размер переносимой НК, трудности масштабирования, воспроизводства, стабильности, высокая стоимость. Альтернативными невирусными системами доставки НК, которые на сегодняшний день получили широкое распространение, являются катионные липосомы. За счет электростатического взаимодействия они могут компактизовать разные по размеру НК, формируя комплексы - липоплексы. Катионные липосомы неиммуногенны, немутагенны, стабильны при хранении, относительно дешевые по сравнению с вирусными системами доставки.
На модели культивируемых клеток колоректального рака ранее показана принципиальная возможность индукции апоптотического эффекта при инактивации генов Livin и МСМ4. Обнаружено, что совместное ингибирование генов дает синергетический апоптотический эффект при низких дозах оксалиплатина. Полученные результаты открывают возможность разработки лекарственного средства на основе малых интерферирующих РНК к генам Livin и МСМ4 для лечения рака толстой кишки.
Предлагаемая композиция включает созданные олигонуклеотиды миРНК и катионные липосомы. При решении указанных выше проблем применения миРНК при разработке их конструкции и состава были учтены необходимость повышения устойчивости к воздействию нуклеаз и понижения иммуногенности олигонуклеотидов миРНК, что является одним их технических результатов разработки. С этой целью в состав последовательности олигонуклеотидов миРНК был введен 2'-дезокситимидин-3'-фосфоротиоат в положении 20-го нуклеотида, который через остаток фосфорной кислоты связан с концевым 2'-дезокситимидин-3'-фосфатом в положении 21-го. Такая структура обеспечивает устойчивость олигонуклеотидов миРНК и их дуплексов к воздействию нуклеаз. Кроме того, в первичную структуру олигонуклеотидов введены модифицированные основания: 2'-ОМе-уридин-3'-фосфат и 2'-ОМе-цитидин-3'-фосфат. Введение модифицированных нуклеотидов способствует усилению устойчивости к гидролизу внутри нуклеотидных фосфорных связей, а, следовательно, и всего нуклеотидного комплекса. Для каждого из олигонуклеотидов разработана своя схема чередования фосфодиэфирных связей между рибозой (Р), дезоксирибозой (ДР) и 2'ОМе-рибозой (МеР):
Олигонуклеотид №1
5'-Р-Р-Р-Р-МеР-Р-Р-Р-Р-МеР-Р-Р-Р-Р-Р-Р-Р-Р-Р-ДР-ДР-3'
Олигонуклеотид №2
5'-Р-Р-Р-Р-Р-Р-Р-Р-Р-МеР-Р-Р-Р-Р-Р-Р-МеР-Р-Р-ДР-ДР-3'
Олигонуклеотид №3
5'-Р-Р-Р-Р-Р-Р-Р-Р-Р-Р-МеР-Р-Р-Р-Р-Р-Р-МеР-Р-ДР-ДР-3'
Олигонуклеотид №4
5'-Р-Р-Р-Р-Р-Р-МеР-Р-Р-Р-Р-Р-Р-МеР-Р-Р-Р-Р-Р-ДР-ДР-3'
При модификации олигонуклеотидов учитывалось, что нуклеотидные остатки в позициях 2-6 в направляющих олигонуклеотидах №2 и №4 не могут быть изменены, так как являются затравочной областью (seed-регион), которая обеспечивает первоначальное связывание белкового комплекса с таргетной последовательностью РНК. Для олигонуклеотидов №1 и №3 позицию модифицированного нуклеотидного остатка определяли, основываясь на требовании, что модифицированные нуклеотидные остатки прямой последовательности не должны образовывать пару с модифицированными нуклеотидными остатками комплементарной последовательности. Олигонуклеотиды №1 и №3 не участвуют в распознавании таргетной РНК («пассажирская» цепь). Так как модифицированный нуклеотид меняет энергию связывания нуклеотидной пары, постулировали, что между модифицированными нуклеотидными остатками внутри олигонуклеотида должно быть не менее трех немодифицированных нуклеотидных остатков.
В результате получены следующие олигонуклеотиды миРНК для ингибирования генов МСМ4 и Livin:
Олигонуклеотид №1 - МСМ4, «пассажирская» цепь
5'-C-U-C-A-Umet-C-U-C-U-Umet-A-C-C-C-A-C-A-G-G-dTs-Dt-3'
Олигонуклеотид №2 - МСМ-4, направляющая (взаимодействующая с целевой РНК) цепь
5'-C-C-U-G-U-G-G-G-Umet-A-A-G-A-G- A-Umet-G-A-G-dTs-dT-3'
Олигонуклеотид №3 - Livin, «пассажирская» цепь
5'-G-G-A-A-G-A-G-A-C-U-Umet-U-G-U-C-C-A-Cmet-A-dTs-dT-3'
Олигонуклеотид №4 - Livin, направляющая (взаимодействующая с целевой РНК) цепь
5'-U-G-U-G-G-A-Cmet-A-A-A-G-U-C-Umet-C-U-U-C-C-dTs-dT-3'
где G, С, A, U – рибонуклеотиды;
Umet - 2'-O-methyluridine-3'-phosphate (2'-О-метилуридин-3'-фосфат);
Cmet - 2'-Omethylcytidine-3'-phosphate (2'-O-метилцитидин-3'-фосфат);
dTs - 2'-deoxythymidine-3'-phosphorothioate (2'-дезокситимидин-3'-фосфоротиоат);
dT - 2'-deoxythymidine-3'-phosphate (2'-дезокситимидин-3'-фосфат).
Разработанная комбинация модифицированных и немодифицированных нуклеотидов для каждого из олигонуклеотидов уникальна и позволяет получать миРНК и их дуплексы с измененными стереохимическими характеристиками, что помимо повышения устойчивости к действию нуклеаз снижает их сродство к толл-подобным рецепторам (англ. Toll-like receptor, TLR), обеспечивая тем самым пониженную иммуногенность лекарственного средства. В клетках млекопитающих в составе рибосомальных и транспортных РНК встречаются 2'ОМе-рибонуклеотиды и они не являются токсичными.
Полученные дуплексы миРНК были оценены на предмет функциональной активности с использованием коммерческого вектора Lipofectamine RNAiMAX (Invitrogen, США) и культуры клеток карциномы толстой кишки НТ-29 (АРС-/-). Трансфекцию проводили комбинацией дуплексов Livin + MCM4 в соотношении 1:1 прямым методом по протоколу производителя. Результаты трансфекции анализировали при помощи флуоресцентной микроскопии с использованием стандартного набора для определения апоптоза (Vybrant Apoptosis Assay Kit №5, Invitrogen, США).
Проведенное исследование позволяет заключить, что разработанная конструкция и состав олигонуклеотидов миРНК не оказывают существенного влияния на получение конечного эффекта и могут быть применены для получения эффекта апоптоза.
Олигонуклеотиды миРНК были синтезированы амидофосфитным триэфирным методом с использованием твердофазного ДНК синтезатора ASM-1000 («Биосет», Новосибирск) по схеме, включающей следующие этапы (шаги синтеза):
- удаление тритильной защиты;
- конденсация;
- блокирование непрореагировавших 5'-гидроокислов;
- окисление;
Второй шаг синтеза:
- удаление тритильной защиты и промывка;
- конденсация;
- блокирование непрореагировавших 5'-гидроокислов;
- сульфирование;
Третий шаг синтеза:
- удаление тритильной защиты и промывка;
- конденсация;
- блокирование непрореагировавших 5'-гидроокислов;
- окисление;
Затем последовательное наращивание олигонуклеотида: 4-21 шаг синтеза, аналогично первому шагу синтеза.
Олигонуклеотид №1
5'-C-U-C-A-Umet-C-U-C-U-Umet-A-C-C-C-A-C-A-G-G-dTs-Dt-3'
Олигонуклеотид №2
5'-C-C-U-G-U-G-G-G-Umet-A-A-G-A-G-A-Umet-G-A-G-dTs-dT-3'
Олигонуклеотид №3
5'-G-G-A-A-G-A-G-A-C-U-Umet-U-G-U-C-C-A-Cmet-A-dTs-dT-3'
Олигонуклеотид №4
5'-U-G-U-G-G-A-Cmet-A-A-A-G-U-C-Umet-C-U-U-C-C-dTs-dT-3';
И получение целевого промежуточного продукта:
- аммонолиз;
- снятие силильной защиты;
- переосаждение.
В процессе синтеза олигонуклеотидов: при реализации перечисленных этапов малые интерферирующие РНК (миРНК) и комплементарные им последовательности к генам Livin и МСМ4 получали путем стандартного синтеза, амидофосфитным триэфирным методом на основе О-нуклеофильного внутримолекулярного катализа при помощи коммерческого синтезатора со стандартным циклом элонгации. Основная часть синтеза, наращивание цепи соответствующим активированным мономером, для каждого из олигонуклеотидов состояла из 21 шага. В качестве полимерного носителя использовали универсальный CPG носитель (Glen Research) с размером пор . Синтез проводили на уровне 0,5-1,0 мкмоль. Использовали мономеры (Glen Research): dT-CE-фосфорамидит; Bz-A-CE- фосфорамидит; Ас-С-СЕ-фосфорамидит; Ac-G-CE- фосфорамидит; U-CE- фосфорамидит; 2'-OMe-U- СЕ-фосфорамидит; 2'-ОМе-С- СЕ- фосфорамидит. Реакцию сульфирования осуществляли при помощи сульфатизирующего реагента (Sulfurizing Reagent II, Glen Research). Тритильную защиту удаляли 4% раствором дихлоруксусной кислоты в дихлорэтане. Непрореагировавшие 5'-гидроксилы блокировали стандартным образом смесью тетрагидрофуран:лутидин:уксусный ангидрид (80:10:10) и смесью тетрагидрофуран:N-метилимидазол (84:16). Реакцию окисления проводили с использованием йода. Силильную защиту снимали 1M тетрабутиламмоний фторидом в тетрогидрофуране. Аммонолиз осуществляли с использованием водного аммиака. Реакцию детритилирование проводили с использованием уксусной кислоты. Колонку промывали ацетонитрилом, синтез вели в атмосфере аргона. Очистку синтезированных олигонуклеотидов проводили двумя общепринятыми методами: в полиакриламидном гене (ПААГ) или с использованием высокоэффективного жидкостного хроматографического разделения (ВЭЖХ). Качество полученных продуктов синтеза и их химическую чистоту оценивали при помощи хромато-масс-спектрометрического анализа. Образцы анализировали на системе высокоэффективного жидкостного хроматографического разделения с детектором времяпролетного квадрупольного масс-спектрометра высокого разрешения (LC-MS/MS Q-TOF). В качестве элюента использовали метанол, являющийся полярным протонным растворителем.
Структурные схемы этапов синтеза приведены на фиг. 1.
На базе синтезированных олигонуклеотидов получены дуплексы миРНК:
Для ингибирования гена МСМ4 получен дуплекс
Для ингибирования гена Livin получен дуплекс
где Gp, Ср, Ар, Up – рибонуклеотиды;
Ump -2'-O-methyluridine-3'- phosphate (2'-О-метилуридин-3'-фосфат);
Cmp - 2'-Omethylcytidine-3'-phosphate (2'-O-метилцитидин-3'-фосфат);
dTsp - 2'-deoxythymidine-3'-phosphorothioate (2'-дезокситимидин-3'-фосфоротиоат);
dTp - 2'-deoxythymidine-3'-phosphate (2'-дезокситимидин-3'-фосфат).
Получение дуплексов миРНК проводили в следующем растворе: 5Х раствор для миРНК (300 мM KCl; 30 мM Hepes рН7,5; 1 мM MgCl2).
Для создания эффективных катионных липосом в их состав должен входить катионный липид, функцией которого является компактизация НК, и фосфолипиды -липиды-помощники, способствующие проникновению НК в клетку. При этом катионный липид присутствует в количестве от 25 до 67 мол. % на общее количество липидов в композиции. Спермин является природным соединением, участвует в клеточном метаболизме и присутствует во всех эукариотических клетках. Катионные липиды на основе спермина содержат четыре вторичные аминогруппы, благодаря которым происходит конденсация НК. Известно, что катионные липиды, содержащие полиамин, показывают более высокую эффективность трансфекции НК по сравнению с липидами, в состав которых входит четвертичный амин или один вторичный амин. В качестве наиболее эффективных липидов-помощников используются 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE), который способствует переходу из ламелярной фазы в инвертированную гексагональную и яичный фосфатидилхолин (PC), способствующий проникновению в опухоль.
Техническим результатом изобретения также является расширение арсенала средств, способных эффективно доставлять НК в клетки в присутствии сыворотки в ростовой среде. Технический результат достигается предлагаемыми композициями, которые содержат: 1) поликатионный амфифил в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту; 2) нейтральные фосфолипиды (DOPE и PC) в качестве структурообразующих и промотирующих компонентов. При этом катионный липид присутствует в количестве от 25 до 67 мол. % на общее количество липидов в композиции.
Поликатионный липид может иметь, например, один из следующих составов:
-{2,3-dioleyloxy-N-[2(sperminecarboxamido)ethyl]-N,N-dimethyl-1-propanaminium trifluoroacetate}, или DOSPA (Lipofectamine);
- Di-octadecyl-amido-glycyl-spermine, или DOGS, Transfectam;
- 3-β(N-(N',N'-dimethyl,N'-hydroxyethyl aminopropane)carbamoyl) cholesterol iodide (DMHAPC-Chol);
- 3β[N-(N',N'-dimethylaminoethane)-carbamoyl]cholesterol, или DC-Chol;
- 1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид (2X3).
Технический результат также достигается способом получения композиции для доставки малых интерферирующих РНК, характеризующимся тем, что липидную пленку, состоящую из поликатионного амфифила и нейтрального фосфолипида DOPE, гидратируют в воде, и полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке или экструзии.
На основе поликатионного амфифила, предпочтительно, 2X3, нейтрального фосфолипида DOPE и нейтрального яичного фосфатидилхолина (PC) была приготовлена композиция (2X3:DOPE:PC, 50:45:5, мольное соотношение). DOPE и PC не могут самостоятельно переносить НК, так как не имеют в своей структуре катионной группировки, необходимой для связывания и компактизации нуклеиновых кислот. Для формирования композиций использовали гидратирование липидной пленки, состоящей из поликатионного амфифила, DOPE и PC, взятых в соотношении 50:45:5 (мольное соотношение), с последующей ультразвуковой обработкой или экструзией.
Липосомы получали различными способами. В зависимости от используемого метода получают липосомы разного размера и с различающимися характеристиками. Размер липосом важен с точки зрения их применения. В некоторых случаях, например, для инкапсуляции бактерий или крупных белков, нужны крупные липосомы, однако для фармацевтического применения предпочтительны мелкие липосомы, поскольку такие липосомы медленнее выводятся, чем крупные частицы. Кроме того, крупные липосомы могут вызывать эмболию сосудов или не достигать места своего терапевтического воздействия.
Для получения липосом было выбрано два способа.
Первый способ основан на гидратации липидной пленки; для этого смесь липидов в колбе растворяют в органическом растворителе (хлороформ, дихлорметан или спирт) и удаляют растворитель в вакууме в токе аргона, после чего на стенке колбы образуется липидная пленка. Добавление к этой пленке воды или буфера приводит к образованию многослойных липосом. Последующая обработка таких липосом ультразвуком приводит к образованию однослойных липосом.
Второй способ включает стадию гидратации липидной пленки с образованием многослойных липосом, которые превращают в однослойные путем процесса продавливания (экструзии) липидной дисперсии через поликарбонатные фильтры с определенным размером пор. В нашем случае были выбраны мембраны с размером пор 100 нм.
В качестве жидкой фазы были выбраны стерильная вода и раствор Рингера, которые разрешены к медицинскому применению в Российской Федерации.
Были получены три образца катионных липосом:
Образец Л2 приготовлен в стерильной воде методом ультразвукового озвучивания.
Образец Л3 приготовлен в стерильной воде методом экструзии.
Образец Л4 приготовлен в растворе Рингера методом ультразвукового озвучивания.
Образцы Л2 и Л3 представляли собой бесцветные слегка опалесцирующие растворы, в то время как образец Л4 являлся раствором с высокой степенью мутности.
Изучение физико-химических характеристик - размера и поверхностного потенциала (ζ-потенциала) - липосом, связанных с их коллоидной стабильностью, является одним из необходимых этапов при создании липосомальных систем доставки НК.
Для определения размера и ζ-потенциала липосом использовали метод динамического лазерного светорассеяния (ДЛС). Метод ДЛС используется при анализе размера частиц и их поверхностного потенциала в растворе. Распределение по размерам, полученное в ходе ДЛС-измерений, является зависимостью относительной интенсивности рассеяния света от размера частиц и известно как распределение по интенсивности. Из этого распределения после математической обработки получают распределение по количеству частиц.
Определение размеров и поверхностного потенциала полученных образцов катионных липосом проводили на анализаторах Delsa Nano С (Beckman Coulter, США) и Nano ZS (Malvern, Великобритания). Для осуществления измерений готовили 1 мл растворов образцов Л2, Л3 и Л4 в стерильной воде с конечной концентрацией по катионному липиду 0,05 мМ (0,1 мл основного раствора + 0,9 мл стерильной воды).
Как следует из полученных результатов, липосомы Л2, приготовленные в стерильной воде с помощью ультразвука, имели средний размер около 100 нм, индекс полидисперсности указывал на их умеренное распределение по размерам. Липосомы Л3, полученные экструзией через фильтр с диаметром пор 100 нм, имели размер около 120 нм, что соответствует размеру пор, а небольшое значение индекса полидисперсности свидетельствовало об образовании фракции частиц с узким распределением по размерам. Для липосом Л4, приготовленных в растворе Рингера, характерно наличие двух фракций частиц и широкое распределение по размерам. Также следует отметить, что липосомы были стабильны в течение 2 недель, поскольку их размеры не изменялись.
Все липосомы являются положительно заряженными, о чем свидетельствуют положительные значения ζ-потенциалов. Следует отметить, что разница в значениях ζ-потенциалов связана как с размером липосом, так и с ионной силой растворов, в которых они были приготовлены. Так, заряд липосом, приготовленных в растворе Рингера (многокомпонентный физиологический раствор с теоретической осмолярностью 309 мосмоль), был больше заряда липосом Л2 и Л3, приготовленных в стерильной воде. Самыми неудачными липосомами следует признать образец Л4, который имеет тенденцию к агрегации и характеризуется очень широким распределением частиц по размерам. Полученные образцы были проверены на наличие бактериальной обсемененности. Посторонней микрофлоры не обнаружено.
В то же время в экспериментах на мышиной модели была выявлена токсичность липосом. Было предположено и подтверждено с помощью масс-спектрометрии наличие в липосомах побочных продуктов синтеза. Для их устранения был проведен диализ липосом с использованием диализных мешков с размером пор 3.5 кДа в течение 3 дней с трехкратной заменой воды в течение суток. Такая процедура позволила существенно снизить токсичность липосом. Двукратное с интервалом два часа внутривенное введение 0,5 мл 0,814 мМ суспензии липосом не приводило к гибели подопытных мышей.
Наилучший результат по обеспечению минимальной токсичности был достигнут при получении липосом в стерильной воде путем озвучивания и фильтрования через фильтр с порами наноразмеров и с очисткой путем диализа.
Разработанная композиция включает несколько действующих веществ: олигонуклеотиды миРНК к гену МСМ4 и миРНК к гену Livin. На заключительной стадии получения базового препарата для ингибирования роста и стимуляции апоптоза клеток колоректального рака липосомальный вектор объединяют с дуплексами миРНК. Для определения наилучших соотношений миРНК-липосомальный вектор при их комплексообразовании по эффективности переноса малых РНК в клетку были проведены специальные исследования с использованием стандартного флуоресцентного дуплекса (BLOCK-iT Fluorescent, Invitrogen, США, препарат сравнения). Для этого 10 пикомоль миРНК смешивали с липосомальными векторами в разных соотношениях с учетом заряда. Трансфекцию проводили на клетках карциномы толстой кишки НТ-29. Эффективность переноса оценивали при помощи проточной цитометрии через 24 ч после трансфекции. Результаты анализа представлены на фиг. 2, где представлена эффективность трансфекции в зависимости от типа вектора и степени его загрузки. По оси x - соотношение дуплекс:липосома с учетом заряда. По оси y - процент клеток с привнесенным флуоресцентным сигналом.
Было показано, что липосомальные векторы, полученные разными методами, но идентичные по химическому составу, отличаются друг от друга по эффективности переноса миРНК в клетку. Наихудший результат зафиксирован для липосом L3, полученных в среде с раствором Рингера. Наилучшая эффективность переноса была показана для вектора L2. Максимальная эффективность наблюдалась при соотношениях дуплекс:липосома от 1:2 до 1:12.
Полученная композиция была оценена на предмет функциональной активности с использованием культуры клеток карциномы толстой кишки НТ-29. Трансфекцию проводили комбинацией дуплексов Livin + MCM4 в соотношении 1:1. Результаты трансфекции анализировали при помощи флуоресцентной микроскопии с использованием стандартного набора для определения апоптоза (Vybrant Apoptosis Assay Kit №5, Invitrogen, США).
В серии специальных экспериментов in vitro определена доза препарата, обеспечивающая максимальный биологический эффект. В частности показано, что превышение дозы в три раза (150 нM по дуплексу) не приводит к усилению биологического эффекта. Зависимость биологического эффекта от дозы препарата (композиции) представлена на фиг. 3.
Оценку цитотоксичности субстанции провели с использованием МТТ-теста на эпителиальных клетках чело