Последовательности нуклеиновых кислот и пептиды/белки семейства ft, обусловливающие свойства подавления цветения у трансформированных ими растений табака и трансгенных растений
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности, к применению последовательности нуклеиновой кислоты, кодирующей белок, для получения трансгенного растения, у которого стадия цветения подавлена, остановлена или задержана. Также раскрыто применение пептида или белка и вектора для получения трансгенного растения, у которого стадия цветения подавлена, остановлена или задержана. Изобретение позволяет получить трансгенное растение, у которого стадия цветения подавлена, остановлена или задержана. 3 н. и 7 з.п. ф-лы, 18 ил., 4 табл., 4 пр.
Реферат
Настоящее изобретение относится к новым последовательностям нуклеиновых кислот, происходящим из них аминокислотным, пептидным и белковым последовательностям и трансформированным ими растениям и их потомству. Последовательности нуклеиновых кислот обеспечивают задержку или ингибирование цветения. Кроме того, настоящее изобретение относится к способам инженерии нецветущих растений для обеспечения сдерживания трансгенных растений, в особенности тех, которые могут размножаться вегетативно.
Переход от вегетативного роста к репродуктивному развитию является важной особенностью жизненного цикла растений. Точный выбор момента времени начала цветения важен для обеспечения успешного репродуктивного цикла у растений. В сельском хозяйстве и лесном хозяйстве этот переход также очень важен, поскольку он оказывает значительное влияние на выход и биомассу. В качестве примера, развитие цветков является помехой в намерении продуцировать большое количество биомассы, поскольку развитие цветков у растений часто сопровождается завершением вегетативного роста и старением. По этой причине модуляция момента времени цветения, в частности, его задержка, должны привести к увеличению биомассы, поскольку создается возможность превращения всей энергии растения в вегетативный рост, и старение растительного материала подавляется или по крайней мере замедляется.
Многоконтурная сеть путей передачи сигналов, включающая экзогенные сигналы вроде светового периода и яровизации, сильно контролирует относящуюся к развитию стадию цветения в жизненном цикле растения посредством регуляции экспрессии большого числа генов. В ходе эволюции дупликация ключевых генов, контролирующих цветение, по-видимому, сыграла важную роль, принимая во внимание тот факт, что новые функции создавались с помощью генов-гомологов. Известными примерами являются члены семейства фосфатидилэтаноламин-связывающих белков (PEBP) растений, семейства, также обнаруженного у бактерий и животных, причем они вовлечены в различные биологические процессы, являясь, например, ингибиторами протеаз и киназ. У растений, однако, члены семейства PEBP играют важную роль в идентичности меристемы ростка и принимают участие в контролировании времени цветения. Самым известным членом является белок локуса цветения FLOWERING LOCUS T (FT). FT воспринимает условия индукции цветения в листьях и запускает развитие цветков в апикальной меристеме ростка (SAM), являясь, следовательно, мобильной сигнальной молекулой цветения, описанной как «флориген», термин, уже предложенный в 1937 году Чайлахяном. Исследования гомологов у нескольких видов показали, что FT играет невидоспецифическую универсальную роль в стимулировании цветения, например, у видов двудольных растений вроде Arabidopsis, помидора, тополя, яблони, тыквы, сахарной свеклы (Pin et al., 2010) и многих других.
В типовом растении Arabidopsis thaliana экспрессия FT активируется в клетках-спутниках флоэмы листьев с помощью фактора транскрипции с доменами типа «цинковые пальцы» - B-боксами CONSTANS (CO) в условиях индукции - длинного дня (LD) вследствие того факта, что белок CO стабилизируется только в свете. Впоследствии белок FT проникает в элементы ситовидных трубок и переносится посредством массового перетекания в SAM, где он взаимодействует с фактором транскрипции с bZIP-доменами FD; вместе с ним активирует последующие мишени развития цветков, такие как второй цветковый интегратор - супрессор сверхэкспрессии CONSTANS 1 SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1 (SOC1) и ген идентичности цветковых меристем APETALA1 (AP1). Ближайшим гомологом FT в Arabidopsis является сестра-двойняшка FT (TWIN SISTER OF FT, TSF), которая появилась в результате дупликации гена. TSF является прямой регуляторной мишенью CO и действует в качестве промотора цветков, таким образом проявляя избыточную активность относительно FT. В условия отсутствия индукции - короткого дня (SD) цветение не обязательного в отношении LD растения Arabidopsis контролируется с помощью FT-независимого пути с участием гиббереллинов, который непосредственно активирует экспрессию SOC1.
Другим важным ключевым регулятором цветения в Arabidopsis является TERMINAL FLOWER 1 (TFL1); его гомолог CENTRORADIALES из львиного зева является членом-основателем семейства генов PEBP растений. Хотя и обладая высокой степенью схожести последовательности с FT, TFL1 является цветковым репрессором и ответствен за структуру соцветия, являясь, таким образом, функциональным антагонистом родственного ему FT. Однако замена нескольких определенных аминокислот может превратить TFL1 в индуктор цветения, а FT в репрессор цветения соответственно (Hanzawa Y., Money T., and Bradley D. (2005), A single amino acid converts a repressor to an activator of flowering. Proc. Natl. Acad. Sci. U.S.A. 102, 7748; Ahn J.H., Miller D., Winter V.J., Banfield M.J., Lee J.H., Yoo S.Y., Henz S.R., Brady R.L., and Weigel D. (2006), A divergent external loop confers antagonistic activity on floral regulators FT and TFL1. EMBO J. 25, 605-614). Специфическое определение FT и TFL осуществляют на транскрипционном уровне. FT экспрессируется только в листьях и впоследствии переносится в SAM, в то время как экспрессия и трансляция TFL1 происходят только в SAM. Оба белка, TFL и FT, как сообщалось, взаимодействуют с одним и тем же кофактором FD в верхушке ростка, регулируя, таким образом, репрессию или активацию транскрипции генов-мишеней: Комплекс TFL/FD репрессирует транскрипцию генов идентичности цветковых меристем, которые активируются с помощью комплекса FT/FD. Таким образом, нельзя не допустить общую координацию двух белков PEBP в регуляции развития цветков, которые имеют антагонистические функции, и каждый из которых представляет собой подсемейство семейства PEBP. Гомологи TFL1 со схожей функцией подавления цветения являются широко распространенными у других видов и являются одним из трех основных кладов семейства PEBP. Помимо FT, TSF и TFL, в Arabidopsis были охарактеризованы еще три члена семейства PEBP, а именно мать FT и TFL1 (MOTHER OF FT AND TFL1; MFT), которая, судя по всему, проявляет избыточную активность относительно FT, и брат FT и TFL1 (BROTHER OF FT AND TFL1; BFT), а также ARABIDOPSIS THALIANA CENTRORADIALES (ATC), которые демонстрируют избыточную активность относительно TFL1.
Хотя FT и TFL 1 рассматриваются как относящиеся к одному и тому же семейству и идентичны на 57% по их аминокислотной последовательности, они функционируют как антагонисты при развитии цветков, и, более того, каждый из них представляет собой филогенетически отличное подсемейство семейства PEBP.
В известном уровне техники предлагается модуляция времени цветения. Этого можно достичь посредством сверхэкспрессии репрессоров развития цветков, или экспрессию активаторов развития цветков уменьшают с помощью РНК-интерференции (RNAi). Однако во всех этих случаях цветение растения лишь задерживается, но никогда не подавляется. Одним примером является белок FLC Arabidopsis, который может использоваться в качестве репрессора развития цветков, чтобы задержать время цветения, см. WO 2000/050615.
Недавно в сахарной свекле был идентифицирован альтернативный способ подавления цветения. У этого вида растений в ходе эволюции появилась антагонистическая пара гомологов FT (BvFT1 и BvFT2), регулирующая переход к цветению, причем BvFT1, хотя и являясь гомологом FT, подавляет цветение, в то время как BvFT2 стимулирует его (Pin et al., Science 330, 1397 (2010)). Была предложена модуляция экспрессии генов этих белков, в частности, посредством отрицательной регуляции или супрессии гена BvFT2 или положительной регуляции гена BvFT1, для достижения задержки ответа - яровизации в растущих растениях сахарной свеклы или для вызова развития у растений сахарной свеклы фенотипа не выходя в стрелку, см. WO 2010/025888. Однако, поскольку устойчивая к выходу в стрелку сахарная свекла не будет цвести, вследствие не выхода в стрелку, не будут получены семена. Чтобы быть в состоянии сохранить, размножить и коммерциализировать устойчивые к выходу в стрелку растения сахарной свеклы, необходимо, чтобы указанная модуляция была условной или латентной, поскольку сахарную свеклу нельзя размножить вегетативно. Поэтому предлагается использовать индуцируемые промоторы в виде гибридных конструкций для трансфекции. В примерах, BvFT2 был подвергнут сайленсингу посредством получения исходя из него, кассеты для РНК-интерференции. Отмечаемая задержка цветения составляла от нуля до, в одном из 29 случаев, более 87 дней. Кроме того, BvFT1 был экспрессирован под контролем конститутивного промотора Ubi3 из Arabidopsis и в однолетних, и в двухлетних трансгенных растениях. Они продемонстрировали задержку выхода в стрелку, колеблющую от нескольких недель до более трех месяцев.
Поскольку время цветения оказывает огромное влияние на продукцию биомассы, необходимо понимать, каким образом регулируется время цветения у видов, представляющих агрономический интерес. Хотя табак (Nicotiana tabacum), подобно многим другим членам семейства растений Solanaceae, имеет основное экономическое значение в качестве культуры, относительно немного известно о регуляции цветения у табака, и проанализировано лишь несколько генов. Для углубленного исследования развития цветков, табак представляет огромный интерес, поскольку этот вид, по всей вероятности, является результатом события тетраплоидизации и содержит геном LD-культивара Nicotiana sylvestris в сочетании с таковым близкого родственника факультативного SD-культивара Nicotiana tomentosiformis. Однако в отличие от типового растения Arabidopsis, молекулярная основа развития цветков у табака лишь слабо понята, поскольку лишь несколько генов были идентифицированы и охарактеризованы до сих пор.
У трансгенных растений, экспрессирующих ингибитор цветения, который находится под контролем условного или латентного промотора, будут прежде или позже развиваться цветы - или нежелательные, или для получения потомства. Таким образом, раньше или позже такие растения будут непременно источником для продукции пыльцевых зерен. Очевидно, что контролирование такой пыльцы является затруднительным, в случае, когда растения относятся к представляющим коммерческий интерес культурам, выращиваемым вне теплицы. По этой причине ауткроссинг с дикими родственниками и с соответствующими культурными растениями все еще возможен, и нельзя обойти распространение трансгенов в природе.
Целью или задачей настоящего изобретение является преодоление по крайней мере в некоторой степени этого недостатка и обеспечение нуклеиновой кислоты, кодирующей аминокислотную последовательность, способную к подавлению или задержке развития цветков, которая предпочтительно относится к кладу FT в соответствии с большей частью ее аминокислот и мотивом, но которая в любом случае демонстрирует частичную последовательность, которая отклоняется от всех последовательностей и мотива белков FT, известных в данной области техники, придавая новые и уникальные особенности растениям, трансформированным конструкциями, включающими указанную нуклеиновую кислоту. В частности, указанная нуклеиновая кислота может использоваться для создания трансгенных растений, предпочтительно культур, которые или являются растениями с задержкой цветения, или, даже более предпочтительно, являются нецветущими и остаются нецветущими в течение более одного вегетационного периода. Настоящее изобретение фокусируется, таким образом, на использовании растений, которые могут размножаться вегетативно, например, табака или картофеля.
Авторы настоящего изобретения смогли идентифицировать в табаке четыре гомолога FT, называемых NtFT1-4, которые филогенетически относятся к подсемейству FT, но имеют антагонистические функции в развитии цветков. Функция этих белков была исследована с помощью сверхэкспрессии. Неожиданно смогли установить, что растения, сверхэкспрессирующие NtFT, демонстрируют полностью отличные фенотипы, простирающиеся от очень рано цветущих ростков в культуре тканей (NtFT4) до нецветущих, возрастом 9 месяцев и гигантов высотой более 5 м (NtFT1-3). Обычно растение табака сорта SR1 зацветет через приблизительно 6-8 недель после прорастания и достигает высоты приблизительно 1-1,5 м в это время. Посредством сверхэкспрессии одного из FT, которые вызывают подавление цветения, можно было создать растения табака, которые растут исключительно вегетативно в течение по крайней мере девяти месяцев и за этот период достигают высоты, составляющей более 5 м. Авторы настоящего изобретения установили, что этот эффект может быть перенесен на виды, отличные от табака, по крайней мере в семействе Solanacea. Эти результаты позволяют использовать указанные NtFT1, NtFT2 и NtFT3 или их части для конструкций, которые могут использоваться для трансформации не только табака, но также других видов растений семейства Solanacea вроде картофеля. Кроме того, можно трансформировать растения других семейств растений, вроде растений семейства растений Brassicaceae или Asteraceae, например, каучуконосной культуры Taraxacum koksaghyz (Asteraceae), для подавления перехода к цветению. Выбранный вид растений должен предпочтительно размножаться вегетативно.
На фиг. 10 представлено совмещение белков - выбранных для примера членов семейства PEBP растений. Столбы полностью идентичных аминокислот во всех последовательностях при совмещении обозначены с использованием «*»; консервативные замены обозначены с использованием «:»; полуконсервативные замены обозначены с использованием «.». Звездочками отмечены аминокислоты, необходимые для функционирования AtFT в противоположность AtTFL1 (Ahn et al., 2006, см. выше); курсивным шрифтом отмечены аминокислоты, опосредующие функцию BvFT1 в противоположность BvFT2 (Pin et al., 2010, см. выше). Существует один неконсервативный район, в котором AtFT, NtFT4, а также стимулирующий цветение белок из сахарной свеклы, BvFT2, демонстрируют идентичный мотив «YAPGW».
Настоящим изобретением обеспечивается новый класс белков и нуклеиновых кислот, кодирующих указанные белки, причем белки (1) обладают свойствами подавления и (2) включают мотив «NAPDIIDS» вместо мотива «YAPGW» всех стимулирующих цветение белков. Кроме того, этот мотив также отличается от уже охарактеризованного мотива «NAPQQ», подавляющего цветение BvFT1 в идентичном районе белка. Предпочтительно, (3) белки относятся к кладу FT. Термин «относящиеся к кладу FT» будет предпочтительно означать, что белки можно отнести филогенетически к кладу FT и/или имеют по крайней мере 50%, предпочтительно 80% и наиболее предпочтительно 100% аминокислот, которые являются одинаково консервативными в каждом из AtFT, AtTFL1, BvFT1 и BvFT2 (см. колонки аминокислот, отмеченных *, на фиг. 10), и/или имеют по крайней мере 70%, предпочтительно 80% и наиболее предпочтительно 90% цепи аминокислотной последовательности в любом из белков AtFT, AtTFL1, BvFT1 и BvFT2.
Кроме того, авторы настоящего изобретения обнаружили мотив «APDIIDS», и более того мотив «NAPDIIDS», вносящий вклад в свойства подавления цветения указанных и родственных пептидов и белков, и, следовательно, впервые пришли к заключению, что ген StSP5G картофеля (из Solanum tuberosum), который, как сообщалось до сих пор, является возможным ингибитором развития клубней картофеля, и ген SISP5G помидор (из Solanum lycopersicum), а также белки, происходящие из них, играют важную роль в подавлении цветения картофеля и помидор и трансгенных растений, трансформированных ими.
Авторы настоящего изобретения, кроме того, предоставляют нуклеиновые кислоты и белки или пептиды, которые могут экспрессироваться с указанных нуклеиновых кислот, причем последовательностью нуклеиновых кислот является частично или полностью таковая одной из SEQ ID NO: 1, 2, 3 и 4 (фиг. 1-4), или причем последовательностью белков или пептидов является частично или полностью таковая одной из SEQ ID NO 5, 6, 7 и 8 (фиг. 5-8), предпочтительно как указано в зависимых пунктах формулы изобретения.
Кроме того, любая из последовательностей нуклеиновых кислот настоящего изобретения может находиться под контролем промотора. Промотором может быть клеточноспецифический, временно индуцируемый промотор, первоначально присутствующий в растениях табака промотор, предпочтительно промотор, контролирующий природно гены FT1-FT4, в силу чего осуществляется индукция экспрессии FT в клетках-спутниках флоэмы. Кроме того, промотором может быть происходящий из табака тканеспецифический или клеточноспецифический, с течением времени конститутивно активный промотор вроде промотора FD (причем FD является кофактором FT), который предпочтительно экспрессируется в SAM, ткани индукции цветения.
Взамен, промотор может происходить из другого растения, например, клеточноспецифический, временно индуцируемый промотор FT Arabidopsis или таковой переносчика сахарозы AtSUC, оба из которых активны в клетках-спутниках флоэмы листьев в качестве источника. Промотором мог бы быть, кроме того, тканеспецифический или клеточноспецифический, с течением времени конститутивно активный промотор вроде промотора FD Arabidopsis, запускающий экспрессию в SAM.
Другие имеющиеся в продаже промоторы или промоторы, доступные из других источников, а также синтетические промоторы, оба необязательно в сочетании с другими регулирующими компонентами и, в частности, энхансерными компонентами, могут также использоваться, например, ограниченный в пространственном и временном отношении, сильный конститутивно активный, вирусный промотор 35S вируса мозаики цветной капусты (CaMV). В любом случае промотор может быть конститутивным, но эта особенность не является необходимой особенностью.
Нуклеиновые кислоты и пептиды/белки настоящего изобретения предпочтительно используются для увеличения биомассы на растение/на единицу времени, посредством модуляции (отсрочки) времени цветения, или его полного подавления.
Далее настоящее изобретение, кроме того, описывается в виде предпочтительных вариантов осуществления и примеров.
Идентификация и филогенетическая классификация гомологов FT из Nicotiana tabacum
Для идентификации возможных гомологов FT в табаке были скринированы общедоступные базы данных, касающихся последовательностей, (NCBI), используя кодирующую область FT Arabidopsis (AtFT) в качестве BLAST-запрашиваемой последовательности, что привело к идентификации клона кДНК (DV999455.1), который содержит полную открытую рамку считывания, на что указывало совмещение с AtFT. На основе этого клона кДНК были сконструированы праймеры, которые были впоследствии использованы для нескольких подходов с использованием ПЦР, используя кДНК и геномную ДНК листьев табака. Поступая таким образом, можно было идентифицировать открытые рамки считывания и геномные последовательности четырех возможных гомологов FT, которые были названы NtFT1-4; последовательность нуклеиновой кислоты каждого из них показана в SEQ ID NO: 1-4 (см. фиг. 1-4). Совмещение геномных последовательностей и последовательностей кДНК выявило экзон-интронную структуру NtFT1-4, как показано на фиг. 9A. На этой фигуре показана классификация FT-гомологов NtFT1-4 табака. Как следует из части (A), экзон-интронная структура NtFT1-4 табака имеет сходство с таковой AtFT. Экзоны представлены в виде прямоугольников, тогда как линии представляют интроны. Пунктирные линии означают интроны неизвестного размера. В части (B) изображено филогенетическое древо семейства PEBP растений, определенное Karlgren и др. (2011), включающее идентифицированные FT-гомологи NtFT1-4 табака. Значение сокращений является следующим: ATC: A. thaliana Centroradialis; BFT: A. thaliana Brother of FT and TFL1; FT: A. thaliana Flowering Locus T; MFT: A. thaliana Mother of FT and TFL1; NtCET1, 2, 4: N. tabacum Centroradialis-подобные гены из табака; NtFT1-4: N. tabacum Flowering Locus T; TFL1: A. thaliana Terminal Flower 1; TSF: A. thaliana Twin Sister of Flowering Locus T.
Как следует из этих последовательностей, все возможные NtFT имеют геномную структуру, схожую среди них и с таковой генов FT из других видов (при сравнении для примера с AtFT), с четырьмя экзонами, прерываемыми тремя интронами. В то время как длина экзонов является в высокой степени консервативной, длина интронов отличается среди NtFT.
Анализ последовательностей предполагаемых FT табака показал, что они относятся к семейству генов PEBP, поскольку все белки обладают характерным доменом PEBP. Для прояснения филогенетической связи идентифицированных FT-гомологов из табака было создано древо с использованием метода максимального правдоподобия, исходя из совмещения четырех предполагаемых FT табака, для облегчения отнесения FT-гомологов табака к трем кладам семейства PEBP (см. фиг. 9B и пример 1). Тогда как белки Arabidopsis AtFT, AtTFL1 и AtMFT попадают в три основных клада ожидаемым образом, FT-гомологи табака группируются явно в FT-подобном кладе, что служит указанием на их стимулирующую цветение функцию.
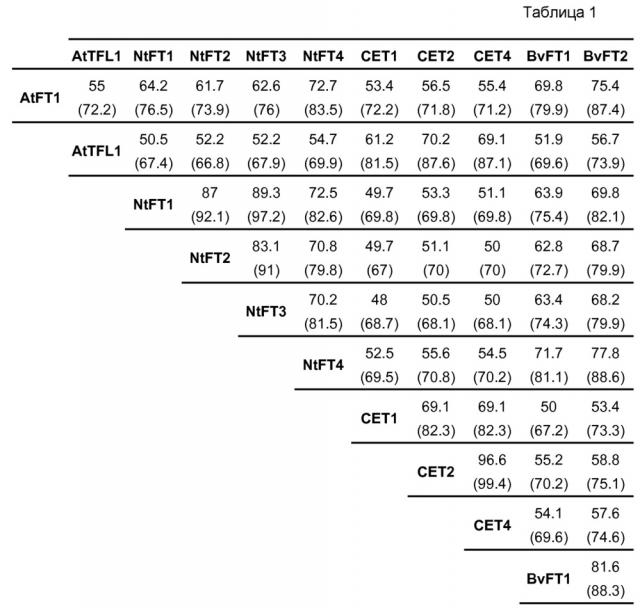
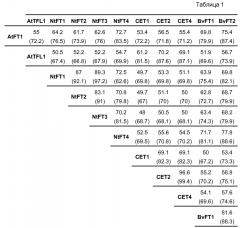
Для подтверждения филогенетической классификации NtFT1-4, было осуществлено совмещение аминокислотных последовательностей этих предполагаемых FT табака со стимулирующими цветение FT Arabidopsis, а также с подавляющим цветение TFL1 Arabidopsis и его гомологами в табаке CET1, CET2 и CET4 (фиг. 10). Возможные FT табака демонстрируют относительно высокую степень идентичности всей последовательности, составляющую от ~70% (NtFT3 с NtFT4) до ~89% (NtFT1 с NtFT3) другом с другом и от ~62% (NtFT2) до ~73% (NtFT4) с AtFT. В противоположность, они демонстрируют меньшую степень идентичности последовательности с CET табака (~52%) и с TFL1 Arabidopsis (~52%). Подробный перечень всех наименований последовательностей, полученный с помощью EMBOSS Needle (http://www.ebi.ac.uk/Tools/psa/emboss_needle/), представлен в таблице 1 ниже. Учитывая филогенетическое древо и схожесть последовательностей, становится очевидным, что предполагаемые FT табака, а именно NtFT1-4, относятся к FT-кладу, а не к TFL1-кладу.
Обнаружение антагонистической функции генов FT табака при цветении
Для оценки функции NtFT1-4 в регуляции времени цветения, соответствующие гены были эктопическим образом сверхэкспрессированы под контролем сильного и конститутивного промотора 35S вируса мозаики цветной капусты (35S:NtFT) в табаке. После трансформации с использованием агробактерий было регенерировано вплоть до 7 независимых трансгенных линий для каждой конструкции.
При культивировании ткани табака авторы настоящего изобретения установили, что конструкция 35S:NtFT4 сильно ускоряет цветение, и сверхэкспрессия приводит к цветкам и подобным цветкам структурам на очень ранней стадии развития растения. Этот вывод можно сделать, исходя из фиг. 11A и 11B: На фотографиях (A) и (B) представлены проростки растений, в случае которых кодирующая область NtFT4 была клонирована 3’ от конститутивного промотора вируса мозаики цветной капусты (35S) и трансформирована в табак с помощью трансформации с использованием Agrobacterium. Можно было регенерировать только проростки с подобными цветкам структурами, несмотря на то, что развитие проростков было задержано, и они не образовали корней, в силу чего регенерация зрелых растений была аннулирована. Следовательно, они не могли регенерироваться в зрелые растения. Фенотип был почти идентичен таковому, обусловленному сверхэкспрессией FT Arabidopsis (35S:AtFT), который служил в качестве контроля в этом эксперименте (фиг. 11C и 11D).
В противоположность, в случае трансформантов, полученных с использованием конструкций 35S:NtFT1, 35S:NtFT2 и 35S:NtFT3, развивались почти нормальные ростки при культивировании ткани. Ростки при использовании всех трех конструкций с различными уровнями экспрессии размножали с использованием черенков (для получения двух клонов каждой линии с идентичными уровнями экспрессии) и выращивали в культуре ткани до развития корней у ростков. Впоследствии, трансгенные клоны каждой линии перемещали в фитотроны, при этом один клон выращивали в условиях LD (длинного дня), а другой - в условиях SD (короткого дня), и определяли время цветения. В этих условиях, у совместно выращиваемых контрольных растений дикого типа цветки начинали развивать через четыре (LD) и пять (SD) недель, что означает, что цветение было задержанным в условиях SD. В этом же эксперименте с использованием LD/SD выращивания, NtFT1-, NtFT2- или NtFT3-трансгенные растения развивались по-разному и продемонстрировали слабо, умеренно и сильно измененные фенотипы, по отношению ко времени цветения и росту в обоих условиях выращивания. Это можно было заметить, как продемонстрировано на фиг. 12A-12F: Репрезентативные трансгенные линии табака, сверхэкспрессирующие NtFT1 (A, D), NtFT2 (B, E) или NtFT3 (C, F), выращивали в условиях длинного дня (A-C) или короткого дня (D-F). В момент времени, когда растения дикого типа (WT) начинали цвести, трансгенные линии были отнесены к трем фенотипическим группам в соответствии с характеристикой роста и временем цветения: трансгенные линии со слабо измененным фенотипом начинали цвести лишь на несколько дней позже растений WT, в случае линий с умеренно измененным фенотипом цветение было задержанным на приблизительно одну неделю. Только в случае конструкции 35S:NtFT3 нельзя было заметить умеренно измененный фенотип. Во время цветения WT, все слабо измененные растения продемонстрировали фенотип, сравнимый с таковым растений WT, и время цветения было лишь слегка отсроченным (~3d), тогда как у умеренно измененных растений первые цветки развивались на 1-1,5 неделю позже, и они продемонстрировали слегка уменьшенную длину междоузлия. В противоположность, у сильно измененных растений какие-либо цветки не развивались в этот же период времени, и становилось явным сильное уменьшение протяженности роста, вызванное значительным укорочением междоузлий. Во время этого периода роста количество листьев было сравнимым с WT, независимо от того, демонстрируют ли растения слабо, умеренно или сильно измененный фенотип. Всесторонние эксперименты с использованием количественной (q) ПЦР в режиме реального времени, используя тотальную РНК листьев, свидетельствовали о прямой корреляции между фенотипом и уровнем экспрессии трансгена, при этом наибольший уровень транскрипта с конкретного гена NtFT отмечался в наиболее сильно измененных растениях. Это можно найти на фиг. 12G-12I, показывающих, что имеется положительная корреляция степени фенотипического изменения - изменения характеристики роста и времени цветения с уровнем экспрессии соответствующего трансгена. На диаграммах фиг. 12J-L представлены результаты количественной ПЦР в режиме реального времени, на которых уровень экспрессии WT был принят за 1, и представлены средние значения для всех линий, представляющих каждый из трех фенотипических классов. «Усы» представляют собой среднеквадратическое отклонение от среднего значения; в случае n=1 «усы» представляют собой среднеквадратическое отклонение от соответствующих тройных повторов количественной ПЦР в режиме реального времени. На фиг. (J)-(L) показаны недели (после перемещения в фитотрон) до цветения растений WT и трансгенных растений, сверхэкспрессирующих или NtFT1 (J), NtFT2 (K), или NtFT3 (L) в условиях длинного дня (LD) и короткого дня (SD). Символ «>» означает, что растения являются все еще нецветующими после отмеченных недель.
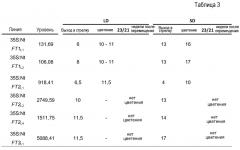
Затем приступили к определению, действительно ли подавлено развитие цветков у сильно измененных растений, или оно является все еще отсроченным. По этой причине все сильно измененные растения с 35S:NtFT1-3 дополнительно выращивали в условиях LD в теплице. На фиг. 13 показаны характеристики роста трансгенных линий табака с сильно измененным фенотипом, сверхэкспрессирующих NtFT1-3. На фотографиях (A)-(J) показаны временные ряды для выбранных для примера линий, сверхэкспрессирующих NtFT1, NtFT2 или NtFT3, выращиваемых в условиях длинного дня. Фотографии сделаны через 8, 11,5 и 29 недель после перемещения (wat) в фитотрон. Растение дикого типа (WT) в I и J является растением возрастом 8 недель. Момент времени выхода в стрелку линий с сильно измененным фенотипом коррелирует с уровнями сверхэкспрессии (таблица 3), поскольку растения, характеризующиеся выходом в стрелку уже через 8,5 недель после перемещения (35S:NtFT7L1 и 35S:NtFT2L1), демонстрируют наименьший уровень экспрессии в пределах растений с сильно измененным фенотипом. Хотя растения с уплощенным фенотипом через 8,5 недель после перемещения начинали выходить в стрелку через приблизительно 11,5 недель после перемещения, они все еще растут именно вегетативно без каких-либо попыток начать развивать цветки в условиях LD. Мерка слева означает 50 см, мерка справа - 1 м. На фиг. 13 (K) изображено сравнение количества листьев, высоты, диаметра стебля и размера листа между цветущим растением WT и сильно сверхэкспрессирующими линиями табака через 28 недель после перемещения. Очевидно, что все параметры являются значительно увеличенными у сильно сверхэкспрессирующих линий. На фиг. 13 (L) изображено сравнение листьев наверху, посередине и внизу между 28-недельными растениями 35S:NtFT2L2, 35S:NtFT3L1 и цветущим, 8-недельным растением WT. Метка=10 см.
Все из 35S:NtFT1-трансгенной и одной из 35S:NtFT2-трансгенных линий начинали выходить в стрелку через 6-8 недель, и в результате у них развивались цветки на высоте, составляющей приблизительно 2 метра, через 11 недель (на фиг. 13A и B, E и F представлена для примера одна отдельная линия), в то время как у остальных 35S:NtFT2-трансгенной и всех 35S:NtFT3-трансгенных линий сохранялся уплощенный и без цветения фенотип (фиг. 13C и 13D, 13G и 13H). Эксперименты с использованием количественной ПЦР в режиме реального времени показали, что уровень транскрипта NtFT был, как правило, выше у растений, у которых сохранялся уплощенный фенотип (таблица 3). 35S:NtFT2-трансгенную и все 35S:NtFT3-трансгенные линии с уплощенным фенотипом и без цветения непрерывно выращивали в течение более 9 месяцев в теплице без перехода в репродуктивную фазу (фиг 13I и J), что было наибольшей продолжительностью наблюдения. Трансгенные линии достигали размера вплоть до 5 м, демонстрируя таким образом огромное увеличение биомассы: В конце эксперимента они имели ~120 листьев с максимальным размером 65 см в длину в случае зрелых листьев с приблизительно 1,5-кратным увеличением размера по сравнению с 8-недельным растением WT (фиг. 13K и L). Схожее увеличение биомассы в приблизительно 3,5 раз также явно для стебля (фиг. 13K). Следует отметить, что выращивание сильно сверхэкспрессирующих растений в условиях SD должно было быть завершено через 6 месяцев, когда растения были высотой 2 м и достигали потолка фитотрона. До тех пор, растения развивались так же, как их аналоги, выращиваемые в условиях LD. Такой вывод можно сделать, исходя из фиг. 14, на которой изображены характеристики роста трансгенных линий табака с сильно измененным фенотипом, сверхэкспрессирующих NtFT1-3 в условиях SD. На фотографиях (A)-(J) показаны временные ряды для выбранных для примера линий, сверхэкспрессирующих NtFT1, NtFT2 или NtFT3, выращиваемых в условиях SD. Фотографии сделаны, как указано ниже в случае каждого изображения (wat: недели после перемещения в фитотрон). Растение дикого типа в I и J является растением возрастом 8 недель. Момент времени выхода в стрелку линий с сильно измененным фенотипом коррелирует с уровнями сверхэкспрессии (таблица 3), поскольку растения, характеризующиеся выходом в стрелку уже через 4-6 недель после перемещения (35S:NtFT7L1 и 35S:NtFT2L1), демонстрируют наименьший уровень экспрессии в пределах растений с сильно измененным фенотипом. Хотя растения с уплощенным фенотипом через 4-6 недель после перемещения начинали выходить в стрелку через приблизительно 14-16 недель после перемещения, они все еще растут именно вегетативно без каких-либо попыток начать развивать цветки в условиях SD. Из-за ограниченной высоты фитотрона выращивание в условиях SD должно было быть прекращено, поскольку растения достигали верхнего уровня фитотрона.
Обнаружение профилей экспрессии на базальном уровне всех NtFT в листьях
Был проанализирован пространственный и временной профиль экспрессии подавляющих цветение NtFT1-3 и стимулирующего цветение NtFT4. Для этого тотальную РНК из ткани листа, верхушки, стебля и корня растений табака возрастом 4 недели, выращиваемых в условиях LD и SD, экстрагировали и подвергали количественной ПЦР в режиме реального времени. На фиг. 15, уровни экспрессии отдельных NtFT представлены относительно NtEF1α, который служил в качестве контрольного гена. NtFT1, NtFT2 и NtFT4 экспрессировались исключительно в ткани листа в обоих световых условиях, однако уровень транскрипции всех генов был низким и находился вблизи предела обнаружения в условиях LD. Это можно обнаружить на фиг. 15A и B, которые показывают, что NtFT1, 2 и 4 экспрессируются исключительно в листьях в условиях SD (A), а также в условиях LD (B), хотя уровень экспрессии в условиях LD находился вблизи предела обнаружения. Значения были приведены к уровню транскрипта с контрольного гена EF1α. Хотя кДНК можно получить для NtFT3, уровень экспрессии был слишком низким, чтобы достоверно проанализировать его пространственно-временной профиль экспрессии с помощью количественной ПЦР в режиме реального времени.
Для получения большего количества сведений о локусе экспрессии подавляющих цветение генов NtFT, пространственный профиль экспрессии исследовали посредством экспрессии для примера ER-меченного варианта зеленого флуоресцентного белка (GFPER) под контролем фрагмента промотора размером 1 т.п.о. NtFT3 (PNtFT3). Пять независимых трансгенных линий табака было получено в результате трансформации с использование агробактерий и названы PNtFT3: GFPER. ER-меченный вариант GFP был выбран для предотвращения распространения GFP через флоэму для правильной идентификации GFP-экспрессирующих клеток. На фиг. 15 (C) и (D) продемонстрирована локализация экспрессии NtFT3 с помощью лазерной сканирующей конфокальной микроскопии CLSM. Фрагмент размером 1 т.п.о. промотора NtFT3 был клонирован 5’ от гена-репортера GFP-ER и стабильно трансформирован в растения табака с помощью трансформации с использованием Agrobacterium. CLSM показала, что экспрессия GFP ограничена сосудистым пучком листьев, как продемонстрировано с использованием поперечного среза черешка листа на фиг. 15 (C). Наибольший сигнал можно было наблюдать в венах базальных листьев, однако экспрессия и, следовательно, флуоресценция была слабой, на что указывала сильная автофлуоресценция ксилемы вследствие высоких интенсивностей лазерного излучения, необходимых для обнаружения. Таким образом, экспрессия NtFT3 может локализоваться в сосудистом пучке, а точнее в клетках-спутниках (D, продольный срез черешка). Автофлуоресценция ксилемы (X) служит отражением низкого уровня экспрессии NtFT3. Стрелки в (C) указывают на сосудистые пучки. Острие стрелки в (D) обозначает ситовидные пластинки, окрашенные анилиновым синим. CC: клетка-спутник; SE: элемент ситовидных трубок; Мерки=50 мкм. Как явствует из продольного среза черешка, PNtFT3, как можно было установить на клеточном уровне, является активным в клетках-спутниках флоэмы (CC), которые типично локализуются рядом с элементами ситовидных трубок (SE), ситовидные пластинки которых окрашивались окрашивающим каллозу красителем анилиновым синим (фиг. 15D). Таким образом, активность PNtFT3 зеркально отображает специфическую для листьев экспрессию NtFT1, NtFT2 и NtFT4, что таким образом указывает на общий пространственный профиль экспрессии обоих FT с активирующей и подавляющей функцией.
Затем более детально был проанализирован временной профиль экспрессии NtFT посредством сравнения уровней экспрессии во время различных стадий развития. Ввиду этого, тотальную РНК из проростков табака и базальных листьев, которые собирали еженедельно до цветения с растений табака, выращиваемых в условиях LD, а также в условиях SD, использовали для оценки экспрессии NtFT1-4 с помощью количественной ПЦР в режиме реального времени. Как можно обнаружить на фиг. 15(E)-15(G), уровни экспрессии NtFT1 (E), NtFT2 (F) и NtFT4 (G) постепенно увеличиваются во время развития в условиях SD, демонстрируя наименьший уровень экспрессии в проростках (момент времени 1) и наибольший уровень экспрессии в листьях цветущих растений (момент времени 6). Уровни транскриптов определяли в проростках (момент времени 1) и базальных листьях, которые собирали каждую неделю до открытия первых цветков (момент времени 2-6). Значения приводили к уровню транскрипта с контрольного гена EF1α.
Как уже отмечалось при анализе пространственного профиля экспрессии, уровни экспрессии NtFT3 в условиях SD и LD, а также уровни экспрессии остальных NtFT в условиях LD приближались к пределу обнаружения. В случае NtFT1, NtFT2 и NtFT4 отмечались схожие профили экспрессии в условиях SD: Все гены продемонстрировали довольно низкий уровень экспрессии в проростках, но последовательное увеличение было явным во время стадий развития, и уровни экспрессии всех NtFT достигали максимума в момент цветения, факт, который, по-видимому, также очевиден для NtFT3. Хотя NtFT4, судя по всему, проявлял обычно более низкий уровень экспрессии, чем NtFT1 и NtFT2, увеличение экспрессии NtFT4 (в 4400 раз) значительно превосходило уве