Идентификация опухолеассоциированных антигенов для диагностики и терапии
Иллюстрации
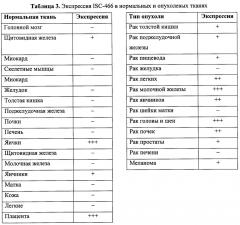
Показать всеНастоящее изобретение относится к биохимии, в частности к фармацевтической композиции, способу лечения или профилактики, а также способу торможения развития опухоли или ракового заболевания, характеризующихся экспрессией опухолеассоциированного антигена, с использованием такой композиции. Указанный антиген имеет последовательность, которая кодируется нуклеиновой кислотой SEQ ID NO: 1, а композиция включает эффективное количество антитела, связывающегося с указанным антигеном. Настоящее изобретение также раскрывает способ диагностики указанных раковых заболеваний, включающий детектирование или определение количества антигена в биологическом образце, взятом у пациента. При этом увеличившееся количество указанного антигена по сравнению с пациентом, у которого нет указанной опухоли или рака, указывает на наличие указанной опухоли или рака. Настоящее изобретение также раскрывает набор для выявления экспрессии указанного антигена в биологическом образце пациента. Настоящее изобретение благодаря обнаружению указанного антигена в ряде раковых заболеваний позволяет обнаружить новые методы для их лечения и диагностики. 6 н. и 19 з.п. ф-лы, 31 ил., 16 табл., 16 пр.
Реферат
Уровень техники
Несмотря на междисциплинарные подходы и всестороннее применение классических терапевтических процедур, раковые заболевания все еще остаются в числе главных причин смертности. Более современные терапевтические концепции направлены на включение иммунной системы пациента в общую терапевтическую концепцию при помощи рекомбинантных противоопухолевых вакцин и других специфических мероприятий типа терапии с помощью антител. Предпосылкой успеха такой стратегии является распознавание опухолеспецифичных или опухолеассоциированных антигенов либо эпитопов иммунной системой пациента, эффекторные функции которой нужно при этом усилить. Раковые клетки в биологическом отношении существенно отличаются от исходных нераковых клеток. Эти отличия обусловлены генетическими изменениями, возникающими при развитии опухоли, и приводят, среди прочего, к образованию измененных в качественном или количественном отношении молекулярных структур у раковых клеток. Ассоциированные с раком структуры такого типа, которые распознаются иммунной системой конкретного несущего опухоль организма, именуются опухолеассоциированными антигенами. Специфическое распознавание опухолеассоциированных антигенов включает клеточные и гуморальные механизмы, составляющие два взаимозависимые звена: Т-лимфоциты CD4+ и CD8+ распознают прошедшие процессинг антигены, представленные на молекулах МНС (главного комплекса гистосовместимости) II и I класса, соответственно, тогда как B-лимфоциты вырабатывают молекулы циркулирующих антител, которые непосредственно связываются с антигенами, не подвергавшимися процессингу. Потенциальное клинико-терапевтическое значение опухолеассоциированных антигенов вытекает из того, что распознавание антигенов на клетках неоплазмы иммунной системой ведет к запуску цитотоксических эффекторных механизмов и, в присутствии хелперных T-клеток, может вызвать элиминацию раковых клеток (Pardoll, Nat. Med. 4: 525-31, 1998). В соответствии с этим главной задачей раковой иммунологии является молекулярное определение этих структур. Молекулярная природа этих антигенов оставалась загадочной в течение длительного времени. Лишь после разработки соответствующих методов клонирования стало возможным систематическое скринирование экспрессионных библиотек кДНК опухолей на предмет ассоциированных с ними антигенов путем анализа структуры мишеней цитотоксических T-лимфоцитов (van der Bruggen et al., Science 254: 1643-7, 1991) или при помощи циркулирующих аутоантител (Sahin et al., Curr. Opin. Immunol. 9: 709-16, 1997) в качестве зондов. С этой целью создавали экспрессионные библиотеки кДНК из свежей опухолевой ткани и подвергали их экспрессии рекомбинантными методами в виде белков в соответствующих системах. Выделенные из пациентов иммуноэффекторы, а именно клоны CTL с признаками опухолеспецифического лизиса либо циркулирующие аутоантитела, использовались для клонирования соответствующих антигенов.
За последние годы таким образом было идентифицировано множество антигенов при различных неоплазиях.
Однако зонды, используемые для идентификации антигенов классическими методами, обычно являются иммуноэффекторами (циркулирующими аутоантителами или клонами CTL) из пациентов на поздней стадии рака. Целый ряд данных показывает, что рак может привести к возникновению толерантности и анергизации T-клеток, а при развитии заболевания из репертуара иммуноэффекторов исчезают именно те специфичности, которые могли бы вызвать эффективное иммуноузнавание. Текущие исследования на пациентах пока не дали надежных данных о реальном действии ранее обнаруженных и используемых опухолеассоциированных антигенов. Следовательно, нельзя исключить того, что белки, вызывающие спонтанные иммунные ответы, не являются искомыми структурами.
Раскрытие изобретения
Целью настоящего изобретения является получение искомых структур-мишеней для диагностики и терапии раковых заболеваний.
Эта цель достигается объектами формулы изобретения.
В соответствии с изобретением идентифицированы гены, которые избирательно или аномально экспрессируются в раковых клетках и при этом образуют опухолеассоциированные антигены. Эти гены и/или их генетические продукты и/или производные и/или фрагменты применимы в качестве структур-мишеней для терапевтических и диагностических методов.
Опухолеассоциированные антигены, идентифицированные в соответствии с изобретением, имеют аминокислотную последовательность, которая кодируется нуклеиновой кислотой, выбранной из группы, состоящей из: (a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 1, 5, 9, 13, 17, 21, 25, 28, 30, 35, 39, 41, 45, 49, 61, 62 и 64-67 из перечня последовательностей, ее часть или производную последовательность, (b) нуклеиновой кислоты, гибридизующейся с нуклеиновой кислотой по п.а в строгих условиях, (c) нуклеиновой кислоты, вырожденной по отношению к нуклеиновой кислоте по п.a или b, и (d) нуклеиновой кислоты, комплементарной нуклеиновой кислоте по п.a, b или c. В предпочтительном воплощении опухолеассоциированный антиген, идентифицированный в соответствии с изобретением, имеет аминокислотную последовательность, которая кодируется нуклеиновой кислотой, выбранной из группы, состоящей из: (a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 1, 5, 9, 13, 17, 21, 25, 28, 30, 35, 39, 41, 45, 49, 61, 62 и 64-67 из перечня последовательностей. В еще более предпочтительном воплощении опухолеассоциированный антиген, идентифицированный в соответствии с изобретением, включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 2, 6, 10, 14, 18, 22, 26, 29, 31, 36, 40, 42, 46, 50-60, 63, 68 и 69 из перечня последовательностей, ее часть или производную последовательность.
Настоящее изобретение в общем касается применения идентифицированных по изобретению опухолеассоциированных антигенов либо их частей или производных, нуклеиновых кислот, кодирующих идентифицированные по изобретению опухолеассоциированные антигены либо их части или производные, нуклеиновых кислот, направленных против данных кодирующих нуклеиновых кислот, антител или T-клеток, направленных против идентифицированных по изобретению опухолеассоциированных антигенов либо их частей или производных, и/или клеток хозяина, экспрессирующих идентифицированные по изобретению опухолеассоциированные антигены либо их части или производные для терапии, диагностики и/или мониторинга неопластических заболеваний. Это может включать и применение комбинации из двух или нескольких таких антигенов, нуклеиновых кислот, антител, T-клеток и/или клеток хозяина, а в одном воплощении также и в сочетании с другими опухолеассоциированными антигенами, чем те, которые идентифицированы по изобретению, кодирующих их нуклеиновых кислот или нуклеиновых кислот, направленных против данных кодирующих нуклеиновых кислот, антител или T-клеток, направленных против данных опухолеассоциированных антигенов, и/или клеток хозяина, экспрессирующих данные опухолеассоциированные антигены.
В тех воплощениях изобретения, которые касаются применения антител, направленных против идентифицированных по изобретению опухолеассоциированных антигенов либо их частей или производных, также могут применяться и T-клеточные рецепторы, направленные против идентифицированных по изобретению опухолеассоциированных антигенов либо их частей или производных, необязательно в комплексе с молекулами МНС.
Особенно пригодными для терапии, профилактики, диагностики и/или мониторинга являются те части идентифицированных по изобретению опухолеассоциированных антигенов, которые не относятся к трансмембранной части, в особенности внеклеточные части опухолеассоциированных антигенов или входящие в их состав. Таким образом, в соответствии с изобретением, для терапии, профилактики, диагностики и/или мониторинга предпочтительны те части идентифицированных по изобретению опухолеассоциированных антигенов, которые не относятся к трансмембранной части, в особенности внеклеточные части опухолеассоциированных антигенов или входящие в их состав, либо соответствующие части нуклеиновых кислот, кодирующих идентифицированные по изобретению опухолеассоциированные антигены. Аналогичным образом предпочтительно применение таких антител, которые направлены против тех частей идентифицированных по изобретению опухолеассоциированных антигенов, которые не относятся к трансмембранной части, в особенности внеклеточных частей опухолеассоциированных антигенов или входящих в их состав.
Для терапии, профилактики и/или диагностики предпочтительными являются такие заболевания, при которых происходит избирательная экспрессия или аномальная экспрессия опухолеассоциированных антигенов, идентифицированных по изобретению.
Кроме того, изобретение касается нуклеиновых кислот и белков или пептидов, образующихся при альтернативном сплайсинге (сплайс-варианты) известных генов или при альтернативной трансляции через альтернативные рамки считывания. В этом аспекте изобретение касается нуклеиновых кислот, содержащих нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28 и 49 из перечня последовательностей. Более того, в этом аспекте изобретение касается и белков или пептидов, содержащих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 29 и 50 из перечня последовательностей.
Альтернативный сплайсинг гена последовательности транскрипта (сплайс-варианта). Трансляция сплайс-варианта на участке альтернативной последовательности приводит к альтернативному белку, который может заметно отличаться по структуре и функции от исходного белка. Опухолеассоциированные сплайс-варианты могут образовывать опухолеассоциированные транскрипты и опухолеассоциированные белки/антигены. Их можно использовать в качестве молекулярных маркеров как для выявления раковых клеток, так и для терапевтического воздействия на опухоли. Детектирование раковых клеток в образце из пациента может проводиться в соответствии с изобретением, например, методом ПЦР-амплификации после экстрагирования нуклеиновых кислот, с помощью олигонуклеотидов, специфичных к сплайс-вариантам.
В соответствии с изобретением, для детектирования подходят все системы детекции, зависящие от последовательности. К ним относятся, помимо ПЦР, к примеру, системы генных чипов/микроматриц, нозерн-гибридизация, методы на основе защиты от РНКаз (RDA) и другие. Общим для всех систем детекции является то, что они основываются на специфической гибридизации по меньшей мере с одной нуклеотидной последовательностью, специфичной для сплайс-варианта. Однако раковые клетки можно детектировать по изобретению и при помощи антител, распознающих специфический эпитоп, кодируемый сплайс-вариантом. Такие антитела могут быть получены при использовании для иммунизации таких пептидов, которые специфичны для данного сплайс-варианта. Особенно подходят для иммунизации такие аминокислотные последовательности, которые заметно отличаются от того варианта генетического продукта, который преимущественно вырабатывается в здоровых клетках. При этом детектирование раковых клеток с помощью антител может проводиться на образцах, взятых у пациента, или в виде интраскопии с помощью введенных внутривенно антител.
Наряду с применимостью для диагностики, сплайс-варианты с новыми или измененными эпитопами являются привлекательной мишенью для иммунотерапии, так как такие эпитопы можно использовать для наводки антител или Т-лимфоцитов, как описано в настоящем изобретении. При пассивной иммунотерапии антитела или T-лимфоциты, распознающие специфичные для сплайс-варианта эпитопы, передают адоптивный иммунитет. Как и в случае других антигенов, антитела могут вырабатываться и по стандартной методике с использованием полипептидов, содержащих такие эпитопы. В качестве альтернативы для иммунизации можно использовать нуклеиновые кислоты, кодирующие пептиды, содержащие данные эпитопы. Известны и подробно описаны различные методы получения эпитопоспецифичных T-лимфоцитов in vitro или in vivo (к примеру, Kessler JH et al., 2001; Sahin et al., 1997), которые также основываются на использовании пептидов, содержащих специфичные для сплайс-варианта эпитопы, или нуклеиновых кислот, кодирующих данные пептиды. Пептиды, содержащие специфичные для сплайс-варианта эпитопы, или нуклеиновые кислоты, кодирующие такие пептиды, могут применяться и в качестве фармацевтически активных веществ при активной иммунотерапии (напр., вакцинации, вакцинотерапии).
В одном аспекте изобретение касается фармацевтической композиции, включающей агента, распознающего идентифицированный по изобретению опухолеассоциированный антиген либо нуклеиновую кислоту, кодирующую опухолеассоциированный антиген, причем он предпочтительно специфичен для клеток, в которых происходит экспрессия или аномальная экспрессия опухолеассоциированных антигенов, идентифицированных по изобретению. В другом аспекте изобретение касается фармацевтической композиции, включающей агента, который: (I) ингибирует экспрессию или активность опухолеассоциированного антигена, идентифицированного по изобретению, и/или (II) обладает ингибирующей или разрушающей опухоли активностью и при этом избирателен в отношении клеток, экспрессирующих или аномально экспрессирующих опухолеассоциированный антиген, идентифицированный по изобретению, и/или (III) при введении он избирательно повышает количество комплексов между молекулой МНС и опухолеассоциированным антигеном, идентифицированным по изобретению, или его частью, к примеру, пептидным эпитопом. В определенных воплощениях данный агент может вызвать гибель клеток, ухудшение роста клеток, повреждение клеточной мембраны или секрецию цитокинов, а предпочтительно обладает ингибирующей опухоли активностью. В одном воплощении агентом является антисмысловая нуклеиновая кислота, которая избирательно гибридизуется с нуклеиновой кислотой, кодирующей опухолеассоциированный антиген, идентифицированный по изобретению. В другом воплощении агентом является короткая интерферирующая РНК (SiRNA), предпочтительно включающая смысловую нить РНК и антисмысловую нить РНК, причем смысловая и антисмысловая нити РНК образуют двойную спираль РНК, и при этом смысловая нить РНК включает нуклеотидную последовательность, практически идентичную заданной последовательности из 19-25 следующих друг за другом нуклеотидов в нуклеиновой кислоте, кодирующей опухолеассоциированный антиген, предпочтительно мРНК, кодирующей опухолеассоциированный антиген. В следующем воплощении агентом является антитело, которое избирательно связывается с опухолеассоциированным антигеном, в особенности активируемое комплементом или конъюгированное с токсином антитело, которое избирательно связывается с опухолеассоциированным антигеном. В предпочтительном воплощении антитело, которое избирательно связывается с опухолеассоциированным антигеном, конъюгировано с терапевтически полезным веществом и/или привлекает естественные или искусственные эффекторные механизмы к клеткам, экспрессирующим или аномально экспрессирующим данный опухолеассоциированный антиген. В следующем воплощении агентом являются цитотоксические T-лимфоциты, распознающие опухолеассоциированный антиген или его часть, связанные с молекулой МНС на клетке, и вызывающие лизис клеток, помеченных таким образом. В следующем воплощении агентом являются хелперные T-лимфоциты, которые усиливают эффекторные функции других клеток, специфически распознающих данный опухолеассоциированный антиген или его часть.
В следующем воплощении агент включает двух или несколько агентов, каждый из которых распознает другой опухолеассоциированный антиген и/или ингибирует экспрессию или активность другого опухолеассоциированного антигена и/или обладает ингибирующей опухоли или разрушающей опухоли активностью и при этом избирателен в отношении клеток, экспрессирующих или аномально экспрессирующих другой опухолеассоциированный антиген, и/или при введении он избирательно повышает количество комплексов между молекулой МНС и другим опухолеассоциированным антигеном или его частью, причем по меньшей мере один из данных различных опухолеассоциированных антигенов является антигеном, идентифицированным по изобретению. Предпочтительно опухолеассоциированный антиген, селективный в отношении опухолей, служит меткой для привлечения эффекторных механизмов в какое-то определенное место. Изобретение включает воплощения, в которых сам агент не обладает способностью к ингибированию активности опухолеассоциированного антигена либо не обладает ингибирующей или разрушающей опухоли активностью, но опосредует такое действие, в частности, путем привлечения эффекторных механизмов, в особенности механизмов, способных вызвать повреждение клеток, в определенное место, в частности, к опухоли или к раковым клеткам.
Активность опухолеассоциированного антигена, идентифицированного по изобретению, может представлять собой любую активность белка или пептида. В одном воплощении такая активность представляет собой энзиматическую активность.
В соответствии с изобретением, выражение "ингибировать экспрессию или активность" означает полное или практически полное ингибирование экспрессии или активности либо снижение экспрессии или активности.
Агент, при введении которого избирательно повышается количество комплексов между молекулой МНС и опухолеассоциированным антигеном, идентифицированным по изобретению, или его частью, включает один или несколько компонентов, выбранных из группы, состоящей из: (i) опухолеассоциированного антигена или его части, (ii) нуклеиновой кислоты, кодирующей данный опухолеассоциированный антиген или его часть, (iii) клеток хозяина, экспрессирующих данный опухолеассоциированный антиген или его часть, и (iv) выделенных комплексов между пептидным эпитопом данного опухолеассоциированного антигена и молекулой МНС.
Изобретение также касается фармацевтической композиции, включающей один или несколько компонентов, выбранных из группы, состоящей из: (i) опухолеассоциированного антигена, идентифицированного по изобретению, или его части, (ii) нуклеиновой кислоты, кодирующей идентифицированный по изобретению опухолеассоциированный антиген или его часть, (iii) антител, связывающихся с идентифицированным по изобретению опухолеассоциированным антигеном или его частью, (iv) антисмысловой нуклеиновой кислоты, специфически гибрйдизующейся с нуклеиновой кислотой, кодирующей идентифицированный по изобретению опухолеассоциированный антиген, (v) SiRNA, направленной против нуклеиновой кислоты, кодирующей идентифицированный по изобретению опухолеассоциированный антиген, (vi) клеток хозяина, экспрессирующих идентифицированный по изобретению опухолеассоциированный антиген или его часть, и (vii) выделенных комплексов между идентифицированным по изобретению опухолеассоциированным антигеном или его частью и молекулой МНС.
В одном воплощении нуклеиновая кислота, кодирующая идентифицированный по изобретению опухолеассоциированный антиген или его часть, в фармацевтической композиции находится в экспрессионном векторе и функционально связана с промотором. В другом воплощении нуклеиновая кислота, кодирующая идентифицированный по изобретению опухолеассоциированный антиген или его часть, в фармацевтической композиции находится в вирусе, как подробно описано ниже.
В следующем воплощении клетки хозяина, входящие в фармацевтическую композицию по изобретению, секретируют опухолеассоциированный антиген или его часть, экспресссируют его на поверхности и предпочтительно также экспресссируют молекулы МНС, связывающиеся с данным опухолеассоциированным антигеном или его частью. В одном воплощении клетки хозяина экспресссируют молекулы МНС эндогенно. В другом воплощении клетки хозяина экспресссируют молекулы МНС и/или опухолеассоциированный антиген или его часть рекомбинантным способом. Клетки хозяина предпочтительно не являются пролиферативными. В предпочтительном воплощении клетки хозяина представляют собой антигенпрезентирующие клетки, в частности дендритные клетки, моноциты или макрофаги.
В следующем воплощении антитело, входящее в фармацевтическую композицию по изобретению, является моноклональным антителом. В других воплощениях антитело является химерным или гуманизированным антителом, фрагментом естественного антитела или синтетическим антителом. Антитело может быть конъюгировано с полезным для терапии или диагностики агентом, который в настоящем изобретении также именуется терапевтическим или диагностическим агентом.
Антисмысловая нуклеиновая кислота, входящая в фармацевтическую композицию по изобретению, может содержать последовательность из 6-50, в частности 10-30, 15-30 и 20-30, следующих друг за другом нуклеотидов нуклеиновой кислоты, кодирующей опухолеассоциированный антиген, идентифицированный по изобретению.
В следующих воплощениях опухолеассоциированный антиген или его часть, обеспечиваемый фармацевтической композицией по изобретению непосредственно либо посредством экспрессии нуклеиновой кислоты, связывается с молекулой МНС на поверхности клеток, причем это связывание предпочтительно вызывает цитолитическую реакцию и/или высвобождение цитокинов.
В предпочтительных воплощениях SiRNA, направленная на нуклеиновую кислоту согласно SEQ ID NO: 1, смысловая нить РНК имеет последовательность SEQ ID NO: 70, а антисмысловая нить РНК имеет последовательность SEQ ID NO: 71, либо смысловая нить РНК имеет последовательность SEQ ID NO: 72, а антисмысловая нить РНК имеет последовательность SEQ ID NO: 73.
Фармацевтическая композиция по изобретению может содержать фармацевтически совместимый носитель и/или адъювант.
Фармацевтическая композиция по изобретению предпочтительно применяется для лечения или профилактики заболеваний, характеризующихся избирательной экспрессией или аномальной экспрессией опухолеассоциированных антигенов. В предпочтительном воплощении заболевание является неопластическим заболеванием, предпочтительно раковым.
В предпочтительном воплощении фармацевтическая композиция по изобретению имеет вид вакцины, которая может иметь терапевтическое или профилактическое применение. Такая вакцина предпочтительно включает идентифицированный по изобретению опухолеассоциированный антиген или его часть и/или нуклеиновую кислоту, кодирующую идентифицированный по изобретению опухолеассоциированный антиген или его часть. В предпочтительных воплощениях нуклеиновая кислота находится в вирусе или клетках хозяина.
Изобретение также касается способов лечения, профилактики, диагностики или мониторинга, т.е. определения регрессирования, прогрессирования, течения и/или возникновения заболеваний, характеризующихся экспрессией или аномальной экспрессией одного или нескольких опухолеассоциированных антигенов, идентифицированных по изобретению, предпочтительно неопластических заболеваний, в особенности раковых. В одном воплощении лечение или профилактика включает введение фармацевтической композиции по изобретению.
Способы диагностики и/или способы мониторинга по изобретению обычно касаются детектирования и/или определения количества одного или нескольких параметров, выбранных из группы, состоящей из: (i) нуклеиновой кислоты, кодирующей идентифицированный по изобретению опухолеассоциированный антиген или его часть, (ii) опухолеассоциированного антигена, идентифицированного по изобретению, или его части, (iii) антител против идентифицированного по изобретению опухолеассоциированного антигена или его части, и (iv) T-лимфоцитов, предпочтительно цитотоксических или хелперных T-лимфоцитов, специфичных к идентифицированному по изобретению опухолеассоциированному антигену или его части и/или комплексу между опухолеассоциированным антигеном или его частью и молекулой МНС, в биологическом образце, взятом у пациента, предпочтительно у пациента, страдающего данным заболеванием, пациента с подозрением на данное заболевание или с вероятностью данного заболевания. Способы такого детектирования и/или определения количества описаны в настоящем изобретении и должны быть понятны специалистам.
Предпочтительно наличие такой нуклеиновой кислоты, опухолеассоциированного антигена или его части, антител и/или T-лимфоцитов либо повышение количества такой нуклеиновой кислоты, опухолеассоциированного антигена или его части, антител и/или T-лимфоцитов по сравнению с пациентами без данного заболевания указывает на наличие данного заболевания или вероятность возникновения данного заболевания.
Способы диагностики и/или мониторинга по изобретению включают и такие воплощения, в которых посредством детектирования и/или определения количества такой нуклеиновой кислоты, опухолеассоциированного антигена или его части, антител и/или T-лимфоцитов можно оценить и/или прогнозировать метастазирование данного заболевания, при этом предпочтительно наличие такой нуклеиновой кислоты, опухолеассоциированного антигена или его части, антител и/или T-лимфоцитов либо повышение количества такой нуклеиновой кислоты, опухолеассоциированного антигена или его части, антител и/или T-лимфоцитов по сравнению с пациентами без данного заболевания или без метастазов данного заболевания указывает на метастазирование данного заболевания или вероятность метастазирования данного заболевания.
В предпочтительных воплощениях такое детектирование и/или определение количества включает: (i) контактирование биологического образца с агентом, специфически связывающимся с нуклеиновой кислотой, кодирующей опухолеассоциированный антиген, или с ее частью, с опухолеассоциированным антигеном или его частью, с антителом или его частью или с T-лимфоцитами, и (ii) детектирование образования или определение количества комплекса между агентом и нуклеиновой кислотой или ее частью, опухолеассоциированным антигеном или его частью, антителом или его частью или T-лимфоцитами. В одном воплощении заболевание характеризуется экспрессией или аномальной экспрессией двух или нескольких разных опухолеассоциированных антигенов, а детектирование или определение количества включает детектирование или определение количества двух или нескольких нуклеиновых кислот, кодирующих два или несколько разных опухолеассоциированных антигенов или их частей, двух или нескольких разных опухолеассоциированных антигенов или их частей, двух или нескольких антител, связывающихся с двумя или несколькими разными опухолеассоциированными антигенами или их частями, и/или двух или нескольких разновидностей T-лимфоцитов, специфичных к двум или нескольким разным опухолеассоциированных антигенам или их частям, либо их комплексов с молекулами МНС. В другом воплощении биологический образец, взятый у пациента, сравнивают со сравнимым нормальным биологическим образцом.
Способы мониторинга по изобретению предпочтительно включают детектирование и/или определение количества одного или нескольких параметров, указанных выше, в первом образце в один момент времени и в другом образце во второй момент времени, при этом течение заболевания определяется путем сравнения двух образцов.
В соответствии с изобретением, детектирование нуклеиновой кислоты или ее части или определение количества нуклеиновой кислоты или ее части может проводиться с помощью олиго- или полинуклеотидного зонда, специфически гибридизующегося с данной нуклеиновой кислотой или ее частью, либо оно может проводиться путем избирательной амплификации данной нуклеиновой кислоты или ее части, например, амплификации методом ПЦР. В одном воплощении олиго- или полинуклеотидный зонд включает последовательность из 6-50, в частности 10-30, 15-30 и 20-30, следующих друг за другом нуклеотидов данной нуклеиновой кислоты.
В предпочтительных воплощениях опухолеассоциированный антиген или его часть, подлежащие детектированию или определению количества способами настоящего изобретения, находятся внутри клетки, на поверхности клетки или в комплексе с молекулой МНС. В соответствии с изобретением, детектирование опухолеассоциированного антигена или его части или определение количества опухолеассоциированного антигена или его части может проводиться с помощью антител, специфически связывающихся с данным опухолеассоциированным антигеном или его частью.
В соответствии с изобретением, детектирование антител или определение количества антител может проводиться с помощью белка или пептида, специфически связывающегося с данным антителом.
В соответствии с изобретением, детектирование или определение количества T-лимфоцитов, специфичных к опухолеассоциированному антигену или его части либо его комплексам с молекулой МНС, может проводиться с помощью клеток, презентирующих комплекс между данным опухолеассоциированным антигеном или его частью и молекулой МНС. Кроме того, T-лимфоциты можно детектировать по их пролиферации, продукции цитокинов и цитотоксической активности, запускаемых при специфической стимуляции комплексом между молекулой МНС и опухолеассоциированным антигеном или его частью. Т-лимфоциты также можно детектировать с помощью рекомбинантных молекул МНС или комплексов из двух или нескольких молекул МНС с иммуногенными фрагментами одного или нескольких опухолеассоциированных антигенов.
Агент, используемый для детектирования или определения количества в способах изобретения, к примеру, олиго- или полинуклеотидный зонд, антитело, белок или пептид либо клетки, предпочтительно подвергается мечению удобным для детектирования образом, в частности, с помощью детектируемого маркера типа радиоактивного маркера или ферментного маркера.
В предпочтительном аспекте изобретение касается способа лечения, профилактики, диагностики или мониторинга заболеваний, характеризующихся экспрессией или аномальной экспрессией опухолеассоциированного антигена, идентифицированного по изобретению, при этом способ включает введение антител, связывающихся с данным опухолеассоциированным антигеном или его частью и конъюгированных с терапевтическим или диагностическим агентом. Антитела могут являться моноклональными антителами. В других воплощениях антитела являются химерными или гуманизированными антителами либо фрагментами естественных антител.
В определенных воплощениях способы диагностики или мониторинга по изобретению заболеваний, характеризующихся экспрессией или аномальной экспрессией опухолеассоциированного антигена, идентифицированного по изобретению, выполняются на биологических образцах, содержащих или предположительно содержащих распространяющиеся раковые клетки или метастазирующие раковые клетки. К таким биологическим образцам относятся, к примеру, кровь, сыворотка крови, костный мозг, мокрота, бронхиальная жидкость и/или бронхиальный смыв.
В одном предпочтительном аспекте изобретение касается способа лечения пациентов, страдающих заболеванием, характеризующимся экспрессией или аномальной экспрессией опухолеассоциированного антигена, идентифицированного по изобретению, при этом способ включает: (i) получение образца, содержащего иммунореактивные клетки, у данного пациента или другого представителя того же вида, в частности у здорового лица, либо представителя другого вида, (ii) контактирование данного образца с клетками хозяина, экспрессирующими данный опухолеассоциированный антиген или его часть, в условиях, способствующих выработке цитолитических T-клеток против опухолеассоциированного антигена или его части, и (iii) введение цитолитических T-клеток пациенту в количестве, подходящем для лизиса клеток, экспрессирующих опухолеассоциированный антиген или его часть. В одном воплощении способ включает клонирование T-клеточного рецептора из полученных цитолитических T-клеток и перенос нуклеиновой кислоты, кодирующей этот T-клеточный рецептор, в T-клетки, полученные из данного пациента или другого представителя того же вида, в частности здорового лица, либо представителя другого вида, при этом T-клетки приобретают нужную специфичность и, как и в п.iii, могут быть введены пациенту.
В одном воплощении клетки хозяина эндогенно экспрессируют молекулу МНС. В другом воплощении клетки хозяина рекомбинантным путем экспрессируют молекулу МНС и/или опухолеассоциированный антиген или его часть. Предпочтительно клетки хозяина презентируют опухолеассоциированный антиген или его часть при помощи молекул МНС на своей поверхности. Клетки хозяина предпочтительно не являются пролиферативными. В предпочтительном воплощении клетки хозяина представляют собой антигенпрезентирующие клетки, в частности дендритные клетки, моноциты или макрофаги.
Изобретение также касается способа лечения заболеваний, характеризующихся экспрессией или аномальной экспрессией опухолеассоциированного антигена, идентифицированного по изобретению, при этом способ включает: (i) идентификацию клеток у пациента, экспрессирующих аномальное количество опухолеассоциированного антигена, (ii) получение образца данных клеток, (iii) культивирование данных клеток и (iv) введение данных клеток пациенту в количестве, подходящем для запуска иммунного ответа на эти клетки.
Настоящее изобретение также касается нуклеиновой кислоты, выбранной из группы, состоящей из: (a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 28, 30, 35, 39, 41, 45, 49, 61, 62 и 64-67, ее часть или производную последовательность, (b) нуклеиновой кислоты, гибридизующейся с нуклеиновой кислотой по п.a в строгих условиях, (c) нуклеиновой кислоты, вырожденной по отношению к нуклеиновой кислоте по п.a или b, и (d) нуклеиновой кислоты, комплементарной нуклеиновой кислоте по п.a, b или с.Изобретение также касается нуклеиновой кислоты, кодирующей белок или полипептид, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 29, 31, 36, 40, 42, 46, 50-60, 63, 68 и 69, ее часть или производную последовательность.
В следующем аспекте изобретение касается рекомбинантной молекулы нуклеиновой кислоты, в частности молекулы ДНК или РНК, включающей нуклеиновую кислоту по изобретению.
Изобретение также касается клеток хозяина, содержащих нуклеиновую кислоту или рекомбинантную молекулу нуклеиновой кислоты по изобретению.
Клетки хозяина также могут содержать нуклеиновую кислоту, кодирующую молекулу МНС. В одном воплощении клетки хозяина эндогенно экспрессируют молекулу МНС. В другом воплощении клетки хозяина рекомбинантным путем экспрессируют молекулу МНС и/или нуклеиновую кислоту или рекомбинантную молекулу нуклеиновой кислоты по изобретению или ее часть. Предпочтительно клетки хозяина не являются пролиферативными. В предпочтительном воплощении клетки хозяина представляют собой антигенпрезентирующие клетки, в частности дендритные клетки, моноциты или макрофаги.
В следующем воплощении изобретение касается олигонуклеотидов, гибридизующихся с нуклеиновой кислотой, идентифицированной по изобретению, которые могут использоваться в качестве генетических зондов или "антисмысловых" молекул. Молекулы нуклеиновой кислоты в виде олигонуклеотидных праймеров или соответствующих зондов, гибридизующихся с идентифицированной по изобретению нуклеиновой кислотой или ее частью, могут использоваться для поиска нуклеиновых кислот, гомологичных данной нуклеиновой кислоте, идентифицированной по изобретению, напр., методами ПЦР-амплификации, саузерн- и нозерн-гибридизации. Гибридизация может проводиться в условиях низкой строгости, более предпочтительно в условиях средней строгости и наиболее предпочтительно в условиях высокой строгости.
В следующем аспекте изобретение касается белка или пептида, кодируемого нуклеиновой кислотой, выбранной из группы, состоящей из: (a) нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбран