Способ закрытия дефекта в кости
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной хирургии, травматологии и ортопедии, и может быть использовано при лечении остеомиелита с дефектом кости. Способ закрытия дефекта кости в эксперименте включает измельчение коралла семейства «Асrороrа» до размеров фрагментов от 98 мкм до 400 мкм. Затем проводят инкубацию этих фрагментов с 1,0-1,5 мл венозной крови, взятой у крысы, путем помещения в холодильник на 12 часов при температуре 4°С . Инкубированной кораллово-кровяной массой заполняют дефект кости после его обработки антисептиком. Способ обеспечивает упрощение подготовки пломбировочной массы, исключение контроля на биосовместимость, сокращение времени подготовки пломбировочной массы к имплантации, повышение качества антибактериальной защиты. 7 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной хирургии, травматологии и ортопедии, и может быть использовано при лечении остеомиелита с дефектом кости.
Исторически предпочтение закрытию дефекта в кости отдавалось его пломбировке. По данным Т.Я. Арьева и Г.Д. Никитина (1955), первоначально хирурги использовали вещества, которые были абсолютно чужеродные для организма: йодоформ (Moseting-Moorhof, 1880); губки (Hamilton, 1881); салициловую кислоту (Schmidt, 1882); медную амальгаму (Maier, 1893); гипс (Deesman, 1893); стекло (Salzer, 1896); свинец (Lesser, 1896); желатин (Schepelman, 1918); вазелин (Оrr, 1919); стеклянную вату и древесный уголь (Kummel, 1920); парафин (Silvestrini, 1920); мазь А.В. Вишневского (A.M. Рыжих, 1943) [5]. Кроме этого применяли: куриный желток [18]; белую глину, азотнокислый и сернокислый висмут, древесные опилки и торф, гуттаперчу, морской песок, Poultry manure (птичий помет), молотый кофе, смесь сахара и хлорамина, сахар, столярный клей, расплавленный парафин, азотнокислый и сернокислый висмут и еще около 50 разновидностей наполнителей [5]. Результаты этих опытов в основном не оправдывали ожидания исследователей и пациентов. Эти пломбы являлись инородными телами в костной полости, а также обладали токсичным действием на живой организм. Поэтому все перечисленные материалы отторгались и вызывали нагноение раны. Однако некоторые вещества нашли свое применение в медицине и в настоящее время.
Современные способы закрытия дефекта кости после удаления секвестра включают: санацию костного дефекта с ультразвуковым санированием полости, введением антибиотиков и химических реагентов, например раствор динатриевой соли этилендиаминтетрауксусной кислоты [3, 20, 26, 29, 37], и стимуляцией регенерации кости; санацию очага воспаления с костной аутопластикой [4, 23, 24, 36]; применение вакуумтерапии для лечения гематогенного остеомиелита [2, 10, 12, 13, 25]; хирургическую санацию с дренированием двумя раздельными дренажами и проведение антибактериальной терапии в сочетании с антисептическими и иммунными препаратами [14, 26, 27, 28, 31, 40]; введение в полость сложного полимерного состава, основой которого служил полиакрилат («костный цемент») с антибиотиками [39]; применение резорбируемых пломб, обладающих способностью стимулировать остеогенез, оказывать противовоспалительное и противомикробное действие [11]. В состав современных резорбируемых пломб могут входить как неорганические вещества (гидроксиаппатит), так и полимерные органические соединения (полилактид, биоситалл, гидроксиапол) [17]. В некоторые резорбируемые пломбы могут быть добавлены антибиотики или молекулы, способствующие более выраженному остеогенному эффекту, например коллаген [38].
Одним из самых популярных современных биодеградирующих пломб является комбинированный препарат «Коллапан», в его состав входит гидроксиаппатит, коллаген и комплекс антимикробных средств [8]. Особенностью «Коллапана» является то, что на его поверхности формируется полноценная костная ткань без формирования соединительно-тканных прослоек между его гранулами [18].
Несмотря на многообразие современных способов пломбировки остаточных полостей костей конечностей, процент неудовлетворительных результатов при лечении остается достаточно велик: по данным ряда авторов положительный эффект достигается лишь в 55-65% случаев [6].
Современные исследователи сходятся во мнении, что более физиологичным способом замещения остаточных полостей, в сравнении с пломбировкой, является трансплантация, то есть пластика биологическими тканями [1, 5, 7, 16, 19, 21, 23, 24, 40]; костные «гранулы», использование кожи, мышцы кости, крови, кровяных сгустков и другие замещающие субстанции [22, 42].
Для активизации репаративного остеогенеза используют: кальций-фосфатный материал, например препарат КоллапАн - биокомпозиционный материал на основе синтетического гидроксиапатита, коллагена и антибиотика (производится отечественной фирмой «Интермедапатит»); препарат Остим (Ostim) - синтетический гидроксиапатит ультравысокой дисперсности в виде пасты («Osartis», Германия); препарат Хронос (chronOs) - гранулы β-трикальцийфосфатной керамики («Mathys Medical Ltd» Швейцария); препарат Церосорб (Cerosorb) - гранулы β-трикальцийфосфатной керамики («Curasan», Германия) [8, 9, 15, 31, 32, 34, 35].
Близким к предлагаемому способу закрытия дефекта кости является техническое решение [33], суть которого заключалась в том, что образцы натурального коралла (НК) механически измельчали в планитарной шаровой мельнице (Retch, Германия: размеры частиц 300-600 мкм) и стерилизовали γ-облучением в дозе 25 кГр. Выполняли оценку острой цитотоксичности и матриксных свойств поверхности НК на культуре иммортализованных нормальных фибробластов человека (ФЧ). За сутки до начала опыта in vitro частицы НК помещали в 96 луночные культуральные планшеты и для насыщения заливали полной ростовой средой (ПРС) следующего состава: среда ДМЕМ («ПанЭко» Россия), 10% эмбриональная телячья сыворотка («HyClone», США), глютамин (292 мг/л), гентамицин (50 мг/л) («ПанЭко» Россия). Затем среду с образцами НК (опыт) декантурировали и вносили суспензию ФЧ в объеме 200 мкл ПРС (плотность посева 70 тыс. клеток на лунку). Контролем служила культура ФЧ на полистирене (культуральный пластик). Опытные и контрольные лунки были представлены в триплетах. Культивирование осуществляли при 37°С и атмосфере влажного воздуха, содержащего 5% СО2. Смену ПРС в планшетах осуществляли дважды в неделю.
Цитотоксичность НК определяли через 24 ч. Матриксные свойства кораллов оценивали в динамике культивирования на них клеток 3, 7 и 14 сут. Жизнеспособность ФЧ на этапах экспериментов оценивали с помощью МТТ-теста [41], рассчитывая пул жизнеспособных клеток (ПЖК) в каждый конкретный срок по оптической плотности раствора формазана, в сравнении с контролем.
Для исследования биосовместимости образцов НК в экспериментах in vivo использовали модель подкожной трансплантации. Для этого крысам-самкам линии Wistar весом 180-200 г - под наркозом делали кожный надрез в области грудного отдела позвоночника и в образованный «карман» имплантировали образец НК весом 120 мг. Рану закрывали узловатыми швами. Животных выводили из эксперимента 3, 6, 9 и 12 нед. Проводили визуальную и гистологическую оценку (окраска гематоксилином и эозином) фрагмента ткани с НК.
Исследования in vivo остеозамещающих потенций НК проводили на краевой резекции большеберцовой кости. У крыс на границе верхней и средней трети кости голени с помощью бора формировали «окончатый дефект» (длина 6-8 мм, ширина 1,5-2 мм, глубина 2,5-3 мм) до нижнего кортикального слоя. Область дефекта заполняли стерильными частицами НК. Операционную рану послойно ушивали. Для проведения морфологических исследований зоны дефекта животных выводили из эксперимента через 3, 6, 9 и 12 нед (по 2 животных в каждый срок), производили гистологические препараты по описанной выше методике.
На микропрепаратах из периферической части этой зоны наблюдалось почти полное замещение вещества НК компактной костной тканью с формированием органотипических структур (остеонов). В отдельных полях зрения между остеонами были остатки вещества коралла, зоны скопления остеобластов, активная неоваскуляризация. В центре некоторых остеонов были выявлены полости с жировой тканью и цепочки остеобластов по периферии полости, по мнению авторов, с зачатками костномозгового матрикса. Авторы полагали, что данные эксперимента при краевой резекции большеберцовой кости крысы при закрытии костного дефекта имплантом на основе натурального коралла свидетельствуют о выраженных остеорепаративных потенциях скелета коралла из семейства Асrороrа.
К недостаткам известного технического решения [33] можно отнести: сложность подготовки коралла для закрытия дефекта в кости, требующей специального дорогостоящего оборудования и реагентов для подготовки пломбировочной массы к имплантации; применение культуры иммортализованных нормальных фибробластов человека, что вызвало необходимость контроля НК на биосовместимость; повышен риск инфекционных осложнений при многочисленных манипуляциях при подготовке коралла к имплантации.
Задача предлагаемого технического решения - устранить недостатки прототипа путем упрощения методики подготовки пломбировочной массы, исключения необходимости выполнять контроль на биосовместимость применяемой пломбировочной массы, сокращения времени подготовки пломбировочной массы к имплантации, повысить качество антибактериальной защиты, исключить использование специального дорогостоящего оборудования и реагентов для подготовки пломбировочной массы к имплантации.
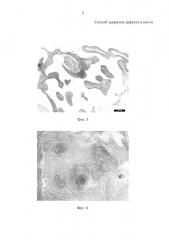
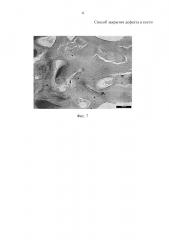
На фиг. 1-5 представлен следующий поясняющий материал:
на фиг. 1 - измельченный экзоскелет коралла Асrороrа, применяемый в остеопластике с размером фрагментов от 98 мкм до 400 мкм с пористой структурой (нативный препарат - микроскопия в отраженном свете с увеличением × 7);
на фиг. 2 - прорастание сосудов в толщу трансплантата на 7 сутки после операции (окраска гематоксилином и эозином, увеличение × 40);
на фиг. 3 - миграция фибробластов и наработка ими волокнистого матрикса на 10 сутки после операции (окраска гематоксилином и эозином, увеличение × 40);
на фиг. 4 - на 20 сутки после операции развитие хрящевой ткани в полостях трансплантата, который имеет ячеистое строение из-за пустот, остающихся после растворения коралла в процессе декальцинации (окраска гематоксилином и эозином, увеличение × 40);
на фиг. 5 - формирование костных манжеток в полостях трансплантата на 30 сутки после операции (окраска гематоксилином и эозином, увеличение × 40);
на фиг. 6 - формирование остеонов на 40 сутки после операции (окраска гематоксилином и эозином, увеличение × 40);
на фиг. 7 - сформированная костная ткань на 60 сутки после операции (окраска гематоксилином и эозином, увеличение × 40);
Выполнение поставленной задачи достигается тем, что в качестве пломбировочного материала применяются измельченный коралл семейства Асrороrа, с размером фрагментов от 98 мкм до 400 мкм (фиг. 1) после предварительного инкубирования в цельной крови, взятой у объекта, взятого в эксперимент.
Реализация способа закрытия дефекта в кости осуществлялась в эксперименте на беспородных крысах-самцах с массой 300-340 г, у которых под общим обезболиванием с соблюдением асептики и антисептики на границе верхней и средней трети кости голени с помощью шаровидной стоматологической фрезы формировали дефект 8×2×2,5 мм (40 мм3) до нижнего кортикального слоя. После гемостаза рану закрывали наглухо, и кожный шов обрабатывали настойкой йода со спиртом. Конечность крысы обездвиживали в коленном и голеностопном суставах лангетной повязкой от середины бедра до стопы. Во время операции у животного брали венозную кровь до 1,0-1,5 мл, которой обрабатывали измельченный коралл семейства Асrороrа, помещенный в стерильную емкость. Емкость с обработанным кровью кораллом помещали в холодильник на 12 часов при температуре 4°С. Затем инкубированной кораллово-кровяной массой заполняли дефект кости после обработки его антисептиком (раствор фурацилина). Через 7 суток в толще трансплантата определяли кровеносные сосуды (фиг. 2). На 10 сутки после операции была выявлена миграция фибробластов, окруженных волокнистым матриксом (фиг. 3). Хрящевая ткань в трансплантате появлялась уже на 20 сутки. В трансплантате были ячейки лишенные ткани, которые появились в результате растворения коралла в процессе декальцинации (фиг. 4). Через 30 суток после операции в полостях трансплантата были сформированы костные манжетки (фиг. 5), а к 40 суткам - формировались остеоны (фиг. 6). Окончательное формирование костной ткани было определено на 60 сутки после операции (фиг. 7).
Положительный эффект, достигаемый применением способа:
1. Для закрытия дефекта кости применен коралл семейства Асrороrа после предварительной инкубации с кровью экспериментального животного, что исключило необходимость выполнять контроль на биосовместимость применяемой пломбировочной массы;
2. Сократилось время и упростилась методика подготовки пломбировочной массы к имплантации, что повысило качество антибактериальной защиты;
3. Не требуется специального дорогостоящего оборудования и реагентов для подготовки пломбировочной массы к имплантации.
Список использованной литературы
1. Агафонов И.А. Пластика кровоснабжаемыми тканями при лечении хронического остеомиелита: автореф. дис. … канд. мед. наук: 14.00.22 / Агафонов И.А. - Л., 1971. - 26 с.
2. Авторское свидетельство СССР 602179, А61Н 9/00, опубл. 15.04.1974.
3. Авторское свидетельство СССР 1122323, A61K 31/71, опубл. 07.11.84.
4. Авторское свидетельство СССР 1503775, МПК: А61В 17/56, опубл. 30.08.89.
5. Арьев Т.Я. Мышечная пластика костных полостей / Т.Я. Арьев, Г.Д. Никитин. - М.: Медгиз, 1955. - 175 с.
6. Батаков В.Е. Применение плазменного аутофибронектина в комплексном лечении хронического остеомиелита: дис. … канд. мед. наук / В.Е. Батаков - Самара, 2010. - 139 с
7. Барабаш А.А. Свободная костная пластика в дистракционный регенерат при ортопедической патологии (экспериментально-клиническое исследование): автореф. дис. … канд. мед. наук. - Новосибирск, 1998. - 19 с.
8. Берченко Г.Н., Кесян Г.А., Уразгильдеев Р.З., Арсеньев ИГ., Микелаишвили Д.С. Сравнительное экспериментально-морфологическое исследование влияния некоторых используемых в травматолого-ортопедической практике кальций-фосфатных материалов на активизацию репаративного остеогенеза // Бюллетень Восточно-сибирского научного центра Сибирского отделения РАМН. - 2006. - №4(50). - 327-333.
9. Бушуев О.М. Использование Коллапана в комплексном лечении хронического остеомиелита: автореф. дис. … канд. мед. наук. - Москва, 1999. - 21 с.
10. Турин А.В. Роль монооксида азота в центральных механизмах регуляции температуры тела: автореф. дисс. на соиск. уч. степ к.б.н. - Москва, 1995. - 22 с.
11. Глухов А.А., Алексеева Н.Т., Микулич Е.В. Экспериментальное обоснование применения струйной санации и тромбоцитарного концентрата в лечении хронического остеомиелита длинных трубчатых костей // Вестник экспериментальной и клинической хирургии - 2012. - Т. 5, №1. - С. 131-136.
12. Двужильная Е.Д., Южаков С.Ф. Применение вакуумтерапии при гнойных воспалительных процессах // Клиническая хирургия. - 1967. - №5. С. 32.
13. Ефименко Н.А., Хрупкий В.И., Марахонич Л.А. и др. Воздушно-плазменные потоки и NO-терапия - новая технология в клинической практике военных лечебно-профилактических учреждений // Военно-мед. журнал. - 2005. - №5. - С. 51-54.
14. Исаков Ю.Ф., Долецкий С.Я. Детская хирургия. - М.: Медицина, 1971. - С. 148
15. Кесян Г.А., Берченко Г.Н., Уразгильдеев Р.З. и др. Сочетанное применение обогащенной тромбоцитами аутоплазмы и биокомпозиционного материала коллапан в комплексном лечении больных с длительно несрастающимися переломами и ложными суставами длинных костей конечностей // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2011, №2. - С. 26-32.
16. Козло, И.В. Пластическое замещение остеомиелитических дефектов голени и стопы лоскутами с осевым типом кровоснабжения: клинико-анатомическое исследование: автореф. дис. … канд. мед. наук / И.В. Козлов. - СПб., 2008. - 22 с.
17. Котельников Г.П., Сонис А.Г. Влияние гравитационной терапии на репаративный остеогенез у пациентов с остеомиелитом нижних конечностей // Саратовский научно-медицинский журнал - 2010. - Т. 6 - №3 - С. 695-700.
18. Кузнецов Н.А., Никитин В.Г., Телешова Е.Б., Мильчаков А.А. Антисептики и биодеградирующие импланты в лечении хронического послеоперационного остеомиелита // Хирургия. - 2009. - №5 - С. 31-35.
19. Лубегина З.П., Штин В.П. Взаимоотношение сосудов остеомиелитической полости и пересаженной мышцы после некрэктомии в эксперименте // Ортопедия, травматология и протезирование. - 1976. - №6. - С. 76-77.
20. Машковский М.Д. Лекарственные средства: Изд. 12-е. - М.: Медицина, 1993. - Т. 2. - С. 227-228.
21. Мельникова А.В. Замещение клетками пуповинной крови костных полостей экспериментального остеомиелита: экспериментальное исследование: автореф. дис. … канд. мед. наук - Уфа, 2009 - 21 с.
22. Микулич Е.В. Современные принципы лечения хронического остеомиелита //Вестник новых медицинских технологий - 2012. - Т. XIX, №2 - С. 180-184.
23. Никитин Г.Д., Рак А.В., Линник С.А., Николаев В.Ф., Никитин Д.Г. / Костная мышечно-костная пластика при лечении хронического остеомиелита и гнойных ложных суставов. - СПб: Издательство «ЛИГ», 2002, 185 с. (93-94).
24. Никитин, Г.Д., ., Рак А.В., Линник С.А. и др. Хирургическое лечение остеомиелита. - СПб: Русская графика, 2000. - 288 с. (90-94)
25. NO терапия: теоретические аспекты, клинический опыт и проблемы применения экзогенного оксида азота в медицине", под ред. Грачева С.В., Шехтера А.Б., Козлова Н.П. - М.: Издательский дом «Русский врач», 2001. - С. 122-124.
26. Охотский В.П. Активное дренирование в лечении больных с хроническим посттравматическим остеомиелитом длинных трубчатых костей // Первый Белорусский международный конгресс хирургов. - Витебск, 1996. - С. 81-82.
27. Патент SU 1140767, А61В 17/56, опубл. 23.02.1985.
28. Патент RU 2221573, A61K 33/08, А61М 25/00, А61Р 19/08, опубл. 20.01.2004.
29. Патент RU 2222324, A61K 31/198, A61N 7/00, А61Р 19/08, опубл. 27.01.2004.
30. Патент RU 2288665, А61В 17/56, опубл. 10.12.2006.
31. Патент RU 2356508, А61В 17/56, опубл. 27.05.2009.
32. Рак А.В. Оперативное лечение ложных суставов длинных трубчатых костей: автореферат дис. на соискание ученой степени кандидата медицинских наук. - Ленинград, 1974. - 17 с.
33. Свиридова И.К., Сергеева Н.С., Франк Г.А., Тепляков В.В., Кирсанова В.А., Ахмедова С.А., Мыслевцов И.В., Шанский Я.Д. Клеточная травматология и тканевая инженерия. - 2010. - Т. 5, №4. - С. 43-48.
34. Терновой К.С., Прокопова Л.В., Алексюк К.П. Лечение остеомиелита у детей. - Киев: Здоровье, 1979. - С. 131-132.
35. Уразгильдеев З.И., Бушуев О.М., Берченко Г.Н. Применение Коллапана для пластики остеомиелитических дефектов костей // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 1998. - №2. - С. 31-35.
36. Хронический остеомиелит. Сборник научных трудов / под ред. проф. Г.Д. Никитина // Труды ЛСГМИ. - Ленинград, 1982. - 134 с. (30 и 79).
37. Cameron J.A. The choice of irrigant during hand instrumentation and ultrasonic irrigationof the root canal: a scanning electron microscope study.//Austral. Dental. Jorn. - 1995. - Vol. 40 (2). - P. 85-90.
38. Carpenter, J., Khang T.J., Webster D. Nanometer polymer surface features: the influence on surface energy, protein adsorption and endothelial cell adhesion // Nanotechnology. - 2008. - Vol. 19 (50). - P. 505-508.
39. Sealy P.I. et al. Delivery of antifungal agents using bioactive and non-bioactive bone cements // Annual of pharmacotherapy - 2009 - Vol. 43.- P. 1606-1615.
40. Me GRow J.B. et all. Atlas of muscle a musculocuteon fons flaps norflok, - Hampton Press, 1986. - 485 p.
41. Mossman T.J. Rapid colorivetric, assay for cellular growth and cytotoxity assays // Immunol. Methods. - 1983. - Vol. 65. - P. 55-63.
42. Parsons, В., Straus E. Surgical management of chronic osteomyelitis // Am. J. Surg. - 2004. - Vol. 188 Suppl. - P. 57-66.
Способ закрытия дефекта кости в эксперименте, включающий имплантацию в сформированный у крысы костный дефект измельченного коралла семейства «Асrороrа», отличающийся тем, что измельченный коралл с размерами фрагментов от 98 мкм до 400 мкм инкубируют с 1,0-1,5 мл венозной крови, взятой у крысы, путем помещения в холодильник на 12 часов при температуре 4°С и затем инкубированной кораллово-кровяной массой заполняют дефект кости после обработки антисептиком.