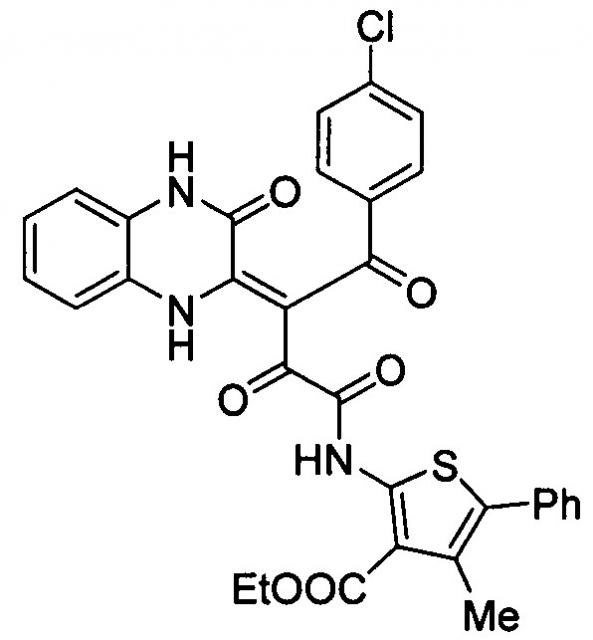
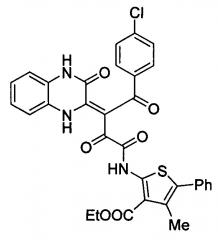
Способ получения (z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1н)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата
Иллюстрации
Показать всеИзобретение относится к способу получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1Н)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата формулы
путем взаимодействия 3-(4-хлорбензоил)пирроло[1,2-a]хиноксалин-1,2,4(5H)-триона и этил 2-амино-5-метил-4-фенил-4,5-дигидротиофен-3-карбоксилата в безводной уксусной кислоте.
Технический результат - новый способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата, позволяющий сократить время проведения реакции, избежать использования дорогостоящего растворителя (ацетонитрила) для проведения синтеза и перекристаллизации соединения и увеличить выход целевого продукта, который может быть использован для лечения сахарного диабета второго типа. 2 з.п. ф-лы, 2 пр.
Реферат
Изобретение относится к области органической химии, а именно к способам получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1Н)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата
обладающего выраженной противодиабетической активностью и низкой токсичностью.
Известен способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата, принятый за прототип (Патент РФ №2606230; МПК C07D 409/12, А61K 31/519, А61K 31/381, А61Р 3/10; 10.01.2017), согласно которому соединение получают путем добавления к кипящему раствору 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона в сухом ацетонитриле раствора этил 2-амино-5-метил-4-фенил-4,5-дигидротиофен-3-карбоксилата в сухом ацетонитриле, кипячения реакционной смеси в течение 30 минут, дальнейшего охлаждения реакционной массы и выдерживания ее при комнатной температуре в течение суток. Недостатками данного способа являются относительно невысокие выходы целевого продукта, длительное время протекания реакции, необходимость перекристаллизации для получения чистого продукта, использование дорогостоящего растворителя (ацетонитрила) для проведения синтеза и для перекристаллизации продукта.
Задачей заявляемого изобретения является разработка способа синтеза (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1Н)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата, лишенного вышеперечисленных недостатков.
Технический результат - новый способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата, позволяющий сократить время проведения реакции, избежать использования дорогостоящего растворителя (ацетонитрила) для проведения синтеза и перекристаллизации соединения и увеличить выход целевого продукта, который может быть использован для лечения сахарного диабета второго типа.
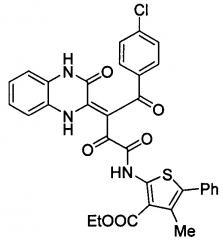
Поставленная задача решается использованием в новом способе получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1Н)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата формулы
уксусной кислоты в качестве более дешевого растворителя для проведения синтеза.
Предлагаемое соединение получают путем смешивания суспензии 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона в безводной уксусной кислоте и раствора этил 2-амино-5-метил-4-фенил-4,5-дигидротиофен-3-карбоксилата в безводной уксусной кислоте при температуре 20-110°С, нагревания реакционной смеси в течение 30-60 минут при температуре 100-110°С, охлаждения реакционной массы и последующей очистки отмывкой галогенсодержащим органическим растворителем, например дихлорметаном.
Схема реакции.
При этом (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилат может быть использован для лечения сахарного диабета второго типа. Изобретение иллюстрируется нижеприведенными примерами.
Пример 1. Способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата - вариант 1.
В трехгорлую круглодонную колбу, снабженную обратным холодильником с хлоркальциевой трубкой, капельной воронкой и механической мешалкой, помещают 11,19 г 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона и 350 мл безводной уксусной кислоты. Реакционную смесь нагревают при перемешивании до 100-110°С. При перемешивании в течение 15 минут к реакционной смеси прикапывают раствор 8,29 г этил 2-амино-4-метил-5-фенилтиофен-3-карбоксилата в 140 мл безводной уксусной кислоты, после чего реакционную смесь в течение 30 минут интенсивно перемешивают при 100-110°С до полного исчезновения темно-фиолетового осадка. По истечении времени реакционную смесь охлаждают до комнатной температуры, выпавший оранжевый осадок отфильтровывают. Для дополнительной очистки полученный оранжевый осадок отмывают дихлорметаном. Для этого осадок помещают в стакан, приливают к нему 700 мл дихлорметана, суспензию перемешивают с помощью мешалки при комнатной температуре 30 минут и отфильтровывают осадок. Ярко-оранжевое кристаллическое вещество. Выход 14.02 г (72%), т.пл. 243-245°С (плавится с разложением). ИК спектр (ФСМ-120, вазелиновое масло, ν, см-1): 3205, 3180 (NHCO), 3152 (NH), 1693 (СОО), 1682 (CONHгетероцикла), 1670 (CONHбоковой цепи), 1660 (COAr), 1611 ш (С2=O), 1549 (амид II).
Спектр ЯМР 1Н (Bruker АМ-400 [рабочая частота 400 МГц] в ДМСО-d6, внутренний стандарт - ТМС. Спектр ЯМР 1Н, δ, м.д.: 1.39 т (3Н, СН3СН2, J 7.0 Гц), 2.35 с (3Н, СН3), 4.40 к (2Н, СН3CH2, J 7.0 Гц), 7.23-7.48 м (10Н, НAr), 7.75-7.83 м (3Н, НAr), 12.32 с (1H, N4'H), 12.36 с (1Н, NHамид.), 14.95 уш.с (1H, N1'H).
Найдено, %: С 62.67; Н 3.98; N 6.75; S 5.10. C32H24O6N3ClS. Вычислено, %: С 62.59; Н 3.94; N 6.84; S 5.22.
Пример 2. Способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата - вариант 2.
В трехгорлую круглодонную колбу, снабженную обратным холодильником с хлоркальциевой трубкой и механической мешалкой, помещают 11,19 г 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона и 350 мл безводной уксусной кислоты. При перемешивании к реакционной смеси при комнатной температуре приливают раствор 8,29 г этил 2-амино-4-метил-5-фенилтиофен-3-карбоксилата в 140 мл безводной уксусной кислоты. Реакционную смесь нагревают при перемешивании до 100-110°С и интенсивно перемешивают при этой температуре 30-60 минут до полного исчезновения темно-фиолетового осадка. По истечении времени реакционную смесь охлаждают до комнатной температуры, выпавший оранжевый осадок отфильтровывают. Для дополнительной очистки полученный оранжевый осадок отмывают дихлорметаном. Для этого осадок помещают в стакан, приливают к нему 700 мл дихлорметана, суспензию перемешивают с помощью мешалки при комнатной температуре 30 минут и отфильтровывают осадок. Ярко-оранжевое кристаллическое вещество. Выход 15.79 г (81%), т.пл. 243-245°С (плавится с разложением). Спектральные характеристики полученного продукта аналогичны описанным выше в примере 1.
Таким образом, использование в синтезе (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата в качестве растворителя более дешевой по сравнению с ацетонитрилом уксусной кислоты позволяет сократить время проведения реакции, увеличить выход целевого продукта, для очистки которого не требуется перекристаллизации.
1. Способ получения (Z)-этил 2-(4-(4-хлорфенил)-2,4-диоксо-3-(3-оксо-3,4-дигидрохиноксалин-2(1H)-илиден)бутанамидо)-4-метил-5-фенилтиофен-3-карбоксилата формулы
характеризующийся тем, что суспензию 3-(4-хлорбензоил)пирроло[1,2-а]хиноксалин-1,2,4(5H)-триона в безводной уксусной кислоте смешивают с раствором этил 2-амино-5-метил-4-фенил-4,5-дигидротиофен-3-карбоксилата в безводной уксусной кислоте, нагревают реакционную смесь в течение 30-60 минут при температуре 100-110°С, после чего охлаждают реакционную массу.
2. Способ по п. 1, отличающийся тем, что смешивание суспензии и раствора исходных реагентов проводят при температуре 20-100°С.
3. Способ по п. 1, отличающийся тем, что полученный целевой продукт дополнительно очищают путем отмывки галогенсодержащим органическим растворителем, например дихлорметаном.