Способ получения антимикробных пептидов из тромбоцитов курицы домашней
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к микробиологии и биохимии, и предназначено для получения антимикробных пептидов. Для получения антимикробных пептидов из тромбоцитов курицы домашней осуществляют следующие сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5). Центрифугируют собранную кровь при 250 g в течение 30 минут. Полученный супернатант центрифугируют при 1000 g 30 минут. Полученные осажденные тромбоциты отмывают трижды средой 199 с добавлением 3,8% цитрата натрия. Отмытую тромбоцитарную массу ресуспендируют в 10%-ной уксусной кислоте и выдерживают при -15…-20°С в течение 24 часов. Размораживают и центрифугируют полученный экстракт при 1000 g в течение 40 минут. Высаживают антимикробные вещества из полученного супернатанта охлажденным ацетоном в соотношении 1:7 (объем/объем) в течение 12 часов при 4°С. Центрифугируют осадок при 6000 g в течение 10 минут, высушивают на воздухе при интенсивном перемешивании и измельчают. Обессоливают полученный ацетоновый осадок путем обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) в ступенчатом градиенте увеличения концентрации 80% водного ацетонитрила в 0,1% водной трифторуксусной кислоте (ТФУ) до значения 75%. После элюции с колонки подупаривают суммарный экстракт от избыточного содержания ацетонитрила на вакуумной центрифуге с последующей лиофилизацией. Перерастворяют высушенный обессоленный экстракт в 0,1% ТФУ и разделяют методом аналитической ОФ-ВЭЖХ в линейном градиенте повышения концентрации водного ацетонитрила в водной ТФУ от 8 до 40% (основной) и 40-56% (дополнительный). Собирают и лиофилизируют антимикробные пептиды. Использование изобретения обеспечивает получение очищенных антимикробных пептидов из тромбоцитов курицы домашней. 2 табл., 1 пр.
Реферат
Изобретение относится к микробиологии и биохимии, а именно получению антимикробных пептидов из тромбоцитов курицы домашней, и может быть использовано для получения новых лекарственных препаратов, обладающих антимикробной активностью.
В связи со значительными темпами роста устойчивости возбудителей инфекционных заболеваний к антибиотикам [Виноградова К.А., Булгакова В.Г., Полин А.Н., Кожевин П.А. Устойчивость микроорганизмов к антибиотикам: резистома, ее объем, разнообразие и развитие // Антибиотики и химиотерапия. 2013, т. 58. №5-6: 38-48], актуален поиск альтернативных терапевтических средств, резистентность к которым у микроорганизмов будет развиваться ограниченно или полностью отсутствовать [Ashby М., Petkova А., Hilpert K. Cationic antimicrobial peptides as potential new therapeutic agents in neonates and children: A review // Current Opinion in Infectious Diseases. 2014. 27(3): 258-267]. Такими средствами могут явиться антимикробные пептиды [Кокряков В.Н., Ковальчук Л.В., Г.М., Шамова О.В. Катионные противомикробные пептиды как молекулярные факторы иммунитета: мультифункциональность. Журнал микробиологии, эпидемиологии и иммунобиологии. 2006. №2: 98]. Выделение и структурно-функциональное изучение антимикробных пептидов животного происхождения создает предпосылки для разработки и производства химически или биотехнологически синтезированных гомологов этих соединений [Кокряков В.Н. Очерки о врожденном иммунитете. СПб.: Наука, 2006: 108].
Известно, что клетки крови, в частности кровяные пластинки человека и животных, являются источником различных катионных пептидов, обладающих выраженной антимикробной активностью [Tang Y.-Q., Yeaman M.R., Selsted М.Е. Antimicrobial peptides from human platelets. Infection and Immunity. 2002, 70(12): 6524-6533; Ivanov I.B., Gritsenko V.A. Comparative activities of cattle and swine platelet microbicidal proteins. Probiotics and Antimicrobial Proteins. 2009, 1(2): 148-151]. Описан способ получения тромбоцитарного катионного белка из кровяных пластинок человека [Бухарин О.В., Черешнев В.А., Сулейманов К.Г. Антимикробный белок тромбоцитов. Екатеринбург, 2000: 35-99]; тромбоцитов свиньи и крупного рогатого скота [патент РФ №2278675, МПК А61K 35/14, А61K 38/02, А61Р 31/04, 2005], кровяных пластинок человека и лошади [Горшков Н.И., Малахова И.И., Красиков В.Д., Журлов О.С., Иванов Ю.Б. Жидкостная хроматография тромбоцитарных белков. Сорбционные и хроматографические процессы. 2010, т. 10. Вып. 5: 661-668], тромбоцитов кролика [Yeaman M.R., Tang Y.-Q., Shen A.J., Bayer A.S., Selsted M. Purification and in vitro es of rabbit platelet microbicidal proteins. Infect. Immunol. 1997, 65: 1024-1025].
Авторами впервые установлено наличие антимикробных веществ в кислотном экстракте тромбоцитов курицы домашней (Gallus gallus) по подавлению роста штаммов Bacillus subtilis, которые наиболее чувствительны к действию тромбоцитарного катионного белка [ М.В., Шейда Е.В., Карташова О.Л., Жуков А.П. Антимикробная активность тромбодефенсинов разных видов животных // Известия Оренбургского государственного аграрного университета. 2009, №4(24): 177-179].
В результате этих исследований было сделано предположение о наличии в тромбоцитах курицы домашней антимикробных пептидов. Однако кислотный экстракт содержит уксусную кислоту, исключающую возможность его использования in vivo, а также компоненты в низкомолекулярном диапазоне, что не позволяет оценить функциональные свойства активных соединений в индивидуальном состоянии.
Задачей заявляемого технического решения является создание способа получения очищенных антимикробных пептидов из тромбоцитов курицы домашней.
Для достижения указанного технического результата в заявляемом способе получения антимикробных пептидов из тромбоцитов курицы домашней проводят сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5) в соотношении 5 частей крови : 1 часть 3,8% раствора цитрата натрия; центрифугирование собранной крови при 250 g в течение 30 минут для получения супернатанта, обогащенного тромбоцитами; центрифугирование супернатанта при 1000 g 30 минут для осаждения тромбоцитов; отмывание осажденных тромбоцитов трижды средой 199 с добавлением 3,8% цитрата натрия в соотношении 1:10 (вес/вес); ресуспендирование отмытой тромбоцитарной массы в 10%-ной уксусной кислоте в соотношении 1:10 (вес/объем) и выдерживание при -15…-20°С в течение 24 часов; проведение размораживания и центрифугирования полученного экстракта при 1000 g в течение 40 минут; высаживание антимикробных веществ из полученного супернатанта охлажденным ацетоном в соотношении 1:7 (объем/объем) в течение 12 часов при 4°С; центрифугирование осадка при 6000 g в течение 10 минут, высушивание на воздухе при интенсивном перемешивании и измельчение; обессоливание полученного ацетонового осадка путем обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) в ступенчатом градиенте увеличения концентрации 80% водного ацетонитрила в 0,1% водной трифторуксусной кислоте (ТФУ) до значения 75%; после элюции с колонки подупаривание суммарного экстракта от избыточного содержания ацетонитрила на вакуумной центрифуге с последующей лиофилизацией; перерастворение высушенного обессоленного экстракта в 0,1% ТФУ и разделение методом аналитической ОФ-ВЭЖХ в линейном градиенте повышения концентрации водного ацетонитрила в водной ТФУ от 8 до 40% (основной) и 40-56% (дополнительный); сбор и лиофилизацию антимикробных пептидов.
Достигаемый при осуществлении изобретения технический результат состоит в том, что заявляемый способ получения антимикробных пептидов из тромбоцитов курицы домашней позволяет проводить их наработку в полупрепаративных и препаративных количествах (от миллиграммов до десятков миллиграммов), достаточных для последующего изучения их функциональных свойств, в том числе проведения стадий предклинических испытаний.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Способ осуществляется следующим образом.
1. Осуществляют сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5) в соотношении 5 частей крови : 1 часть 3,8% раствора цитрата натрия.
2. Собранную кровь центрифугируют при 250 g в течение 30 минут для получения супернатанта, обогащенного тромбоцитами.
3. Супернатант центрифугируют при 1000 g 30 минут для осаждения тромбоцитов.
4. Осажденные тромбоциты отмывают трижды средой 199 с добавлением 3,8% цитрата натрия в соотношении 1:10 (вес/вес).
5. Отмытую тромбоцитарную массу ресуспендируют в 10%-ной уксусной кислоте в соотношении 1:10 (вес/объем) и выдерживают при -15…-20°С в течение 24 часов.
6. Проводят размораживание и полученный экстракт центрифугируют при 1000 g в течение 40 минут.
7. Антимикробные вещества из полученного супернатанта высаживают охлажденным ацетоном в соотношении 1:7 (объем/объем) в течение 12 часов при 4°С.
8. Осадок центрифугируют при 6000 g в течение 10 минут, высушивают на воздухе при интенсивном перемешивании и измельчении.
9. Проводят твердофазную экстракцию (обессоливание) полученного ацетонового осадка путем обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) в ступенчатом градиенте увеличения концентрации 80% водного ацетонитрила в 0,1% водной трифторуксусной кислоте (ТФУ) до значения 75%.
10. После элюции с колонки суммарный экстракт подупаривают от избыточного содержания ацетонитрила на вакуумной центрифуге с последующей лиофилизацией (с целью удаления остаточных количеств ТФУ),
11. Высушенный обессоленный экстракт перерастворяют в 0,1% ТФУ и разделяют методом аналитической ОФ-ВЭЖХ в линейном градиенте повышения концентрации водного ацетонитрила в водной ТФУ от 8 до 40% (основной) и 40-56% (дополнительный).
12. Собирают и лиофилизируют антимикробные пептидны.
Примеры конкретного выполнения:
Пример 1
На птицефабрике «Оренбургский бройлер» осуществили сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5) в соотношении 5 частей крови : 1 часть 3,8% раствора цитрата натрия.
Из 5000 мл свежей цитратной куриной крови путем центрифугирования при 250 g в течение 30 минут получили обогащенный тромбоцитами супернатант. Тромбоциты осадили центрифугированием при 1000 g в течение 30 минут. 5 мл осажденных тромбоцитов трижды отмыли средой 199 с добавлением 3,8%) цитрата натрия в соотношении 1:10, после чего ресуспендировали в 45 мл 10%-ной уксусной кислоты в соотношении 1:10 и выдержали при -15…-20°С в течение 24 часов. Затем тромбоцитарную массу разморозили и подвергли центрифугированию при 1000 g в течение 40 минут. Антимикробные вещества из полученного супернатанта высадили охлажденным ацетоном в соотношении 1:7 (объем/объем) в течение 12 часов при 4°С. После центрифугирования (6000 g в течение 10 минут) осадок высушили на воздухе при интенсивном перемешивании и измельчении. Затем полученный ацетоновый осадок перерастворили в 0,1% водной трифторуксусной кислоте (ТФУ) и обессолили методом ОФ-ВЭЖХ на колонке-картридже Aquapore С8 (Applied Biosystems, США). После выхода с колонки всех несвязавшихся компонентов элюирование сорбировавшейся фракции осуществили ступенчатым градиентом (75%) концентрации 80% ацетонитрила в 0,1% ТФУ. Детектирование поглощения вели при длине волны 214 нм. В дальнейшем после упаривания органического растворителя на вакуумной центрифуге (Lab-conco, США), обессоленный экстракт разделили методом аналитической ОФ-ВЭЖХ в линейном градиенте увеличения концентрации 80% ацетонитрила в 0,1% ТФУ на колонке Luna C18 4,6×250 мм (Phenomenex, США) с детектированием поглощения при длине волны 214 нм. Собранные фракции лиофилизовали с целью удаления органического растворителя и остаточных количеств ТФУ.
В результате хроматографического разделения получили 13 фракций антимикробных пептидов.
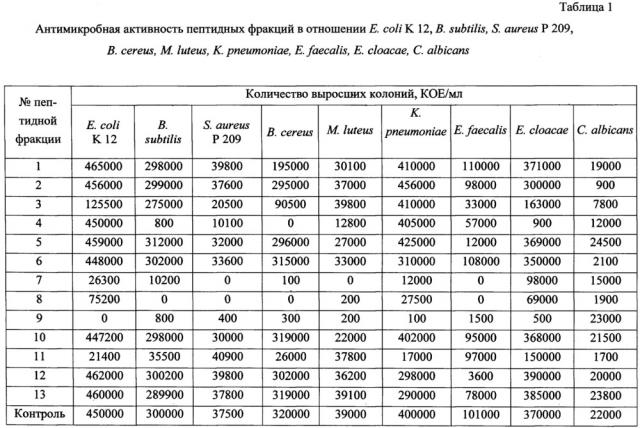
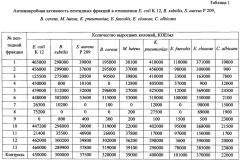
Антимикробную активность полученных пептидных фракций протестировали на тест-культурах Escherichia coli K 12, Bacillus subtilis, Staphylococcus aureus P 209, Bacillus cereus, Micrococcus luteus, Klebsiella pneumoniae, Enterococcus faecalis, Enterobacter cloacae, Candida albicans методом микротитрования в бульоне [Wiegand I., Hilpert K., Hancock R.E.W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature protocols. 2008, 3(2): 163-175].
Для этого тест-культуры вырастили на агаре Мюллера-Хинтона при 37°С в течение 18 часов, приготовили их взвеси с плотностью 0,181; 0,184 и 0,228, соответственно. Оптическую плотность определили на спектрофотометре STAT FAX 2100 при длине волны 630 нм. Фракции пептидов ресуспендировали в растворе 0,01% уксусной кислоты, содержащем 0,2% бычьего сывороточного альбумина (SIGMA, Германия), и приготовили серийные двукратные разведения пептидов в лунках стерильного 96-луночного полипропиленового планшета.
По 100 мкл бактериальной и грибковой суспензии внесли в лунки 96-луночного полипропиленового планшета с 1-го по 11 ряд и добавили по 11 мкл двукратных разведений тестируемых пептидов в каждую лунку с 1-го по 10-ый ряд. 11 ряд - контроль роста культуры. В 12-ый ряд планшета внесли стерильный Мюллер-Хинтон бульон (контроль стерильности и бланк для сканирования ячеек). В лунки 11-го и 12-го рядов добавили по 11 мкл раствора 0,01% уксусной кислоты, содержащего 0,2% бычьего сывороточного альбумина. Планшеты инкубировали при 37°С. Через 24 часа инкубирования высевали по 10 мкл содержимого из лунок на Мюллер-Хинтон агар. Учитывали количество колоний, выросших при 37°С в течение 24 часов.
Полученные результаты представлены в таблице 1, из которой видно, что 1, 2 и 13 пептидные фракции подавляли рост В. subtilis, 5 пептидная фракция - S. aureus Р 209; 4 пептидная фракция - В. subtilis и S. aureus Р 209; 6 пептидная фракция - S. aureus Р 209 и Е. coli K 12; 11 пептидная фракция - Е. coli K 12 и В. subtilis; 3, 7, 8, 9 и 10 пептидные фракции - все три изученных микроорганизма.
Пептидные фракции 1, 2, 4, 5, 6, 10 подавляли рост В. cereus и М. luteus; 3 пептидная фракция - В. cereus; 13 пептидная фракция - В. cereus и K. pneumoniae; 7, 8, 9, 11, 12 пептидные фракции - подавляли рост всех трех тест-культур.
Пептидные фракции 5 и 13 подавляли рост Е. faecalis; 1 пептидная фракция - С. albicans; пептидные фракции 6 и 12 - Е. cloacae и С. albicans; пептидная фракция 9 - Е. faecalis и Е. cloacae; пептидные фракции 2, 3, 4, 7, 8, 10, 11 - подавляли рост всех изученных тест-культур.
Полученные данные свидетельствуют о том, что все полученные пептидные фракции в той или иной мере подавляют рост не только бактерий, но и грибов Candida albicans, то есть характеризуются антимикробной активностью и являются антимикробными пептидами.
Пример 2
В ЗАО «Птицефабрика Оренбургская» осуществили сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5) в соотношении 5 частей крови : 1 часть 3,8% раствора цитрата натрия.
Согласно примеру 1 из тромбоцитов крови кур были получены 13 фракций антимикробных пептидов.
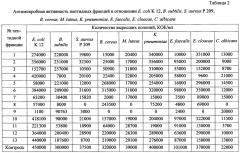
Антимикробную активность полученных пептидных фракций протестировали на тест-культурах Escherichia coli K 12, Bacillus subtilis, Staphylococcus aureus P 209, Bacillus cereus, Micrococcus luteus, Klebsiella pneumoniae, Enterococcus faecalis, Enterobacter cloacae, Candida albicans методом микротитрования в бульоне. Полученные результаты представлены в таблице 2, из которой видно, что все полученные пептиды обладали антимикробной активностью в отношении изученных микроорганизмов, подавляя их рост.
Таким образом, заявляемый способ получения антимикробных пептидов из тромбоцитов курицы домашней обеспечивает получение пептидов, обладающих высокой ингибирующей активностью в отношении как грамположительных, так и грамотрицательных микроорганизмов, а также грибов Candida albicans, что позволяет рассматривать их в перспективе в качестве основы для создания антимикробных препаратов.
Способ получения антимикробных пептидов из тромбоцитов курицы домашней, включающий следующие этапы:
- сбор свежей крови кур в пластиковые контейнеры с добавлением 3,8% раствора цитрата натрия (рН 3,5) в соотношении 5 частей крови : 1 часть 3,8% раствора цитрата натрия;
- центрифугирование собранной крови при 250 g в течение 30 минут для получения супернатанта, обогащенного тромбоцитами;
- центрифугирование супернатанта при 1000 g 30 минут для осаждения тромбоцитов;
- отмывание осажденных тромбоцитов трижды средой 199 с добавлением 3,8% цитрата натрия в соотношении 1:10 (вес/вес);
- ресуспендирование отмытой тромбоцитарной массы в 10%-ной уксусной кислоте в соотношении 1:10 (вес/объем) и выдерживание при -15…-20°С в течение 24 часов;
- проведение размораживания и центрифугирования полученного экстракта при 1000 g в течение 40 минут;
- высаживание антимикробных веществ из полученного супернатанта охлажденным ацетоном в соотношении 1:7 (объем/объем) в течение 12 часов при 4°С;
- центрифугирование осадка при 6000 g в течение 10 минут, высушивание на воздухе при интенсивном перемешивании и измельчение;
- обессоливание полученного ацетонового осадка путем обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) в ступенчатом градиенте увеличения концентрации 80% водного ацетонитрила в 0,1% водной трифторуксусной кислоте (ТФУ) до значения 75%;
- после элюции с колонки подупаривание суммарного экстракта от избыточного содержания ацетонитрила на вакуумной центрифуге с последующей лиофилизацией;
- перерастворение высушенного обессоленного экстракта в 0,1% ТФУ и разделение методом аналитической ОФ-ВЭЖХ в линейном градиенте повышения концентрации водного ацетонитрила в водной ТФУ от 8 до 40% (основной) и 40-56% (дополнительный);
- сбор и лиофилизацию антимикробных пептидов.