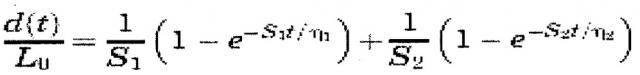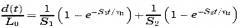Лечение дегенеративных изменений межпозвоночных дисков с использованием клеток, полученных из ткани пуповины человека
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для улучшения насыщенности клетками и архитектуры дегенерированного диска у пациента с дегенеративными изменениями межпозвоночного диска. Для этого осуществляют введение фармацевтической композиции, содержащей гидрогель и выделенную однородную популяцию клеток в межпозвоночный диск в количестве, эффективном для лечения такого заболевания или состояния. При этом выделенная однородная популяция клеток, полученных из ткани пуповины человека, способна к самообновлению и размножению в культуре. Популяция имеет потенциал для дифференцирования, экспрессирует ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок, не вырабатывает CD31, CD34 и HLA-DR, экспрессирует по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга повышенные уровни интерлейкина 8 и ретикулона 1, экспрессирует CD10, CD13, CD44, CD73 и CD90, и не экспрессирует CD117 или теломеразу. Гидрогель включает фибриноген и тромбин. Также предложен способ улучшения насыщенности клетками дегенерированного диска у пациента. Группа изобретений обеспечивает восстановление и регенерацию ткани межпозвоночного диска у пациента. 2 н. и 28 з.п. ф-лы, 21 табл., 7 ил., 12 пр.
Реферат
Область применения изобретения
Настоящее изобретение относится по существу к области клеточной терапии. В некоторых аспектах настоящее изобретение относится к использованию клеток, полученных из ткани пуповины, для лечения заболевания или состояния, связанного с дегенеративными изменениями межпозвоночных дисков.
Предпосылки создания изобретения
В настоящем описании цитируются различные публикации, включая патенты, опубликованные заявки на патенты, технические статьи и научные статьи. Каждая из таких цитированных публикаций считается полностью и для любых целей включенной в настоящий документ путем ссылки.
Боли в пояснице являются одним из наиболее широко распространенных нарушений здоровья и приводят к значительному физическому и эмоциональному дискомфорту у страдающих ими пациентов. Одной из основных причин болей в пояснице является нарушение структуры межпозвоночного диска (МПД). МПД состоит из волокнистого внешнего фиброзного кольца, окружающего более мягкое, гелеобразное, студенистое ядро. Волокна фиброзного кольца прикрепляются к концевым пластинкам тел позвонков спинного мозга и окружают студенистое ядро, создавая изобарическое окружение. Под аксиальной нагрузкой студенистое ядро сжимается и радиально передает нагрузку на фиброзное кольцо. Многослойная структура фиброзного кольца придает ему высокую прочность на разрыв и таким образом позволяет ему расширяться в радиальном направлении в ответ на передаваемую нагрузку.
В здоровом МПД клетки внутри студенистого ядра составляют по объему лишь приблизительно один процент ткани диска. Эти клетки вырабатывают внеклеточный матрикс (ВКМ), содержащий высокую долю протеогликанов. Протеогликаны содержат сульфатированные функциональные группы, которые удерживают воду, тем самым придавая студенистому ядру амортизирующие свойства. Клетки студенистого ядра также могут секретировать небольшие количества цитокинов и матричных металлопротеиназ (ММП), которые помогают регулировать метаболизм клеток студенистого ядра.
При некоторых заболеваниях МПД постепенные дегенеративные изменения МПД вызываются нарушениями механической устойчивости в других частях позвоночника. В таких ситуациях повышенная нагрузка и давление на студенистое ядро заставляет клетки внутри дисков (или проникшие внутрь макрофаги) выбрасывать повышенные по сравнению с нормальными условиями количества вышеупомянутых цитокинов. При других заболеваниях МПД генетические факторы или апоптоз могут привести к снижению количества клеток в дисках и/или высвобождению токсичных количеств цитокинов и ММП. В некоторых ситуациях может быть нарушена насосная функция диска (например, из-за снижения концентрации протеогликанов внутри студенистого ядра), что приводит к ослаблению потока питательных веществ в диск и потока отходов жизнедеятельности из диска. Такое снижение способности к подаче питательных веществ к клеткам и отводу отходов их жизнедеятельности может привести к снижению жизнеспособности клеток и угнетению их метаболизма, тем самым вызывая еще большую деградацию ВКМ, сопровождаемую также накоплением высоких уровней токсинов, которые могут вызывать раздражение нервов и боль.
По мере развития дегенеративных изменений МПД накапливающиеся в студенистом ядре в токсических количествах цитокины и ММП начинают разрушать ВКМ. В частности, ММП (опосредуемые цитокинами) начинают расщеплять удерживающие воду части протеогликанов, тем самым понижая их способность к удержанию воды. Такое разрушение может привести к понижению гибкости студенистого ядра, что изменяет распределение нагрузки внутри диска и, в свою очередь, может привести к расслаиванию фиброзного кольца. Такие изменения вызывают повышение механической неустойчивости, что заставляет клетки выбрасывать еще большие количества цитокинов и приводит к повышению активности ММП. По мере развития описанного разрушительного каскада и прогрессирования дегенеративных изменений МПД диск начинает выпячиваться (ʺгрыжа межпозвоночного дискаʺ) и в конце концов разрывается, что приводит к контакту между студенистым ядром и спинным мозгом и вызывает боль.
На сегодня основными способами терапии дегенеративных изменений МПД являются хирургические вмешательства, при которых поврежденные диски вырезают или сращивают с соседними дисками. Хирургические способы терапии направлены на ослабление боли и других симптомов дегенеративных изменений МПД, но никак не способствуют восстановлению или регенерации пораженных МПД. Одним из подходов к восстановлению клеток и тканей МПД с дегенеративными изменениями является использование клеточной терапии, в которой вводят живые клетки для восстановления, замены и/или реконструкции пораженных тканей. В ряде недавних исследований изучали применение клеточной терапии для лечения состояний с дегенеративными изменениями МПД. Например, в патентах США № 6352557 (Ferree) и 6340369 (Ferree II) описан забор живых клеток МПД у пациента, культивирование клеток и их трансплантация в пораженные МПД. Аналогичным образом, в работе Alini, Eur. Spine J., 2002 г.: 11(Supp.2): S215-220 описано выделение и культивирование клеток из студенистого ядра, их встраивание в биоматрицу и последующая инъекция таких встроенных клеток пациентам для восстановления функционирования пораженных МПД. Такие подходы, несмотря на их перспективность, пока показали лишь ограниченную эффективность в восстановлении МПД с дегенеративными изменениями, и страдают от осложнений, вызванных иммунологической несовместимостью между донорами клеток и реципиентами.
Альтернативный подход на основе клеточной терапии заключается в использовании стволовых клеток, обладающих способностью к делению и дифференцированию в клетки, составляющие пораженные ткани. Трансплантацию стволовых клеток можно использовать в качестве клинического инструмента для восстановления целевой ткани, тем самым восстанавливая ее физиологическую и анатомическую функциональность. Область применения технологии стволовых клеток очень широка и охватывает технологии культивирования тканей, доставку агентов генной терапии и клеточных терапевтических агентов, т.е. доставку биотерапевтических агентов в целевую область с использованием экзогенно вводимых живых клеток или клеточных компонентов, которые содержат или вырабатывают такие агенты (обзор приведен в работе Tresco, P. A. et al., Advanced Drug Delivery Reviews, 2000 г.; 42:2-37). Обнаружение стволовых клеток стимулировало исследования, направленные на селективное получение конкретных типов клеток для восстановительной медицины. Одним из препятствий к реализации терапевтического потенциала технологии стволовых клеток является трудность получения достаточного количества стволовых клеток. Одним из источников стволовых клеток являются эмбриональные ткани, или ткани плода. Эмбриональные стволовые клетки и клетки-предшественники выделены из ряда видов млекопитающих, включая человека, и для нескольких типов таких клеток продемонстрирована способность к самообновлению и размножению, а также дифференцированию по нескольким различным клеточным линиям дифференцирования. Однако получение стволовых клеток из эмбриональных тканей и тканей плода создает множество этических и моральных вопросов, что препятствовало дальнейшему развитию терапевтических агентов на основе эмбриональных стволовых клеток.
Поэтому в данной области существует потребность в разработке терапевтических агентов на основе стволовых клеток, позволяющих обойти трудности, связанные с использованием стволовых клеток из эмбриональных тканей и тканей плода. Ткани из послеродового материала, такого как пуповина и плацента, привлекли к себе интерес в качестве альтернативного источника мультипотентных или плюрипотентных стволовых клеток. Например, описаны способы извлечения стволовых клеток путем перфузии плаценты или сбора из крови или ткани пуповины. Ограничения таких способов получения стволовых клеток заключались в неадекватном объеме собираемой крови пуповины или количества получаемых клеток, а также неоднородности или отсутствии характеризации популяций клеток, получаемых из таких источников.
Соответственно, наличие надежного, хорошо охарактеризованного и достаточно обильного источника по существу однородных популяций стволовых клеток, обладающих способностью к дифференцированию в клетки, фенотипически сходные с эндогенными клетками МПД, будет очень полезным во множестве диагностических и терапевтических приложений для восстановления, регенерации и/или замены клеток МПД, а также для воссоздания и/или реконструкции тканей МПД.
Изложение сущности изобретения
В одном аспекте в настоящем документе описаны способы лечения заболевания или состояния, связанного с дегенеративными изменениями МПД. Способы содержат введение клеток, полученных из ткани пуповины, в количестве, эффективном для лечения такого заболевания или состояния. Ткань пуповины, из которой получают клетки, предпочтительно по существу не содержит крови. Клетки, полученные из ткани пуповины, предпочтительно способны к самообновлению и размножению в культуре и имеют потенциал к дифференцированию, например, в клетки фенотипа МПД; требуют L-валин для роста; могут расти в атмосфере с содержанием кислорода по меньшей мере приблизительно 5%; не вырабатывают CD117 или HLA-DR или теломеразу; экспрессируют альфа-актин гладких мышц; и экспрессируют, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина 8 и ретикулона 1.
В другом аспекте в настоящем документе описаны фармацевтические композиции для лечения заболевания или состояния, связанного с дегенеративными изменениями МПД, где композиции содержат фармацевтически приемлемый носитель и клетки, полученные из ткани пуповины, в количестве, эффективном для лечения такого заболевания или состояния, причем ткань пуповины, из которой получают клетки, предпочтительно по существу не содержит крови, и где клетки способны к самообновлению и размножению в культуре и имеют потенциал к дифференцированию, например, в клетки фенотипа МПД; требуют L-валин для роста; могут расти в атмосфере с содержанием кислорода по меньшей мере приблизительно 5%; не вырабатывают CD117 или HLA-DR или теломеразу; экспрессируют альфа-актин гладких мышц; и экспрессируют, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина 8 и ретикулона 1.
В соответствии с другим аспектом, в настоящем документе описаны наборы для лечения пациента, имеющего заболевание или состояние, связанное с дегенеративными изменениями МПД, где наборы содержат инструкции для использования набора в способе терапии заболевания или состояния, связанного с дегенеративными изменениями МПД, фармацевтически приемлемый носитель и клетки, полученные из ткани пуповины, в количестве, эффективном для лечения такого заболевания или состояния, причем ткань пуповины, из которой получают клетки, предпочтительно по существу не содержит крови, и где клетки способны к самообновлению и размножению в культуре и имеют потенциал к дифференцированию, например, в клетки фенотипа МПД; требуют L-валин для роста; могут расти в атмосфере с содержанием кислорода по меньшей мере приблизительно 5%; не вырабатывают CD117 или HLA-DR или теломеразу; экспрессируют альфа-актин гладких мышц; и экспрессируют, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина 8 и ретикулона 1. В некоторых вариантах осуществления описанные в настоящем документе наборы дополнительно содержат по меньшей мере один реагент и/или инструкции для культивирования клеток. В некоторых вариантах осуществления описанные в настоящем документе наборы содержат инструкции для индуцирования клеток к по меньшей мере частичному дифференцированию in vitro, например, в клетки, имеющие фенотип клеток студенистого ядра и/или фенотип клеток фиброзного кольца.
В различных вариантах осуществления клетки, полученные из ткани пуповины, используемые в способах, композициях и/или наборах, описанных в настоящем документе, экспрессируют рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок 2. В некоторых вариантах осуществления описанные в настоящем документе клетки, полученные из ткани пуповины, экспрессируют CD10, CD13, CD44, CD73 и CD90. В некоторых вариантах осуществления описанные в настоящем документе клетки, полученные из ткани пуповины, обладают способностью к дифференцированию в клетки фиброзного кольца и/или клетки студенистого ядра.
В различных вариантах осуществления заболевание или состояние, связанное с дегенеративными изменениями МПД, может быть связано с возрастом, травмой, аутоиммунной или воспалительной реакцией, генетическим дефектом, отложением иммунного комплекса и/или их комбинациями. Планируемый для лечения МПД может быть интактным или находиться на любой стадии поражения или дегенеративных изменений. Например, планируемый для лечения МПД может иметь грыжу, разрыв, отслоение и/или иные повреждения или факторы дегенеративных изменений.
В некоторых вариантах осуществления описанные в настоящем документе способы содержат введение недифференцированных клеток, полученных из ткани пуповины, или клеточных производных. Клетки, полученные из ткани пуповины человека, вырабатывают полезные трофические факторы, включая без ограничений цитокины, факторы роста, ингибиторы протеаз, белки внеклеточного матрикса, которые стимулируют выживание, рост и дифференцирование эндогенных клеток-предшественников клеток МПД. Описанные трофические факторы могут секретироваться непосредственно трансплантированными клетками, полученными из ткани пуповины человека, в несущем их организме. Трофические факторы или другие клеточные производные можно собрать из клеток, полученных из ткани пуповины человека, ex vivo и затем ввести их пациенту.
В некоторых вариантах осуществления описанные в настоящем документе клетки, полученные из ткани пуповины, индуцируют in vitro для дифференцирования в клетки линии дифференцирования хондроцитов и/или в клетки, имеющие фенотип клеток фиброзного кольца, клеток студенистого ядра и/или других клеток, аналогичных клеткам МПД, до, после или одновременно с введением клеток. Соответственно, в некоторых вариантах осуществления описанные в настоящем документе способы дополнительно содержат стадию индуцирования клеток, полученных из ткани пуповины, для по меньшей мере частичного дифференцирования in vitro.
В некоторых вариантах осуществления клетки, полученные из ткани пуповины, могут быть модифицированы способами генной инженерии для экспрессирования продукта гена, такого как, без ограничений, продукта гена, стимулирующего восстановление и/или регенерацию тканей МПД. Например, в некоторых вариантах осуществления клетки, полученные из ткани пуповины, модифицируют способами генной инженерии для экспрессирования трофического фактора или другого продукта гена. В некоторых вариантах осуществления продукт гена оказывает трофический эффект или иным способом модулирует клетки, полученные из ткани пуповины, дополнительные типы клеток, введенные вместе с клетками, полученными из ткани пуповины, эндогенные клетки МПД и/или другие эндогенные клетки. В некоторых вариантах осуществления продукт гена представляет собой компонент внеклеточного матрикса или агент, который модулирует внеклеточный матрикс. В некоторых вариантах осуществления продукт гена стимулирует экспрессию одного или более белка внеклеточного матрикса.
В некоторых вариантах осуществления клетки, полученные из ткани пуповины, вводят вместе с клетками по меньшей мере одного другого типа, такими как, без ограничений, клетками фиброзного кольца, клетками студенистого ядра, фибробластами, хондроцитами, мезенхимальными стволовыми клетками, клетками, полученными из жировой ткани или другими мультипотентными или плюрипотентными стволовыми клетками. Указанные клетки по меньшей мере одного другого типа можно вводить одновременно с, до или после введения клеток, полученных из ткани пуповины.
В некоторых вариантах осуществления клетки, полученные из ткани пуповины, вводят вместе с по меньшей мере одним агентом. Например, в некоторых вариантах осуществления клетки, полученные из ткани пуповины, вводят вместе с трофическим фактором, таким как, без ограничений, TGF-бета, GDF-5, TIMP-1 и PDGF-BB. В различных вариантах осуществления указанный по меньшей мере один агент оказывает трофический эффект или иным способом модулирует клетки, полученные из ткани пуповины, один или более дополнительных типов клеток, введенных вместе с клетками, полученными из ткани пуповины, эндогенные клетки МПД и/или другие эндогенные клетки. В некоторых вариантах осуществления указанный по меньшей мере один агент стимулирует экспрессию одного или более белка внеклеточного матрикса. Другие агенты включают в себя без ограничений противовоспалительные агенты, агенты, повышающие выживаемость клеток, болеутоляющие агенты и иммуномодулирующие агенты. Агент можно вводить одновременно с, до или после введения клеток, полученных из ткани пуповины.
В различных аспектах клетки можно вводить, направлять для введения или формулировать для введения путем инъекции в МПД, включая, например, студенистое ядро и/или фиброзное кольцо МПД с дегенеративными изменениями. В некоторых вариантах осуществления клетки вводят, направляют для введения или формулируют для введения таким образом, что клетки инкапсулируют внутри имплантируемого устройства или имплантируют в устройстве или матрице, содержащей клетки.
Другой вариант осуществления настоящего изобретения представляет собой способ лечения заболевания или состояния, связанного с дегенеративными изменениями межпозвоночных дисков, содержащий введение фармацевтической композиции, содержащей по меньшей мере (1) гидрогель и (2) выделенную однородную популяцию клеток, полученных из ткани пуповины человека, в межпозвоночный диск в количестве, эффективном для лечения такого заболевания или состояния, где ткань пуповины по существу не содержит крови, и где выделенная однородная популяция клеток способна к самообновлению, размножению в культуре и имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Выделенная однородная популяция клеток может дополнительно иметь одну из следующих характеристик: (а) экспрессировать ретикулон, лиганд хемокинового рецептора 3 и гранулоцитарный хемотаксический белок; (b) не вырабатывать CD31, CD34 и HLA-DR; (c) экспрессировать, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина 8 и ретикулона 1; и (d) экспрессировать CD10, CD13, CD44, CD73 и CD90. В другом варианте осуществления настоящего изобретения выделенная однородная популяция клеток экспрессирует рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и/или гранулоцитарный хемотаксический белок. Композицию можно вводить путем инъекции. В одном варианте осуществления композиция дополнительно содержит: (а) клетки по меньшей мере одного другого типа, которые могут быть модифицированы способами генной инженерии для экспрессирования по меньшей мере одного экзогенного продукта гена (такого как, например, трофический фактор); и/или (b) по меньшей мере один агент, такой как, например, трофический фактор (например, TGF-бета, GDF-5, PDGF-BB и TIMP1). В другом варианте осуществления композицию вводят в межпозвоночный диск с дегенеративными изменениями, например, в студенистое ядро или фиброзное кольцо межпозвоночного диска. Выделенную популяцию клеток можно по меньшей мере частично индуцировать для дифференцирования in vitro перед введением. В одном варианте осуществления настоящего изобретения выделенную однородную популяцию клеток индуцируют для дифференцирования в клетки, имеющие фенотип клеток фиброзного кольца, или в клетки, имеющие фенотип клеток студенистого ядра.
Еще один вариант осуществления настоящего изобретения представляет собой способ лечения заболевания или состояния, связанного с дегенеративными изменениями межпозвоночных дисков, содержащий введение гидрогеля и выделенной однородной популяции клеток, полученных из ткани пуповины человека, в межпозвоночный диск в количестве, эффективном для лечения такого заболевания или состояния, где ткань пуповины по существу не содержит крови и где выделенная однородная популяция клеток способна к самообновлению, размножению в культуре, и имеет потенциал для дифференцирования и не экспрессирует CD117 и/или теломеразу. Выделенная однородная популяция клеток может дополнительно иметь одну из следующих характеристик: (а) экспрессировать ретикулон, лиганд хемокинового рецептора 3 и гранулоцитарный хемотаксический белок; (b) не вырабатывать CD31, CD34 и HLA-DR; (с) экспрессировать, по отношению к фибробластам, мезенхимальным стволовым клеткам или клеткам костного мозга гребня подвздошной кости человека, повышенные уровни интерлейкина 8 и ретикулона 1; и (d) экспрессировать CD10, CD13, CD44, CD73 и CD90. В другом варианте осуществления выделенная однородная популяция клеток экспрессирует рецептор окисленных липопротеинов низкой плотности 1, ретикулон, лиганд хемокинового рецептора 3 и гранулоцитарный хемотаксический белок. Гидрогель и выделенную однородную популяцию клеток можно вводить путем инъекции. Гидрогель вводят одновременно с, до или после введения выделенной однородной популяции клеток, полученных из ткани пуповины человека. В одном варианте осуществления выделенную однородную популяцию клеток вводят внутри имплантируемого устройства. В другом варианте осуществления способ дополнительно содержит введение клеток по меньшей мере одного другого типа одновременно с, до или после введения выделенной однородной популяции клеток, полученных из ткани пуповины человека. Указанные клетки по меньшей мере одного другого типа могут быть модифицированы способами генной инженерии для экспрессирования по меньшей мере одного экзогенного продукта гена (такого как трофический фактор или экзогенный продукт гена, модулирующий экспрессию одного или более белков внеклеточного матрикса).
Способ может дополнительно содержать введение по меньшей мере одного агента, такого как, например, трофический фактор (например, TGF-бета, GDF-5, PDGF-BB и TIMP1), который может оказывать трофический эффект на выделенную однородную популяцию клеток, полученных из ткани пуповины человека. В некоторых вариантах осуществления выделенную однородную популяцию клеток и гидрогель вводят в межпозвоночный диск с дегенеративными изменениями, например, в студенистое ядро межпозвоночного диска или фиброзное кольцо межпозвоночного диска. В других вариантах осуществления выделенную однородную популяцию клеток, полученных из ткани пуповины человека, индуцируют для по меньшей мере частичного дифференцирования in vitro. Выделенную однородную популяцию клеток можно индуцировать для дифференцирования в клетки, имеющие фенотип клеток фиброзного кольца, или в клетки, имеющие фенотип клеток студенистого ядра.
Еще один вариант осуществления настоящего изобретения представляет собой способ лечения заболевания или состояния, связанного с дегенеративными изменениями межпозвоночных дисков, содержащий введение гидрогеля в количестве, эффективном для лечения такого заболевания или состояния. Для такого способа можно использовать любой известный специалистам в данной области гидрогель (такой как раскрытые в настоящем документе). В одном варианте осуществления гидрогель содержит фибриноген и тромбин. В другом варианте осуществления гидрогель содержит фибриновый клей, такой как, например, фибриновый клей EVICEL® (EVICEL® Fibrin sealant (Human), Omrix Pharmaceuticals, Ltd.).
Вышеизложенные и прочие характеристики и преимущества настоящего изобретения станут очевидными после следующего более подробного описания предпочтительных вариантов осуществления изобретения, проиллюстрированных с помощью прилагаемых чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Приведенное выше краткое описание, а также приведенное ниже подробное описание настоящего изобретения будут более понятны при изучении вместе с приложенными чертежами. Для целей иллюстрирования настоящего изобретения на фигурах представлены варианты осуществления настоящего изобретения. Однако следует понимать, что настоящее изобретение не ограничивается только приведенными точными конструкциями, примерами и устройствами.
На фиг. 1 и 2 представлены МРТ-томограммы поясничного отдела позвоночника (см. пример 12). На взвешенных по T2 МРТ-томограммах срединной сагиттальной плоскости в контрольной группе видны выглядящие здоровыми диски. Диски в группе с проколом имеют признаки дегенеративных изменений (потемнение и потеря высоты). Диски в обработанных группах имеют менее выраженные признаки дегенеративных изменений по сравнению с дисками из группы с проколом. В частности, на фиг. 1 и 2 представлены образцы взвешенных по T2 МРТ-томограмм поясничного отдела позвоночника для дисков с L1-2 по L5-6 во временных точках 0 (до кольцевого прокола), 3 недели (до инъекционной хирургии), 6 недель и 12 недель (перед умерщвлением). Проколотые диски (L2-3, L3-4 и L4-5) указаны рамками (L2-3, L3-4 и L4-5 сверху вниз). Непроколотые контрольные диски (L1-2 и L5-6) не имеют никаких признаков дегенеративных изменений. Диски контрольных образцов, как и ожидалось, не имели дегенеративных изменений (фиг. 1A). Проколотые диски (фиг. 1B) с течением времени уменьшались в размерах и темнели, что указывает на дегенеративные изменения. Диски, проколотые и обработанные носителем (фиг. 1C), клетками + буфер (фиг. 2A) и клетками + носитель (фиг. 2B), со временем демонстрировали менее выраженные признаки дегенеративных изменений по сравнению с проколотыми дисками (фиг. 1B).
На фиг. 3 представлены взвешенные по T2 МРТ-томограммы (площадь диска и индекс МРТ) (см. пример 12). В частности, средняя площадь по МРТ студенистого ядра (фиг. 3A) и индекс МРТ (фиг. 3B) при объединении данных по дискам L2-3, L3-4 и L4-5 (диски, которые прошли лечение) для каждой группы кроликов, выраженные в виде процентной доли от значения в момент времени 0, показывают, что группа с проколом испытывает наибольшее снижение площади и индекса с течением времени, тогда как группы с дисками, проколотыми и затем обработанными носителем, клетками в буфере (B+C) или клетками в носителе (C+C), испытывают меньшее снижение площади и индекса. На фиг. 3 маркер ‡ указывает значимость по сравнению с контрольной группой и маркер * указывает значимость по сравнению с проколотой группой. Кроме того, индекс МРТ на фиг. 3 определяли следующим образом:
Индекс МРТ = Площадь студенистого ядра × Интенсивность сигнала
На фиг. 4 представлены средние кривые нормированного полного смещения (фаза нагружения + течение) для залитого в компаунд позвоночно-двигательного сегмента диска L3-4 через 12 недель (см. пример 12). Зависимость смещения от времени при постоянном нагружении имеет характерный вид кривых ползучести. Диски, обработанные клетками в буфере, ведут себя более похоже на проколотые диски, диски, обработанные клетками в носителе, ведут себя более похоже на контрольные диски, поведение дисков, обработанных только носителем, среднее между ними. Средние кривые ползучести получали для каждого условия. Аксиальное тестирование дает характерный вид кривых ползучести на ранних стадиях тестирования (время от 0 до 200 секунд). Пунктирными границами указана стандартная ошибка измерения. Кривые, полученные для проколотых дисков и дисков, обработанных клетками в буфере, выглядят аналогично, так же как кривые для контрольных дисков и дисков, обработанных клетками в носителе. Кривые для каждой из этих групп явно отделяются от кривой для дисков, обработанных только носителем.
На фиг. 5, 6 и 7 представлены гистологические сагиттальные срезы дисков L4-5, полученные после умерщвления на 12 неделе в каждой группе лечения, окраска H&E, увеличение 20x и 100x (см. пример 12). На фиг. 5A представлен гистологический сагиттальный срез диска L4-5 для контрольной группы. На фиг. 5B представлен гистологический сагиттальный срез диска L4-5 для группы с проколом. На фиг. 6A представлен гистологический сагиттальный срез диска L4-5 для группы с дисками, обработанными только носителем. На фиг. 6B представлен гистологический сагиттальный срез диска L4-5 для группы с дисками, обработанными клетками в буфере. На фиг. 7 представлен гистологический сагиттальный срез диска L4-5 для группы с дисками, обработанными клетками в носителе.
Подробное описание примеров осуществления изобретения
В настоящем описании и пунктах формулы изобретения используются различные термины, относящиеся к способам и другим аспектам настоящего изобретения. Такие термины считаются имеющими общепринятое в данной области значение, если иное не оговорено особо. Другие явно определенные термины должны толковаться согласно приведенным в настоящем документе определениям.
В настоящем описании и в прилагаемых пунктах формулы изобретения формы единственного числа включают и множественные обозначения, если только содержание текста не определяет иного. Так, например, отсылка к ʺклеткеʺ включает в себя и комбинацию двух или более клеток и т.п.
Используемый в настоящем документе термин ʺприблизительноʺ при указании измеримой величины, такой как количество, продолжительность во времени и т.п., считается охватывающим отклонения ±20% или ±10%, более предпочтительно ±5%, еще более предпочтительно ±1% и наиболее предпочтительно ±0,1% от указанного значения, поскольку такие отклонения приемлемы для реализации раскрываемых способов.
Термин «полученные из» используется для указания, что клетки получили из их биологического источника и вырастили, размножили в культуре, иммортализовали или иным образом обработали in vitro.
Термин ʺвыделенныйʺ означает измененный ʺрукой человекаʺ от естественного природного состояния. Если молекула или композиция встречается в природе, она считается ʺвыделеннойʺ, если ее изменили и/или удалили из естественной среды.
Термины ʺэкспрессироватьʺ, ʺэкспрессируемыйʺ или ʺэкспрессияʺ для молекулы нуклеиновой кислоты или гена относится к процессу биосинтеза продукта гена, например биосинтезу полипептида.
ʺТрофические факторыʺ представляют собой вещества, которые стимулируют выживание, рост, дифференцирование, пролиферацию и/или созревание клеток, или стимулируют повышенную биологическую активность клеток. Термин ʺклеточные производныеʺ относится к любому материалу, который можно получить из клетки, и включает в себя кондиционированную клетками среду, клеточный лизат, белки внеклеточного матрикса, трофические факторы, клеточные фракции, клеточные мембраны.
Термин ʺдегенеративные измененияʺ относится к любому физическому повреждению, нарушению, дегенеративным изменениям или травме МПД.
Термин ʺпатологияʺ относится к любому структурному или функциональному признаку отклонения от нормального состояния для клетки, ткани, органа или системы по результатам измерения с использованием любого известного специалистам соответствующего способа.
ʺЗаболеваниеʺ представляет собой любое отклонение от или нарушение здоровья, состояния или функционирования клетки, ткани, органа, системы или организма в целом по результатам измерения с использованием любого известного специалистам подходящего способа.
Термины ʺлечитьʺ, ʺтерапияʺ или ʺлечениеʺ относятся к любому успеху или признаку успеха в ослаблении симптомов или облегчении течения заболевания, нарушения или состояния, включая любые объективные или субъективные параметры, такие как ослабление боли, ремиссия, ослабление симптомов или перевод заболевания, нарушения или состояния в более легко переносимую пациентом форму, замедление скорости развития дегенеративных изменений или угасания функции, перевод итоговой точки дегенеративных изменений в менее угнетающую для пациента форму или улучшение общего физического или умственного состояния пациента. Лечение или облегчение симптомов может основываться на объективных или субъективных параметрах; включая результаты врачебного осмотра, неврологического осмотра и/или психиатрической экспертизы.
Термины ʺэффективное количествоʺ и ʺтерапевтически эффективное количествоʺ в настоящем документе используются как взаимозаменяемые и относятся к количеству соединения, материала или композиции, согласно приведенному в настоящем документе описанию, достаточному для достижения требуемого биологического результата, такого как, без ограничений, биологические результаты, раскрытые, описанные или проиллюстрированные в настоящем документе. Такие результаты могут без ограничений включать в себя лечение заболевания или повреждения МПД у субъекта по результатам измерения с использованием любого известного специалистам подходящего способа.
Термин ʺфармацевтически приемлемыйʺ относится к тем свойствам и/или веществам, которые являются приемлемыми для пациента с фармакологической/токсикологической точки зрения, и являются приемлемыми для производителя - специалиста в области химии фармацевтических препаратов с физической/химической точки зрения в отношении состава композиции, возможности ее приготовления, стабильности, комфортности для пациента и биодоступности. Термин ʺфармацевтически приемлемый носительʺ относится к среде, которая не снижает эффективности биологического действия активных компонентов и не является токсичной для организма, в который ее вводят.
Было обнаружено, что заболевания и состояния, связанные с дегенеративными изменениями межпозвоночного диска (МПД), можно лечить путем введения клеток, полученных из ткани пуповины, согласно приведенному в настоящем документе описанию. Преимуществом является то, что описанные в настоящем документе способы, композиции и наборы стимулируют восстановление и регенерацию МПД с дегенеративными изменениями и тем самым ослабляют один или более симптомов, связанных с дегенеративными изменениями МПД. Соответственно, в одном аспекте, в настоящем документе описаны способы лечения заболевания или состояния, связанного с дегенеративными изменениями МПД, содержащие введение клеток, полученных из ткани пуповины, в МПД в количестве, достаточном для лечения заболевания или состояния.
В различных вариантах осуществления заболевание или состояние, связанное с дегенеративными изменениями МПД, может быть связано с возрастом, травмой, аутоиммунной или воспалительной реакцией, генетическим дефектом, отложением иммунного комплекса (например, формированием рубцовой ткани), и/или их комбинациями. Планируемый для лечения МПД может быть интактным или находиться на любой стадии поражения или развития дегенеративных изменений. Например, планируемый для лечения МПД может иметь грыжу (например, когда на части фиброзного кольца имеется выпячивание или иное раздутие), разрыв (например, когда по меньшей мере часть фиброзного кольца разорвана, что приводит к снижению давления и/или объема студенистого ядра), расслоение (например, когда происходит разделение двух или более слоев фиброзного кольца) и/или иные повреждения или факторы дегенеративных изменений (например, когда фиброзное кольцо имеет трещины, надрывы и т.п. и/или при деградации или изменении свойств внеклеточного матрикса).
В различных вариантах осуществления клетки, полученные из ткани пуповины, вводят в МПД с дегенеративными изменениями, например, путем инъекции, трансплантации, имплантации, инжектирования или введения в виде комплекса клеток с матриксом, либо с использованием любого другого способа, известного в области клеточной терапии. В некоторых вариантах осуществления клетки вводят непосредственно в фиброзное кольцо и/или студенистое ядро МПД.