Высокостабильный т-клеточный рецептор и способ его получения и применения
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно предложен высокостабильный Т-клеточный рецептор, что может быть использовано в медицине. Полученный Т-клеточный рецептор, имеющий мутации в своем гидрофобном коровом домене, используют в составе фармацевтической композиции для лечения опухоли. Настоящее изобретение позволяет осуществлять эффективную терапию заболеваний, связанных с образованием опухолей. 9 н. и 16 з.п. ф-лы, 49 ил., 13 табл., 16 пр.
Реферат
Область изобретения
Настоящее изобретение относится к области биотехнологии, и, в частности, относится к высокостабильному и растворимому Т-клеточному рецептору (Т cell receptor, TCR), мутантному в своем гидрофобном коровом домене. Настоящее изобретение также относится к получению и применению рецептора.
Предшествующий уровень техники
Существует только два типа молекул, которые могут распознавать антигены специфическим образом. Один из типов представляет собой иммуноглобулин или антитело, а другой представляет собой Т-клеточный рецептор (TCR), который представляет собой α/β или γ/δ гетеродимерный гликопротеин на клеточной мембране. Физический репертуар TCR иммунной системы формируется в тимусе путем V(D)J-рекомбинации, а затем положительной и отрицательной селекции. В периферическом окружении TCR опосредуют распознавание специфических комплексов Главный комплекс гистосовместимости (Major Histocompatibility Complex, МНС)-пептид Т-клетками, и в этом качестве являются важными для функционирования иммунной системы на клеточном уровне.
TCR является единственным рецептором для антигенов конкретных пептидов в главном комплексе гистосовместимости (МНС). Экзогенные или эндогенные пептиды могут являться единственным признаком аномалии в клетке. В иммунной системе, как только антигенспецифические TCR связываются с комплексами рМНС (пептид-МНС), происходит прямой физический контакт Т-клетки и антигенпрезентирующей клетки (antigen presenting cell, АРС). Затем происходит взаимодействие других мембранных молекул в Т-клетке и АРС, и инициируются последующая передача сигнала в клетке и другие физиологические ответы таким образом, что диапазон различных антигенспецифических Т-клеток демонстрирует иммунные действия в отношении своих мишеней.
На мембране Т-клетки TCR ассоциируется с инвариантными белками CD3, вовлеченными в опосредованную передачу сигнала, с образованием комплекса. TCR существуют во множестве форм, которые являются сходными по структуре, но экспрессирующие их Т-клетки обладают весьма отличающимися анатомическими расположениями и, вероятно, функциями. Внеклеточная часть TCR состоит из двух проксимальных относительно мембраны константных доменов, и двух дистальных относительно мембраны вариабельных доменов. Вариабельные домены содержат полиморфные петли, аналогичные участкам антител, определяющим комплементарность (от англ. complementary determining region - участки, определяющие комплементарность, CDR). Именно эти петли образуют связывающий сайт молекулы TCR и определяют пептидную специфичность. Лиганды МНС класса I и класса II, соответствующие TCR, также относятся к белкам суперсемейства иммуноглобулинов, но специализированы на презентации антигенов, и обладают полиморфным сайтом связывания пептидов, позволяющим осуществлять презентацию различных наборов коротких пептидных фрагментов на поверхности клеток АРС.
Подобно иммуноглобулину (антителу), представляющему собой разновидность молекулы, распознающей антиген, TCR могут быть разработаны для применения в диагностике и терапии. Тем не менее, сложно получить белки в (водо)растворимой форме, образованные из более чем одной полипептидной субъединицы и содержащие трансмембранный домен, поскольку во многих случаях белок стабилизируются своей трансмембранной областью. Последнее относится и к TCR и отражено в научной литературе. Сообщается о том, что усеченная форма TCR, содержащая только внеклеточные домены или только внеклеточные и цитоплазматические домены, может распознаваться TCR-специфическими антителами, что свидетельствует о том, что часть рекомбинантного TCR, распознанная антителами, уложена правильным образом. Однако, ее не удается получить с хорошим выходом, она не стабильна и/или не может распознавать комплексы пептид-МНС в низкой концентрации.
Растворимый TCR полезен не только для исследования взаимодействий TCR-pMHC, но также в качестве потенциального диагностического средства для обнаружения инфекции или в качестве маркера аутоиммунных заболеваний. Аналогично, растворимые TCR могут быть использованы для доставки терапевтического агента, например, цитотоксического соединения или иммуностимулирующего соединения, в клетки, которые осуществляют презентацию определенного антигена, или для ингибирования Т-клеток, например клеток, взаимодействующих с аутоиммунным пептидным антигеном. Для этих задач важна модификация белка TCR. Она особенно важна для гетерогенной экспрессии TCR в прокариотических или эукариотических системах.
В отношении экспрессии растворимого TCR в Е. coli, когда TCR отделяют от мембраны, нестабильность и низкий выход белка представляют собой основные препятствия для разработки терапевтических или диагностических реагентов с TCR или его фрагментом. Для преодоления присущей одноцепочечным TCR нестабильности, в некоторых литературных источниках описано получение гетеродимеров TCR, содержащих нативный дисульфидный мостик, связывающий соответствующие субединицы (Garboczi, et al., (1996), Nature 384 (6605): 134-41; Garboczi, et al., (1996), J Immunol 157(12): 5403-10; Chang et al., (1994), PNAS USA 91: 11408-11412; Davodeau et al., (1993), J. Biol. Chem. 268(21): 15455-15460; Golden et al., (1997), J. Imm. Meth. 206: 163-169; патент США №6080840). Однако, хотя такие TCR могут распознаваться TCR-специфическими антителами, они могут распознавать только нативный лиганд в относительно высокой концентрации, что свидетельствует о том, что распознавание нестабильно.
Кроме того, для получения TCR с исходной антигенной специфичностью существует множество исследований на тему улучшения стабильности водорастворимых фрагментов TCR, включающих вариабельные домены одноцепочечного TCR (Novotny, et al. (1991) PNAS USA 88:8646-8650), внеклеточные домены в гетеродимерном TCR (Garcia1 et al. (1996) Science 274:209-219), или модификацию таких молекул (Shusta et al. (2000) Nature Biotechnology 18:754-759), Boulter et al. (2003) Protein Engineering 16:707-711). В этих исследованиях Novotny et al. использовали гибкий пептид для связывания вариабельных доменов для конструирования одноцепочечного TCR. Однако, стабильные молекулы могут быть получены только после замены гидрофобных остатков, представленных на поверхности, на гидрофильные остатки, содержащие водорастворимые боковые цепи. Shusta et al. модифицировали структуру вариабельного домена одноцепочечного TCR путем введения случайных мутаций в целую молекулу, отображения на поверхности дрожжей и отбора при помощи FACS (клеточный сортер с возбуждением флуоресценции). Garcia et al. сконструировали внеклеточный домен 2С в α/β TCR с сохранением в структуре нативных межцепочечных дисульфидных связей. Boulter et al. улучшили конструкцию α/β гетеродимера путем введения искусственной дисульфидной связи между двумя константными доменами.
Подход с использованием дисульфида между константными доменами использовался для векторов фагового дисплея TCR, которые использовали для получения множества высокоаффинных TCR (Li et al. (2005) Nature Biotechnology 34:349-354; Liddy et al. (2012) Nature Medicine 18:980-987). Тем не менее, авторы изобретения обнаружили, что вероятность успешного получения TCR с использованием таких конструкций все же очень низка, и сложно получать TCR, обладающие как высокой аффинностью, так и высокой стабильностью. Таким образом, необходимо разрабатывать новые стратегии для получения TCR и их фрагментов, обладающих растворимостью в воде, высокой аффинностью и высокой стабильностью.
Краткое описание изобретения
Цель настоящего изобретения состоит в разработке высокостабильного Т-клеточного рецептора (TCR).
Еще одна цель настоящего изобретения состоит в разработке способов получения и применения указанного высокостабильного Т-клеточного рецептора.
В первом аспекте изобретения предложен Т-клеточный рецептор (TCR), обладающий следующими свойствами:
(1) гидрофобный коровый домен TCR является мутантным; и
(2) TCR обладает стабильностью более высокой, чем стабильность соответствующего TCR, имеющего гидрофобное ядро дикого типа.
В одном из предпочтительных воплощений "мутантный" означает, что гидрофобный коровый домен TCR по настоящему изобретению имеет мутацию по сравнению с соответствующим гидрофобным коровым доменом TCR дикого типа.
В одном из предпочтительных воплощений "стабильностью более высокой, чем" означает, что стабильность TCR по настоящему изобретению увеличена по меньшей мере на 5%, предпочтительно по меньшей мере на 30%, и еще предпочтительней по меньшей мере на 80% по сравнению с TCR, имеющим гидрофобное ядро дикого типа.
В одном из предпочтительных воплощений "гидрофобное ядро дикого типа" относится к гидрофобному ядру, идентичному по аминокислотной последовательности гидрофобному ядру встречающегося в природе TCR, и не является мутантным.
В одном из предпочтительных воплощений "соответствующий TCR, имеющий гидрофобное ядро дикого типа" относится к TCR, идентичному по последовательности других доменов с последовательностями TCR по настоящему изобретению, за исключением того, что его гидрофобное ядро представляет собой ядро дикого типа по сравнению с TCR по настоящему изобретению, гидрофобное ядро которого является мутантным. Дополнительно или предпочтительно "соответствующий TCR, имеющий гидрофобное ядро дикого типа" относится к TCR дикого типа, который встречается в природе и не содержит какого-либо мутантного сайта, и в особенности к молекуле sTv, имеющей вариабельный домен α-цепи и вариабельный домен β-цепи дикого типа. Типичные примеры включают LC13-WT.
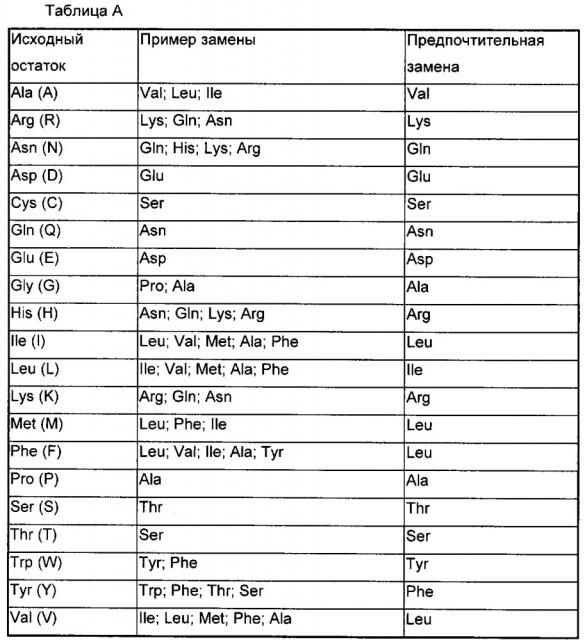
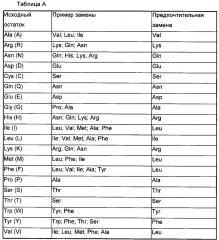
В одном из предпочтительных воплощений участки CDR в TCR являются участками дикого типа или содержат мутации, повышающие аффинность.
В одном из предпочтительных воплощений "аффинность" относится к аффинности связывания молекулы TCR и ее соответствующего антигена.
В одном из предпочтительных воплощений в каркасе вариабельного домена TCR и константном домене гидрофобные остатки, боковая цепь которых направлена к поверхности, являются мутантными. То есть, аминокислотные остатки, представленные на поверхности в каркасе вариабельного домена и константном домене в TCR являются мутантными. Предпочтительно, мутантные аминокислотные остатки представляют собой аминокислотные остатки, представленные на поверхности в вариабельном домене α-цепи и/или β-цепи TCR. Конкретнее, позиции аминокислот, представленных на поверхности, включают позиции 4, 12, 16, 93, 97, 100 и 105 в вариабельном домене α-цепи TCR и последнюю позицию α-цепи, кодируемой J-геном; позиции 4 и 101 в вариабельном домене β-цепи TCR, и последнюю позицию, и третью позицию с конца β-цепи, кодируемой J-геном. Нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT (международная база данных по иммуногенетике).
В одном из предпочтительных воплощений мутации гидрофобных остатков, боковая цепь которых направлена к поверхности, в каркасе вариабельного домена в TCR включают (не ограничиваясь приведенным списком) в α-цепи: I7S, A9S, A10S, V20S, А92Е, A93S; I→T во второй позиции с конца короткоцепочечного пептида, кодируемого J-геном; в β-цепи: I12S; или какая-либо их комбинация; где нумерация позиций аминокислот является нумерацией, представленной в IMGT.
В одном из предпочтительных воплощений TCR является растворимым.
В одном из предпочтительных воплощений TCR представляет собой мембранный белок.
В одном из предпочтительных воплощений TCR содержит (а) всю или часть α-цепи TCR, за исключением ее трансмембранного домена; и (б) всю или часть β-цепи TCR, за исключением ее трансмембранного домена;
и каждый из (а) и (б) независимо содержит функциональный вариабельный домен, или функциональный вариабельный домен и по меньшей мере часть константного домена цепи TCR.
В одном из предпочтительных воплощений TCR представляет собой одноцепочечный TCR, состоящий из вариабельного домена α-цепи TCR и вариабельного домена β-цепи TCR, связанных гибким линкерным пептидом.
В одном из предпочтительных воплощений мутации включают по меньшей мере одну мутацию в гидрофобном ядре.
В одном из предпочтительных воплощений TCR имеет одну или более чем одну мутацию в следующих позициях: позиции в гидрофобном ядре аминокислотной последовательности вариабельного домена α и/или β-цепи, т.е. позиции аминокислот 11, 13, 19, 21, 53, 76, 89, 91, 94 вариабельного домена и/или третья, пятая или седьмая позиции аминокислот с конца α-цепи короткоцепочечного пептида, кодируемого J-геном, и/или вторая, четвертая или шестая аминокислотные позиции с конца β-цепи короткоцепочечного пептида, кодируемого J-геном, где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT.
В одном из предпочтительных воплощений одна или более чем одна из следующих позиций в вариабельном домене α-цепи TCR является мутантной: позиции аминокислот 11, 13, 19, 21, 53, 76, 89, 91 или 94 вариабельного домена α-цепи и/или третья, пятая или седьмая позиции аминокислот с конца α-цепи короткоцепочечного пептида, кодируемого J-геном, где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT (международная база данных по иммуногенетике).
В одном из предпочтительных воплощений одна или более чем одна из следующих позиций в вариабельном домене α-цепи, представленном в SEQ ID NO: 9, или SEQ ID NO: 29, или SEQ ID NO: 31, или SEQ ID NO: 33 TCR, является мутантной: позиции аминокислот 11, 13, 19, 21, 53, 76, 89, 91 или 94 в вариабельном домене α-цепи, и/или третья, пятая или седьмая позиции аминокислот с конца α-цепи короткоцепочечного пептида, кодируемого J-геном, где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT.
В одном из предпочтительных воплощений одна или более чем одна из следующих позиций в вариабельном домене β-цепи TCR является мутантной: позиции аминокислот 11, 13, 19, 21, 53, 76, 89, 91 или 94 в вариабельном домене β-цепи и/или вторая, четвертая или шестая позиции с конца β-цепи короткоцепочечного пептида, кодируемого J-геном, где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT.
В одном из предпочтительных воплощений одна или более чем одна из следующих позиций в вариабельном домене β-цепи, представленном в SEQ ID NO: 11 или SEQ ID NO: 30, или SEQ ID NO: 32, или SEQ ID NO: 34 TCR, является мутантной: позиции аминокислот 11, 13, 19, 21, 53, 76, 89, 91 или 94 в вариабельном домене β-цепи и/или вторая, четвертая или шестая позиции с конца β-цепи короткоцепочечного пептида, кодируемого J-геном, где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT.
В одном из предпочтительных воплощений вариабельный домен α-цепи TCR содержит один или более чем один аминокислотный остаток, выбранный из группы, состоящей из: 11L, 11М или 11Е; 13V, 13R или 13K; 19V; 21I; 91L или 91I; и 94V или 94I; и/или вариабельный домен β-цепи TCR содержит один или более чем один аминокислотный остаток, выбранный из группы, состоящей из: 11L или 11V; 13V; 19V; 89L; 91F или 91I; 94V или 94L; шестая позиция с конца β-цепи, кодируемой J-геном, представляет собой Т; и четвертая позиция с конца β-цепи, кодируемой J-геном, представляет собой М; где нумерация позиций аминокислот представляет собой нумерацию, представленную в IMGT.
В одном из предпочтительных воплощений аминокислотный остаток, находящийся в вариабельном домене α-цепи и/или β-цепи TCR и представленный на поверхности, является мутантным.
В одном из предпочтительных воплощений TCR содержит один или более чем один аминокислотный остаток вариабельного домена α-цепи, выбранный из группы, состоящей из: 4L; 12N; 16S; 93N или 93R; 97N; 100G; 105S; и последняя позиция α-цепи, кодируемой J-геном, представляет собой D; и/или TCR содержит один или более чем один аминокислотный остаток вариабельного домена β-цепи, выбранный из группы, состоящей из: 4I; 101L; последняя позиция β-цепи, кодируемой J-геном, представляет собой D; и третья позиция с конца β-цепи, кодируемой J-геном, представляет собой Е.
В одном из предпочтительных воплощений TCR содержит вариабельный домен α-цепи, аминокислотная последовательность которого выбрана из группы, состоящей из SEQ ID NO: 15, 17, 35, 37, 39, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 97, 99, 101, 103, 105 и 107.
В одном из предпочтительных воплощений TCR содержит вариабельный домен β-цепи, аминокислотная последовательность которого выбрана из группы, состоящей из SEQ ID NO: 16, 18, 36, 38, 40, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 98, 100, 102, 104, 106 и 108.
В одном из предпочтительных воплощений комбинация вариабельного домена α-цепи и вариабельного домена β-цепи TCR выбрана из группы, состоящей из:
(а) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 15, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 16;
(б) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 17, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 18;
(в) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 15, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 18;
(г) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 35, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 36;
(д) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 37, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 38;
(е) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 39, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 40;
(ж) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 75, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 86;
(з) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 76, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 87;
(и) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 77, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 88;
(к) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 78, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 89;
(л) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 79, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 90;
(м) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 80, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 91;
(н) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 81, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 92;
(о) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 82, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 93;
(п) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 83, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 94;
(р) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 84, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 95;
(с) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 85, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 96;
(т) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 97, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 98;
(у) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 99, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 100;
(ф) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 101, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 102;
(х) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 103, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 104;
(ц) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 105, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 106; и
(ч) вариабельного домена α-цепи, имеющего аминокислотную последовательность SEQ ID NO: 107, и вариабельного домена β-цепи, имеющего аминокислотную последовательность SEQ ID NO: 108.
В одном из предпочтительных воплощений гидрофобный коровый домен вариабельного домена α-цепи в TCR имеет по меньшей мере одну из следующих мутаций: аминокислота в позиции 19 мутирована до V, аминокислота в позиции 21 мутирована до I, аминокислота в позиции 91 мутирована до L и/или гидрофобный коровый домен вариабельного домена β-цепи имеет по меньшей мере одну из следующих мутаций: аминокислота в позиции 91 мутирована до F или I, и/или аминокислота в четвертой позиции относительно последней аминокислоты последовательности короткого пептида J-гена β-цепи мутирована до М. В одном из предпочтительных воплощений мутации выбраны из группы, состоящей из:
(1) в вариабельном домене α-цепи аминокислота в позиции 19 мутирована до V, аминокислота в позиции 21 мутирована до I, аминокислота в позиции 91 мутирована до L; в вариабельном домене β-цепи аминокислота в позиции 91 мутирована до F, аминокислота в четвертой позиции с конца β-цепи короткого пептида, кодируемого J-геном, мутирована до М; или
(2) в вариабельном домене α-цепи аминокислота в позиции 19 мутирована до V, аминокислота в позиции 21 мутирована до I, и в вариабельном домене β-цепи аминокислота в позиции 91 мутирована до I; или
(3) в вариабельном домене α-цепи аминокислота в позиции 19 мутирована до V, аминокислота в позиции 21 мутирована до I, аминокислота в позиции 91 мутирована до L; в вариабельном домене β-цепи аминокислота в позиции 91 мутирована до F.
В одном из предпочтительных воплощений гидрофобный коровый домен вариабельного домена α-цепи TCR имеет по меньшей мере одну из следующих мутаций: L19V, L21I, 191L; и/или гидрофобный коровый домен вариабельного домена β-цепи имеет по меньшей мере одну из следующих мутаций: V91F или V91I; и/или аминокислота в четвертой позиции с конца β-цепи короткого пептида, кодируемого J-геном, мутирована с L до М.
В одном из предпочтительных воплощений мутации выбраны из группы, состоящей из:
(1) L19V, L21I, 191L в вариабельном домене α-цепи, V91F в вариабельном домене β-цепи, и аминокислота в четвертой позиции с конца β-цепи короткого пептида, кодируемого J-геном, мутирована с L до М; или
(2) L19V, L21I в вариабельном домене α-цепи, и V91I в вариабельном домне β-цепи; или
(3) L19V, L21I, 191L в вариабельном домене α-цепи, и V91I в вариабельном домне β-цепи;
где нумерация аминокислот представлена в IMGT.
В одном из предпочтительных воплощений TCR дополнительно имеет дисульфидную связь, связывающую константный домен α-цепи и константный домен β-цепи.
В одном из предпочтительных воплощений дисульфидная связь представлена в природном TCR или введена искусственно.
В одном из предпочтительных воплощений искусственно введенная дисульфидная связь располагается между константными доменами α- и β-цепей TCR.
В одном из предпочтительных воплощений искусственно введенные цистеиновые остатки, образующие межцепочечную дисульфидную связь, замещают по меньшей мере одну пару аминокислотных остатков α- и β-цепей, включающих, но не ограниченных приведенным списком:
(а) Т в константном домене α-цепи в позиции 48 и S в константном домене β-цепи в позиции 57; или
(б) Т в константном домене α-цепи в позиции 45 и S в константном домене β-цепи в позиции 77; или
(в) Т в константном домене α-цепи в позиции 10 и S в константном домене β-цепи в позиции 17; или
(г) Т в константном домене α-цепи в позиции 45 и D в константном домене β-цепи в позиции 59; или
(д) S в константном домене α-цепи в позиции 15 и Е в константном домене β-цепи в позиции 15; или
(е) S в константном домене α-цепи в позиции 61 и S в константном домене β-цепи в позиции 57; или
(ж) L в константном домене α-цепи в позиции 50 и S в константном домене β-цепи в позиции 57; или
(з) S в константном домене α-цепи в позиции 15 и V в константном домене β-цепи в позиции 13; или
(и) L в константном домене α-цепи в позиции 12 и S в константном домене β-цепи в позиции 17; или
(к) S в константном домене α-цепи в позиции 61 и R в константном домене β-цепи в позиции 79; или
(л) L в константном домене α-цепи в позиции 12 и F в константном домене β-цепи в позиции 14; или
(м) V в константном домене α-цепи в позиции 22 и F в константном домене β-цепи в позиции 14; или
(н) Y в константном домене α-цепи в позиции 43 и L в константном домене β-цепи в позиции 63; или
(o) Y в константном домене α-цепи в позиции 10 и S в константном домене β-цепи в позиции 17.
Используемая здесь нумерация позиций аминокислот, заменяемых в константном домене α-цепи и β-цепи, представляет собой нумерацию позиций, представленную в источнике Stable, souble T-cell receptor молекул for crystallization and therapeutics (Jonathan M. Boulter et al., 2003, Protein Engineering 16 (9): 707-711).
В одном из предпочтительных воплощений TCR отбирают при помощи технологии фагового дисплея.
В одном из предпочтительных воплощений TCR связан с конъюгатом (ковалентно или другими способами).
В одном из предпочтительных воплощений конъюгат представляет собой один или более чем один конъюгат, выбранный из группы, состоящей из:
(1) обнаруживаемого маркера;
(2) терапевтического агента; и
(3) группировки, модифицирующей PK (от англ. pharmacokinetic profile - фармакокинетический профиль).
Предпочтительно, обнаруживаемый маркер содержит: флуоресцентную или люминесцентную метку, радиоактивную метку, контрастирующий агент для МРТ (магнитно-резонансная томография) или КТ (рентгеновская компьютерная томография), или фермент, способный продуцировать обнаруживаемый продукт.
Предпочтительно, терапевтический агент содержит: радионуклид, биотоксин, цитокин (например, ИЛ-2 и т.п.), антитело, Fc (кристаллизующийся фрагмент) антитела, scFv (одноцепочечный фрагмент вариабельной области) антитела, золотую наночастицу/наностержень, вирусную частицу, липосому, наномагнитную частицу, фермент, активирующий пролекарство (например, DT-диафораза (DTD) или дифенилгидролаза-подобный белок (BPHL)), химиотерапевтический агент (например, цисплатин) или наночастицу в какой-либо форме.
В одном из предпочтительных воплощений конъюгат представляет собой антитело против CD3, связанное с С- или N-концом α- и/или β-цепей TCR.
Во втором аспекте изобретения предложена молекула нуклеиновой кислоты, содержащая последовательность, кодирующую TCR в соответствии с первым аспектом изобретения, или комплементарную ей последовательность.
В третьем аспекте изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты в соответствии со вторым аспектом изобретения.
В четвертом аспекте изобретения предложена клетка-хозяин, которая содержит вектор в соответствии с третьим аспектом изобретения, или в которой экзогенная молекула нуклеиновой кислоты в соответствии со вторым аспектом изобретения интегрирована в хромосоме.
В одном из предпочтительных воплощений клетка-хозяин выбрана из группы, состоящей из: прокариотической и эукариотической клетки, такой как Escherichia coli, дрожжей, клетки СНО (яичника китайского хомячка) и т.п.
В пятом аспекте изобретения предложен способ получения TCR в соответствии с первым аспектом изобретения, включающий:
(1) инкубацию клетки хозяина в соответствии с четвертым аспектом изобретения, таким образом экспрессирующей TCR в соответствии с первым аспектом изобретения; и
(2) выделение или очистку TCR.
В шестом аспекте изобретения предложен комплекс TCR, содержащий одну или более чем одну молекулу TCR в соответствии с первым аспектом изобретения.
В одном из предпочтительных воплощений комплекс содержит комплекс, образуемый TCR по изобретению, связанным с терапевтическим агентом или обнаруживаемым маркером.
В одном из предпочтительных воплощений комплекс содержит две или более чем две молекулы TCR.
В седьмом аспекте изобретения предложено применение TCR в соответствии с первым аспектом изобретения для производства лекарственного средства для лечения опухоли, вирусной инфекции или аутоиммунного заболевания.
В восьмом аспекте изобретения предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и безопасную и эффективную дозу какого-либо TCR в соответствии с первым аспектом изобретения.
В девятом аспекте изобретения предложен способ лечения заболевания, включающий введение субъекту, нуждающемуся в таком введении, TCR в соответствии с первым аспектом изобретения, или комплекса TCR в соответствии с шестым аспектом изобретения, или фармацевтической композиции в соответствии с восьмым аспектом изобретения.
В одном из предпочтительных воплощений заболевание включает опухоль, аутоиммунное заболевание и вирусную инфекцию.
В десятом аспекте изобретения предложен способ получения TCR в соответствии с первым аспектом изобретения, включающий:
(1) введение мутации аминокислотного остатка в гидрофобный коровый домен TCR; и
(2) отбор тех TCR, стабильность которых значительно увеличивается, таким образом получая TCR в соответствии с первым аспектом изобретения.
В одном из предпочтительных воплощений способ отбора включает метод фагового дисплея, но не ограничивается им.
В одном из предпочтительных воплощений на стадии (2) TCR, имеющий мутантный гидрофобный коровый домен, представляется при помощи метода фагового дисплея, и затем отбирается.
В одном из предпочтительных воплощений способ дополнительно включает стадию определения последовательности, активностей и/или других признаков отбираемых TCR.
Следует понимать, что в настоящем изобретении технические признаки, особо описанные выше и ниже (такие как примеры), могут комбинироваться друг с другом, таким образом составляя новое или предпочтительное техническое решение, и не обязательно должны быть описаны друг за другом.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1 демонстрирует структурную диаграмму типичного вариабельного домена TCR. Такой TCR представляет собой TCR дикого типа, специфический к опухолевому антигену MAGE A3 HLA А1.
Фиг. 2а и 2б соответственно демонстрируют аминокислотную последовательность и последовательность нуклеиновой кислоты (SEQ ID NO: 9 и 10) вариабельного домена α-цепи TCR после сайт-направленной мутации. Аминокислотная последовательность представляет собой оптимизацию аминокислотной последовательности вариабельного домена α-цепи TCR, раскрытой в патентной литературе (WO 2012/013913). В частности, гидрофобные остатки в вариабельном домене, имеющие боковые цепи, направленные к поверхности, мутированы в гидрофильные или полярные остатки. Жирные и подчеркнутые буквы представляют аминокислотные остатки после мутации.
Фиг. 3а и 3б соответственно демонстрируют аминокислотную последовательность и последовательность нуклеиновой кислоты (SEQ ID NO: 11 и 12) вариабельного домена β-цепи TCR после сайт-направленной мутации. Аминокислотная последовательность представляет собой оптимизацию аминокислотной последовательности вариабельного домена β-цепи TCR, раскрытой в патентной литературе (WO 2012/013913). В частности, гидрофобные остатки в вариабельном домене, имеющие боковые цепи, направленные к поверхности, мутированы в гидрофильные или полярные остатки. Жирные и подчеркнутые буквы представляют аминокислотные остатки после мутации.
Фиг. 4 демонстрирует способ лигирования каждого праймера в процессе конструирования MAGE-sTv-WT.
Фиг. 5а и 5б соответственно демонстрируют аминокислотную последовательность и последовательность нуклеиновой кислоты (SEQ ID NO: 13 и 14) линкера между α- и β-цепями в процессе конструирования библиотек мутантных штаммов sTv.
Фиг. 6а и 6б соответственно демонстрируют аминокислотную последовательность вариабельного домена α- и β-цепи (SEQ ID NO: 15 и 16) мутантного штамма sTv MG29. Мутантные остатки по сравнению с референсными MAGE-sTv-WT выделены жирным и подчеркнуты.
Фиг. 7а и 7б соответственно демонстрируют аминокислотную последовательность вариабельного домена α- и β-цепей (SEQ ID NO: 17 и 18) мутантного штамма sTv P8F1. Мутантные остатки по сравнению с референсными MAGE-sTv-WT выделены жирным и подчеркнуты.
Фиг. 8а и 8б соответственно демонстрируют аминокислотную последовательность вариабельного домена α- и β-цепи (SEQ ID NO: 15 и 18) мутантного штамма sTv P8F2. Мутантные остатки по сравнению с референсным MAGE-sTv-WT выделены жирным и подчеркнуты.
Фиг. 9 демонстрирует значения OD (оптической плотности) для различных отобранных мутантных штаммов и MAGE-sTv-WT в ИФА (иммуноферментном анализе) против антигена MAGEA3, EBV (вирус Эпштейна-Барр), вируса гриппа, NY-ESO.
Фиг. 10а и 10б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 29) и вариабельного домена β-цепи (SEQ ID NO: 30) в LC13-WT.
Фиг. 11а и 11б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 31) и вариабельного домена β-цепи (SEQ ID NO: 32) в JM22-WT.
Фиг. 12а и 12б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 33) и вариабельного домена β-цепи (SEQ ID NO: 34) в 1G4-WT.
Фиг. 13а и 13б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 35) и вариабельного домена β-цепи (SEQ ID NO: 36) в LC13-sTv.
Фиг. 14а и 14б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 37) и вариабельного домена β-цепи (SEQ ID NO: 38) в JM22-sTv.
Фиг. 15а и 15б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 39) и вариабельного домена β-цепи (SEQ ID NO: 40) в 1G4-sTv.
Фиг. 16 демонстрирует аминокислотную последовательность линкера (SEQ ID NO: 41), используемого для конструирования одноцепочечной молекулы sTV.
Фиг. 17 демонстрирует результат SDS-PAGE (электрофореза в полиакриламидном геле с додецилсульфатом натрия) очищенных белков LC13-WT и LC13-sTv. Дорожка 1: маркеры молекулярной массы, дорожка 2: LC13-WT, дорожка 3: LC13-sTv.
Фиг. 18а и 18б соответственно демонстрируют профиль SEC (гель-фильтрационной хроматографии) очищенных белков LC13-WT и LC13-sTv.
Фиг. 19 демонстрирует результат SDS-PAGE очищенного белка JM22-WT и JM22-sTv. Дорожка 1: маркеры молекулярной массы, дорожка 2: JM22-WT, дорожка 3: JM22-sTv.
Фиг. 20а и 20б соответственно демонстрируют профиль SEC очищенного белка JM22-WT и JM22-sTv.
Фиг. 21 демонстрирует результат SDS-PAGE очищенного белка 1G4-WT и 1G4-sTv. Дорожка 1: маркеры молекулярной массы, дорожка 2: 1G4-WT, дорожка 3: 1G4-sTv.
Фиг. 22а и 22б соответственно демонстрируют профиль SEC очищенного белка 1G4-WT и 1G4-sTv.
Фиг. 23 демонстрирует аминокислотную последовательность 1G4-sTv (SEQ ID NO: 42).
Фиг. 24 демонстрирует значения OD мутантного штамма 1G4-sTv против различных антигенов.
Фиг. 25 демонстрирует аминокислотную последовательность вариабельного домена α-цепи отобранных мутантных штаммов 1G4-sTv, обладающих высокой стабильностью (SEQ ID NO: 75-85).
Фиг. 26 демонстрирует аминокислотную последовательность вариабельного домена в β-цепи отобранных мутантных штаммов 1G4-sTv, обладающих высокой стабильностью (SEQ ID NO: 86-96).
Фиг. 27 демонстрирует график ДСК (дифференциальной сканирующей калориметрии) мутантных штаммов 1G4-sTv, обладающих высокой стабильностью.
Фиг. 28 демонстрирует график ДСК для 1G4-WT.
Фиг. 29а и 29б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 97) и вариабельного домена β-цепи (SEQ ID NO: 98) G15, обладающего высокой стабильностью.
Фиг. 30 демонстрирует результат SDS-PAGE очищенного белка 1G4-WT, 1G4-sTv, G13, G15, G9. Дорожка 1: маркеры молекулярной массы, дорожка 2: 1G4-WT, дорожка 3: 1G4-sTv, дорожка 4: G13, дорожка 5: G15, дорожка 6: маркеры молекулярной массы, дорожка 7: G9.
Фиг. 31а, 31б и 31в соответственно демонстрируют профиль SEC очищенных белков G9, G13 и G15.
Фиг. 32а и 32б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 99) и вариабельного домена β-цепи (SEQ ID NO: 100) LC13-G9.
Фиг. 33а и 33б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 101) и вариабельного домена β-цепи (SEQ ID NO: 102) LC13-G15.
Фиг. 34а и 34б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 103) и вариабельного домена β-цепи (SEQ ID NO: 104) JM22-G9.
Фиг. 35а и 35б соответственно демонстрируют аминокислотные последовательности вариабельного домена α-цепи (SEQ ID NO: 105) и вариабельного домена β-цепи (SEQ ID NO: 106) JM22-G15.
Фиг. 36 демонстрирует результат SDS-PAGE очищенных белков LC13-WT, LC13-sTv, LC13-G15 и LC13-G9. Дорожка 1: маркеры молекулярной ма