Новые связывающие c5a нуклеиновые кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии. Описана молекула L-нуклеиновой кислоты, способная связываться с C5a человека, где молекула L-нуклеиновой кислоты содержит центральный участок нуклеотидов, где центральный участок нуклеотидов содержит нуклеотидную последовательность 5' AUGn1GGUGKUn2n3RGGGHUGUKGGGn4Gn5CGACGCA 3' [SEQ ID NO: 61], где n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и G, A, U, C, H, K и R являются рибонуклеотидами, и dU, dG и dA являются 2'-дезоксирибонуклеотидами. Также описано использование данной молекулы для лечения или предотвращения заболевания, ассоциированного с активацией комплемента и опосредуемыми С5а патогенными механизмами. Также описано использование данной молекулы в диагностике такого заболевания. Также описан способ обнаружения указанной молекулы в образце. 8 н. и 18 з.п. ф-лы, 23 ил., 1 табл., 10 пр.
Реферат
Настоящее изобретение относится к молекуле нуклеиновой кислоты, способной связываться с C5a и/C5, к ее применению для изготовления лекарственного средства, диагностического средства и средства для обнаружения, соответственно, к композиции, содержащей указанную молекулу нуклеиновой кислоты, комплексу, содержащему указанную молекулу нуклеиновой кислоты, способу скрининга антагониста активности, опосредуемой C5a и/C5, с использованием указанной молекулы нуклеиновой кислоты, и способу обнаружения указанной молекулы нуклеиновой кислоты.
Первичная структура анафилатоксина C5a человека (фактор комплемента 5a; SwissProt entry P01031) была определена в 1978 году (Fernandez & Hugh 1978). Он состоит из 74 аминокислот, которые имеют молекулярную массу 8200 Да, в то время как углеводная часть имеет массу приблизительно 3000 Да. Углеводная часть C5a существует в качестве одного комплексного олигосахаридного элемента, присоединенного к аспарагину в положении 64. Три дисульфидных связи обеспечивают стабильную жесткую структуру молекулы.
Хотя трехмерная структура форм C5a из различных видов млекопитающих в основном сохранена, аминокислотная последовательность не очень хорошо сохранилась в процессе эволюции. Выравнивание последовательностей демонстрируют общую идентичность последовательностей C5a человека и мыши, составляющую 64%. C5a человека имеет следующий процент идентичных аминокислот с C5a из:
- Macaca mulatta (макак-резус) 85%
- Macaca fascicularis (яванский макак) 85%
- Bos taurus (дикий бык) 69%
- Sus scrofa (свинья) 68%
- Mus musculus (мышь) 64%
- Rattus norvegicus (крыса) 61%
Помимо ограниченной гомологии последовательностей, гликозилирование также является гетерогенным. В то время как C5a человека гликозилирован по аспарагину 64, гомолог мыши вообще не гликозилирован. Более отдаленно родственные белки человека C3a и C4a обладают только 35 и 40%, соответственно, идентичностью с C5a.
Система комплемента была открыта в начале последнего столетия в качестве чувствительной к нагреванию фракции сыворотки, которая "комплементировала" опосредуемый антисывороткой лизис клеток и бактерий. Являясь гуморальным компонентом природного неспецифического (врожденного) иммунного ответа, она играет важную роль в защите хозяина против инфекционных агентов и в воспалительном процессе. Комплемент может активироваться тремя различными путями: (i) после того, как антитело связывается с поверхностью клетки или бактерией (называемый классическим каскадом), (ii) прямо посредством бактериальных или вирусных гликолипидов (называемый альтернативным каскадом), или (iii) посредством углеводов на бактериях (называемый лектиновым каскадом). Все эти каскады активации сходятся в точке активации компонентов комплемента C3 и C5, где начинается общий конечный каскад, завершающийся сборкой мембраноатакующего комплекса (сокращенно MAC). Система комплемента состоит более чем из 20 растворимых белков, которые функционируют либо в качестве протеолитических ферментов, либо в качестве связывающих белков, составляющих вплоть до приблизительно 10% от всех глобулинов в сыворотке позвоночных. Кроме того, система комплемента включает множество различных рецепторов клеточной поверхности, которые проявляют специфичность в отношении протеолитических фрагментов белков комплемента и которые экспрессируются воспалительными клетками и клетками, регулирующими адаптивный иммунный ответ. Существует несколько регуляторных белков, которые ингибируют активацию комплемента и, таким образом, защищают клетки-хозяева от случайной атаки комплемента. Система комплемента может активироваться независимо или вместе с адаптивным иммунным ответом.
Функции комплемента включают процесс опсонизации (т.е. обеспечение большей чувствительности бактерий к фагоцитозу), лизис бактерий и чужеродных клеток путем встраивания поры (называемой мембраноатакующим комплексом) в их мембрану, образование хемотактически активных веществ, повышение сосудистой проницаемости, обеспечение сокращения гладких мышц и стимуляцию дегрануляции тучных клеток. Аналогично каскаду свертывания, процесс активации комплемента организован в виде последовательных ферментативных стадий, также известных как ферментативный каскад (Sim and Laich, 2000). Подробная последовательность этих взаимодействий приведена ниже.
Классический каскад. Этот каскад антителозависимой активации дополняет специфический антительный ответ. Он настолько же тщательно контролируется, как и альтернативный каскад, но лишен способности к спонтанной инициации, т.е. антителонезависимой функции распознавания, и механизма усиления по принципу отрицательной обратной связи. Активаторами классического каскада являются комплексы антиген-антитело, β-амилоид, ДНК, полиинозиновая кислота, комплексы полианион-поликатион, такие как гепарин/протамин, некоторые оболочечные вирусы, кристаллы мононатрийурата, липид A клеточной стенки бактерий, пликатовая кислота, полисахарид яда муравьев, субклеточные мембраны (такие как митохондрии), а также происходящие из клеток и плазмы ферменты, такие как плазмин, калликреин, активированный фактор Хагемана, эластаза и катепсины. Индуцируемый антителом классический каскад начинается с C1, который связывается с Fc-фрагментом антитела (IgM > IgG3 > IgG1 >> IgG2), лигированным с антигеном клеточной поверхности. C1 представляет собой комплекс распознавания, состоящий из 22 полипептидных цепей в 3 субъединицах: C1q, C1r, C1s. Фактической областью распознавания является C1q - гликопротеин, содержащий коллаген-подобный домен (обладающий остатками гидроксипролина и гидроксилизина), который выглядит как букет тюльпанов. При связывании через C1q, C1r активируется, становясь протеазой, которая расщепляет C1s до формы, которая активирует (путем расщепления) как C2, так и C4, на C2a/b и C4a/b. C2a и C4b в комбинации образуют C4b2a - C3-конвертазу (C3-активирующий фермент). C4a обладает только слабой активностью анафилатоксина, однако не является хемотактическим. C3 является центральным для всех трех каскадов активации. В классическом каскаде конвертаза C4b2a расщепляет C3 на C3a/b. C3a представляет собой анафилатоксин. C3b в комбинации с C4b2a образует комплекс C4b2a3b (C5-конвертаза). C3b также может связываться прямо с клетками, что делает их чувствительными к фагоцитозу (опсонизация).
Альтернативный каскад. Этот каскад не требует антител для активации и имеет большое значение для защиты хозяина против бактериальной и вирусной инфекции, поскольку, в отличие от классического каскада, он прямо активируется поверхностными структурами вторгающихся микроорганизмов, такими как бактериальные/вирусные гликолипиды или эндотоксины. Другими активаторами являются инулины, эритроциты кролика, десиалированные эритроциты человека, фактор яда кобры или фосфоротиоатные олигонуклеотиды. Шесть белков: C3, факторы B, D, H, I и пропердин, вместе выполняют функции инициации, распознавания и активации каскада, которые приводят к образованию связанной с активатором конвертазы C3/C5. Каскад начинается с C3. Небольшое количество C3b всегда встречается в циркуляции в результате спонтанного расщепления C3 ("работа C3 на холостом ходу"), однако концентрации, как правило, держатся на очень низком уровне вследствие последующей деградации. Однако когда C3b связывается с сахарами на клеточной поверхности, он может служить в качестве ядра для активации альтернативного каскада. Затем фактор B связывается с C3b. В присутствии фактора D связавшийся фактор B расщепляется на Ba и Bb; Bb содержит активный центр для C3-конвертазы. Далее, пропердин связывается с C3bBb, стабилизируя C3bBb-конвертазу на клеточной поверхности, что приводит к расщеплению других молекул C3. Наконец, образуется альтернативная C5-конвертаза C3bBb3b, которая расщепляет C5 на C5a/b. После появления C5b инициирует сборку мембраноатакующего комплекса, как описано выше. Как правило, только грамотрицательные клетки могут прямо лизироваться антителом вместе с комплементом; грамположительные клетки в основном устойчивы. Однако фагоцитоз значительно усиливается путем опсонизации C3b (фагоциты имеют рецепторы C3b на их поверхности) и антитело не всегда требуется. Кроме того, комплемент может нейтрализовать вирусные частицы либо путем прямого лизиса, либо путем предотвращения проникновения вируса в клетки-хозяева.
Лектиновый каскад. Открытый самым поздним каскад лектинов или маннан-связывающих лектинов (сокращенно MBL) зависит от врожденного распознавания чужеродных веществ (т.е. бактериальных поверхностей). Этот каскад обладает структурным и функциональным сходством с классическим каскадом. Активация лектинового каскада начинается с помощью белка острой фазы MBL, который распознает маннозу на бактериях, IgA и, возможно, структур, обнажаемых поврежденным эпителием. MBL гомологичен C1q и запускает ассоциированные с MBL сериновые протеазы (сокращенно MASP), для которых было описано три формы: MASP1, MASP2 и MASP3. Последующий лектиновый каскад активации практически идентичен активации классического каскада с образованием тех же C3- и C5-конвертаз. Кроме того, существуют некоторые данные о том, что MASP в некоторых условиях могут прямо активировать C3.
Терминальный каскад. Все три каскада активации сходятся в точке образования C5-конвертазы (C4b2a3b в классическом и лектиновом каскаде, C3bBb3b в альтернативном каскаде), которая расщепляет C5 на C5a/b. C5a обладает активностью анафилатоксина и является хемотактическим. Другой фрагмент C5 C5b функционирует посредством его гидрофобного участка связывания в качестве якоря на поверхности клеток-мишеней, на которой образуется литический мембраноатакующий комплекс (MAC или терминальный комплекс комплемента, сокращенно TCC). MAC собирается из пяти белков-предшественников: C5b, C6, C7, C8 и C9. Конечным событием является образование олигомеров C9, которые встраиваются в качестве трансмембранных каналов в плазматическую мембрану, что приводит к осмотическому лизису клетки. Сборка MAC контролируется растворимым белком фактором S плазмы (также называемый витронектином) и SP-40,40 (также известный как кластерин) и CD59 и HRF (гомологичный фактор рестрикции) на мембранах клеток-хозяев. Многие типы клеток являются чувствительными к опосредуемому комплементом лизису: эритроциты, тромбоциты, бактерии, вирусы, обладающие липопротеиновой оболочкой, и лимфоциты.
Система комплемента является мощным механизмом инициации и усиления воспаления. Оно опосредуется фрагментами компонентов комплемента. Анафилатоксины являются наиболее четко определенными фрагментами, и они являются протеолитическими фрагментами сериновых протеаз системы комплемента: C3a, C4a и C5a. Анафилатоксины продуцируются не только в ходе активации комплемента, но также при активации других ферментных систем, которые могут прямо расщеплять C3, C4 и C5. Такие ферменты включают тромбин, плазмин, калликреин, тканевые и лейкоцитарные лизосомальные ферменты и бактериальные протеазы. Анафилатоксины обладают мощными эффектами на стенки кровеносных сосудов, что вызывает сокращение гладких мышц (например, мышц подвздошной кишки, бронхов, матки и сосудов) и повышение проницаемости сосудов. Эти эффекты демонстрируют специфическую тахифилаксию (т.е. многократная стимуляция индуцирует снижение ответов), и они могут блокироваться антигистаминами; они, возможно, непрямо опосредуются высвобождением гистамина из тучных клеток и базофилов. C5a представляет собой N-концевой продукт расщепления α-цепи белка плазмы C5 из 74 аминокислот. Он связывается с высокой аффинностью рецептором C5aR (также известным как C5R1 или CD88) - молекулой, присутствующей на многих различных типах клеток: в наибольшей степени на нейтрофилах, макрофагах, гладкомышечных клетках и эндотелиальных клетках. C5a до настоящего времени является наиболее мощным анафилатоксином, приблизительно в 100 раз более эффективным, чем C3a, и в 1000 раз более эффективным, чем C4a. Эта активность снижается в порядке C5a > гистамин > ацетилхолин > C3a >> C4a.
C5a является чрезвычайно мощным в отношении стимуляции хемотаксиса, прикрепления нейтрофилов, формировании их дыхательного взрыва и дегрануляции. C5a также стимулирует нейтрофилы и эндотелиальные клетки к представлению большего количество молекул адгезии; внутривенная инъекция C5a, например, быстро приводит к нейтропении в экспериментах на животных путем запуска прикрепления нейтрофилов к стенкам кровеносных сосудов. После лигирования рецептора C5a нейтрофилов следует мобилизация мембранной арахидоновой кислоты, которая метаболизируется до простагландинов и лейкотриенов, включая LTB4, другой мощный хемоаттрактант для нейтрофилов и моноцитов. После лигирования C5a-рецепторов моноцитов высвобождается IL-1. Таким образом, локальное высвобождение C5a в участках воспаления приводит к мощным провоспалительным стимулам. В действительности, высвобождение C5a прямо или непрямо связано с множеством острых и хронических состояний, таких как ассоциированные с иммунным комплексом заболевания в общем (Heller et al., 1999); астма (Kohl, 2001); септический шок (Huber-Lang et al., 2001); синдром системного воспалительного ответа (сокращенно SIRS); полиорганная недостаточность (сокращенно MOF); острый респираторный дистресс-синдром (сокращенно ARDS); синдром воспаленной кишки (сокращенно IBD) (Woodruff et al., 2003); инфекции; тяжелые ожоги (Piccolo et al., 1999); реперфузионное повреждение органов, таких как сердце (van der Pals et al., 2010), селезенка, мочевой пузырь, поджелудочная железа, желудок, легкое, печень, почка, конечности, скелетные мышцы или кишечник (Riley et al., 2000); псориаз (Bergh et al., 1993); миокардит; рассеянный склероз (Muller-Ladner et al., 1996) и ревматоидный артрит (сокращенно RA) (Woodruff et al., 2002).
Опубликованы многочисленные обзоры, касающиеся взаимосвязи между системой комплемента и заболевания (Kirschfink, 1997; Kohl, 2001; Makrides, 1998; Walport, 2001a; Walport, 2001b). Повреждение клеток комплементом происходит вследствие активации либо классического, либо альтернативного каскада на поверхности клетки. MAC представляет собой надмолекулярную организованную структуру, которая состоит приблизительно из двадцати белковых молекул и имеет молекулярную массу приблизительно 1,7 миллиона Да. Полностью собранный MAC содержит одну молекулу каждого из C5b, C6, C7 и C8 и несколько молекул C9. Все эти компоненты MAC являются гликопротеинами. Когда C5 расщепляется C5-конвертазой и образуется C5b, начинается самосборка MAC. C5b и C6 образуют стабильный и растворимый бимолекулярный комплекс, который связывается с C7 и индуцирует представление им метастабильного участка, через который образующийся тримолекулярный комплекс (C5b-7) может встраиваться в мембраны, когда это происходит на липидном бислое-мишени или вблизи него. Встраивание опосредуется гидрофобными областями на комплексе C5b-7, который появляется после связывания C7 с C5b-6. Мембраносвязанный C5b-7 обеспечивает сборку MAC на участке мембраны и формирует рецептор для C8. Связывание одной молекулы C8 с каждым комплексом C5b-7 дает начало небольшим трансмембранным каналам с функциональным диаметром менее 1 нм, которые могут нарушать мембраны бактерий и эритроцитов, являющихся мишенями. Каждый мембраносвязанный комплекс C5b-8 действует в качестве рецептора для множества молекул C9 и, по-видимому, способствует встраиванию C9 в углеводородный центр клеточной мембраны. Связывание одной молекулы C9 инициирует процесс олигомеризации C9 в области атаки на мембрану. После включения в комплекс по меньшей мере 12 молекул образуется отдельная структура канала. Таким образом, конечный продукт состоит из тетрамолекулярного комплекса C5b-8 (c молекулярной массой приблизительно 550 кДа) и трубкообразного поли-C9 (с молекулярной массой приблизительно 1100 кДа). Эта форма MAC после встраивания в клеточные мембраны образует завершенные трансмембранные каналы, обеспечивающие осмотический лизис клетки. Образованные трансмембранные каналы варьируют по размеру в зависимости от количества молекул C9, включенных в структуру канала. В то время как присутствие поли-C9 не является абсолютно необходимым для лизиса эритроцитов или ядросодержащих клеток, оно может быть необходимым для уничтожения бактерий.
Система комплемента в основном полезна для защиты организма против вторгающихся микроорганизмов. Ранние компоненты каскада комплемента важны для опсонизации инфекционных агентов после их элиминации из организма. Кроме того, они выполняют несколько нормальных функций иммунной системы, таких как контроль образования и выведения иммунных комплексов или удаления дебриса, погибших тканей и чужеродных веществ. Все три каскада активации, которые распознают различные молекулярные структуры, которые (в здоровом организме) определяют широкий набор не являющихся своими структур, помогают контролировать вторгающиеся микроорганизмы. Терминальный каскад комплемента - который завершается сборкой MAC - представляет собой следующую линию защиты путем лизиса бактерий и чужеродных клеток.
Важность функциональной системы комплемента становится очевидной при рассмотрении защитных эффектов комплемента. Например, индивидуумы с отсутствием одного из белков альтернативного каскада или более поздних компонентов (C3-C9) имеют тенденцию к приобретению тяжелых инфекций пиогенными организмами, в частности, видами Neisseria. Дефицит компонентов классического каскада (таких как C1, C2, C4) также ассоциирован с увеличенным, хотя и не сильно повышенным, риском инфекции. Компоненты комплемента, такие как C1 и MBL, также не обладают способностью нейтрализовывать вирусы путем препятствования взаимодействию вируса с клеточной мембраной хозяина, таким образом, препятствуя вхождению в клетку.
Следует отметить, что, хотя расщепление C5 приводит к C5a, а также к MAC, клинические признаки дефицита C5 не отличаются значительно от клинических признаков дефицитов других терминальных компонентов (например, C6, C7, C8, C9), что указывает на то, что отсутствие C5a не вносит значительного вклада в клиническую картину у пациентов с дефицитом C5. Таким образом, селективный антагонизм C5a является перспективным в качестве оптимального инструмента воздействия так, чтобы нормальные вышележащие и нижележащие функции комплемента в отношении предотвращения заболевания оставались неизмененными. Таким образом, блокируется только вредоносная сверхпродукция провоспалительного анафилатоксина.
Тот факт, что мыши с дефицитом C5aR - хотя они более чувствительны к инфекциям Pseudomonas aeruginosa - в остальном выглядят нормальными, указывает на то, что блокада функции C5a не имеет вредоносных эффектов.
Известно несколько соединений, нацеленных на C5a или C5 или соответствующий рецептор, и их успешно исследовали в моделях in vivo. Некоторые из них далее исследовали в клинических испытаниях. Специфичное к C5 гуманизированное антитело экулизумаб одобрено для лечения пароксизмальной ночной гемоглобинурии, и была продемонстрирована его эффективность для лечения атипичного гемофильного уремического синдрома (aHUS), острого опосредуемого антителом отторжения аллотрансплантата и синдрома холодовой агглютинации. Оно препятствует расщеплению C5 и ингибирует действие как C5a, так и C5b. Помимо сходных находящихся на стадии испытания антител против C5 и фрагментов антител, особый интерес представляют антитела, которые селективно нарушают взаимодействие C5a:C5aR (CD88) и оставляют расщепление C5 и зависимое от C5b образование MAC неизмененными. Примерами являются гуманизированное mAb против C5a MEDI-7814, которое находится на фазе I клинической разработки для потенциального в/в лечения воспалительных нарушений и повреждения тканей, и антитело против C5a TNX-558, для которого, однако, не описано разработок с 2007 года. Антитело к рецептору C5a нейтразумаб находится на стадии разработки для лечения ревматоидного артрита и инсульта (Ricklin & Lambris, 2007; Wagner & Frank, 2010).
Пегилированный аптамер против C5 (ARC-1905) находится на стадии доклинической разработки для лечения AMD. CCX168 представляет собой низкомолекулярный ингибитор C5aR, в настоящее время находящийся на фазе II клинической разработки для лечения ассоциированного с цитоплазматическими антителами против нейтрофилов васкулитом (ChemoCentryx Press Release Oct 17, 2011). Другим антагонистом C5aR, находящимся в клинической разработке, является MP-435 для лечения ревматоидного артрита.
В последнее время не было описано разработок для низкомолекулярных антагонистов/пептидомиметиков рецепторов C5a JPE-1375, JSM-7717 (Ricklin & Lambris 2007). Другой ингибитор рецептора C5a CD88, циклический гексапептид PMX53, является эффективным в моделях воспаления на животных, однако он не достигает конечных результатов в плацебо-контролируемых двойных слепых испытаниях у пациентов с ревматоидным артритом. Клиническая разработка для AMD также прекратилась (Wagner & Frank 2010). Опубликовано, что находящийся на стадии испытаний вариант PMX53, PMX205 является активным в моделях деменции при болезни Альцгеймера на мышах (Fonseca et al., 2009). Следующим находящимся на стадии клинических испытаний соединением является антагонист рецептора C5a (C5aR) CCX-168. Было начато испытание фазы I для лечения воспалительных и аутоиммунных заболеваний в январе 2010 года.
Помимо эффектов C5a, как описано выше, новые данные позволили предположить, что образование C5a в микроокружении опухоли усиливает рост опухоли путем подавления противоопухолевого опосредуемого CD8+ T-клетками ответа, при этом указанное подавление, по-видимому, ассоциировано с привлечением супрессорных клеток миелоидного происхождения в опухоли и усилением их направленных на T-клетки супрессивных способностей. Markiewski et al. продемонстрировали, что блокада рецепторов C5a пептидным антагонистом рецептора C5a приводила к замедлению роста опухоли в модели на мышах (Markiewski et al., 2008).
Большинство пептидных соединений подвержено деградации, и, кроме того, модификация пептидазами демонстрирует высокую скорость выведения из организма, предпочтительно организма человека. Таким образом, эти пептидные соединения нельзя считать подобными лекарственному средству молекулами, являющимися предпосылкой для разработки лекарственных средств, обычно подлежащими выпуску в продажу.
В прошлом было разработано несколько шпигельмеров, специфично связывающихся с C5a человека, но не с C5a других видов (см. WO 2009/040113 и WO 2010/108657).
Поскольку для доклинической и клинической разработки необходимы модели на животных, проблемой, лежащей в основе настоящего изобретения, является предоставление соединения, которое взаимодействует с C5a мыши. Более конкретно, проблемой, лежащей в основе настоящего изобретения, является предоставление соединения, которое взаимодействует как с C5a мыши, так и с C5a человека.
Следующей проблемой, лежащей в основе настоящего изобретения, является предоставление соединения для изготовления лекарственного средства для лечения заболеваний человека и/или не человека, где заболевание характеризуется тем, что C5a либо прямо, либо непрямо вовлечен в патогенетический механизм такого заболевания.
Следующей проблемой, лежащей в основе настоящего изобретения, является предоставление соединения для изготовления диагностического средства для лечения заболевания, где заболевание характеризуется тем, что C5a либо прямо, либо непрямо вовлечен в патогенетический механизм такого заболевания.
Эти и другие проблемы, лежащие в основе настоящего изобретения, решаются содержанием прилагаемой формулы изобретения. Предпочтительные варианты осуществления могут быть взяты из зависимых пунктов формулы изобретения.
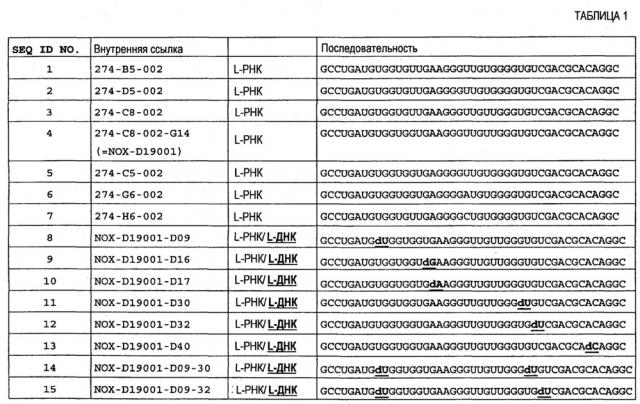
Проблема, лежащая в основе настоящего изобретения, решается в первом аспекте, который также является первым вариантом осуществления первого аспекта, с помощью молекулы нуклеиновой кислоты, способной связываться с C5a человека, где молекула нуклеиновой кислоты содержит центральный участок нуклеотидов, где центральный участок нуклеотидов содержит нуклеотидную последовательность
5' AUGn1GGUGKUn2n3RGGGHUGUKGGGn4Gn5CGACGCA 3' [SEQ ID NO: 61], где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U, C, H, K и R являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
Во втором варианте осуществления первого аспекта, который также является вариантом осуществления первого варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность, выбранную из группы:
a) 5' AUGn1GGUGUUn2n3AGGGUUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 62],
b) 5' AUGn1GGUGUUn2n3GGGGUUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 63],
c) 5' AUGn1GGUGUUn2n3AGGGUUGUUGGGn4Gn5CGACGCA 3' [SEQ ID NO: 64],
d) 5' AUGn1GGUGGUn2n3AGGGUUGUUGGGn4Gn5CGACGCA 3' [SEQ ID NO: 65],
e) 5' AUGn1GGUGGUn2n3GGGGUUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 66],
f) 5' AUGn1GGUGGUn2n3GGGGAUGUGGGGn4Gn5CGACGCA 3'[SEQ ID NO: 67], и
g) 5' AUGn1GGUGUUn2n3GGGGCUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 68],
где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U и C являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
В третьем варианте осуществления первого аспекта, который также является вариантом осуществления второго варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность
5' AUGn1GGUGGUn2n3AGGGUUGUUGGGn4Gn5CGACGCA 3' [SEQ ID NO: 65], где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U и C являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
В четвертом варианте осуществления первого аспекта, который также является вариантом осуществления третьего варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность, выбранную из группы:
a) 5' AUGdUGGUGGUGAAGGGUUGUUGGGUGUCGACGCA 3' [SEQ ID NO: 73],
b) 5' AUGUGGUGGUdGAAGGGUUGUUGGGUGUCGACGCA 3' [SEQ ID NO: 74],
c) 5' AUGUGGUGGUGdAAGGGUUGUUGGGUGUCGACGCA 3' [SEQ ID NO: 75],
d) 5' AUGUGGUGGUGAAGGGUUGUUGGGdUGUCGACGCA 3' [SEQ ID NO: 76],
e) 5' AUGUGGUGGUGAAGGGUUGUUGGGUGdUCGACGCA 3' [SEQ ID NO: 77],
f) 5' AUGdUGGUGGUGAAGGGUUGUUGGGdUGUCGACGCA 3' [SEQ ID NO: 78],
g) 5' AUGdUGGUGGUGAAGGGUUGUUGGGUGdUCGACGCA 3' [SEQ ID NO: 79],
h) 5' AUGUGGUGGUGAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 80],
i) 5' AUGdUGGUGGUGAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 81],
j) 5' AUGdUGGUGGUdGAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 82],
k) 5' AUGdUGGUGGUGdAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 83],
l) 5' AUGdUGGUGGUdGdAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 84],
предпочтительно центральный участок нуклеотидов представляет собой
5' AUGdUGGUGGUGAAGGGUUGUUGGGdUGUCGACGCA 3' [SEQ ID NO: 78] или
5' AUGdUGGUGGUdGdAAGGGUUGUUGGGdUGdUCGACGCA 3' [SEQ ID NO: 84].
В пятом варианте осуществления первого аспекта, который также является вариантом осуществления второго варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность
5' AUGn1GGUGGUn2n3GGGGUUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 66], где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U и C являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
В шестом варианте осуществления первого аспекта, который также является вариантом осуществления второго варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность
5' AUGn1GGUGGUn2n3GGGGAUGUGGGGn4Gn5CGACGCA 3' [SEQ ID NO: 67], где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U и C являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
В седьмом варианте осуществления первого аспекта, который также является вариантом осуществления второго варианта осуществления первого аспекта, центральный участок нуклеотидов содержит нуклеотидную последовательность
5' AUGn1GGUGUUn2n3AGGGUUGUUGGGn4Gn5CGACGCA 3' [SEQ ID NO: 64], где
n1 представляет собой U или dU, n2 представляет собой G или dG, n3 представляет собой A или dA, n4 представляет собой U или dU, n5 представляет собой U или dU, и
G, A, U и C являются рибонуклеотидами, и
dU, dG и dA являются 2'-дезоксирибонуклеотидами.
В восьмом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого и седьмого вариантов осуществления первого аспекта, центральный участок нуклеотидов состоит из рибонуклеотидов и 2'-дезоксирибонуклеотидов.
В девятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого и седьмого вариантов осуществления первого аспекта, центральный участок нуклеотидов состоит из рибонуклеотидов.
В десятом варианте осуществления первого аспекта, который также является вариантом осуществления первого, второго, третьего, четвертого, пятого, шестого, седьмого, восьмого и девятого вариантов осуществления первого аспекта, молекула нуклеиновой кислоты содержит в направлении 5'→3' первый концевой участок нуклеотидов, центральный участок нуклеотидов и второй концевой участок нуклеотидов, где
первый концевой участок нуклеотидов содержит от одного до пяти нуклеотидов и
второй концевой участок нуклеотидов содержит от одного до пяти нуклеотидов,
предпочтительно
первый концевой участок нуклеотидов содержит от трех до пяти нуклеотидов и
второй концевой участок нуклеотидов содержит от трех до пяти нуклеотидов,
более предпочтительно
первый концевой участок нуклеотидов содержит три нуклеотида и
второй концевой участок нуклеотидов содержит три нуклеотида.
В одиннадцатом варианте осуществления первого аспекта, который также является вариантом осуществления десятого варианта осуществления первого аспекта, первый концевой участок нуклеотидов содержит нуклеотидную последовательность 5' Z1Z2Z3Z4G 3', и второй концевой участок нуклеотидов содержит нуклеотидную последовательность 5' Z5Z6Z7Z8Z9 3', где
Z1 представляет собой G или отсутствует, Z2 представляет собой S или отсутствует, Z3 представляет собой S или отсутствует, Z4 представляет собой B или отсутствует, Z5 представляет собой C или dC, Z6 представляет собой V или отсутствует, Z7 представляет собой S или отсутствует, Z8 представляет собой S или отсутствует, Z9 представляет собой C или отсутствует, и
G, S, B, C, V являются рибонуклеотидами, и
dC представляет собой 2'-дезоксирибонуклеотид,
предпочтительно
a) Z1 представляет собой G, Z2 представляет собой S, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 представляет собой C, или
b) Z1 отсутствует, Z2 представляет собой S, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 отсутствует, или
c) Z1 отсутствует, Z2 отсутствует, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 отсутствует, Z9 отсутствует, или
d) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 отсутствует, Z8 отсутствует, Z9 отсутствует, или
e) Z1 отсутствует, Z2 представляет собой S, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 представляет собой C, или
f) Z1 отсутствует, Z2 отсутствует, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 представляет собой C, или
g) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 представляет собой C, или
h) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 отсутствует, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 представляет собой C, или
i) Z1 отсутствует, Z2 отсутствует, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 отсутствует, или
j) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 отсутствует, или
k) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 отсутствует, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 представляет собой S, Z9 отсутствует, или
l) Z1 отсутствует, Z2 представляет собой S, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 отсутствует, Z9 отсутствует, или
m) Z1 отсутствует, Z2 представляет собой S, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 отсутствует, Z8 отсутствует, Z9 отсутствует, или
n) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 отсутствует, Z5 представляет собой C, Z6 представляет собой V, Z7 представляет собой S, Z8 отсутствует, Z9 отсутствует, или
o) Z1 отсутствует, Z2 отсутствует, Z3 отсутствует, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 представляет собой S, Z8 отсутствует, Z9 отсутствует, или
p) Z1 отсутствует, Z2 отсутствует, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 представляет собой V, Z7 отсутствует, Z8 отсутствует, Z9 отсутствует, или
q) Z1 отсутствует, Z2 отсутствует, Z3 представляет собой S, Z4 представляет собой B, Z5 представляет собой C или dC, Z6 отсутствует, Z7 отсутствует, Z8 отсутствует, Z9 отсутствует.
В двенадцатом варианте осуществления первого аспекта, который также является вариантом осуществления десятого и одиннадцатого вариантов осуществления первого аспекта, первый концевой участок нуклеотидов содержит нуклеотидную последовательность 5' GCCUG 3', и второй концевой участок нуклеотидов содержит нуклеотидную последовательность 5' CAGGC 3' или 5' dCAGGC 3', где
C, A, G и U представляют собой рибонуклеотиды, и
dC представляет собой 2'-дезоксирибонуклеотид.
В 13-м варианте осуществления первого аспекта, который также является вариантом осуществления двенадцатого варианта осуществления первого аспекта, второй концевой участок нуклеотидов содержит нуклеотидную последовательность 5' dCAGGC 3'.
В 14-м варианте осуществления первого аспекта, который также является вариантом осуществления двенадцатого варианта осуществления первого аспекта, второй концевой участок нуклеотидов содержит нуклеотидную последовательность 5' CAGGC 3'.
В 15-м варианте осуществления первого аспекта, который также является вариантом осуществления десятого и одиннадцатого вариантов осуществления первого аспекта,
первый концевой участок нуклеотидов содержит нуклеотидную последовательность 5' CCUG 3' или 5' CUG 3'или 5' UG 3' или 5' G 3', и
второй концевой участок нуклеотидов содержит нуклеотидную последовательность 5' dCAGGC 3', где
C, A, G и U представляют собой рибонуклеотиды, и
dC пред