Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток
Иллюстрации
Показать всеИзобретение относится к области иммунологии и биотехнологии. Изобретение представляет собой способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток, включающий выделение мононуклеарных клеток из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции МНК ростовых факторов, нагрузка незрелых дендритных клеток антигенами лизата аутологичных опухолевых клеток рака молочной железы in vitro, стимуляцию созревания дендритных клеток, совместное культивирование дендритных клеток с лимфоцитами неприлипающей фракции в соотношении 1:10 с добавлением IL-12 и IL-18, причем добавление к прилипающей фракции мононуклеарных клеток ростовых факторов осуществляют в течение 72 часов, нагрузку дендритных клеток антигенами опухолевого лизата проводят в течение 24 часов, стимуляцию созревания дендритных клеток осуществляют в течение 48 часов, затем производят оценку экспрессии маркеров на поверхности зрелых дендритных клеток, а препарат, полученный при совместном культивировании в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток, замораживают с последующей разморозкой и фракционированием, причем фракционирование размороженных клеток и их культивирование осуществляют в течение 2-4 часов непосредственно перед инъекцией, в результате чего клетки разделяются на прилипающую и неприлипающую фракции, а затем обогащенную дендритными клетками прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов. Изобретение позволяет обеспечить защиту от формирования отдаленных метастазов и стимулирует специфический цитотоксический ответ против существующих. 7 ил.
Реферат
Изобретение относится к иммунологии и биотехнологии, конкретно - к созданию клеточных препаратов, обеспечивающих противоопухолевую активность в организме больного раком молочной железы и их применению в медицине при послеоперационном и поддерживающем лечении для профилактики или терапии отдаленных метастазов.
Опухоль может быть представлена широким спектром антигенов. Некоторые антигены представлены у всех опухолей определенного типа, а некоторые антигены могут быть обнаружены только у данного пациента. Дендритные клетки (ДК) способны представлять антигены, полученные из различных источников, что позволяет им эффективно стимулировать опухоль-специфичные эффекторные Т-клетки.
В данном процессе, первым шагом является обеспечение ДК опухоль-специфичными антигенами [Markiewicz M.A., Kast W.M. Progress in the development of immunotherapy of cancer using ex vivo-generated dendritic cells expressing multiple tumor antigen epitopes. // Cancer Invest. - 2004. - Vol. 22. - p.417-434]. Использование опухолевого лизата как источника опухолевых иммуногенов, обладает потенциальным преимуществом в стимуляции ответа против различных известных и неизвестных опухоль-ассоциированных антигенов (ОАА).
Данный метод позволяет вызвать поликлональный иммунный ответ, стимулируя как CD4+, так и цитотоксический CD8+ тип иммунного ответа, тем самым снижая возможность опухоли избежать иммунного ответа. Данный метод уменьшает время и усилия, направленные на выявление и синтез отдельных иммунодоминантных пептидных эпитопов, позволяя ДК естественно процессировать опухолевые антигены.
Недостатком данного метода является ограниченный объем опухолевого материала, использующийся для изготовления лизата, а также ограниченная пригодность опухолевых клеток, полученных от пациентов [Liu L.N., Shivakumar R., Allen С, Fratantoni J.С. Delivery of whole tumor lysate into dendritic cells for cancer vaccination. // Electroporation Protocols // Edited by Li S. // Methods Mol Biol. - 2008. - Vol. 423. - p. 139-153]. Эффективность вакцины будет зависеть от концентрации иммуногенных и иммуносупрессивных АГ в материале опухоли [Dong Н., Dai G., Xu L, Zhang Y., et al. Tumor cell lysate induces the immunosuppression and apoptosis of mouse immunocytes. Molecular Medicine Reports. - 2014. - Vol. 10. - p. 2827-2834].
Известен способ стимуляции цитотоксического иммунного ответа против клеток опухолевой линии аденокарциномы молочной железы, экспрессирующих специфические антигены, с помощью дендритных клеток, трансфецированных полиэпитопной ДНК-конструкцией (RU 2520091, C12N 5/084, 2014). Данный способ стимуляции специфического противоопухолевого иммунного ответа против клеток рака молочной железы осуществляют с помощью дендритных клеток, трансфецированных полиэпитопной ДНК-конструкцией. Полученные из периферической крови условно-здоровых доноров, трансфецированные полиэпитопной конструкцией, дендритные клетки культивируются с неприлипшей фракцией мононуклеарных клеток.
Недостатком способа является ограничения в применении способа в клинической практике. Введение ДНК-конструкций в клетку пациента осуществляется методами химической трансфекции или электропорации. Реагенты для химической трансфекции являются токсичными, а электропорация резко снижает количество жизнеспособных клеток и требует несертифицированных расходных материалов.
Известен способ получения противоопухолевой вакцины, включающий выделение мононуклеарных лимфоцитов, инкубацию выделенных мононуклеарных лимфоцитов с ростовыми факторами для получения из мононуклеарных лимфоцитов незрелых дендритных клеток, получение полилизата опухолей, обработку полученных незрелых дендритных клеток полилизатом опухолей, индукцию созревания незрелых дендритных клеток, обработанных полилизатом опухолей, в зрелые дендритные клетки, нагруженные полилизатом опухолей. Полилизат выбран из группы включающей рак яичников, рак кишечника, рак пищевода, рак желудка, рак молочной железы, меланому, рак почки, рак легкого. По мнению авторов описанная вакцина может применяться для изготовления лекарственного средства для профилактики злокачественного новообразования (RU 2008102736, C12N 5/08, 2009).
Недостатком способа является применение к пациенту смеси антигенов, полученных из аллогенных источников. Это может привести к развитию тяжелых иммунологических нарушений.
Известен способ послеоперационной терапии рака почки с использованием совместной культуры ДК и цитокин-активированных клеток. ДК получали из мононуклеарных клеток (МНК) периферической крови больных раком почки путем культивирования МНК, обогащенных фракцией моноцитов, в течение 4 дней в присутствии IL-4 (500 ед/мл) и GM-CSF (1000 ед/мл). Затем в культуру полученных дендритных клеток (ДК) добавляли лизат опухолевой ткани пациента и оставляли на 24 часа, а затем вносили TNF-α (1000 ед/мл) для созревания в течение последующих двух суток. Неприлипающую фракцию клеток для получения цитокин-индуцированных киллеров культивировали в среде RPMI 1640, содержащей 1000 ед/мл rhIL-2 и 10% инактивированной теплом сыворотки IV группы в количестве (3-5)×106/мл, во флаконе 25-см2, поверхность которого покрыта иммобилизованными anti-CD3 моноклональными антителами (20 мкг/мл). Сокультивирование ДК и цитокин-индуцированных киллеров проводилось в течение 7 дней без добавления дополнительных факторов. Введение пациенту совместной культуры производилось через 4 недели после операции внутривенно в количестве 3*108 клеток капельно в 100 мл раствора Рингера с лактатом через периферический внутривенный капельный катетер. Была отмечена хорошая переносимость метода, а побочные эффекты - гриппоподобные состояния, такие как лихорадка и усталость, - самостоятельно проходили в течение 2-3 часов. Ни у одного из пациентов не отмечалось эффектов, соответствующих III классу цитотоксичности или аутоиммунным реакциям (Zhan HL, Gao X, Pu XY, Li W, Li ZJ, Zhou XF, Qiu JG. A randomized controlled trial of postoperative tumor lysate-pulsed dendritic cells and cytokine-induced killer cells immunotherapy in patients with localized and locally advanced renal cell carcinoma. Chin Med J (Engl). 2012 Nov; 125(21): 3771-7).
Недостатком способа является стимуляция только неспецифической активации цитокин-индуцированных клеток, преимущественно киллеров, без прямой активации Т-клеточного ответа.
Известен способ послеоперационной терапии рака желудка и колоректального рака с использованием ДК и цитокин-активированных клеток. ДК получали из мононуклеарных клеток (МНК) периферической крови больных раком желудка и колоректальным раком путем культивирования МНК, обогащенных фракцией моноцитов, в течение 6 дней в присутствии IL-4 (20 нг/мл) и GM-CSF (50 нг/мл). Затем в культуру полученных дендритных клеток (ДК) добавляли лизат опухолевых клеток линий AGS (для рака желудка) или LS-174-T (колоректальный рак) на 2 суток. Неприлипающую фракцию клеток для получения цитокин-индуцированных киллеров культивировали в среде RPMI 1640, содержащей 10% фетальной сыворотки теленка, 1000 ед/мл rhIL-2, 300 ед/мл IFN-gamma, anti-CD3 моноклональными антителами (20 нг/мл). Инфузию ДК и цитокин-индуцированных киллеров начинали через 2-3 дня после химиотерапии. ДК вводили двумя частями. Одна часть смешивалась с цитокин-индуцированными киллерами с добавлением IL-2 и вводилась внутривенно. Другая часть вводилась подкожно в район лимфоузлов, соответствующих области поражения. Была отмечена хорошая переносимость метода, а побочные эффекты, такие как лихорадка и повышение температуры до 37-40°C проходили самостоятельно или под действием жаропонижающих препаратов (Gao D, Li С, Xie X, Zhao Р, Wei X, Sun W, Liu HC, Alexandrou AT, Jones J, Zhao R, Li JJ. Autologous tumor lysate-pulsed dendritic cell immunotherapy with cytokine-induced killer cells improves survival in gastric and colorectal cancer patients. PLoS One. 2014 Apr 3;9(4):e93886. doi: 10.1371/journal.pone.0093886. eCollection 2014).
Недостатком способа является отсутствие этапа созревания дендритных клеток, что может привести к развитию не только желаемого цитотоксического ответа, но и способствовать формированию толерантности к опухолевым антигенам. Отсутствие этапа совместного культивирования дендритных клеток с цитокин-индуцированными клетками не позволит в полной мере сформировать антиген-специфический противоопухолевый ответ.
Наиболее близким к предложенному является способ генерации антиген-специфических цитотоксических клеток с противоопухолевой активностью при раке молочной железы, включающий выделение мононуклеарных клеток (МНК) из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции МНК ростовых факторов, нагрузку незрелых дендритных клеток антигенами опухолевого лизата in vitro, стимуляцию созревания дендритных клеток. При этом к полученным незрелым ДК добавляют лизат аутологичных опухолевых клеток в дозе 100 мкг/мл, а еще через 48 часов в течение последующих 24 часов вносят рчФНО-альфа в дозе 25 нг/мл. Затем проводят совместное культивирование зрелых активированных лизатом дендритных клеток и неприлипающей фракции МНК в соотношении 1:10 в присутствии рекомбинантного человеческого интерлейкина-12 в дозе 10 нг/мл и рекомбинантного человеческого интерлейкина-18 в дозе 100 нг/мл. После добавления ростовых факторов к прилипающей фракции МНК производят культивирование в течение 48 часов для получения незрелых дендритных клеток (RU 2521506, C12N 5/0783, 2014).
Недостатком способа является то, что при 48 часах культивирования клетки прилипающей фракции моноцитов недостаточно полно дифференцируются в дендритные клетки, что приводит к меньшему содержанию зрелых дендритных клеток в составе клеточной фракции, предназначенной для совместного культивирования с мононуклеарными клетками. Следует отметить, что полученный данным способом препарат не может быть применен непосредственно для иммунотерапии, т.к. клетки с течением времени подвергаются апоптозу, из-за отсутствия реализации полученных эффекторных функций.
Задачей изобретения является повышение эффективности способа иммунотерапии рака молочной железы.
Техническим результатом изобретения является создание клеточного препарата, который в организме пациента обеспечивает защиту от формирования отдаленных метастазов и стимулирует специфический цитотоксический ответ против существующих.
Поставленная задача достигается тем, что в способе иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток, включающем выделение мононуклеарных клеток из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции мононуклеарных клеток ростовых факторов, нагрузка незрелых ДК антигенами лизата аутологичных опухолевых клеток рака молочной железы in vitro, стимуляцию созревания ДК, совместное культивирование ДК с лимфоцитами неприлипающей фракции в соотношении 1:10 с добавлением IL-12 и IL-18, добавление к прилипающей фракции мононуклеарных клеток ростовых факторов осуществляют в течение 72 часов, нагрузку ДК антигенами опухолевого лизата проводят в течение 24 часов, стимуляцию созревания ДК осуществляют в течение 48 часов, затем производят оценку экспрессии маркеров на поверхности зрелых дендритных клеток, а препарат, полученный при совместном культивировании в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток, замораживают с последующей разморозкой и фракционированием, причем фракционирование размороженных клеток и их культивирование осуществляют в течение 2-4 часов непосредственно перед инъекцией, в результате чего клетки разделяются на прилипающую и неприлипающую фракции, а затем обогащенную ДК прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов.
Изобретение, на наш взгляд, является новым и соответствует критерию «изобретательский уровень».
Добавление к прилипающей фракции мононуклеарных клеток ростовых факторов в течение 72 часов, нагрузка ДК антигенами опухолевого лизата - в течение 24 часов, осуществление стимуляции созревания ДК в течение 48 часов, повышают эффективность иммунотерапии за счет получения морфологически и фенотипически зрелых дендритных клеток в составе применяемого препарата, что подтверждается оценкой экспрессии маркеров на поверхности зрелых дендритных клеток.
Совместное культивирование в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток способствует приобретению эффекторных функций Т-клетками, в частности цитотоксической активности, что повышает эффективность иммунотерапии в целом.
Замораживание полученного препарата с его последующей разморозкой и фракционированием, и культивированием клеток в течение 2-4 часов непосредственно перед введением препарата пациенту позволяют разделить клетки на прилипающую и неприлипающую фракции, что повышает эффективность иммунотерапии за счет использования нескольких путей миграции иммуногенных клеток в составе препарата к очагу поражения и исключает возможную пирогенную реакцию организма пациента.
Обогащенную ДК прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов, что повышает эффективность иммунотерапии за счет активации цитотоксических механизмов, направленных на лизис единичных клеток, потенциально способных формировать отдаленные метастазы и стимулировать специфический цитотоксический ответ против существующих метастазов.
Изобретение осуществляется следующим образом.
Выделенные из периферической крови больных раком молочной железы клетки прилипающей фракции мононуклеарных клеток культивируются в концентрации 1 млн/мл в полной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10-5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% СО2 при 37°C с добавлением рчГМ-КСФ (100 нг/мл) и рчИЛ-4 (50 нг/мл). Через 72 часа культивирования к полученным незрелым ДК добавляется лизат опухолевой ткани в дозе 100 мкг/мл. Еще через 24 часа культивирования добавляется для созревания рчФНО-α в дозе 25 нг/мл в течение последующих 48 часов. По окончании этого этапа проводят оценку экспрессии маркеров зрелых дендритных клеток.
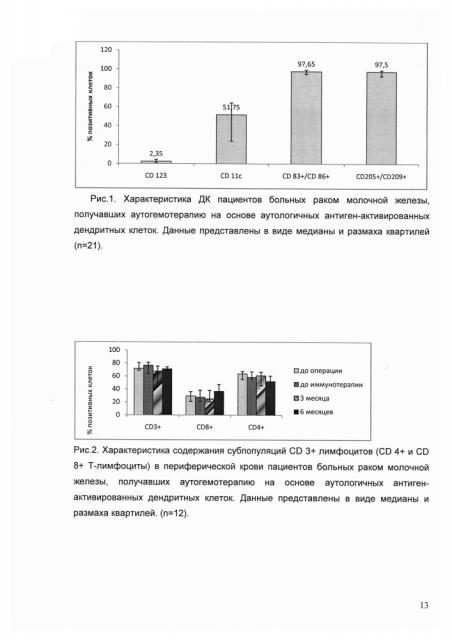
Для характеристики полученных ДК использовали несколько параметров. Результаты представлены на рисунке 1.
- Оценка экспрессии маркера CD 123 (плазмацитоидные ДК) на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA-DR-позитивные клетки, в которых определяли содержание CD 123-плазмацитоидных дендритных клеток. Содержание плазмоцитоидных дендритных клеток составило 2,35% [UQ; LQ: 4,45; 1,25].
- Оценка экспрессии маркера CD 11 с (миелоидные ДК) на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA-DR-позитивные клетки, в которых определяли содержание CD 11с-миелоидных ДК. Содержание миелоидных дендритных клеток составило 51,75% [UQ; LQ: 64,35; 23,925].
- Оценка экспрессии маркеров CD 83+/CD 86+ на поверхности зрелых дендритных клеток. Для этого в популяции больших гранулярных лимфоцитов выделяли популяцию CD 11c+HLA-DR + клеток и в них определяли содержание CD 83+CD86+ дубль-позитивных дендритных клеток, которое составляло 97,65% [UQ; LQ: 94,925; 99,3].
- Оценка экспрессии маркеров CD 205+/CD 209+ на поверхности зрелых дендритных клеток. Для этого в популяции больших гранулярных лимфоцитов выделяли популяцию CD 11c+HLA-DR + клеток и в них определяли содержание CD 205+CD209 + дубль-позитивных дендритных клеток, которое составляло 97,5% [UQ; LO: 99,1; 92,9].
После анализа поверхностного фенотипа зрелых дендритных клеток осуществляли совместное культивирование дендритных клеток и неприлипшей фракции мононуклеарных клеток в соотношении 1:10 с добавлением IL-12 (8 нг/мл) и IL-18 (80 нг/мл) еще в течение 96 часов.
Полученную культуру клеток замораживают для длительного хранения. Курс лечения включал 3-4-кратное введение вакцины. Утром, в день инъекции, производилась разморозка замороженной аликвоты клеток. Размороженные клетки культивировались в течение 3 часов. Прилипшая фракция механически с помощью скрепера снимается с поверхности культурального флакона и готовится для подкожного введения. Неприлипшая фракция готовится для внутривенного введения. Обе клеточные фракции трехкратно отмываются физиологическим раствором. Для подкожного введения клетки (2-3 млн) ресуспендируются в объеме 800-1000 мкл и вводятся подкожно, в три точки в подлопаточную область. Для внутривенного введения клетки (20-30 млн) ресуспендируются в 100 мл физиологического раствора с добавлением 2 мл 10% альбумина. Введение клеток осуществляется на фоне премедикации дексаметазоном (8 мг). Введение клеток в адъювантном режиме производится на фоне химиотерапии (1 раз в три недели, между курсами) или же после окончания курса химиотерапии (1 раз в неделю). Введение клеток в неоадъювантном (самостоятельном) режиме производится 1 раз в неделю.
Непосредственных осложнений при введении препарата не отмечалось. У пациенток с наличием отдаленных изменений наблюдалось повышение температуры до 37,2°C и 37,5°C в среднем через 2 суток после инъекции. Купировались симптоматически (прием НПВС).
Для иммунологической оценки эффективности проводимой терапии мы оценивали иммунный статус пациентов и цитотоксическую активность циркулирующих мононуклеарных клеток. Нами исследовано содержание популяций CD 3+ клеток - CD 4 и CD 8, CD 3- CD 16/56 и CD 19, CD 14 моноцитов, экспрессирующих и не экспрессирующих HLA-DR (моноциты и супрессорные миелоидные предшественники соответственно), Т-регуляторных клеток, миелоидных и плазмоцитоидных ДК до операции, до начала иммунотерапии, через 3 и 6 месяцев после окончания иммунотерапии. Данные получены для 12 пациентов, получавших терапию в адъювантном режиме.
Для оценки содержания субпопуляций лимфоцитов была использована схема гейтирования, предложенная производителем набора. Среди CD 45+ лейкоцитов выделяли CD 3+ и CD 3-субпопуляции. Среди CD 3+ клеток определяли CD 4 и CD 8 Т-лимфоциты, из CD 3- клеток - CD 16/56 NK-клетки и CD 19 В-лимфоциты. Результаты представлены на рисунках 2 и 3. Таким образом, статистически значимые изменения отмечены только для CD 19 В-лимфоцитов - достоверное снижение к началу иммунотерапии по сравнению с состоянием до операции и повышение через 3 месяца после иммунотерапии.
Для оценки содержания Т-регуляторных клеток среди CD 45+ лейкоцитов выделяли популяцию CD4+CD25+ лимфоцитов и определяли содержание клеток, несущих маркер FoxP3. Результаты представлены на рисунке 4. Таким образом, через 3 месяца после проведения иммунотерапии наблюдается достоверное снижение уровня Т-регуляторных (CD 4+CD25+FoxP3) клеток, которое сохраняется и через 6 месяцев после иммунотерапии.
Для оценки содержания CD 14 моноцитов, экспрессирующих и не экспрессирующих HLA DR (моноциты и супрессорные миелоидные предшественники, соответственно) среди CD 45+ лейкоцитов выделяли CD14+ моноциты и оценивали на них экспрессию HLA DR. Результаты представлены на рисунке 5. Таким образом, через 3 месяца после проведения иммунотерапии достоверно увеличивается содержание CD 14+HLA DR+ моноцитов, и достоверно снижается содержание миелоидных супрессоров CD 14+HLA DR-, которое сохраняется и через 6 месяцев после иммунотерапии.
Оценка экспрессии маркеров CD 11с (миелоидные ДК) и CD 123 (плазмацитоидные ДК) и на поверхности зрелых дендритных клеток. Для этого в популяции CD 45-позитивных клеток выделяли линейно-негативные HLA DR-позитивные клетки, в которых определяли содержание CD 11с миелоидных ДК и CD 123 плазмацитоидных. Результаты представлены на рисунке 6. Данные представлены как процент позитивных клеток от CD 45-позитивных клеток. На фоне иммунотерапии происходит прирост миелоидных дендритных клеток, а содержание плазмоцитоидных дендритных клеток практически не изменяется.
При исследовании цитотоксической активности мононуклеарных клеток против опухолевой линии аденокарциномы молочной железы MCF-7 было показано постепенное усиление цитотоксической активности через 3 и 6 месяцев после иммунотерапии по сравнению с исходным уровнем (до иммунотерапии - ИТ). Результаты представлены на рисунке 7. На рисунках 3-7 стрелками показаны достоверные различия.
В настоящее время для пациенток, прошедших иммунотерапию в адъювантном режиме, прошло около 2 лет наблюдения за 6 пациентками; 1 год наблюдения за 4 пациентками; менее 1 года за 6 пациентками; менее 6 месяцев наблюдения за 5 пациентками. За этот период пациенты не обращались в онкодиспансер по поводу прогрессирования или рецидивирования заболевания. У одной пациентки была отмечена гиперплазия надключичного лимфоузла, однако дальнейшего роста не наблюдалось. У другой пациентки прошедшей курс иммунотерапии в ноябре 2015 г., выявлен метастаз в головной мозг (оперативное пособие в условиях НИИТО, гистологически - аденокарцинома).
Для пациентов, получавших иммунотерапию в неоадъювантном (самостоятельном) режиме.
Пациентка М., 31 год. Через 6 месяцев после курса иммунотерапии при контрольном МСКТ было зафиксировано снижение количества метастазов в легких на 35-40%, уменьшение гидроторакса, улучшение состояния кожи железы. Пациентка Е., 50 лет. При введении вакцины пациентом было отмечено облегчение выраженности болевого синдрома в пораженной железе. Однако у данного пациента была очень агрессивная и химиорезистентная опухоль (на момент включения в исследование проводилась третья линия терапии, включающая капецитабин и тамоксифен) и в январе 2016 г. пациентка умерла. Пациентка Н., 63 года, взята в исследование ввиду интересного клинического диагноза T×N×M1, при котором первичная опухоль не выявлена, а происхождение опухоли было определено только после иссечения и исследования мягкотканого метастаза. На момент включения в исследование пациентка принимала золедроновую кислоту и тамоксифен. Через 2 недели после курса иммунотерапии пациентом было отмечено исчезновение метастаза в затылочной области, уменьшение отека правой руки. По результатам МСКТ отмечена положительная динамика по состоянию костей скелета.
Предложенное изобретение позволяет повысить эффективность способа иммунотерапии рака молочной железы.
Техническим результатом изобретения является создание клеточного препарата, который в организме пациента обеспечивает защиту от формирования отдаленных метастазов и стимулирует специфический цитотоксический ответ против существующих.
Предлагаемое изобретение является эффективным компонентом в комплексном лечении рака молочной железы, не оказывает значимых побочных эффектов и способствует достижению признаков стабилизации болезни.
Способ иммунотерапии рака молочной железы с помощью антиген-активированных дендритных клеток, включающий выделение мононуклеарных клеток из периферической крови пациента, разделение клеток на прилипающую и неприлипающую фракции, добавление к прилипающей фракции МНК ростовых факторов, нагрузка незрелых дендритных клеток антигенами лизата аутологичных опухолевых клеток рака молочной железы in vitro, стимуляцию созревания дендритных клеток, совместное культивирование дендритных клеток с лимфоцитами неприлипающей фракции в соотношении 1:10 с добавлением IL-12 и IL-18, отличающийся тем, что добавление к прилипающей фракции мононуклеарных клеток ростовых факторов осуществляют в течение 72 часов, нагрузку дендритных клеток антигенами опухолевого лизата проводят в течение 24 часов, стимуляцию созревания дендритных клеток осуществляют в течение 48 часов, затем производят оценку экспрессии маркеров на поверхности зрелых дендритных клеток, а препарат, полученный при совместном культивировании в течение 96 часов зрелых дендритных клеток и лимфоцитов неприлипающей фракции мононуклеарных клеток, замораживают с последующей разморозкой и фракционированием, причем фракционирование размороженных клеток и их культивирование осуществляют в течение 2-4 часов непосредственно перед инъекцией, в результате чего клетки разделяются на прилипающую и неприлипающую фракции, а затем обогащенную дендритными клетками прилипающую фракцию вводят пациенту подкожно, а активированные лимфоциты неприлипающей фракции с повышенным содержанием цитотоксических клеток и Т-хелперов первого типа вводят пациенту внутривенно на фоне премедикации дексаметазоном, по меньшей мере 3-4 курсами в течение 3-4 месяцев, причем общее количество введенных клеток не менее 100 миллионов.