Тканевые конструкции, полученные с помощью биоинженерии, и способы их получения и применения
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана биоинженерная конструкция для восстановления больных или поврежденных тканей. Указанная конструкция содержит мезенхимальные стволовые клетки и слой внеклеточного матрикса, продуцируемый указанными клетками, при этом указанные мезенхимальные клетки не являются производными эмбриона человека и выращены в условиях среды с заданным химическим составом, свободной от i) сыворотки животных и экстрактов тканей животных и ii) свободной от привнесенных вирусов животных или межвидовых вирусов, для получения указанного слоя внеклеточного матрикса, который синтезируют и собирают указанные мезенхимальные стволовые клетки. Указанная культуральная среда содержит (i) основную питательную среду, (ii) трансформирующий фактор роста альфа (ТФР-α), (iii) инсулин, (iv) L-глютамин или производное L-глютамина, и (v) аскорбат или производное аскорбата. Изобретение может быть использовано в терапии, направленной на восстановление больных или поврежденных тканей. 15 з.п. ф-лы, 17 ил., 13 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/347725, поданной 24 мая 2010 г., предварительной заявки на патент США №61/337938, поданной 12 февраля 2010 г., и предварительной заявки на патент США №61/295073, поданной 14 января 2010 г.; содержание каждой из которых полностью и непосредственно включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Кость, хрящ, сухожилия, связки, мышцы, жировая ткань и строма костного мозга являются примерами мезенхимальных тканей (т.е. тканей, развивающихся из мезенхимальных стволовых клеток).
Мезенхимальные ткани могут повреждаться во время хирургических операций или же их заболевание может развиваться в результате генетического нарушения или внешних воздействий.
Соответственно, существует потребность в новых способах терапии для восстановления больных или поврежденных тканей.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны биоинженерные конструкции, содержащие внеклеточный матрикс (ВКМ) в формах, оптимизированных для конкретного терапевтического применения. Некоторые конструкции состоят из внеклеточного матрикса, синтезируемого культивируемыми мезенхимальными стволовыми клетками (МСК). Некоторые конструкции также содержат клетки, синтезирующие указанный матрикс. В некоторых конструкциях указанные клетки девитализированы. В других конструкциях клетки, синтезирующие внеклеточный матрикс, удалены для получения бесклеточных (децеллюляризованных) конструкций.
Некоторые конструкции имеют толщину по меньшей мере приблизительно 30 мкм. Некоторые конструкции включают поры со средним диаметром в диапазоне от 10 до 100 мкм. Некоторые конструкции обладают средней Fmax, равной по меньшей мере 0,4 Н. Некоторые конструкции обладают пределом прочности на растяжение (UTS), равным по меньшей мере 0,4 МПа. Некоторые конструкции обладают по меньшей мере 0,4-кратным допуском упругой деформации относительно начальной длины.
ВКМ в указанных конструкциях может затем быть обработан (например, быть дегидратирован, сшит перекрестными связями, сокращен, микронизирован, стерилизован и т.д.) или скомбинирован с другими биологически активными веществами или вспомогательными материалами (например, шелком, адгезивом и т.д.) для получения терапевтических продуктов.
Также описаны способы получения и модификации указанных биоинженерных конструкций, включая способы контроля толщины конструкции, размера пор и состава.
Описанные в настоящей заявке биоинженерные конструкции могут вводиться пациентам для увеличения жизнеспособности, стимуляции роста и/или восстановления мягкой ткани, в том числе для лечения хронических или острых ран.
Другие характеристики и преимущества будут ясны из приведенных ниже подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
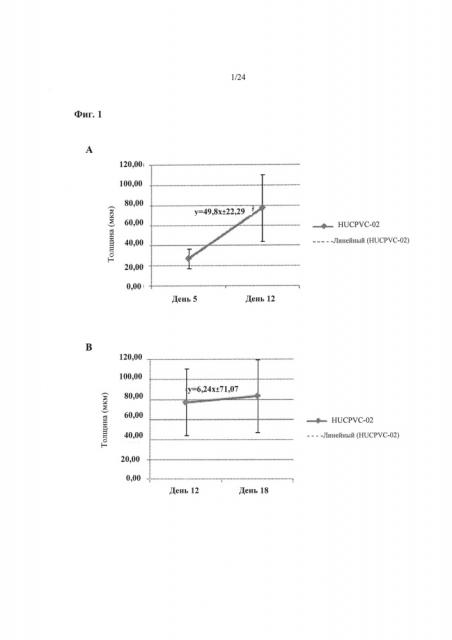
На Фиг.1А-1В приведен анализ зависимости формирования внеклеточного матрикса от времени с применением МСК в период с 5 по 12 день (Фиг.1А) или с 12 по 18 день (Фиг.1 В), n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции). Приведены линия тренда и уравнение касательной.
На Фиг.2 показана корреляция между увеличением толщины биоинженерной конструкции как функции от увеличивающейся концентрации ТФР-альфа. В отсутствие ТФР-альфа: 0 нг/мл; 1,5х:30 нг/мл ТФР-альфа; 5х:100 нг/мл ТФР-альфа; и 10х:200 нг/мл ТФР-альфа, n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции), за исключением 1,5х и 10х, где n=6 (2 независимых конструкции на группу и 3 измерения для каждой конструкции).
На Фиг.3 показана корреляция между уменьшением толщины биоинженерной конструкции как функции от увеличения концентрации простагландина 2 (ПГЕ2) при постоянном количестве ТФР-альфа 20 нг/мл. Без ПГЕ2: 0 нг/мл; 5х:19 нг/мл ПГЕ2; 10х:38 нг/мл ПГЕ2; и 50х: 190 нг/мл ПГЕ2. n=9 (3 независимых конструкции на группу с тремя измерениями для каждой конструкции).
На Фиг.4 показана корреляция между увеличением толщины биоинженерной конструкции как функции от увеличивающейся концентрации ТФР-альфа и плотности посева клеток среди биоинженерных конструкций, получаемых из МСК различных клеточных типов (ДФЧ, неонатальных фибробластов кожи человека; HUCPVC, периваскулярных клеток пуповины человека; КМ-МСК: мезенхимальных стволовых клеток, полученных из костного мозга; и Pre-Adipo: преадипоцитов). Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа) и густота посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеткам на 24 мм вкладыше. Измерения толщины матрикса, полученного из окрашенных гематоксилином - эозином срезов, фиксированных после 18 дней культивирования. Столбцы (среднее±стандартное отклонение, n=12) соответствуют средней толщине n=3 независимых конструкций, измеренной в 4 различных местоположениях.
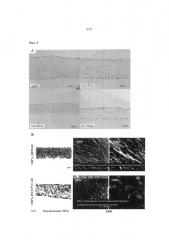
На Фиг.5А-5 В показаны типичные окрашенные гематоксилином-эозином, окрашенные трехцветно по Goldner-Masson (MTG) срезы и SEM-снимки срезов биоинженерных конструкций, полученных из МСК клеток разных типов (ДФЧ; неонатальные фибробласты кожи человека; HUCPVC; периваскулярные клетки пуповины человека; КМ-МСК; мезенхимальные стволовые клетки, полученные из костного мозга; и Pre-Adipo: преадипоциты) после 18 дней культивирования. Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа), плотность посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеток на 24 мм вкладыш. Снимки получали при увеличении 20х.
На Фиг.6А-6С показаны типичные Fmax, предел прочности на растяжение (UTS), и характеристики модуля упругости биоинженерных конструкций, получаемых из МСК клеток разных типов (ДФЧ-02; неонатальные фибробласты кожи человека; HUC-02; периваскулярные клетки пуповины человека; МСК-02: мезенхимальные стволовые клетки, полученные из костного мозга; и PAD-02 (ПАД-02): преадипоциты) после 18 дней культивирования. Применяли культуральную среду с заданным химическим составом, описанную в примере 1 (например, 200 нг/мл ТФР-альфа), плотность посева составляла 30×106 клеток на 75 мм вкладыш, что эквивалентно 9,6×106 клеток на 24 мм вкладыш. Столбцы (среднее±стандартное отклонение, n=9) соответствуют среднему Fmax, UTS и модулю упругости для 3 независимых конструкций, каждый из которых был протестирован трижды.
На Фиг.7А-7 В обобщены различия внеклеточного матрикса и адгезивных компонентов (Фиг.7А; 17 положительно регулируемых генов в происходящих из HUCPVC биоинженерных конструкциях, чем 2-кратно относительно происходящих из ДФЧ) и ростовых факторов (Фиг.7В; 8 положительно регулируемых генов в происходящих из HUCPVC биоинженерных конструкциях, чем 2-кратно относительно происходящих из ДФЧ) между происходящими из HUCPVC и происходящими из ДФЧ биоинженерными конструкциями.
На Фиг.8A-8D показаны результаты сравнения изменений во времени уровней IL-6 (ИЛ-6), IL-8 (ИЛ-8) и ФРЭС в кондиционированной среде, полученной от различных происходящих из МСК и происходящих из ДФЧ биоинженерных конструкций на основе результатов СВА-анализа. Среднее и стандартные отклонения вычисляют в среднем исходя из n=3 кондиционированных образцов среды. Также представлено количественное определение уровней ГК, проведенное с помощью ИФА-анализа.
На Фиг.9 показаны результаты анализа клеточной миграции. Непрямой 2-D анализ миграции для сравнения степени закрытия как функции от кондиционированной среды, собранной в различных вариантах реализации. Анализ выполняется на кератиноцитах, культивируемых на кондиционированной ДФЧ-02 и HUCPVC VCT-02 конструкциями среде, собранной из на 5 день и 18 день. Фигура состоит из репрезентативныхсветлопольных изображений кератиноцитов, окрашенных кислым фуксином после 24 часов индукции в кондиционированной среде, а также графического представленияуровней степени сокращения, отражающего максимальное закрытие в образцах 5-дневнойкондиционированной HUCPVC VCT-02 среды.
На Фиг.10А-10С показаны результаты анализа мультилинейного потенциала, проведенного на происходящих из МСК (HUC-02) и происходящих из ДФЧ (ДФЧ-02) биоинженерных конструкциях, и выделенных из них клетках. На Фиг.10А представлены данные относительно генной экспрессии в клетках в составе биоинженерных конструкций, индуцированных с применением остеогенной индукционной среды с применением панели остеогенных генов. На Фиг.10В показаны данные относительно генной экспрессии в клетках, выделенных из биоинженерных конструкций, индуцированных с применением остеогенной индукционной среды с применением панели остеогенных генов. На Фиг.10С показаны результаты окрашивания масляным красным О клеток в составе биоинженерных конструкций, индуцированных с применением адипогенной индукционной среды.
На Фиг.11А-11Е показаны репрезентативные гистологические срезы и количественное определение окрашенного гладкомышечного альфа-актина (αSMA) из происходящих на 100% из МСК биоинженерных конструкций (Фиг. 11А), происходящих на 50% из HUCPVC и на 50% из ДФЧ биоинженерных конструкций (Фиг.11В), происходящих на 10% из HUCPVC и на 90% из ДФЧ биоинженерных конструкций (Фиг.11С), и из на 100% происходящих из ДФЧ биоинженерных конструкций (Фиг.11D) через 1 неделю после подкожной имплантации безтимусным мышам. Темные участки обозначают позитивное окрашивание на αSMA. На Фиг. 11Е показано количественное определение кровеносных сосудов в области имплантата на основе позитивного окрашивания на αSMA. Для анализа использовали животных общим числом 2 на группу
(n=2). Число αSMA-позитивных сосудов подсчитывали вручную с применением микроскопа с объективом 40х. Указанное число позитивных сосудов затем нормализовали по области имплантата.
На Фиг.12 показаны независимые гистологические изображения биоинженерных конструкций, зафиксированных в формалине непосредственно после культивирования.
На Фиг.13 показаны независимые гистологические изображения биоинженерных конструкций, которым позволили пройти контролируемое сокращение перед фиксацией в формалине.
На Фиг.14A-14G показаны результаты управления размерами пор во внеклеточных матриксах биоинженерных конструкций. На Фиг.14А приведены различные применения биоинженерных конструкций в соответствии с различными величинами среднего диаметра пор. На Фиг.14 В показан количественный анализ среднего диаметра пор со стандартными отклонениями из биоинженерных конструкций, прошедших контролируемое сокращение, лиофилизированных при конечных температурах замораживания -40°С со скоростью 0,1°С в минуту, и либо не сшитых, либо сшитых посредством ЭДК, либо сшитых с применением DHT. На Фиг.14С показан репрезентативный гистологический срез, количественно проанализированный на Фиг.14С.На Фиг.14D показан репрезентативный гистологический срез биоинженерной конструкции, доведенной до конечных температур замораживания -10°С со скоростью 0,5°С в минуту. На Фиг.14Е представлены репрезентативные гистологические срезы биоинженерных конструкций, прошедших контролируемое сокращение и затем либо высушенных на воздухе (верхний ряд), либо лиофилизированных при конечной температуре замораживания - 40°С (нижний ряд). На Фиг.14F показаны происходящие из МСК биоинженерные конструкции с естественными порами, тогда как на Фиг.14G показано, что такой средний диаметр пор может быть увеличен лиофилизацией.
На Фиг.15А-15Е показаны эффекты добавления ОФРФ к культуральной среде с заданным химическим составом на биофизические свойства биоинженерных конструкций. На Фиг.15А показано, что добавление ОФРФ уменьшает толщину биоинженерной конструкции. На Фиг.15 В приведены результаты анализа зависимости «доза-эффект» для ОФРФ, где при увеличении количества добавленного ОФРФ уменьшались уровни аккумуляции подтипов коллагена. На Фиг.15С показаны относительные уровни и кислото- и пепсинорастворимого коллагена (выделено черным) относительно общего количества коллагена и другого коллагена (серый). Сульфатированный гликозаминогликан (сГАГ; Фиг.15D) и гиалуроновая кислота (ГК; Фиг.15Е) аккумулировались в биоинженерных конструкциях с добавлением ОФРФ в меньших количествах по сравнению с контролями.
На Фиг.16 показаны фибробласты кожи человека, мигрировавшие через пористые шелковые каркасы и равномерно распределенные по всему указанному шелковому каркасу.
На Фиг.17A-17D показаны окрашенные эндотелиальные клетки пупочной вены человека на пористых шелковых каркасах с девитализированными фибробластами кожи человека и соответствующий внеклеточный матрикс, in vitro. Анализ ангиогенеза in vitro проводили, исследуя упорядочение окрашенных ЭКПВЧ в вариантах реализации с шелковым каркасом. ЭКПВЧ культивировали на шелковых каркасах в течение 11 дней и получали флуоресцентные снимки. Упорядочение ЭКПВЧ не заметно на шелковом каркасе (Фиг.17А) или шелковом каркасе, предварительно кондиционированном в матриксной среде (Фиг.17В), но хорошо выражено в шелковом каркасе с живыми фибробластами кожи человека (ДФЧ) (Фиг.17С) и шелковом каркасе с девитализированными ДФЧ (Фиг.17D).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем документе описаны биоинженерные конструкции, содержащие внеклеточные матриксы (ВКМ), обладающие определенной толщиной, размером пор и составом. Известно, что ВКМ секретируется определенными клетками и состоит в основном из фибриллярных белков, полисахаридов и других неосновных компонентов. В его компоненты входят структурные элементы, такие как коллаген и эластин, адгезивные белки, такие как гликопротеины фибронектин, ламинин, витронектин, тромбоспондин I и танасцины, а также протеогликаны, такие как декорин, бигликан, хондроитинсульфат и гепаринсульфат, и гликозаминогликаны (GAG), такие как гиалуроновая кислота (ГК).
Различные ВКМ могут синтезироваться разными клетками. По сравнению с фибробластами, обнаружено, например, что МСК синтезируют пористый ВКМ. Кроме того, определенные белки, связанные с васкуляризацией (например, ФРЭСα, ФРЭСС, PDGF(ФPT)-β, РЕСАМ1, CDH5, ANGPT1, ММР2, TIMP1, TIMP3), а также определенные факторы роста и адгезивные белки, такие как гиалуронан, гепарин, IL-6 (ИЛ-6), IL-8 (ИЛ-8), витронектин (VTN), колониестимулирующий фактор 3 (КСФ-3), НМКА1, и CXCL1, по-видимому, синтезируются в больших количествах в ВКМ, продуцируемом МСК, по сравнению с продуцируемым фибробластами (см., например, Фиг.7).
Основным преобладающим компонентом внеклеточного матрикса, продуцируемого фибробластами, является фибриллярный коллаген, в частности, коллаген I типа. Однако клетки также продуцируют другие фибриллярные и нефибриллярные
коллагены, включая коллаген типов II, III, IV, V, VI, VII, VIII, IX, X, XI, XII, XIII, XIV, XV, XVI, XVII, XVIII, XIX и другие.
Иерархическая сеть этих компонентов ВКМ обеспечивает естественную среду, в которой клетки могут выжить и нормально функционировать. Условия культивирования клеток и пост-культуральные методы, описанные в настоящем документе, могут быть применены к типам клеток, способным синтезировать и секретировать внеклеточный матрикс для получения биоинженерных конструкций с определенными биофизическими качествами.
I. Контроль толщины биоинженерной конструкции
Толщина ВКМ может быть оптимизирована под конкретное применение in vivo. Например, более толстые биоинженерные конструкции могут подходить для участков организма, испытывающих механические возмущения (например, коленей) или для любых применений, когда необходимо, чтобы конструкция продолжала существование in vivo в течение длительного отрезка времени.
Большая толщина ВКМ обеспечивает связующие тканеподобные свойства, придающие устойчивость к физическим повреждениям, таким как разрывы или растрескивание. Подходящие ВКМ должны иметь толщину по меньшей мере приблизительно 30 мкм, 40 мкм, 50 мкм, 60 мкм, 70 мкм, 80 мкм, 90 мкм, 100 мкм, 110 мкм, 120 мкм, 130 мкм, 140 мкм, 150 мкм, 160 мкм, 170 мкм, 180 мкм, 190 мкм, 200 мкм, 220 мкм, 240 мкм, 260 мкм, 280 мкм, 300 мкм, 320 мкм, 340 мкм, 360 мкм, 380 мкм, 400 мкм, 450 мкм, 500 мкм, 550 мкм, 600 мкм, 650 мкм, 700 мкм, 750 мкм, 800 мкм, 850 мкм, 900 мкм, 950 мкм или большую, для применения в испытаниях или в клинической практике, в тех случаях, когда такие толщины являются подходящими.
а. Биоинженерные конструкции, получаемые из мезенхимальных стволовых клеток (МСК)
Мезенхимальные стволовые клетки (МСК; также известные как мезенхимальные клетки-предшественники) представляют собой клетки, способные расти в культуре и дифференцироваться в мезенхимальные тканевые клетки, в том числе костные, хрящевые, сухожильные, связочные, мышечные, жировые и костномозговой стромы. МСК неэффективно синтезируют, секретируют и/или организуют компоненты внеклеточного матрикса (т.е. продуцирование эндогенного внеклеточного матрикса) при обычных условиях культивирования. В то же время, при условиях культивирования, описанных далее в настоящем документе, они способны существовать в эффективно секретируемом
внеклеточном матриксе без компонентов экзогенного матрикса (т.е. компонентов матрикса, не продуцируемых культивируемьми клетками, а вводимых другими способами).
МСК могут быть получены из нескольких источников, включая, но не ограничиваясь перечисленными, костный мозг, пуповину, плаценту, амнион и другие соединительные ткани (такие как мышцы, жировая ткань, кость, сухожилие и хрящ). Например, пуповинные МСК могут быть выделены из пуповинной крови, субэндотелия пупочной вены и вартонова студня. MCS также могут быть выделены из трех областей: периваскулярной области (пуповинных периваскулярных клеток или UCPVC), межсосудистой области, плаценты, амниона и субамниона (Troyer and Weiss, 2007). Как вариант, происходящие из костного мозга МСК могут быть получены из костного мозга и включают негемопоэтические мультипотентные клетки, поддерживают экспансию гемопоэтических стволовых клеток, и могут дифференцироваться в различные соединительные ткани.
Могут применяться клетки человека, а также клетки других видов млекопитающих, включая, но не ограничиваясь перечисленными, лошадиные, собачьи, свиные, бычьи, овечьи или грызунов (например, мыши или крысы). Указанные клетки могут быть получены как первичные клетки из соответствующих тканей или, более предпочтительно, из серийно пересеваемых клеток либо пересевом из стабилизированных клеточных культур или банков, прошедших скрининг на отсутствие вирусного или бактериального загрязнения и проверку чистоты. Кроме того, в настоящем изобретении также могут применяться клетки, трансфицированные спонтанно, химически или при помощи вирусов, рекомбинантные клетки или генетически сконструированные клетки. Указанные клетки могут также быть рекомбинантными или сконструированными генетически. Например, указанные клетки могут быть сконструированы таким образом, чтобы продуцировать и доставлять рекомбинантные клеточные продукты, такие как факторы роста, гормоны, пептиды или белки, в организм пациента, непрерывно в течение определенного периода времени либо по мере необходимости, в ответ на биологические, химически или температурные сигналы, в зависимости от условий, имеющих место в организме пациента. Конструирование может обеспечить долгосрочную или краткосрочную экспрессию генного продукта. Долгосрочная экспрессия требуется в том случае, если культивируемую тканевую конструкцию имплантируют или применяют у пациента для доставки терапевтических продуктов пациенту непрерывно на протяжении определенного периода времени. В свою очередь, краткосрочная экспрессия требуется в тех случаях, когда после излечения раны генные продукты культивируемого тканевого продукта уже не нужны или
больше не являются желательными на данном участке. Клетки могут также быть генетически сконструированы таким образом, чтобы экспрессировать белки или различные типы компонентов внеклеточного матрикса, либо «нормальные», но интенсивно экспрессируемые, либо модифицированные определенным образом, придающим биоинженерному комплексу, содержащему внеклеточный матрикс и живые клетки, терапевтические преимущества для более успешного излечения ран, облегченной или направленной неоваскуляризации, или минимизации формирования рубцов или келоида.
Для эффективной секреции внеклеточного матрикса нужной толщины МСК могут культивироваться в течение нескольких дней или недель (например, 18, 19, 20, 21, 22, 23, 24, 25 дней или дольше) в среде неопределенного состава или в среде с заданным химическим составом. В системе с заданным химическим составом можно применять полученные от человека клетки, но в ней отсутствуют химически неидентифицированные и полученные не от человека биологические компоненты или клетки. Указанные культуры поддерживают в инкубаторе для обеспечения необходимых для культуры клеток условий среды с контролируемой температурой, влажностью и газовой смесью, отвечающих общеизвестным параметрам среды. Например, в указанном инкубаторе может поддерживаться температура от приблизительно 34°С до приблизительно 38°С (например, 37±1°С), атмосфера с приблизительно 5-10±1% СО2 и относительная влажность (Rh) приблизительно 80-90%. Как вариант, клетки могут культивироваться в условиях гипоксии. Указанные клетки могут временно находиться в условиях обычных комнатных температуры, воздуха и влажности во время подкормки, посева или других манипуляций с клетками.
Независимо от типа клеток культуральная среда состоит из питательной основы, как правило, дополненной другими компонентами. Питательные основы, как правило, содержащие такие питательные вещества, как глюкоза, неорганические соли, источник энергии, аминокислоты и витамины, хорошо известны в области техники культивирования клеток животных. Примеры включают, не ограничиваясь перечисленными, модифицированную по Дульбекко среду Игла (DMEM); минимальную питательную среду (MEM); Ml99; RPMI 1640; среда Дульбекко, модифицированная по способу Исков (EDMEM). Минимальная питательная среда (MEM) и Ml99 требуют дополнительных добавок в виде предшественников фосфолипидов и заменимых аминокислот. Коммерчески доступные обогащенные витаминами смеси, содержащие дополнительные аминокислоты, нуклеиновые кислоты, кофакторы ферментов, предшественники фосфолипидов и неорганические соли, включают среду Хэма F-12
(Ham's F-12), среду Хэма F-10 (Ham's F-10), NCTC 109 и NCTC 135. Могут применяться также смеси указанных сред, например, DMEM и среда Хэма F-12 в соотношении от 3:1 до 1:3, соответственно.
Составы культуральных сред и введение дополнительных средовых добавок для МСК и дополнительных клеточных типов, таких как фибробласты или эпителиальные клетки, могут быть подобраны в соответствии с общеизвестными в данной области техники способами культивирования (см., например, патент США №5712163 Parenteau, международная публикация WO 95/31473, международная публикация WO 00/29553, международная публикация WO 2009/070720, Ham and McKeehan, Methods in Enzymology, 58:44-93 (1979), Bottenstein et al., Meth. Enzym., 58:94-109 (1979); все перечисленные источники включены в настоящий документ во всей полноте посредством данной ссылки). Например, полученные из МСК биоинженерные конструкции могут культивироваться в среде с добавлением агентов, способствующих синтезу и отложению матрикса указанными клетками. Можно применять культуральную среду с заданным химическим составом, свободную от неидентифицированных экстрактов органов или тканей животных, таких как сыворотка, экстракт гипофиза, экстракт гипоталамуса, плацентарный экстракт или эмбриональный экстракт, или белки и факторы, секретируемые питающими клетками. Такие среды могут быть свободны от неидентифицированных компонентов и биологических компонентов, получаемых из животных источников, но не от человека, для уменьшения риска случайного заражения и инфицирования вирусом животного или межвидовым вирусом. Вместо применения таких экстрактов органов или тканей животных могут применяться искусственные или рекомбинантные функциональные эквиваленты.
В ходе настоящего исследования установлено, что трансформирующий фактор роста альфа (ТФР-α), синтезируемый в макрофагах, клетках мозга и кератиноцитах и индуцирующий развитие эпителия, в выраженной степени стимулирует синтез, секрецию и организацию компонентов внеклеточного матрикса клетками МСК. ТФР-α представляет собой небольшой (-50 остатков) белок с 30% структурной гомологией ЭФР и конкурирует за тот же поверхностно-связанный рецепторный сайт. Он задействован в заживлении ран и способствует фенотипическим изменениям определенных клеток. ТФР-α или длинноцепочечный ТФР-α могут быть добавлены в среду в количестве от приблизительно 0,0005 мкг/мл до приблизительно 0,30 мкг/мл, от приблизительно 0,0050 мкг/мл до приблизительно 0,03 мкг/мл, или от приблизительно 0,01 мкг/мл до приблизительно 0,02 мкг/мл. Согласно некоторым вариантам реализации количество добавленного ТФР альфа составляет 10 нг/мл, 20 нг/мл, 30 нг/мл, 40 нг/мл, 50 нг/мл, 60 нг/мл, 70 нг/мл, 80 нг/мл, 90
нг/мл, 100 нг/мл, 120 нг/мл, 130 нг/мл, 140 нг/мл, 150 нг/мл, 160 нг/мл, 170 нг/мл, 180 нг/мл, 190 нг/мл, 200 нг/мл или больше.
Напротив, простагландин Е2 (ПГЕ2) образуется в результате действия простагландин Е-синтаз на простагландин Н2 (PGH2), и авторами обнаружено, что он ингибирует синтез, секрецию и организацию внеклеточных матриксов клетками МСК в том случае, если присутствует в относительно больших концентрациях. Таким образом, добавление ПГЕ2 (например, в форме 16,16-ПГЕ2) можно использовать для регуляции толщины внеклеточного матрикса и может варьировать от приблизительно 0,000038 мкг/мл до приблизительно 0,760 мкг/мл, от приблизительно 0,00038 мкг/мл до приблизительно 0,076 мкг/мл, или приблизительно 0,038 мкг/мл. Согласно некоторым вариантам реализации количество добавленного ПГЕ2 составляет 10 нг/мл, 20 нг/мл, 30 нг/мл, 40 нг/мл, 50 нг/мл, 60 нг/мл, 70 нг/мл, 80 нг/мл, 90 нг/мл, 100 нг/мл, 120 нг/мл, 130 нг/мл, 140 нг/мл, 150 нг/мл, 160 нг/мл, 170 нг/мл, 180 нг/мл, 190 нг/мл, 200 нг/мл или больше.
Сходным образом, в ходе настоящего исследования обнаружено, что основной фактор роста фибробластов (ОФРФ) ингибирует синтез, секрецию и организацию компонентов внеклеточного матрикса клетками, такими как фибробласты. В частности, уровни пепсинорастворимого коллагена, сульфатированных гликозаминогликанов (сГАГ) и гиалуроновой кислоты (А) уменьшаются при увеличении уровней ОФРФ, и уровни каждого компонента могут уменьшаться на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или больше относительно контроля. Такие различия в композиции компонентов внеклеточного матрикса в дальнейшем дают порошковые формы после высушивания на воздухе и легко измельчаемый порошок при лиофилизации. Такие порошковые формы обладают сниженной вязкостью и в результате способны проходить через иглы шприцов калибра 23, 24, 25, 26, 27, 28, 29, 30 или тоньше. Таким образом, для регуляции толщины и состава внеклеточного матрикса можно использовать добавление ОФРФ в количестве от приблизительно 10 нг/мл, 15 нг/мл, 20 нг/мл, 25 нг/мл, 30 нг/мл, 35 нг/мл, 40 нг/мл, 45 нг/мл, 50 нг/мл, 55 нг/мл, 60 нг/мл, 65 нг/мл, 70 нг/мл, 75 нг/мл, 80 нг/мл, 85 нг/мл, 90 нг/мл, 95 нг/мл, 100 нг/мл или более.
Аскорбат или его производное (например, натрия аскорбат, аскорбиновая кислота или одно из более стабильных химически производных, такое как n-гидрат соли магния фосфата L-аскорбиновой кислоты) можно применять в качестве добавки, способствующей гидроксилированию пролина и секреции проколлагена, растворимого предшественника откладываемых молекул коллагена. Аскорбат также повышающе регулирует синтез коллагена I и III типов.
Инсулин может применяться в качестве добавки, способствующей усвоению глюкозы и аминокислот, что обеспечивает долгосрочные преимущества при многократном пересеве. Добавление инсулина или инсулиноподобного фактора роста (ИФР) необходимо для долгосрочного культивирования, так как в этом случае может происходить потеря способности клеток к усвоению глюкозы и аминокислот и деградация клеточного фенотипа. Инсулин может быть получен из животных источников, как, например, бычий, от человека, или при помощи рекомбинантных методов, как, например, рекомбинантный инсулин человека. Соответственно, инсулин человека удовлетворяет критерию компонента с заданным химическим составом, полученного от человека, а не из другого животного биологического источника. Добавление инсулина рекомендовано при серийном культивировании, и его добавляют в среду в широком диапазоне концентраций. Предпочтительным является диапазон концентраций от приблизительно 0,1 мкг/мл до приблизительно 500 мкг/мл, приблизительно 5 мкг/мл - приблизительно 400 мкг/мл, и приблизительно 375 мкг/мл. Подходящие концентрации при добавлении инсулиноподобного фактора роста, такого как ИФР-1 ИФР-2, и т.п., могут быть легко определены специалистом в данной области техники для типов клеток, выбранных для культивирования.
Трансферрин может применяться в качестве добавки для регуляции транспорта железа. Железо представляет собой важный следовой элемент, обнаруживаемый в сыворотке, но в больших количествах оно может быть токсичным в отсутствие хелатирования трансферрином. Трансферрин может добавляться в диапазоне концентраций от приблизительно 0,05 до приблизительно 50 мкг/мл или приблизительно 5 мкг/мл.
Трийодтиронин (Т3) можно применять в качестве добавки для регуляции клеточного метаболизма и может добавляться в диапазоне концентраций от приблизительно 0 до приблизительно 400 рМ, от приблизительно 2 до приблизительно 200 рМ, или в концентрации приблизительно 20 рМ.
Этаноламин или о-фосфорил-этаноламин, либо и тот, и другой, представляющие собой фосфолипиды, могут применяться в качестве добавки, способствующей синтезу жирных кислот, в частности, при культивировании в бессывороточной среде. Этаноламин и о-фосфорил-этаноламин могут добавляться в диапазоне концентраций от приблизительно 10-6 до приблизительно 10-2 М или приблизительно 1×10-4 М.
Селенистую кислоту можно применять в качестве добавки, обеспечивающей наличие указанного следового элемента в бессывороточной среде. Селенистая кислота
может добавляться в диапазоне концентраций от приблизительно 10-9 М до приблизительно 10-7М, или приблизительно 5,3×10-8М.
Добавление аминокислот может экономить энергию клеток за счет освобождения клеток от необходимости синтезировать эти составляющие элементы белков. Например, могут быть добавлены пролин и глицин, а также гидроксилированная форма пролина, гидроксипролин, представляющие собой основные аминокислоты, составляющие структуру коллагена. Кроме того, аминокислота L-глутамин присутствует в некоторых питательных основах и может быть добавлена в тех случаях, когда она отсутствует или ее количество недостаточно. L-глутамин может также быть добавлен в виде стабильной формы, такой как продаваемая под маркой GlutaMAX-1™ (Gibco BRL, Grand Island, NY). GlutaMAX-1™ представляет собой стабильную дипептидную форму b-аланил-L-глутамина, может применяться наравне с L-глутамином и добавляется в эквимолярных концентрациях в качестве заменителя L-глутамина. Во время хранения и при инкубации указанный дипептид предохраняет L-глутамин от разложения, которое может приводить к нестабильности эффективной концентрации L-глутамина в среде. Как правило, в основную среду добавляют предпочтительно от приблизительно 1 мМ до приблизительно 6 мМ, более предпочтительно - от приблизительно 2 мМ до приблизительно 5 мМ, и наиболее предпочтительно - 4 мМ L-глутамина или GlutaMAX-l™.
Для достижения определенных показателей культуры могут также применяться дополнительные добавки, такие как один или более простагландин, трансформирующие факторы роста (включая трансформирующие факторы роста альфа или бета), фактор роста кератиноцитов (ФРК), фактор роста соединительной ткани (ФРСТ), манноза-6-фосфат (М6Ф) или их комбинации. Например, известно, что и ТФР-β1, и ТАП повышающе регулируют синтез коллагена (Raghow et al., J.Clin. Invest., 79:1285-1288 (1987) и Pardes et al., J.Invest. Derm., 100:549 (1993)).
Кроме того, эпидермальный фактор роста (ЭФР) может применяться в качестве добавки, способствующей установлению культуры за счет роста и заселения клеток. Можно применять нативную или рекомбинантную форму ЭФР. Формы ЭФР человека, нативные или рекомбинантные, предпочтительны для применения в среде при получении эквивалента кожи, не содержащего полученные не от человека биологические компоненты. ЭФР представляет собой необязательный компонент и может быть добавлен в концентрации приблизительно от 1 до 15 нг/мл или приблизительно от 5 до 10 нг/мл.
Гидрокортизон можно применять в качестве добавки, способствующей формированию фенотипа кератиноцитов и, соответственно, усиливающей признаки дифференцировки, такие как содержание инволюкрина и трансглутаминазы
кератиноцитов (Rubin et al., J.Cell Physiol., 138:208-214 (1986)). Таким образом, гидрокортизон представляет собой желательную добавку в тех случаях, когда такие свойства полезны, например, при формировании графтов из пласта кератиноцитов или кожных конструкций. Гидрокортизон может добавляться в диапазоне концентраций от приблизительно 0,01 мкг/мл до приблизительно 4,0 мкг/мл или приблизительно от 0,4 мкг/мл до 16 мкг/мл.
Фактор роста кератиноцитов (ФРК) можно применять в качестве добавки для поддержки эпидермизации в диапазоне от приблизительно 0,001 мкг/мл до приблизительно 0,150 мкг/мл, от приблизительно 0,0025 мкг/мл до приблизительно 0,100 мкг/мл, от приблизительно 0,005 мкг/мл до приблизительно 0,015 мкг/мл, или 5 мкг/мл.
Манноза-6-фосфат (М6Ф) можно применять в качестве добавки для поддержки эпидермизации в концентрации от приблизительно 0,0005 мг/мл до приблизительно 0,0500 мг/мл.
Нейтральные полимеры могут применяться в качестве добавки, стимулирующей стабильность образования и отложения коллагена между образцами. Например, известно, что полиэтиленгликоль (ПЭГ) in vitro способствует переходу растворимого предшественника проколлагена, продуцируемого культивируемыми клетками, в откладывающуюся в матриксе форму коллагена. ПЭГ для тканевых культур добавляется в диапазоне от приблизительно 1000 до приблизительно 4000 MW (молекулярный вес), приблизительно 3400 - приблизительно 3700 MW, приблизительно 5% по весу или менее, от приблизительно 0,01% по весу до приблизительно 0,5% по весу, от приблизительно 0,025% по весу до приблизительно 0,2% по весу, или приблизительно 0,05% по весу. Другие нейтральные полимеры для культур, такие как декстран, предпочтительно декстран Т-40, или поливинилпирролидон (ПВП), предпочтительно в диапазоне 30000-40000 MW, могут также применяться в концентрациях приблизительно 5% по весу или меньших, от приблизительно 0,01% по весу до приблизительно 0,5% по весу, от приблизительно 0,025% по весу до приблизительно 0,2% по весу, или приблизительно 0,05% по весу. Другие агенты для клеточных культур и совместимые с клетками агенты, стимулирующие образование и отложение коллагена, хорошо известны специалистам в данной области техники.
Культуральные подложки и/или перфузия
Высевание клеток на пористую мембрану (т.е. культуральный вкладыш) определенного диаметра может способствовать увеличению толщины биоинженерной конструкции, увеличивая скорость продуцирования внеклеточного матрикса за счет
максимизации площади поверхности с доступом к питательным веществам из культуральной среды. Поры проходят и через верхнюю, и через и нижнюю поверхности мембраны, обеспечивая либо двусторонний контакт среды с развивающейся тканевой конструкцией, либо контакт только с нижней стороны культуры. Среда может также контактировать только с нижней стороной формирующегося из культивируемой ткани конструкции, так что верхняя сторона может контактировать с воздухом, как в случае получения культивируемой кожной конструкции. Как правило, указанная мембрана крепится к одному концу трубчатого элемента или каркаса, который вставляется внутрь и соединяется с основой, такой как чашка Петри или чашка для культивирования, которая может быть накрыта крышкой. Если используют указанные типы сосудов для культивирования, тканевая конструкция формируется с одной стороны мембраны {например, с верхней стороны) и культура контактирует со средой и с нижней, и с верхней поверхности. Размеры пор достаточно малы для того, чтобы не позволять прорастания клеток через мембрану, но достаточно велики для свободного перемещения питательных веществ, содержащихся в культуральной среде, к нижней поверхности указанной биоинженерной конструкции, например, за счет капилл