Способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9н-ксантен-2-карбоновых кислот и их цитотоксическая активность
Иллюстрации
Показать всеИзобретение относится к органической и медицинской химии, а именно: к способу получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот общей формулы I, где: R=СН3О (Ia); R=СН3 (Iб); R=Н (Iв); R=Br (Iг); R=Сl (Iд), путем взаимодействия 6-замещенных 3-(4-оксо-4Н-хромен-3-ил)акриловых кислот, где заместители имеют вышеуказанные значения, с енамином N-(2-метилпроп-1-енил)пирролидином при температуре от 20 до 80°С в течение от 0,5 до 4 часов в присутствии катализатора нитрата лантана (III) в количестве от 0 до 20 мол. % в среде растворителя, выбранного из группы: дихлорметан, этилацетат или ацетонитрил и N-(2-метилпроп-1-енил)пирролидин используют в 10-100% избытке по отношению к акриловым кислотам, с последующей кристаллизацией целевого продукта при подкислении реакционной массы. Технический результат достигается за счет сокращения времени процесса, замены высокотоксичного растворителя и упрощения технологии выделения целевых соединений, проявляющих цитотоксическую активность. 1 з.п. ф-лы, 1 табл., 6 пр.
Реферат
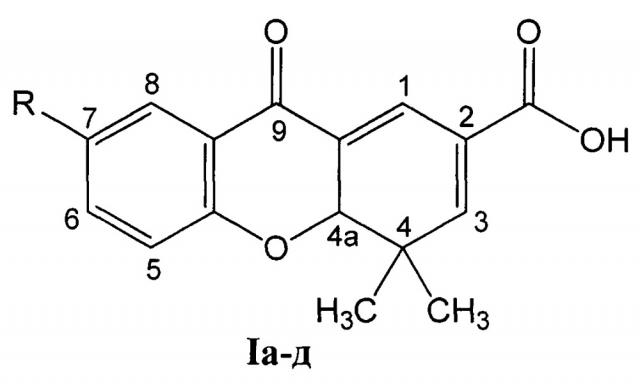
Изобретение относится к области органической и медицинской химии, а именно: к способу получения ряда полифункциональных гетероциклических соединений - 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9Н-ксантен-2-карбоновых кислот Ia-д и их цитотоксической активности, которые могут быть использованы в органическом синтезе и в медицине в качестве потенциальных противоопухолевых средств.
где:
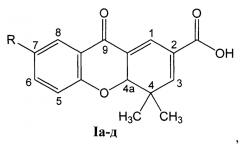
R=СН3О (Iа - 4,4-диметил-7-метокси-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=СН3 (1б - 4,4,7-триметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Н (Iв - 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Br (Iг - 7-бром-4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Cl (Iд - 4,4-диметил-9-оксо-7-хлор-4,4а-дигидро-9H-ксантен-2-карбоновая кислота).
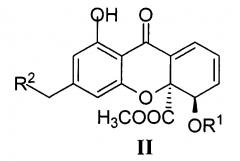
Структурное сходство соединений Ia-д с известными 4,4а-дигидроксантонами природного происхождения - нидулалинами II, обладающими цитотоксическими свойствами [Sato, S. Syntheses of novel antitumor dihydroxanthone derivates with inhibitory activity against DNA topoisimerase II / S. Sato, Y. Sato, T. Yoshimura, et al. // Bioorganic & Medicinal Chemistry Letters. - 1999. - Vol. 9. - P. 2653-2656], делает данный класс соединений перспективным для поиска новых противоопухолевых агентов.
R1 = Н, Ac; R2=Н, ОН
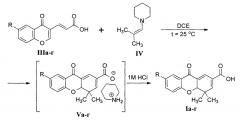
В научно-технической литературе представлен единственный метод синтеза 4,4а-дигидроксантонов Ia-г [Палев, Н.А. Бензо-γ-пиронил-3-винилкарбоновые кислоты в реакции Дильса-Альдера / Н.А. Палев, Н.М. Чернов, Р.В. Шутов и др. // Бутлеровские сообщения. - 2013. - Т. 35. - №9. - С. 28-31]. Реакцию проводили путем взаимодействия 6-замещенных 3-(4-оксо-4Н-хромен-3-ил)акриловых кислот IIIа-г с N-(2-метилпроп-1-енил)пиперидином IV, используемых авторами в мольном отношении 1:1,5, в среде 1,2-дихлорэтана (DCE) при 25°С с последующим многостадийным выделением целевого продукта из промежуточно образующихся солей Va-г:
R=CH3O (a), CH3 (б), H (в), Br (г)
Несмотря на то, что авторы данного метода указывают хороший (78,1-81,3%) выход 4,4а-дигидроксантонов Ia-г, у имеющегося способа существуют следующие недостатки:
- Длительность процесса. Так, в случае получения 7-метокси- и 7-метилпроизводных Iа и Iб длительность процесса составляет более 7 суток.
- Применение высокотоксичного растворителя 1 класса опасности - 1,2-дихлорэтана [ОФС.1.1.0008.15 Остаточные органические растворители // Государственная фармакопея Российской Федерации. XIII издание. - 2015. - Том 1. - Режим доступа: http://193.232.7.120/feml/clinical_ref/pharmacopoeia_1/HTML. - С. 187-191], что влияет на безопасность получаемых продуктов и затрудняет их использование в качестве потенциальных биологически активных веществ.
- Сложная технология выделения целевых продуктов из реакционной массы, включающая замену исходного растворителя на ацетонитрил для кристаллизации соединений Iа-г.
Таким образом, задачей предлагаемого изобретения является разработка более эффективного и безопасного метода синтеза 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот Ia-д, что позволит расширить ассортимент потенциальных противоопухолевых средств.
Техническими результатами, на решение которых направлено изобретение, являются эффективный и безопасный способ получения заявляемых веществ за счет сокращения времени процесса, замены не рекомендуемого к использованию в фармацевтической промышленности высокотоксичного растворителя и упрощения технологии выделения гетероциклических соединений формулы Ia-д, проявляющих цитотоксическую активность.
Задача решается тем, что разработан способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот общей формулы I
где:
R=СН3О (Iа - 4,4-диметил-7-метокси-9-оксо-4,4а-дигидро-9H ксантен-2-карбоновая кислота);
R=СН3 (Iб - 4,4,7-триметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Н (Iв - 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Br (Iг - 7-бром-4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Сl (Iд - 4,4-диметил-9-оксо-7-хлор-4,4а-дигидро-9H-ксантен-2-карбоновая кислота), путем взаимодействия 6-замещенных 3-(4-оксо-4Н-хромен-3-ил)акриловых кислот, где R имеет вышеуказанные значения, с енамином, отличается тем, что в качестве енамина используют N-(2-метилпроп-1-енил)пирролидин, реакцию ведут при температуре от 20 до 80°С в течение от 0,5 до 4 часов в присутствии катализатора нитрата лантана (III) в количестве от 0 до 20 мол. % в среде растворителя, выбранного из группы: дихлорметан, этилацетат или ацетонитрил, N-(2-метилпроп-1-енил)пирролидин используют в 10-100% избытке по отношению к акриловым кислотам, а целевой продукт кристаллизуется при подкислении реакционной массы.
Задача решается также тем, что разработан способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот по п. 1 общей формулы I, обладающих цитотоксической активностью, где R имеет вышеуказанные значения.
В ходе оптимизации имеющего способа синтеза 4,4а-дигидроксантонов Ia-д был разработан двухстадийный метод их получения по следующей схеме:
R=СН3O (а), СН3 (б), Н (в), Br (г), Сl (д)
В отличие от представленного в научно-технической литературе метода разработанный способ обеспечивает:
- Технологически приемлемую продолжительность процесса. В зависимости от заместителя R, температуры проведения синтеза (от 20 до 80 °С) и количества используемого нитрата лантана (III) La(NO3)3 (кислота Льюиса, применяемая в качестве катализатора в количестве от 0 до 20 мол. %) время прохождения реакции составляет от 0,5 до 4 часов. Сокращению времени синтеза также способствует замена N-(2-метилпроп-1-енил)пиперидина IV на более реакционноспособный N-(2-метилпроп-1-енил)пирролидин VI, используемый в 10-100% избытке по отношению к акриловым кислотам IIIа-д.
- Безопасность получаемого продукта из-за исключения из схемы высокотоксичного 1,2-дихлорэтана. В качестве растворителя (solvent) в описываемом способе выступают дихлорметан (наиболее предпочтителен), этилацетат или ацетонитрил в количестве от 1 до 5 мл на 1 ммоль исходной акриловой кислоты IIIа-д, наиболее предпочтительно - от 2 до 3 мл растворителя на 1 ммоль соединения IIIа-д.
- Простоту выделения целевых продуктов. После окончания процесса реакционная масса подкисляется добавлением 0,1-4,0 М (наиболее предпочтительно 1,0-2,0 М) соляной кислоты, при этом 4,4а-дигидроксантоны Ia-д кристаллизуются с выходом 74-82%.
Параметры процесса, а именно температура, растворитель, количество катализатора и избыток реагента VI? выбираются исходя из удобства проведения синтеза и строения субстрата IIIа-д. Так, реакционная способность акриловых кислот IIIа, б при наличии в них электронодонорных заместителей (МеО (а) и Me (б)) значительно падает, что обуславливает необходимость проведения синтеза 4,4а-дигидроксантонов Iа и Iб при 60-80°С (при этом неприемлемо использование легкокипящего дихлорметана и в качестве растворителя выбираются этилацетат или ацетонитрил) с добавлением 15-20 мол. % нитрата лантана и 1,5-2,0 эквивалентов енамина VI на 1 эквивалент акриловой кислоты, при этом длительность процесса составляет 1-2 часа. В то же время получение 7-галогензамещенных 4,4а-дигидроксантонов Iг, д из реакционноспособных кислот IIIг, д гладко протекает в дихлорметане при 35-40°С без добавления катализатора за 4 часа или при 20°С с добавлением 10 мол. % нитрата лантана за 0,5 часа.
Разработанный способ получения 4,4а-дигидроксантонов Ia-д изучен и проверен в лабораторных условиях. Структура и чистота полученных продуктов установлены методами спектроскопии ЯМР 1Н, 13С и масс-спектрометрии высокого разрешения (HRMS-ESI).
Биологические испытания 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9Н-ксантен-2-карбоновых кислот Ia-д показали наличие у них цитотоксической активности в отношении линии клеток карциномы молочной железы MCF-7.
Предлагаемое изобретение проиллюстрировано примерами практического осуществления.
Пример 1. Получение 4,4-диметил-7-метокси-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновой кислоты (Iа).
В круглодонную колбу, снабженную термометром и обратным холодильником, помещают 30 мл этилацетата, 4,9 г (20 ммоль) акриловой кислоты IIIа, 5,0 г (40 ммоль, 100% избыток) енамина VI и 2,2 г (5 ммоль, 20 мол. %) нитрата лантана (в виде гексагидрата). Реакционную смесь нагревают при 75-80°С в течение 1-1,5 часов, конец реакции определяют по ТСХ (этилацетат, проявление в УФ свете). Затем массу охлаждают и по каплям прибавляют 1 М соляную кислоту до рН<2 в водном слое, после чего перемешивают 30 минут при 20-25°С и отфильтровывают выпавший осадок 4,4а-дигидроксантона Iа. Продукт сушат на воздухе, получая 4,5 г (74%, считая на кислоту IIIа) желто-зеленых кристаллов с температурой плавления 214-216°С.Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1,04 (с, 3Н, Me), 1,44 (с, 3Н, Me), 3,77 (с, 3Н, МеО), 5,20 (дд, J=1,5, 3,0 Гц, 1Н, С4аН), 7,04 (д, J=9,0 Гц, 1Н, С5Н), 7,06 (т, J=1,5 Гц, 1Н, С3Н), 7,21 (дд, J=3,0, 9,0 Гц, 1H, С6Н), 7,23 (д, J=3,0 Гц, 1Н, С8Н), 7,31 (дд, J=1,5, 3,0 Гц, 1H, С1Н), 13,04 (уш.с, 1Н, СООН). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 17,53, 25,88, 38,62, 56,00, 81,71, 108,07, 120,15, 121,60, 125,36, 126,36, 126,81, 130,54, 152,73, 154,50, 155,00, 165,89, 179,22. Масс-спектр HRMS-ESI: m/z вычислено для C17H15O5 [М-Н]- 299,0925, найдено 299,0926.
Пример 2. Получение 4,4,7-триметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновой кислоты (Iб).
В круглодонную колбу, снабженную термометром и обратным холодильником, помещают 20 мл дихлорметана, 4,6 г (20 ммоль) акриловой кислоты IIIб, 3,8 г (30 ммоль, 50% избыток) енамина VI и 1,3 г (3 ммоль, 15 мол. %) гексагидрата нитрата лантана. Реакционную смесь нагревают при 35-40°С в течение 3-4 часов, конец реакции определяют по ТСХ (этилацетат, проявление в УФ свете). Затем массу охлаждают и по каплям прибавляют 1 М соляную кислоту до рН<2 в водном слое, после чего перемешивают 30 минут при 20-25°С и отфильтровывают выпавший осадок 4,4а-дигидроксантона Iб. Продукт сушат на воздухе, получая 4,6 г (81%, считая на кислоту IIIб) бледно-желтых кристаллов с температурой плавления 225-226°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1,02 (с, 3Н, Me), 1,42 (с, 3Н, Me), 2,26 (с, 3Н, Me), 5,17 (с, 1H, С4аН), 6,94 (д, J=8,3 Гц, 1Н, С5Н), 7,03 (с, 1Н, С3Н), 7,29 (с, 1Н, С1Н), 7,36 (д, J=8,3 Гц, 1Н, С6Н), 7,58 (с, 1Н, С8Н), 13,00 (уш.с, 1Н, СООН). Спектр ЯМР 13С (100 MГц, ДМСО-d6): δС (м.д.) 17,47, 20,44, 25,87, 38,60, 81,82, 118,47, 121,13, 126,39, 126,74, 126,78, 130,61, 131,48, 137,73, 152,55, 158,53, 165,85, 179,25. Масс-спектр HRMS-ESI: m/z вычислено для С17Н15O4 [М-Н]- 283,0976, найдено 283,0981.
Пример 3. Получение 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновой кислоты (Iв).
В круглодонную колбу, снабженную термометром и обратным холодильником, помещают 25 мл ацетонитрила, 4,3 г (20 ммоль) акриловой кислоты IIIв, 3,8 г (30 ммоль, 50% избыток) енамина VI и 0,87 г (2 ммоль, 10 мол. %) гексагидрата нитрата лантана. Реакционную смесь нагревают при 60-65°С в течение 2-3 часов, конец реакции определяют по ТСХ (этилацетат, проявление в УФ свете). Затем массу охлаждают и по каплям прибавляют 1 М соляную кислоту до рН<2 в водном слое, после чего перемешивают 30 минут при 20-25°С и отфильтровывают выпавший осадок 4,4а-дигидроксантона Iв. Продукт сушат на воздухе, получая 4,1 г (77%, считая на кислоту IIIв) бледно-желтых кристаллов с температурой плавления 186-188°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1,06 (с, 3Н, Me), 1,46 (с, 3Н, Me), 5,33 (дд, J=1,6, 3,1 Гц, 1Н, С4аН), 7,07 (т, J=1,6 Гц, 1Н, С3Н), 7,09 (д, J=8,5 Гц, 1Н, С5Н), 7,12 (т, J=7,5 Гц, 1Н, С7Н), 7,33 (дд, J=1,6, 3,1 Гц, 1Н, С1Н), 7,59-7,63 (м, 1Н, С6Н), 7,83 (дд, J=1,8, 7,8 Гц, 1Н, С8Н), 13,05 (уш.с, 1H, СООН). Спектр ЯМР, 13С (100 МГц, ДМСО-d6): δС (м.д.) 17,51, 25,87, 38,67, 81,99, 118,73, 121,46, 122,51, 126,36, 126,88, 127,34, 130,52, 136,96, 152,79, 160,52, 165,87, 179,36. Масс-спектр HRMS-ESI: m/z вычислено для C16H14O4 [М-Н]- 269,0819, найдено 269,0832.
Пример 4. Получение 7-бром-4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновой кислоты (Iг).
В круглодонную колбу, снабженную термометром и обратным холодильником, помещают 20 мл дихлорметана, 5,9 г (20 ммоль) акриловой кислоты IIIг и 3,0 г (24 ммоль, 20% избыток) енамина VI. Реакционную смесь нагревают при 35-40°С в течение 3-4 часов, конец реакции определяют по ТСХ (этилацетат, проявление в УФ свете). Затем массу охлаждают и по каплям прибавляют 1 М соляную кислоту до рН<2 в водном слое, после чего перемешивают 30 минут при 20-25°С и отфильтровывают выпавший осадок 4,4а-дигидроксантона Iг. Продукт сушат на воздухе, получая 5,6 г (80%, считая на кислоту IIIг) желтых кристаллов с температурой плавления 246-247°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1,05 (с, 3Н, Me), 1,44 (с, 3Н, Me), 5,32 (д, J=2,8 Гц, 1Н, С4аН), 7,05-7,08 (м, 2Н, С3Н, С5Н), 7,32 (д, J=2,8 Гц, 1Н, С1Н), 7,71 (дд, J=2,2, 8,8 Гц, 1Н, С6Н), 7,84 (д, J=2,2 Гц, 1H, С8Н), 13,05 (уш.с, 1Н, СООН). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δC (м.д.) 17,50, 25,79, 38,68, 82,32, 114,06, 121,36, 122,84, 126,35, 127,73, 129,22, 129,62, 139,13, 153,03, 159,50, 165,74, 178,22. Масс-спектр HRMS-ESI: m/z вычислено для C16H13BrO4 [М-Н]- 346,9924, найдено 346,9935.
Пример 5. Получение 4,4-диметил-9-оксо-7-хлор-4,4а-дигидро-9H-ксантен-2-карбоновой кислоты (Iд).
В круглодонную колбу, снабженную термометром и обратным холодильником, помещают 20 мл дихлорметана, 5,0 г (20 ммоль) акриловой кислоты IIIд, 2,8 г (22 ммоль, 10% избыток) енамина VI и 0,87 г (2 ммоль, 10 мол. %) гексагидрата нитрата лантана. Реакционную смесь выдерживают при 20-25°С в течение 0,5-1 часа, конец реакции определяют по ТСХ (этилацетат, проявление в УФ свете). Затем массу охлаждают и по каплям прибавляют 1 М соляную кислоту до рН<2 в водном слое, после чего перемешивают 30 минут при 20-25°С и отфильтровывают выпавший осадок 4,4а-дигидроксантона Iд. Продукт сушат на воздухе, получая 5,0 г (82%, считая на кислоту IIIд) желтых кристаллов с температурой плавления 243-245°С. Спектр ЯМР 1Н (400 МГц, ДМСО-d6): δH (м.д.) 1,05 (с, 3Н, Me), 1,44 (с, 3Н, Me), 5,33 (дд, J=1,5, 3,0 Гц, 1Н, С4аН), 7,08 (т, J=1,5 Гц, 1Н, С3Н), 7,13 (д, J=8,8 Гц, 1Н, С5Н), 7,33 (дд, J=1,5, 3,0 Гц, 1Н, С1Н), 7,61 (дд, J=2,8, 8,8 Гц, 1H, С6Н), 7,72 (д, J=2,8 Гц, 1H, С8Н), 13,07 (уш.с, 1Н, СООН). Спектр ЯМР 13С (100 МГц, ДМСО-d6): δС (м.д.) 17,50, 25,80, 38,68, 82,32, 121,06, 122,36, 126,15, 126,35, 126,53, 127,71, 129,66, 136,39, 153,02, 159,12, 165,75, 178,34. Масс-спектр HRMS-ESI: m/z вычислено для С16Н13СlO4 [М-Н]- 303,0430, найдено 303,0444.
Пример 6. Цитотоксическая активность 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот (Iа-д).
Цитотоксическую активность соединений Ia-д исследовали на клеточной линии карциномы молочной железы MCF-7 (АТСС НТВ-22) с помощью МТТ-теста [Руководство по проведению доклинических исследований лекарственных средств. Часть первая / под. ред. А.Н. Миронова. - М.: Гриф и К, 2012. - 944 с.]. Тест основан на ферментативном (митохондриальном) восстановлении бромида 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия (МТТ) с образованием окрашенных кристаллов формазана.
Клеточную линию выращивали в среде DMEM/F-12 с добавлением 10% бычьей эмбриональной сыворотки, 1% L-глутамина, 50 Е/мл пенициллина и 50 мкг/мл стрептомицина при 37°С и содержании СО2 5% в течение 24 часов. Затем суспензию клеток (100 мкл) с концентрацией 5⋅104 клеток/мл помещали в лунки 96-луночных микропланшетов и инкубировали 1 час при 37°С, после чего в каждую лунку добавляли исследуемые соединения Ia-д или препарат сравнения – фторурацил - в концентрациях 0,0625-256 мкг/мл и инкубировали в течение 48 часов при тех же условиях. По окончании инкубации в каждую лунку добавляли по 30 мкл раствора МТТ (5 мг/мл в фосфатно-солевом буфере) и инкубировали еще в течение 2 часов. Затем осторожно удаляли среду из лунок и добавляли по 100 мкл диметилсульфоксида (ДМСО) для растворения синих кристаллов формазана. Оптическую плотность полученных растворов определяли на планшетном ридере Infinite® 200 PRO (производитель Tecan Trading AG). Из величины оптической плотности, измеренной при 540 нм, вычитали для коррекции фона оптическую плотность, измеренную при 690 нм. Исходя из полученных зависимостей доза-эффект (7 концентраций в трех повторяемостях, р<0,0001) были определены полуингибирующие концентрации IC50, представленные в таблице 1.
Из результатов исследования цитотоксической активности следует, что значения IC50 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот Ia-д значительно меньше аналогичной концентрации препарата сравнения - фторурацила, что говорит о перспективности данной группы соединений для применения их в качестве потенциальных противоопухолевых средств.
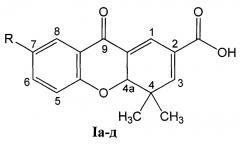
1. Способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот общей формулы I
, где:
R=CH3O (Ia - 4,4-диметил-7-метокси-9-оксо-4,4а-дигидро-9H ксантен-2-карбоновая кислота);
R=СН3 (Iб - 4,4,7-триметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Н (Iв - 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Br (Iг - 7-бром-4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновая кислота);
R=Cl (Iд - 4,4-диметил-9-оксо-7-хлор-4,4а-дигидро-9H-ксантен-2-карбоновая кислота), путем взаимодействия 6-замещенных 3-(4-оксо-4Н-хромен-3-ил)акриловых кислот, где заместители имеют вышеуказанные значения, с енамином, отличающийся тем, что в качестве енамина используют N-(2-метилпроп-1-енил)пирролидин, реакцию ведут при температуре от 20 до 80°С в течение от 0,5 до 4 часов в присутствии катализатора нитрата лантана (III) в количестве от 0 до 20 мол. % в среде растворителя, выбранного из группы: дихлорметан, этилацетат или ацетонитрил, N-(2-метилпроп-1-енил)пирролидин используют в 10-100% избытке по отношению к акриловым кислотам, а целевой продукт кристаллизуется при подкислении реакционной массы.
2. Способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9H-ксантен-2-карбоновых кислот по п. 1 общей формулы I, обладающих цитотоксической активностью, где R имеет вышеуказанные значения.