Дихлорид ди(фенилацетонитрил) палладия и способ его получения
Иллюстрации
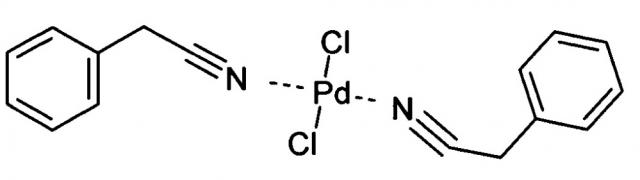
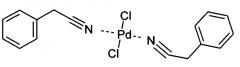
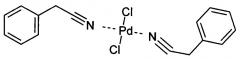
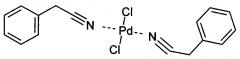
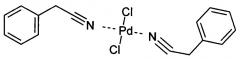
Показать всеИзобретение относится к палладиевому комплексу, а именно к дихлориду ди(фенилацетонитрил)палладия. Комплекс имеет структурную формулу:
Также предложен способ его получения. Данный палладиевый комплекс может быть применен в качестве катализатора в органическом синтезе. 2 н. и 3 з.п. ф-лы, 1 ил., 2 пр.
Реферат
Предлагаемое изобретение относится к каталитической химии и химии комплексных соединений и непосредственно касается палладиевых комплексов, а именно дихлорида ди(фенилацетонитрил) палладия, который может быть применен в качестве катализатора в органическом синтезе, в электротехнической области, в медицине, для обезвреживания токсичных отходов.
Как известно, комплексные соединения платиновых металлов, к которым относится и палладий, широко применяются в различных областях науки и техники. Широкое распространение комплексные соединения платиновых металлов получили благодаря наличию у них каталитической активности. Известно применение данных соединений в качестве катализаторов: в органическом синтезе для проведения различных процессов, таких как гидрирование, окисление, образование углерод-углеродных связей; при получении защитных покрытий; для фотокаталитического обезвреживания токсичных отходов; в составе сенсоров; для изготовления токопроводящих структур [Sing K.S.W., Everett D.Н., Haul R.A.W. at all, «Handbook of Heterogeneous Catalysis», Wiley-VCH Verlag GmbH & Co, Weinheim, 2008; Tsvetkova I.В., Matveeva V.G., Doluda V.Y. at all. J. Mater. Chem, 2012, 22, 6441-6448; Kraus, M. and Tomanova, D. (1974), Polymeric nitrile-palladium chloride complexes and their reaction with olefins. J. Polym. Sci. Polym. Chem. Ed., 12: 1781-1785; RU 2044738, B01J 23/44, 1995].
Поскольку соединения платины очень дорогие, то из экономических соображений в ряде случаев осуществляется замена платиновых комплексных соединений на более дешевые палладиевые комплексы, как, например, в системах нейтрализации отработавших газов ДВС.
Кроме того, известно, что комплексные соединения палладия могут быть использованы как гомогенные катализаторы для органического синтеза, а также в качестве исходных материалов при получения наночастиц металлического палладия, имеющих широкий спектр применения [Elson К.Е., Jenkins I.D., Loughlin W.A. Tetrahedron Lett., 2004, 45, 2491; Mansour A., Portnoy M., Mol J. Catal. A: Chem., 2006, 250, 40; Bergbreiter D.E., Kippenberger A.M., Tao G. Chem. Commun., 2002, 18, 2158].
При анализе достигнутого уровня техники по предлагаемому объекту особый интерес представляют комплексные соединения палладия, образуемые с химическими соединениями, содержащими кратные связи, например, содержащими этиленовые, ацетиленовые, нитрильные и изонитрильные фрагменты в составе молекулы, с которыми палладий образует устойчивые соединения [Y. Zhang, Z. Yuan, and R.J. Puddephatt, Chem. Mater. 1998, 10, 2293-2300; Y.-L. Tung, W.-C. Tseng, C.-Y. Lee, P.-F. Hsu, Y. Chi, S,-M. Peng, and G.-H. Lee, Organometallics 1999, 18, 864-869; Z. Yuan and R.J. Puddephatt, Adv. Mater. 1994, 6(1), 51-54; «Palladium(II) and Platinum(II) Complexes Featuring a Nitrile-Functionalized N-Heterocyclic Carbene Ligand Wylie W.N.O, Alan J. Lough and Robert H, Organometallics, 2010, 29 (3), pp 570-581; US 7531458, C07F 5/00, 2008].
Известно, что комплексные соединения такого типа нередко обладают высокой растворимостью в органических средах, что позволяет получать дисперсные системы, содержащие наночастицы палладия. Такие системы применяются в качестве катализаторов в органическом синтезе.
Особый интерес для настоящего объекта представляют известные нитрильные комплексные соединения палладия, которые по совокупности химических и физических свойств соответствуют требованиям, предъявляемым к катализаторам, поскольку эти вещества устойчивы при хранении, обладают хорошей растворимостью в органических средах.
Каталитическая активность этих соединений палладия, например, в реакции нуклеофильного замещения ароматических галогенидов различными функциональными группами, описана в известных публикациях [Sonogashira K. Et, at all. Convent synthesis of acetylenes// Tetrahedron Letters. - 1975, vol. 16, №50. pp. 4467-4470; hhtps//www.nobelprize.org./nobelprizes/chemistry/laureates/2010.pdf; Смит В.А. Дильман А.Г., Основы современного органического синтеза. М.: Бином. Лаборатория знаний, 2009, с. 126-129].
Исходными продуктами для получения нитрильных комплексов металлов платиновой группы, в частности палладия, могут быть соли палладия и соответствующие нитрилы [Черняев, И.И. Синтез комплексных соединений металлов платиновой группы Справочник, Издательство: Л.: Наука 340 с.; 1964 г.]. Однако этот метод синтеза очень длителен, а конечные продукты получаются с низкими выходами, редко превышающими 30%, что связанно с низкой растворимостью нитрилов в водной среде и протеканием побочных реакций.
В качестве исходного продукта используется также металлический палладий, как, например, в известном способе получения бис(ацетонитрил)палладий дихлорида [US 5681976, С07 15/00, 1997; WO 1997006175], обладающего каталитической активностью. Комплекс получают в 2 стадии: сначала получают тетрахлорпалладиевую кислоту взаимодействием палладия с концентрированной соляной кислотой и хлором, а затем осуществляют взаимодействие данной кислоты с ацетонитрилом.
Для расширения ассортимента комплексных соединений палладия, обладающих высокой растворимостью в органических соединениях, устойчивых при хранении и обладающих высокими каталитическими свойствами, предлагается новое соединение - дихлорид ди(фенилацетонитрил)палладия, обладающий каталитической активностью и способ его получения.
Новое соединение - дихлорид ди(фенилацетонитрил)палладия, имеющий структурную формулу:
Дихлорид ди(фенилацетонитрил)палладия получают реакцией взаимодействия фенилацетонитрила с дихлоридом палладия при их мольном соотношении, равном или более 2:1, проводимой в среде органического растворителя, имеющего температуру кипения не выше 170°С, с последующим выделением целевого продукта и его очисткой перекристаллизацией из углеводородных растворителей.
При мольном соотношении фенилацетонитрила к дихлориду палладия, равном 2:1, реакцию проводят предпочтительно в бензоле.
При мольном соотношении фенилацетонитрила к дихлориду палладия более 2:1 реакцию проводят в среде фенилацетонитрила, используемого в количестве, необходимом для растворения дихлорида палладия.
Стадию очистки целевого продукта осуществляют перекристаллизацией из углеводородных растворителей предпочтительно из гексана или его смеси с бензолом.
Существенными признаками способа получения нового соединения прежде всего являются выбранные исходные продукты, их мольное соотношение, среда, в которой проводится реакция, а также температурные режимы процесса.
Способ получения дихлорида ди(фенилацетонитрил)палладия заключается во взаимодействии фенилацетонитрила с дихлоридом палладия при их мольном равном или более 2:1. В случае осуществления реакции при мольном соотношении фенилацетонитрила к дихлориду палладия, равном 2:1, могут быть использованы органические растворители с температурой кипения не выше 170°С (температуры кипения фенилацетонитрила), выбранные из группы: бензол, толуол, ксилол, дифенилметан. Предпочтительным в данном случае является использование в качестве растворителя бензола.
При введении в реакцию фенилацетонитрила в избыточном количестве (более чем 2:1) он уже играет роль не только участника реакции, но и растворителя и является средой для осуществления реакции. В этом случае его используют в количестве, необходимом для растворения дихлорида палладия.
Процесс проводится при повышенной температуре, верхнее значение которой ограничено температурой кипения фенилацетонитрила (170°С). Температура реакции не должна достигать 200°С - температуры термического разложения получаемого комплекса.
После проведения реакции взаимодействия целевой продукт выделяют и очищают перекристаллизацией из углеводородных растворителей (бензол, толуол, гексан, смесь указанных растворителе), предпочтительно, из гексана или его смеси с бензолом.
Полученный комплекс является новым соединением, строение которого подтверждено ИК-спектром. (См. ниже Фиг. 1).
На графике (Фиг. 1) по оси ординат приводятся значения трансмиссии в %, (поглощение), по оси абсцисс - волновое число (длина волны в см-1).
Предлагаемый способ получения нового комплекса, в отличие от известных способов получения схожих по структуре палладиевых комплексов, позволяет значительно повысить выход и качество по чистоте получаемого продукта, что значительно повышает его каталитическую активность. В результате данного способа получается нерастворимое в воде комплексное соединение палладия, содержащее в качестве лиганда фенилацетонитрил. Известно, что фенилацетонитрил сочетает в себе характеристики присущие как алифатическим нитрилам, а именно высокую реакционную способность, так и характеристики, присущие ароматическим нитрилам, а именно, высокую температуру кипения. Полученный комплекс палладия, содержащий в качестве лиганда фенилацетонитрил, хорошо растворим в предельных и ароматических углеводородах, амидных растворителях и иных органических средах, что может быть использовано для проведения технологических процессов, требующих создание растворов соединений палладия в органических растворителях. Другим свойством, определяющим практическую ценность комплекса палладия с фенилацетонитрилом, является способность его при температурах выше 200°С к разложению до образования металлического палладия, что может быть использовано для изготовления материалов, содержащих металлический палладий в виде частиц различной дисперсности или слоев.
Таким образом, дихлорид ди(фенилацетонитрил)палладия является соединением, предшественником наночастиц палладия, обладающих каталитическими свойствами. Низкая температура разложения данного соединения позволяет применять его как для получения неорганических каталитических систем, так и для включения наночастиц палладия в полимерную матрицу для создания металл-полимерных нанокомпозитов, обладающих комплексом интересных для практического применения.
Каталитическая активность полученного катализатора сопоставима с каталитической активностью известных структурных палладиевых аналогов (дихлорид(диацетонитрил)палладия, дихлорид(дибензонитрил)палладия). Однако эти известные катализаторы имеют меньшую растворимость в неполярных органических растворителях, чем предлагаемый, что дает возможность проведения реакций при использовании меньших концентраций катализатора, что несколько удешевляет процесс синтеза.
Ниже изобретение иллюстрируется следующими примерами:
Пример 1. Получение дихлорида ди(фенилацетонитрила)палладия (при соотношении фенилацетонитрила к дихлориду палладия более 2:1) 3 г дихлорида палладия прибавляют к 20 г фенилацетонитрила и перемешивают в течение 1 часа при комнатной температуре. Затем смесь нагревают до 80°С и перемешивают 6 часов. После охлаждения реакционной массы до комнатной температуры раствор фильтруют и к фильтрату прибавляют 30 мл смеси бензол-гексан 1:1. При растирании происходит кристаллизация, дихлорид ди(фениацетонитрил) палладия выделяется в виде желтых кристаллов. После выдерживания в течение суток при 0°С кристаллы отделяют фильтрованием и перекристаллизовывают из смеси бензол-гексан 1:1. Получают 2,78 г продукта, желтые кристаллы.
Рассчитано: С 46,68, Н 3,42, N 6,80, Cl 17,22, Pd 25,85.
Найдено: С 46,70, Н 3,39, N 6,75, Cl 17,46, Pd 25,7; разлагается при Т>200°С.
Пример 2. Получение дихлорида ди(фенилацетонитрила) палладия (в бензоле, мольное соотношение 1:2,0)
Диспергируют 3 г дихлорида палладия в 50 мл бензола, затем при перемешивании прибавляют раствор 4 мл фенилацетонитрила и перемешивают в течение 2 часов, затем смесь нагревают при температуре кипения бензола (81°С), при этом наблюдается растворение твердого осадка и окрашивание реакционной массы в оранжевый цвет. Смесь охлаждают до 40°С и прибавляют 50 мл н-гексана, затем упаривают в вакууме до объема 25 мл. При охлаждении до температуры 10°С наблюдается образование кристаллов желтого цвета. Кристаллы отделяют фильтрованием после завершения кристаллизации при температуре 0-10°С в течение 24 часов. Получают 2,6 г желтых кристаллов, которые выдерживают в вакууме при комнатной температуре в течение 8 часов для удаления летучих веществ (остатков растворителей).
Рассчитано: С 46,68, Н 3,42, N 6,80, Cl 17,22, Pd 25,85.
Найдено: С 46,70, Н 3,39, N 6,75, Cl 17,46, Pd 25,7.
Строение полученного комплекса подтверждено ИК-спектром (см. ниже Фиг. 1). На графике (Фиг. 1) по оси ординат приводятся значения трансмиссии (поглощение, в %), по оси абсцисс - волновое число (длина волны в см-1).
1. Дихлорид ди(фенилацетонитрил)палладия, структурной формулы:
2. Способ получения дихлорида ди(фенилацетонитрил)палладия, осуществляемый реакцией взаимодействия фенилацетонитрила с дихлоридом палладия при их мольном соотношении, равном или более 2:1, проводимой в среде органического растворителя, имеющего температуру кипения не выше 170°С, с последующим выделением целевого продукта и его очисткой перекристаллизацией из углеводородных растворителей.
3. Способ по п. 2, осуществляемый при мольном соотношении фенилацетонитрила к дихлориду палладия, равном 2:1, и проводимый предпочтительно в бензоле.
4. Способ по п. 2, осуществляемый при мольном соотношении фенилацетонитрила к дихлориду палладия более 2:1 и проводимый в среде фенилацетонитрила, используемого в количестве, необходимом для растворения дихлорида палладия.
5. Способ по п. 2, включающий стадию перекристаллизации целевого продукта из углеводородных растворителей, предпочтительно из гексана или его смеси с бензолом.