Вязкость среды как инструмент контроля предела обнаружения иммунохроматографических тест-систем
Иллюстрации
Показать всеИзобретение относится к аналитической химии и представляет собой способ иммунохроматографического анализа. Иммунохроматографический тест основан на взаимодействии конъюгата специфические антитела-коллоидный маркер с определяемым соединением (антигеном) в ходе движения реагентов вдоль тест-полоски. В зависимости от наличия антигена происходит образование специфических комплексов, обеспечивающих окрашивание в аналитической линии теста. Интенсивность окрашивания, а также чувствительность теста напрямую зависят от времени инкубации пробы и коллоидного конъюгата. Значительные возможности по снижению предела обнаружения дает использование мелкопористых, «медленных» рабочих мембран. Сокращение скорости движения увеличивает время специфического взаимодействия и тем самым снижает предел обнаружения системы. Однако часто использование мелкопористых мембран влечет ряд негативных эффектов, особенно при анализе реальных, часто содержащих корпускулярные частицы проб. В таких случаях происходит забивание пор мембраны и полная остановка течения жидкости, а результаты тестирования признаются недействительными. Предложенный подход отличается тем, что для анализа используется крупнопористая мембрана, а для сокращения скорости движения жидкости в пробу вносятся специальные растворы для повышения вязкости раствора, что приводит к увеличению времени протекания вдоль мембраны. Техническим результатом является снижение предела обнаружения аналитической системы. 1 ил.
Реферат
Описание изобретения
Иммунохроматографические тест-полоски применяются в широком диапазоне областей: в медицине, сельском хозяйстве и при контроле окружающей среды. Существует множество тест-систем для определения маркеров заболеваний (онко-, кардиомаркеры и др.), контроля качества пищевых продуктов (тест-системы на микотоксины, антибиотики), для решения социальных проблем (определение наркотических соединений). С учетом свойств определяемого антигена выбираются те или иные схемы формирования детектируемых иммунных комплексов (R.C. Wong, ed. Lateral Flow Immunoassay. 2009, Humana Press: New York. 224.). Следует, тем не менее, отметить, что большинство практических задач требует проведения анализа с предельно низким уровнем минимальной выявляемой концентрации целевого антигена.
Снижение предела обнаружения может обеспечиваться разными способами, среди которых самым простым является использование большого количества окрашенного коллоидного маркера. Однако даже для «сэндвич»-схем анализа такое решение лимитировано числом образованных иммунных комплексов и кинетическими параметрами антител.
Более универсальным является формирование на основе иммунных комплексов структур, содержащих большие количества оптически детектируемых компонентов. Это усиление может достигаться за счет увеличения размеров коллоидных маркеров при проведении дополнительных химических реакций (Yang W., Li X.В., Liu G.W., Zhang В.В., Zhang Y., Kong Т., Tang J.J., Li D.N., Wang Z. A colloidal gold probe-based silver enhancement immunochromatographic assay for the rapid detection of abrin-a. Biosensors and Bioelectronics 2011, 26(8): 3710-3713) или при использовании биоспецифических лиганд-рецепторных взаимодействий (Urusov А.Е., Zherdev A.V., Dzantiev В.В. Use of gold nanoparticle-labeled secondary antibodies to improve the sensitivity of an immunochromatographic assay for aflatoxin B1. Microchimica Acta 2014. 181 (15-16): 1939-1946; Urusov, A. E., Petrakova, A. V., Zherdev, A. V., & Dzantiev, В. B. (2016). "Multistage in one touch" design with a universal labelling conjugate for high-sensitive lateral flow immunoassays. Biosensors and Bioelectronics, 86, 575-579.). Однако оба эти подхода, несмотря на разнообразие вариантов, имеют общие ограничения, такие как необходимость синтеза дополнительных компонентов и/или усложнение процедуры самого анализа.
Самым простым вариантом снижения предела обнаружения является введение стадии прединкубации анализируемой пробы со специфическими антителами. Это позволяет дать значительное количество времени на специфическую стадию иммунохимического распознавания. Однако такой подход требует использования дополнительных реагентов, отдельно разведенных конъюгатов специфических антител и дополнительных стадий осуществления анализа.
Более простой вариант - использование мембран с малым размером пор, движение жидкости по которым происходит значительно медленнее. Однако такие системы становятся чувствительны к матриксу анализируемых образцов и часто требуют их дополнительной очистки. В противном случае поры мембраны забиваются, и анализ не может завершиться формированием окрашенных аналитической и/или контрольной зон.
Предлагается новый вариант снижения предела обнаружения аналитической системы, основанный на изменении скорости движения жидкости вдоль тест-полоски за счет внесения в пробу реагентов, повышающих вязкость раствора. Такой компонент не требует особых условий хранения и может быть включен в состав рабочего буфера для разведения образца. Однако его использование значительно снижает скорость движения жидкости вдоль мембраны, увеличивая продолжительность иммунохимического взаимодействия и не нарушая структуру теста.
Рассмотрим структуру предлагаемой иммунохроматографической тест-системы. В ее состав входит пластиковая подложка, на которой зафиксирована рабочая и конечная впитывающая мембраны. Процедура проведения анализа и детекции его результата такие же, как и для стандартной иммунохроматографической тест-полоски, - нижний край тест-полоски опускается в соответствующий раствор, где инкубируется 30 минут. После завершения всех стадий формирования детектируемого комплекса окрашивание аналитической зоны (и при необходимости его интенсивность) оцениваются визуально или с помощью фотометрического оборудования.
Данное методическое решение обладает существенными преимуществами по сравнению с известными разработками иммунохроматографических тестов, в которых также реализуется усиление детектируемого сигнала. Ниже представлено сопоставление разработки с двумя ее аналогами.
Аналог №1
Использование двух конъюгатов антител с частицами коллоидного золота двух размеров описано в работе Choi D.H., Lee S.K., Oh Y.K., Bae B.W., Lee S.D., Kim S., Shin Y., Kim M.G. A dual gold nanoparticle conjugate-based lateral flow assay (LFA) method for the analysis of troponin I. Biosensors and Bioelectronics 2010, 25(8), 1999-2002. В состав тест-полоски входят две последовательно расположенные мембраны, пропитанные этими конъюгатами. Первый конъюгат содержит антитела против бычьего сывороточного альбумина, второй - бычий сывороточный альбумин и специфические антитела против детектируемого антигена. Используются коллоиды разного размера, что позволяет, с одной стороны, разделить их в процессе движения по мембране, препятствуя смешиванию до достижения контрольной и аналитических зон, а с другой - усилить аналитический сигнал. Однако данный подход имеет ряд недостатков:
- требует синтеза дополнительных реагентов;
- чувствителен к компонентам пробы, так как происходит формирование более сложного комплекса-агрегата.
Аналог №2
Использование дополнительных мембран с высушенным в высокой концентрации белком (в частности, с бычьим сывороточным альбумином, БСА). Установка такой прослойки между мембранами под образец/конъюгат и рабочей нитроцеллюлозной подложкой позволяет значительно снизить скорость движения потока (Petrakova A.V., Urusov А.Е., Voznyak M.V., Zherdev A.V., Dzantiev В.В. 2015. Immunochromatographic test system for the detection of T-2 toxin. Applied Biochemistry and Microbiology, 51(6), 688-694.).
При проведении анализа поток жидкости проходит через мембрану под образец и мембрану под конъюгат. Реагенты вымываются из мембран и смешиваются с пробой. Следующие мембраны содержат большое количество белка, и ток жидкости останавливается, не переходя на рабочую мембрану. Задержка лимитирована скоростью растворения белка и составляет обычно от 1 до 3 минут. За это время происходит иммуноспецифическая реакция с образованием комплексов антиген-антитело-золотая частица. Как было показано авторами в публикации - такой задержки достаточно для значительного повышения чувствительности аналитической системы.
Данный подход имеет следующие потенциальные недостатки:
- Технологическая сложность установки дополнительного количества мембран на ограниченном участке клеевой подложки.
- Низкая стабильность при хранении - большое количество белка, за полтора-два года хранения может значительно потерять свою растворимость.
- Снижение амплитуды сигнала - избыток белка может привести к блокировке поверхности мембраны и вызвать стерические затруднения иммуноспецифического взаимодействия при образовании на фазе комплексов коллоидный маркер-антитело-антиген (для конкурентной схемы анализа) или коллоидный маркер-антитело-антиген-антитело (для «сэндвич»-схемы анализа).
Эффективность предложенного в патенте подхода подтверждается представленным ниже примером.
Пример 1. Определение тропонина иммунохроматографическим методом.
Предварительно собирали иммунохроматографическую тест-полоску, включавшую в себя следующие компоненты - пластиковая подложка, с закрепленными на ней рабочей мембраной, впитывающей подложкой, мембранами под конъюгат и образец. В качестве рабочей мембраны выбрана Millipore HF 120. На нитроцеллюлозную мембрану наносили специфические антитела к тропонину из концентрации 0,3 мг/мл и объема 0,1 мкл на 1 мм полосы. В контрольную зону наносили антивидовы антитела (иммуноглобулины козы против иммуноглобулинов мыши) в концентрации 0,5 мг/мл и объема 0,1 мкл на 1 мм полоски. Для нанесения реагентов использовали диспенсер «IsoFlow» фирмы «Imagene Technology» (США). Полученные листы нарезали на индивидуальные тест-полоски шириной 4 мм.
Анализ осуществляется следующим образом. Анализируемые пробы предварительно разводили буфером для образца, содержащим усилитель вязкости карбоксиметилцеллюлозную соль натрия. В полученный раствор вносили известную концентрацию антигена (проверка методом «введено-найдено»). После чего край полоски погружали в полученную смесь и инкубировали в течение 30 минут.
Для сравнения было проведено тестирование с теми же полосками по традиционной методике - без добавления усилителя вязкости и при времени инкубации 15 минут.
Результат детектировали визуально и фотометрически по окрашиванию аналитической и контрольной зон. В последнем варианте тест-полоски сканировали на сканере Lide 90 (Canon) с разрешением 600 dpi, без автоматического контрастирования и цветокоррекции. На полученных цифровых изображениях выделяли прямоугольную область, захватывающую не менее чем 90% окрашенной зоны, и с помощью программы Total Lab (Nonlinear Dynamics, Великобритания) получали численное значение интенсивности окрашивания аналитической зоны.
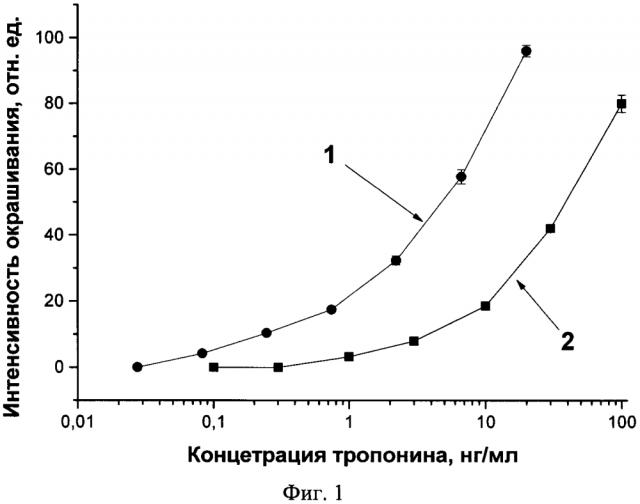
Интенсивности окрашивания аналитических зон тест-полосок после тестирования проб с разным содержанием антигена представлены на фиг. 1. Как следует из полученных концентрационных зависимостей, предел обнаружения тропонина (концентрация, соответствующая достоверному - более 20% - снижению интенсивности окрашивания по сравнению с пробой, не содержащей тропонин) при использовании нового метода анализа схемы без усиления составляет 1 нг/мл, в то время как для предложенной схемы он равен 0,08 нг/мл (выигрыш по пределу обнаружения более чем в 10 раз).
Краткое описание чертежей
На фиг. 1 представлены калибровочные кривые определения тропонина в предлагаемой и традиционной иммунохроматографических системах, 1 - предлагаемая схема проведения анализа, 2 - традиционная схема.
Способ снижения предела обнаружения иммунохроматографических тестов, основанный на оценке интенсивности окрашенной линии в аналитической зоне тест-полоски, отличающийся тем, что в раствор пробы добавляются агенты, увеличивающие вязкость жидкости, т.е. время протекания пробы вдоль рабочей мембраны, а следовательно, время иммунохимической реакции и способствует снижению предела обнаружения.