Предотвращение, разрушение и обработка биопленки лизином бактериофага
Иллюстрации
Показать всеГруппа изобретений относится к способам и композициям для предотвращения, контроля и разрушения бактериальных биопленок с использованием лизина, имеющего способность к лизису стафилококковых и стрептококковых бактерий, включая резистентные к лекарственным средствам. Способы включают контактирование биопленки, включающей одну или несколько из бактерий Staphylococcus или Streptococcus, с композицией, содержащей эффективное количество полипептида лизина, содержащего аминокислотную последовательность SEQ ID NO: 1 или ее варианты, имеющие по меньшей мере 80% идентичности с полипептидом с SEQ ID NO: 1, и являющегося эффективным для лизиса стафилококковых и стрептококковых бактерий в биопленке, причем биопленку эффективно диспергируют или обрабатывают. Изобретения позволяют устранять не только зрелые биопленки, но и предотвращать образование биопленок de novo, при этом применяемый полипептид лизина демонстрирует высокую активность при более низких концентрациях (1X МПК) в сравнении с отсутствием активности антибиотиков, применяемых при высоких концентрациях (1000Х МПК). 4 н. и 17 з.п. ф-лы, 21 ил., 7 табл., 14 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится в целом к предотвращению, контролю, разрушению и обработке бактериальных биопленок с помощью лизина, в частности, лизина, имеющего способность к лизису стафилококковых бактерий, включающих резистентный к лекарственным средствам Staphylococcus aureus, конкретно, лизина PlySs2. Изобретение также относится к композициям и способам для модуляции бактериальных биопленки(биопленок) и образования биопленки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ИЗОБРЕТЕНИЯ
[0002] Развитие бактерий, резистентных к лекарственным средствам является основной проблемой в медицине по мере того, как все больше антибиотиков применяют для лечения широкого ряда болезней и других состояний. Применение большего числа антибиотиков и количества бактерий, проявляющих резистентность, вынуждает использовать более длительное время для лечения. Кроме того, неспецифические антибиотики широкого спектра действия, некоторые из которых оказывают вредные воздействия на пациента, применяются в настоящее время более часто. Проблема, относящаяся к этому возросшему применению, состоит в том, что многие антибиотики не проникают с легкостью через слизистые оболочки.
[0003] Грамположительные бактерии окружены клеточной стенкой, содержащей полипептиды и полисахарид. Грамположительные бактерии включают, но не ограничены ими, роды Actinomyces, Bacillus, Listeria, Lactococcus, Staphylococcus, Streptococcus, Enterococcus, Mycobacterium, Corynebacterium и Clostridium. Медицински значимые виды включают Streptococcus pyogenes, Streptococcus pneumoniae, Staphylococcus aureus и Enterococcus faecalis. Виды Bacillus, которые являются спорообразующими, вызывают сибирскую язву и гастроэнтерит. Спорообразующие виды Clostridium являются ответственными за ботулизм, столбняк, газовую гангрену и псевдомембранный колит. Виды Corynebacterium вызывают дифтерию, а виды Listeria вызывают менингит.
[0004] Новые подходы к противомикробной терапии включают антибиотики на основе ферментов ("энзибиотики"), такие как лизины бактериофагов. Фаги используют эти лизины для расщепления клеточной стенки их бактериальных хозяев, высвобождая вирусное потомство посредством гипотонического лизиса. Аналогичные конечные результаты получают, когда очищенные, рекомбинантные лизины добавляют извне к грамположительным бактериям. Высокая летальная активность лизинов против грамположительных патогенов делает их привлекательными кандидатами для разработки в качестве терапевтических средств (Fischetti, V.A. (2008) Curr Opinion Microbiol 11:393-400; Nelson, D.L. et al. (2001) Proc Natl Acad Sci USA 98: 4107-4112). Лизины бактериофагов первоначально были предложены для эрадикации носоглоточного носительства патогенных стрптококков (Loeffler, J. M. et al. (2001) Science 294: 2170- 2172; Nelson, D. et al. (2001) Proc Natl Acad Sci USA 98: 4107-4112). Лизины являются частью литического механизма, используемого двухцепочечной ДНК (дцДНК) фага для координации лизиса хозяина с завершением вирусной сборки (Wang, I.N. et al. (2000) Annu Rev Microbiol 54: 799-825). Лизины представляют собой гидролазы пептидогликана, которые разрушают связи в бактериальной стенке, быстро гидролизуя ковалентные связи существенно важные для целостности пептидогликана, вызывая бактериальный лизис и сопутствующее высвобождение потомства фага.
[0005] Члены семейства лизинов имеют модульную конструкцию, в которой каталитический домен сопряжен с доменом специфичности или связывания (Lopez, R. et al. (1997) Microb Drug Resist 3: 199-211). Лизины могут быть клонированы из последовательностей вирусных профагов в бактериальных геномах и применяться для лечения (Beres, S B. et al. (2007) PLoS ONE 2(8): 1-14). При добавлении извне, лизины способны получить доступ к связям Грамположительной клеточной стенки (Fischetti, V.A. (2008) Curr Opinion Microbiol 11: 393-400). Было установлено, что литические ферменты бактериофагов являются применимыми при оценке и конкретном лечении различных типов инфекций у субъектов посредством различных путей введения. Например, патент США 5604109 (Fischetti et al.) относится к быстрому обнаружению стрептококков Группы А в клинических образцах, через ферментативное расщепление посредством полуочищенного лизинового фермента, ассоциированного с фагом стрептококков Группы C. Работа с этих ферментом стала базисом для дополнительного исследования, ведущего к способам лечения заболеваний. Патенты Fischetti and Loomis (патенты США 5985271, 6017528 и 6056955) раскрывают применение лизинового фермента, продуцируемого стрептококковыми бактериями группы C, инфицированными бактериофагом C1. Патент США 6248324 (Fischetti and Loomis) раскрывает композицию для лечения дерматологических инфекций посредством применения литического фермента в носителе, подходящем для местного нанесения на кожные ткани. Патент США 6254866 (Fischetti and Loomis) раскрывает способ лечения бактериальных инфекций пищеварительного тракта, который включает введение литического фермента, специфичного для инфицирующих бактерий. Носитель для доставки по меньшей мере одного литического фермента в пищеварительный тракт выбирают из группы, состоящей из клизм с суппозиториями, сиропов или пилюль с энтеросолюбильным покрытием. Патент США 6264945 (Fischetti and Loomis) раскрывает способ и композицию для лечения бактериальных инфекций посредством парентерального введения (внутримышечно, подкожно или внутривенно) по меньшей мере одного литического фермента, продуцируемого бактериями, инфицированными бактериофагом, специфичным для данных бактерий, и соответствующего носителя для доставки литического фермента в пациента.
[0006] Асоциированные с фагом литические ферменты были идентифицированы и клонированы из различных бактериофагов, эффективность каждого из которых при лизисе специфичных бактериальных штаммов была продемонстрирована. Патент США 7402309, 7638600 и опубликованная Заявка РСТ WO 2008/018854 предоставляют различающиеся ассоциированные с фагом литические ферменты, применимые в качестве антибактериальных средств для лечения или снижения степени инфекций Bacillus anthracis. Патент США 7569223 описывает литические ферменты для Streptococcus pneumoniae. Лизин, применимый для Enterococcus (E. faecalis и E. faecium, включая ванкомицин-резистентные штаммы) описан в Патенте США 7582291. US 2008/0221035 описывает мутантные лизины Ply GBS, высокоэффективные при лизисе стрептококков Группы B. Химерный лизин, обозначенный ClyS, с активностью против стафилококковых бактерий, включая Staphylococcus aureus, подробно описан в WO 2010/002959. ClyS является специфичным для стафилококковых бактерий и является неактивным против Streptococcus и других грамположительных бактерий.
[0007] Исходя из их свойства быстрого, активного и специфичного разрушения клеточной стенки и бактерицидных свойств, было предложено использовать лизины в качестве противомикробных терапевтических средств для борьбы с Грамположительными патогенами посредством атаки на экспонированные пептидогликановые клеточные стенки снаружи клетки (Fenton, M et al. (2010) Bioengineered Bugs 1:9-16; Nelson, D et al. (2001) Proc Natl Acad Sci USA 98: 4107-4112). Эффективности действия различных лизинов в качестве средств монотерапии были продемонстрированы на моделях фарингита у грызунов (Nelson, D et al. (2001) Proc Natl Acad Sci USA 98: 4107-4112), пневмонии (Witzenrath, M et al. (2009) Crit Care Med 37:642-649), отита среднего уха (McCullers, J.A. et al. (2007) PLOS pathogens 3: 0001-0003), абсцессов (Pastagia, M et al. Antimicrobial agents and chemotherapy 55: 738-744), бактериемии (Loeffler, J.M. et al. (2003) Infection and Immunity 71: 6199-6204), эндокардита (Entenza, J.M. et al. (2005) Antimicrobial agents and chemotherapy 49: 4789-4792) и менингита (Grandgirard, D et al. (2008) J Infect Dis 197: 1519-1522). В дополнение, лизины, в целом, являются специфичными для их бактериальных хозяйских видов и не лизируют нецелевые организмы, включая симбиотические бактерии человека, которые могут быть благоприятными по отношению к желудочно-кишечному гомеостазу (Blaser, M. (2011) Nature 476: 393-394; Willing, B.P. et al. (2011) Nature reviews. Microbiology 9: 233-243).
[0008] Микроорганизмы имеют тенденцию к образованию прикрепленных к поверхности сообществ биопленки в качестве важной стратегии выживания в различных окружающих условиях. Биопленки состоят из микробиальных клеток, и широкого ряда самогенерируемых внеклеточных полимерных веществ, включающих полисахариды, нуклеиновые кислоты и белки (Flemming HC et al. (2007) J Bacteriol 189: 7945-7947). Биопленки обнаруживают в природных и промышленных водных средах, тканях, и медицинских материалах и устройствах (Costerton JW et al. (1994) J Bacteriol 176: 2137-2142). Биопленки могут быть образованы одиночным бактериальным штаммом, несмотря на то, что большинство природных биопленок образуются множеством бактериальных видов (Yang L et al.(2011) Int J Oral Sci 3: 74-81). Применения антибиотиков часто являются неэффективными для биопленочных популяций вследствие их уникальной физиологии и физического матриксного барьера.
[0009] Стафилококки часто образуют биопленки, фиксированные сообщества, заключенных во внеклеточный матрикс, который прилипает к биомедицинским имплантататам или поврежденной и здоровой ткани. Инфекции, ассоциированные с биопленками, часто являются трудными для лечения, и было оценено, что фиксированные бактерии в биопленках являются в 1000-1500 раз более резистентными к антибиотикам, чем их планктонные аналоги. Данная антибиотическая резистентность биопленок часто приводит к неудаче общепринятой антибиотической терапии и диктует необходимость удаления инфицированных устройств. Было показано, что лизостафин лизировал S. aureus в биопленках и также разрушал внеклеточный матрикс биопленок S. aureus in vitro на пластмассовых и стеклянных поверхностях (Wu, JA et al.(2003) Antimicrob Agents и Chemoth 47(11): 3407-3414). Данное разрушение биопленок S. aureus являлось специфичным для лизостафин-чувствительного S. aureus, и биопленки лизостафин-резистентного S. aureus не подвергались воздействию. Высокие концентрации оксациллина (400 мкг/мл), ванкомицина (800 мкг/мл) и клиндамицина (800 мкг/мл) не имели никакого эффекта на установленные биопленки S. aureus, даже через 24 часа. Лизостафин также разрушал биопленки S. epidermidis, однако, требовались более высокие концентрации. Сообщалось о применении фаговых лизинов для удаления стафилококковых биопленок, со смешанными результатами. Сообщалось, что лизин бактериофага SAL-2 удалял биопленки S. aureus (Son JS et al.(2010) Appl Microbiol Biotechnol 86(5): 1439-1449), в то время как в случае двух сходных фаговых лизинов, phil 1 и phil 2, в то время как phi1 1 гидролизовал стафилококковые биопленки, phi1 2 был неактивным (Sass P and Bierbaum G (2007) Appl Environ Microbiol 73(1): 347-352). Исследовали различные комбинации ферментов для удаления и дезинфекции бактериальных биопленок в различных системах (Johansen C et al.(1997) Appl Environ Microbiol 63: 3724-3728). Данный процесс, однако, требует минимально двух ферментов или средств, одного фермента или средства для удаления прилипших бактерий из биопленок и второго фермента или средства с бактерицидной активностью.
[00010] Недостатки и проблемы, связанные с применяемыми в настоящее время традиционными антибактериальными средствами, наглядно показывают, что в данной области все еще существует потребность в дополнительных специфичных антибактериальных средствах, комбинациях и терапевтических модальностях, а также средствах с более широким спектром действия, в особенности, лишенных высоких рисков приобретенной резистентности, для эффективных и действенных обработки, контроля и предотвращения образования бактериальных биопленок. Следует отметить, что до настоящего времени, не было показано, что лизин, демонстрирующий высокую литическую активность против множественных различных видов патогенных и клинически значимых грамположительных бактерий, который является легко производимым промышленно и стабильным, и не имеет риска или имеет ограниченный риск появления резистентности, является эффективным на биопленках. Соответственно, существует коммерческая необходимость в новых антибактериальных подходах, особенно тех, что функционируют через новые модальности или обеспечивают новые средства для лизиса патогенных бактерий в биопленках.
[00011] Цитирование ссылок в настоящем описании не должно толковаться как допущение, что данные ссылки составляют предшествующий уровень техники по отношению к настоящему изобретению.
КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[00012] В соответствии с настоящим изобретением, предоставлены композиции и способы для профилактики, разрушения и обработки бактериальных биопленок. В своем самом широком аспекте, настоящее изобретение предоставляет применение и использование лизина, имеющего литическую активность широкого спектра действия против множества бактерий, в частности Грамположительных бактерий, включающих, в частности, бактериальные штаммы Staphylococcus, Streptococcus, конкретно, Streptococcus pyogenes (Группа А стреп) и Streptococcus agalactiae (Группа B стреп), при предотвращении, разрушении и обработке биопленок. Лизин и композиции изобретения являются применимыми и применяемыми при лизисе бактериальных штаммов Enterococcus и Listeria, и их применяемых биопленок. Данное изобретение предоставляет способ для деколонизации, диспергирования и удаления бактериальной биопленки, использующий лизин бактериофага, способный к лизису бактерий эффективно и действенно в биопленке. Изобретение таким образом предусматривает обработку, деколонизацию и/или обеззараживание бактериальных биопленок и предотвращение инфекций после диспергирования биопленки(биопленок), где один или несколько видов грамположительных бактерий, в частности, один или несколько из видов бактерий Staphylococcus, Streptococcus, Enterococcus и Listeria бактерии, предполагается или присутствует.
[00013] В соответствии с настоящим изобретением лизин бактериофага, полученный из бактерий Streptococcus suis, используют в способах и применениях изобретения. Лизиновые полипептид(ы), применяемые в настоящем изобретении, конкретно лизин PlySs2, предоставленный в настоящем документе и на ФИГУРЕ 5 (SEQ ID NO: 1), являются уникальными при демонстрации литической активности широкого спектра действия против множества бактерий, в частности, грамположительных бактерий, включающих бактериальные штаммы Staphylococcus, Streptococcus, Enterococcus и Listeria. В одном таком аспекте, лизин PlySs2 является способным к лизису штаммов и бактерий Staphylococcus aureus в биопленках, как демонстрируется в настоящем описании. PlySs2 является эффективным против антибиотик-резистентных бактерий, включающих Staphylococcus aureus, таких как метициллин-резистентные Staphylococcus aureus (MRSA), ванкомицин-резистентные Staphylococcus aureus (VRSA), даптомицин-резистентные Staphylococcus aureus (DRSA) и линезолид-резистентные Staphylococcus aureus (LRSA). PlySs2 является эффективным против бактерий с измененной чувствительностью к антибиотику, таким как Staphylococcus aureus с промежуточной чувствительностью к ванкомицину (VISA).
[00014] В аспекте изобретения предоставлен способ лизиса грамположительных бактерий в биопленке, включающий стадию контактирования биопленки с композицией, содержащей количество изолированного полипептида лизина, эффективного для лизиса грамположительных бактерий в биопленке, включающей S. aureus, изолированного полипептида лизина, содержащего полипептид лизина PlySs2 или его варианты, эффективные для лизиса грамположительных бактерий. Таким образом, предоставлен способ лизиса грамположительных бактерий в биопленке, включающий стадию контактирования биопленки с композицией, содержащей количество изолированного полипептида лизина, эффективного для лизиса грамположительных бактерий в биопленке, изолированного полипептида лизина, содержащего аминокислотную последовательность, предоставленную на ФИГУРЕ 5 или SEQ ID NO: 1 или ее варианты, имеющие по меньшей мере 80% идентичности, 85% идентичности, 90% идентичности, 95% идентичности или 99% идентичности с полипептидом ФИГУРЫ 5 или SEQ ID NO: 1, и эффективного для лизиса грамположительных бактерий в биопленке.
[00015] В аспекте изобретения предоставлен способ диспергирования грамположительных бактерий в биопленке, таким образом, чтобы обеззараживать и высвобождать бактерии, затем чувствительные к антибиотикам, включающий стадию контактирования биопленки с композицией, содержащей количество изолированного полипептида лизина, эффективного для диспергирования грамположительных бактерий в биопленке, включающей S. aureus, изолированного полипептида лизина, содержащего полипептид лизина PlySs2, включающего представленный на ФИГУРЕ 5 или SEQ ID NO: 1, или его варианты эффективные для лизиса грамположительных бактерий.
[00016] В аспекте вышеуказанных способов способы осуществляют in vitro или ex vivo, таким образом, чтобы провести стерилизацию или обеззараживание раствора, материала или устройства, конкретно предназначенного для применения человеком или в человеке.
[00017] Изобретение предоставляет способ уменьшения популяции грамположительных бактерий в биопленке, включающий стадию контактирования биопленки с композицией, содержащей количество изолированного полипептида, эффективного, чтобы лизировать или высвобождать по меньшей мере часть грамположительных бактерий в биопленке, изолированного полипептида, содержащего аминокислотную последовательность ФИГУРЫ 5 (SEQ ID NO: 1) или ее варианты, имеющие по меньшей мере 80% идентичности с полипептидом ФИГУРЫ 5 (SEQ ID NO: 1), и эффективного для лизиса грамположительных бактерий.
[00018] Настоящее изобретение дополнительно предоставляет способ для диспергирования или лечения антибиотикорезистентной инфекции Staphylococcus aureus, которая вовлечена в или включает биопленку у человека, включающий стадию введения человеку с биопленкой инфекции антибиотикорезистентных Staphylococcus aureus, эффективного количества композиции, содержащей изолированный полипептид, содержащий аминокислотную последовательность ФИГУРЫ 5 (SEQ ID NO: 1) или ее варианты, имеющие по меньшей мере 80% идентичности, 85% идентичности, 90% идентичности или 95% идентичности с полипептидом ФИГУРЫ 5 (SEQ ID NO: 1), и эффективный для диспергирования биопленки и лизиса в ней и/или высвобождаемых из нее Staphylococcus aureus, посредством чего количество Staphylococcus aureus у человека снижается, а биопленка и присутствующая инфекция уничтожаются.
[00019] Способ изобретения также включает способ для предотвращения, диспергирования или обработки биопленки грамположительных бактерий, содержащих один или несколько из видов бактерий Staphylococcus или Streptococcus у человека, включающий стадию введения субъекту, имеющему или подозреваемому на обладание, или имеющему риск бактериальной биопленки, эффективного количества композиции, содержащей изолированный полипептид, содержащий аминокислотную последовательность ФИГУРЫ 5 (SEQ ID NO: 1) или ее варианты, имеющие по меньшей мере 80% идентичности, 85% идентичности, 90% идентичности или 95% идентичности с полипептидом ФИГУРЫ 5 (SEQ ID NO: 1), и эффективного для лизиса грамположительных бактерий, посредством чего количество грамположительных бактерий у человека снижается, и зараженность или инфицированность биопленки устраняются. В аспекте способа, биопленка, содержащая или включающая один или несколько из видов бактерий Enterococcus или Listeria, эффективно предотвращается, диспергируется или обрабатывается. В конкретном аспекте этого способа, где субъект подвергается воздействию или имеет риск появления одного или нескольких из видов бактерий Staphylococcus (таких как Staphylococcus aureus), Streptococcus (в частности, Группы А стреп или Группы В стреп, таких как Streptococcus pyogenes или Streptococcus agalactiae, соответственно). Альтернативные бактерии, такие как бактерии Listeria (такие как L. monocytogenes) или Enterococcus (такие как E. faecalis) могут также включаться и быть объектом воздействия, предотвращаться, диспергироваться или обрабатываться в соответствии со способами и композициями изобретения. Субъект может являться человеком. Субъект может являться взрослым человеком, ребенком, младенцем или плодом.
[00020] В любых таких вышеуказанном способе или способах, чувствительные, лизируемые, диспергируемые или обрабатываемые биопленочные бактерии могут быть выбраны из Staphylococcus aureus, Listeria monocytogenes, Staphylococcus simulans, Streptococcus suis, Staphylococcus epidermidis, Streptococcus equi, Streptococcus equi zoo, Streptococcus agalactiae (GBS), Streptococcus pyogenes (GAS), Streptococcus sanguinis, Streptococcus gordonii, Streptococcus dysgalactiae, Streptococcus Группы G, Streptococcus Группы E, Enterococcus faecalis и Streptococcus pneumonia.
[00021] В соответствии с любыми из способов изобретения чувствительные бактерии или биопленочные бактерии могут представлять собой антибиотикоустойчивые бактерии. Бактерии могут являться резистентными к антибиотикам, включая метициллин-резистентные Staphylococcus aureus (MRSA), ванкомицин-резистентные Staphylococcus aureus (VRSA), даптомицин-резистентные Staphylococcus aureus (DRSA) или линезолид-резистентные Staphylococcus aureus (LRSA). Бактерии могут иметьизмененную чувствительность к антибиотику, такие как например, Staphylococcus aureus, обладающие промежуточной чувствительностью к ванкомицину (VISA). Чувствительные бактерии могут представлять собой клинически значимые или патогенные бактерии, в частности, для людей. В аспекте способа(способов), лизиновый полипептид(ы) являются эффективными для лизиса бактериальных штаммов Staphylococcus, Streptococcus, Enterococcus и Listeria.
[00022] Было показано, что покрытие медицинских имплантатов противомикробными средствами может эффективно предотвращать первоначальное прилипание стафилококковых биопленок к имплантатам. Покрытие биомедицинских материалов лизином может также оказаться успешным для предотвращения раннего прилипания бактерий, включая стафилококки, к имплантатам, таким образом, предотвращая образование биопленки. Настоящее изобретение, таким образом, также предоставляет способы для снижения и предотвращения роста бипленки на поверхности устройств, имплантатов, разделительных мембран (например, первапорационных мембран, мембран для диализа, обратного осмоса, ультрафильтрационных и микрофильтрационных мембран) посредством введения или покрытия лизином изобретения, включая лизин PlySs2.
[00023] Альтернативные активные и подходящий лизин(ы) могут использоваться в соответствии со способами и композициями настоящего изобретения, включающие как применяемый лизин(ы) и/или один или несколько дополнительных эффективных и применимых лизинов. В дополнительном аспекте или варианте осуществления способов и применений, предоставленных в настоящем описании, стафилококковый специфичный лизин ClyS применяют в настоящем описании по отдельности или в комбинации с лизином PlySs2, как предоставлено и описано в настоящем описании.
[00024] Другие цели и преимущества станут очевидными для специалистов в данной области из обзора следующего описания, которое приводится со ссылками на следующие иллюстративные чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
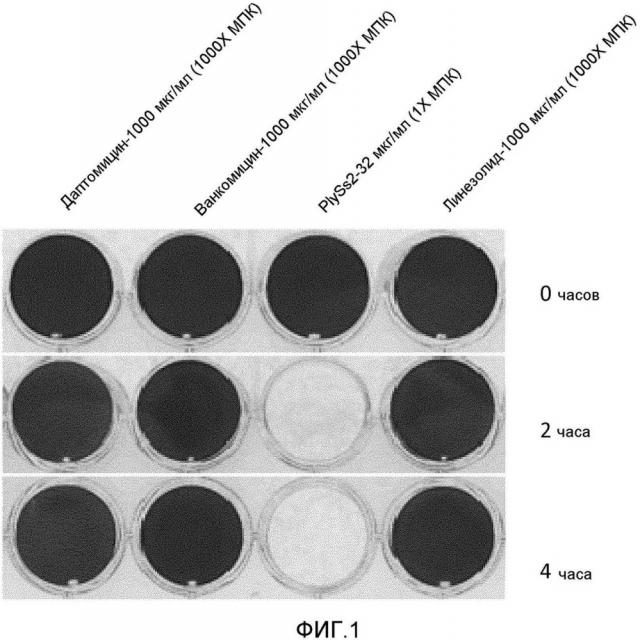
[00025] ФИГУРА 1 изображает биопленки BAA-42 MRSA, обработанные даптомицином, ванкомицином, лизином PlySs2 или линезолидом в количествах и в течение времени до 4 часов. Антибиотики даптомицин, ванкомицин и линезолид добавляли при 1000XМПК для каждого антибиотика. PlySs2 добавляли при 1XМПК. После обработки, биопленки визуализируют с использованием кристаллического фиолетового.
[00026] ФИГУРА 2 изображает биопленки BAA-42 MRSA, обработанные даптомицином, ванкомицином, лизином PlySs2 или линезолидом в количествах и в течение времени до 6 часов. После обработки, биопленки визуализируют с использованием кристаллического фиолетового.
[00027] ФИГУРА 3 изображает биопленки BAA-42 MRSA, обработанные даптомицином, ванкомицином, лизином PlySs2 или линезолидом в количествах и в течение времени до 24 часов. После обработки, биопленки визуализируют с использованием кристаллического фиолетового.
[00028] ФИГУРА 4 изображает биопленки BAA-42 MRSA в 24-луночных чашках Петри, обработанные лизином PlySs2 или даптомицин в течение 0,5 часа, 1 часа, 4 часов и 24 часов при указанных количествах дозирования. После обработки, биопленки визуализируют с использованием кристаллического фиолетового.
[00029] ФИГУРА 5 предоставляет аминокислотную последовательность (SEQ ID NO: 1) и кодирующую последовательность нуклеиновой кислоты (SEQ ID NO: 2) лизина PlySs2. N-концевой CHAP-домен и С-концевой SH-3-домен PlySs2 лизина заштрихованы, с CHAP-доменом (SEQ ID NO: 3), начинающимся с LNN… и заканчивающимся … YIT, и SH-3-доменом (SEQ ID NO: 4), начинающимся с RSY … заканчивающимся … VAT. Остатки активного центра CHAP-домена (Cys26, His102, Glu118 и Asn120), идентифицированные по гомологии с PDB 2K3A (Rossi P et al.(2009) Proteins 74: 515-519), подчеркнуты.
[00030] ФИГУРА 6 предоставляет двадцати-четырех часовой анализ по определению зависимости активности PlySs2 и антибиотика от времени на биопленках MRSA, как оценивали по окрашиванию кристаллическим фиолетовым. Антибиотики даптомицин (ДАП), ванкомицин (ВАН) и линезолид (ЛЗД) добавляли при 1000X МПК для каждого антибиотика. PlySs2 добавляли при 1Х МПК.
[00031] ФИГУРА 7 изображает количественное определение красителя, удерживаемого в качестве индикатора биопленки, удерживаемого при двадцати-четырех часовом анализе по определению зависимости активности PlySs2 и антибиотика от времени на биопленках MRSA. Антибиотики даптомицин (ДАП), ванкомицин (ВАН) и линезолид (ЛЗД) добавляли при 1000X МПК для каждого антибиотика. Лизин PlySs2 добавляли при 1Х МПК.
[00032] ФИГУРА 8 показывает 24-часовую зависимость от времени суб-МПК концентраций PlySs2 в сопоставлении со средой по отдельности на биопленках MRSA, как оценивали посредством окрашивания кристаллическим фиолетовым. PlySs2 добавляли к биопленке штамма BAA-42 MRSA при уровнях 0,1Х МПК и 0,01X МПК.
[00033] ФИГУРА 9A и 9B изображает исследования эрадикации биопленки против MRSA, выращенных на DEPC-катетерах. A: Катетерные биопленки обрабатывали средой по отдельности, 1Х МПК даптомицина, 1000X МПК даптомицина и 1Х МПК PlySs2 в течение 24 часов перд интенсивной промывкой, окрашиванием Метиленовым Синим и фотографированием. B: Через 24 часа обработки, образцы катетера в двух повторностях обрабатывали буфером для лизиса, чтобы удалить остаточные биопленки, и бактериальные КОЕ оценивали на основании относительных световых единиц, с использованием люциферазного реагента, калиброванного против известных концентраций бактерий.
[00034] ФИГУРА 10 изображает анализ методом титрования окрашивания биопленки MRSA DEPC-катетера метиленовым синим через 4 часа обработки буфером или титрованным PlySs2 с МПК, равными 1Х МПК, 0,1X МПК, 0,01X МПК, 0,001X МПК, 0,0001X МПК и 0,00001X МПК PlySs2.
[00035] ФИГУРА 11 изображает анализ методом титрования окрашивания биопленки MRSA DEPC-катетера метиленовым синим через 4 часа обработки буфером или титрованым даптомицином (ДАП) при 5000X МПК, 1000X МПК, 100X МПК, 10X МПК и 1Х МПК.
[00036] ФИГУРА 12A и B показывает анализ зависимости от времени активности PlySs2 против биопленок MRSA в DEPC-катетерах. A: катетеры обрабатывали 1Х МПК PlySs2 (32 мкг/мл) в течение 5 мин, 15 мин, 30 мин, 60 мин, 90 мин, 2 часов, 3 часов, 4 часов и 5 часов перед быстрой промывкой, окрашиванием метиленовым синим и фотографированием. B: После каждой обработки при фиксированном времени, образцы катетера в двух повторностях обрабатывали буфером для лизиса, чтобы удалить остаточные биопленки, и бактериальные КОЕ оценивали на основании относительных световых единиц с использованием люциферазного реагента, калиброванного против известных концентраций бактерий.
[00037] ФИГУРА 13 изображает анализ методом титрования подсчеты КОЕ биопленки MRSA DEPC-катетера после 4-х часовой обработки катетерных биопленок с указанными концентрациями лекарственного средства в соответствии с исследованиями, показанными на ФИГУРАХ 11 и 12. Бактериальные КОЕ, оставшиесяся после обработки лекарственным средством оценивали на основании относительных световых единиц с использованием люциферазного реагента, калиброванного против известных концентраций бактерий. Биопленки, образованные штаммом ATCC BAA-42 Staphylococcus aureus на просветах катетеров из ди(2-этилгексил)фталата (DEHP) обрабатывали в течение 4 часов с указанными концентрациями PlySs2 или даптомицина (ДАП). Раствор Рингера с лактатом по отдельности включали в качестве контроля. После обработки, катетеры сливали и промывали, и колониеобразующие единицы (КОЕ) измеряли с использованием метода, основанного на высвобождении аденозинтрифосфата (АТФ) (набор BacTiter-Glo™ Microbial Cell Viability Assay kit). Красная линия указывает концентрации ДАП при 5000X минимальной подавляющей концентрации (МПК) и PlySs2 при 0,01X МПК, которые приводили в результате к примерно эквивалентным снижениям в биопленках в обработанных катетерных трубках. Обозначение: * = Нижняя граница обнаружения.
[00038] ФИГУРА 14 изображает активность лизина ClyS против биопленки S. aureus. Биопленки из BAA-42 MRSA обрабатывали указанными концентрациями лизина ClyS (1Х МПК 32 мкг/мл, 0,1X МПК 3,2 мкг/мл, 0,01X МПК 0,32 мкг/мл и 0,001X МПК 0,032 мкг/мл) или средой по отдельности в течение 24 часов. Каждую лунку промывали и окрашивали 2% кристаллическим фиолетовым.
[00039] ФИГУРА 15 предоставляет исследований биопленки in vivo у мышей с имплантатами подкожного катетера, обработанными лизином PlySs2 посредством различных способов введения. Биопленки выращивали на катетерах, катетер имплантировали в мышей, и мышей обрабатывали. Катетеры удаляли, окрашивали метиленовым синим, и окрашивание количественно определяли по поглощению при 600 нм. OD при 600 нм/г катетера наносили на график для каждого отрицательного контроля (без бактерий), контроля PlySs2 (без бактерий, холостая обработка), обработки средой, PlySs2, вводимого внутрибрюшинно (ВБ), PlySs2, вводимого внутривенно (ВВ), и PlySs2, вводимого подкожно (ПК).
[00040] ФИГУРА 16 изображает исследования зависимости от времени с оценкой люминального содержимого катетерных биопленок MRSA, обработанных лизином PlySs2 или даптомицином, и оценку бактериальной жизнеспособности и люминальной стерилизации с течением времени при обработке PlySs2 или антибиотиком даптомицином.
[00041] ФИГУРА 17 изображает анализ методом титрования исследования бактериальной биопленки катетера с штаммом CFS 313 Staphylococcal epidermidis (NRS34, VISE штамм). Окрашивание биопленки метиленовым синим показано через 4 часа обработки буфером или титрованными МПК PlySs2, равными 10X МПК, 1Х МПК (8 мкг/мл), 0,1X МПК, 0,01X МПК, 0,001X МПК и 0,0001X МПК PlySs2.
[00042] ФИГУРА 18 изображает анализ предотвращения образования биопленки бактерий BAA-42 MRSA, инокулированных в 24-луночных планшетах и комбинированных немедленно с буфером или PlySs2 при 1Х МПК (32 мкг/мл), или разбавлений, отмеченных до 0,0001X МПК. Планшеты инкубировали в течение 6 часов, промывали PBS, окрашивали кристаллическим фиолетовым для оценки генерации биопленки и фотографировали.
[00043] ФИГУРА 19 изображает анализ методом титрования окрашивания катетерной биопленки штамма CFS 553 MRSA (ATCC 43300) метиленовым синим после 4-часовой обработки буфером или титрованными МПК PlySs2, равных 10X МПК, 1Х МПК (16 мкг/мл), 0,1Х МПК, 0,01X МПК и 0,001X МПК PlySs2.
[00044] ФИГУРА 20 изображает анализ методом титрования окрашивания катетерной биопленки штамма CFS 992 MRSA (JMI 5381) метиленовым синим после 4-часовой обработки буфером или титрованными PlySs2, равных 10X МПК, 1Х МПК (32 мкг/мл), 0,1X МПК, 0,01X МПК и 0,001X МПК PlySs2.
[00045] ФИГУРА 21 изображает результаты сканирующей электронной микроскопии (СЭМ) 3-дневных катетерных биопленок S. aureus, обработанных PlySs2, промытых, фиксированных и сканированных. Показаны 0 минут, 30 секунд и 15 минут обработки PlySs2. 5000X увеличение.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00046] В соответствии с настоящим изобретением могут использоваться общепринятые методы молекулярной биологии, микробиологии и технологии рекомбинантных ДНК в пределах компетентности в данной области. Такие методы поясняются в полном объеме в литературе. См., например, Sambrook et al, "Molecular Cloning: Laboratory Manual" (1989); "Current Protocols in Molecular Biology" Volumes I-III [Ausubel, R.M., ed. (1994)]; "Cell Biology: Laboratory Handbook" Volumes I-III [J.E. Celis, ed. (1994))]; "Current Protocols in Immunology" Volumes I-III [Coligan, J.E., ed. (1994)]; "Oligonucleotide Synthesis" (M.J. Gait ed. 1984); "Nucleic Acid Hybridization" [B.D. Hames & S.J. Higgins eds. (1985)]; "Transcription And Translation" [B.D. Hames & S.J. Higgins, eds. (1984)]; "Animal Cell Culture" [R.I. Freshney, ed. (1986)]; "Immobilized Cells And Enzymes" [IRL Press, (1986)]; B. Perbal, "A Practical Guide To Molecular Cloning" (1984).
[00047] Следовательно, при появлении в настоящем описании, следующие термины будут иметь определения, приведенные ниже.
[00048] Термины "лизин(ы) PlySs", "лизин PlySs2", "PlySs2" и любые варианты, не перечисленные конкретно, могут применяться в настоящем описании взаимозаменяемо, и, при использовании на протяжении настоящей заявки и формулы изобретения относятся к белковому материалу, включающему одиночные белки или множество белков, и распространяются на эти белки, имеющие данные по аминокислотной последовательности, описанные в настоящем описании, и представленные на ФИГУРЕ 5 и SEQ ID NO: 1, и профиль активностей, приведенный в настоящем описании и в Формуле изобретения. Соответственно, белки, проявляющие по существу эквивалентные или измененные активности, предусматриваются аналогичным образом. Эти модификации могут быть преднамеренными, например, такими, как модификации, полученные посредством сайт-направленного мутагенеза, или могут быть случайными, такими, как модификации, полученные посредством мутаций у хозяев, которые являются продуцентами комплекса или его указанных субъединиц. Также, термины "лизин(ы) PlySs", "лизин PlySs2", "PlySs2" предназначены для включения в пределы их объема, белков, конкретно перечисленных в настоящем описании, а также всех по существу гомологичных аналогов, фрагментов или усечений и аллельных вариаций. Лизин PlySs2 описан в патентной заявке США 61/477,836 и заявке РСТ PCT/US2012/34456. Более недавняя статья Gilmer et al.описывает лизин PlySs2 (Gilmer DB et al.(2013) Antimicrob Agents Chemother Epub 2013 April 9 [PMID 23571534]).
[00049] Термин "ClyS", "лизин ClyS " относится к химерному лизину ClyS, с активностью против стафилококковых бактерий, включая Staphylococcus aureus, подробно описанному в WO 2010/002959 и описанному также в Daniel et al.(Daniel, et al.(2010) Antimicrobial Agents и Chemother 54(4): 1603-1612). Примерная аминокислотная последовательность ClyS предоставлена в SEQ ID NO: 5.
[00050] "Литический фермент" включает любой литический фермент бактериальной клеточной стенки, который лизирует одну или несколько бактерий в подходящих условиях и в течение значимого периода времени. Примеры литических ферментов включают, не ограничиваясь ими, различные амидазные литические ферменты клеточной стенки.
[00051] "Литический фермент бактериофага" относится к литическому ферменту, экстрагированному или выделенному из бактериофага, или синтезированному литическому ферменту с аналогичной белковой структурой, которая поддерживает функциональность литического фермента.
[00052] Литический фермент способен к специфическому расщеплению связей, которые присутствуют в пептидогликане бактериальных клеток, чтобы разрушить бактериальную клеточную стенку. В настоящее время также постулируют, что пептидогликан бактериальной клеточной стенки является высококонсервативным среди большинства бактерий, и расщепление только нескольких связей может разрушить бактериальную клеточную стенку. Примерами литических ферментов, которые расщепляют эти связи, являются мурамидазы, глюкозаминидазы, эндопептидазы или N-ацетил-мурамоил-L-аланинамидазы. Fischetti et al.(1974) сообщал, что фермент лизин стрептококкового фага C1 представлял собой амидазу. Garcia et al.(1987, 1990) сообщал, что Cp1 лизин из S. pneumoniae из фага Cp-1 представлял собой лизоцим. Caldentey и Bamford (1992) сообщали, что литический фермент из фага phi 6 Pseudomonas представлял собой эндопептидазу, расщепляющую пептидный мостик, образованный мело-диаминопимелиновой кислотой и D-аланином. Литические ферменты фага T1 и T6 E. coli представляют собой амидазы, как и литический фермент из фага (ply) Listeria (Loessner et al, 1996). Существуют также другие литические ферменты, известные в данной области, которые способны к расщеплению бактериальной клеточной стенки.
[00053] Термин "литический фермент, генетически кодируемый бактериофагом", включает полипептид, способный к лизису бактерий-хозяев, например, обладая по меньшей мере некоторой литической активностью по отношению к клеточной стенке против бактерий-хозяев. Полипептид может иметь последовательность, которая охватывает нативную последовательность литического фермента и его вариантов. Полипептид может быть выделен из разных источников, таких как, бактериофаг ("фаг"), или получен посредством рекомбинантных или синтетических методов. Полипептид может, например, содержать холин-связывающую часть по карбоксильной концевой стороне и может характеризоваться ферментной активностью, способной к расщеплению пептидогликана клеточной стенки (такой как амидазной активности для действия на амдные связи в пептидогликане) по аминоконцевой стороне. Были описаны литические ферменты, которые включают множество ферментных активностей, например, два ферментативных домена, таких как лизин PlyGBS. Дополнительно, были описаны другие литические ферменты, содержащие только каталитический домен и не содержащие домена для связывания с клеточной стенкой.
[00054] "Нативная последовательность ассоциированного с фагом литического фермента" включает полипептид, имеющий такую же аминокислотную последовательность, как и фермент, полученный из бактериального генома (т.е. профага). Такая нативная последовательность фермента может быть выделена или может быть получена р