Способ получения трансгенных растений пшеницы с использованием биобаллистики
Иллюстрации
Показать всеИзобретение относится к области сельскохозяйственной биотехнологии. Изобретение представляет собой способ получения трансгенных растений пшеницы методом биобаллистики, включающий в себя холодовой шок (низкотемпературную обработку растений-доноров), культивирование эксплантов перед трансформацией на среде для индукции каллусообразования, при этом среда содержит пиклорам, осмотическую обработку эксплантов перед трансформацией, при этом экспланты помещают на среду с высоким осмотическим давлением, чтобы вызвать плазмолиз, введение в клетки эксплантов чужеродной ДНК с использованием пушки PIG (particle inflow gun), пролиферацию трансформированных клеток без селективного отбора, регенерацию и селективный отбор трансгенных побегов, укоренение побегов на среде с селективным агентом при пониженной температуре, где для индукции каллусообразования у незрелых зародышей используют холодовой шок, где низкотемпературную обработку свежесобранных колосьев растений-доноров осуществляют при +4°C в течение 48 часов, для индукции каллусообразования у незрелых зародышей используют модифицированную питательную среду, содержащую 0,5 мг 2,4-D, 2 мг пиклорама, 40 г мальтозы, 0,5 г глютамина, 0,1 г гидролизата казеина, перед и после трансформации экспланты выдерживают на осмотической среде, содержащей 120 г/л мальтозы, при этом перед трансформацией в течение 4-6 часов, а после трансформации в течение 20-24 часов, после трансформации клетки экспланта проходят этап размножения (пролиферации) на питательной среде без селективного агента, укоренение побегов проводят на селективной среде и при пониженной температуре. Изобретение может быть использовано для создания трансгенных растений пшеницы с эффективностью до 7,8%. 1 ил., 3 табл., 6 пр.
Реферат
Область техники
Изобретение относится к области сельскохозяйственной биотехнологии, в частности к генетической инженерии высших растений, связанной с созданием трансгенных растений пшеницы. Изобретение может быть использовано в селекции новых сортов и гибридов пшеницы и востребовано семеноводческими компаниями и селекционными станциями, научно-образовательными учреждениями биотехнологического и сельскохозяйственного профиля.
Актуальность изобретения
Пшеница (Triticum aestivum L.) является наиболее важной культурой из всех зерновых культур для большинства населения мира. Она является наиболее важным продуктом питания около двух миллиардов человек (36% населения земного шара). Пшеница обеспечивает 55% углеводов и 20% пищевых калорий, потребляемых во всем мире (Breiman and Graur, 1995)
Потери урожая пшеницы в различных экологических условиях возникают из-за дефицита воды (засухи), засоленности, морозов, жары, грибных и вирусных болезней и насекомых. Каждый из перечисленных факторов среды может снижать урожайность в среднем на 15%. Для увеличения урожайности культуры, в условиях быстро меняющегося климата и сокращения природных ресурсов необходимы сорта нового поколения, широко адаптивные и эффективно использующие ресурсы среды.
За последние тридцать лет были разработаны различные трансгенные методики, позволяющие передавать гены от широкого спектра организмов злаковым культурам. Трансгенные технологии позволяют повысить устойчивость растений к болезням и абиотическим стрессам, улучшить качество зерна, увеличить уровень микроэлементов и витаминов в растении, модифицировать фотосинтез и повысить продуктивность и многое другое. Тем не менее наличие эффективного способа трансформации для введения чужеродной ДНК в геном является существенным барьером для большинства видов однодольных, в том числе кукурузы, риса, овса, ячменя, и в частности пшеницы.
Уровень техники
Первая биобаллистическая трансформация пшеницы осуществлена в 1992 году (Vasil et al, 1992). В настоящее время процесс создания трансгенных растений пшеницы методом биобаллистической трансформации считается достаточно рутинным. Однако это справедливо лишь для некоторых иностранных сортов, отзывчивых к трансформации, таких как Bobwhite, Florida, Fielder, Cadenza и др., но и в этих случаях эффективность трансформации не превышает 1-6% (Weeks I.T. et al, 1993, Chen W.P., et al, 1998, Uze M. et al, 1999, Jordan M.C 2000, Wright M. et al., 2001, Pellegrineschi A. et al. 2002, Greer M.S. et al. 2009, C. et al. 2012, Tassy C. et al. 2014).
Известен способ получения трансгенных растений пшеницы, см. Патент US 6153812 A «Rapid and efficient regeneration of transgenic wheat plants», 2000 г. Основным недостатком данного способа, как, впрочем, и большинства других известных методик, является то, что он разработан для модельного сорта Bobwhite зарубежной селекции и неэффективен для продуктивных сортов отечественной селекции, районированных на территории РФ.
Наиболее близким к данному изобретению является способ получения трансгенных растений пшеницы, см. Патент US 5610042 A «Methods for stable transformation of wheat» 1997. Метод заключается в следующем: незрелые зародыши размером 1-2,5 мм помещают на среду Мурашиге и Скуга (Murashige Т. & Skoog F. 1962) с добавлением 5 или 10 мг/л 2,4-D, 13,7% мальтозы, 100 мг/л пролина, 100 мг/л мио-инозитола и 0,7-0,8% фитоагара или 0,1-0,2% герлита. Зародыши культивируют три недели до образования каллуса. Затем каллус отделяют от зародышей и помещают в жидкую осмотическую среду с перемешиванием на магнитной мешалке на несколько часов и далее переносят на твердую осмотическую среду. Затем с помощью генной пушки (DuPont Biolistic Helium device) трансформируют клетки каллуса. Селекцию начинают через 2-6 недель трансформации. В качестве селективного агента используют метотрексат. Основным недостатком способа является то, что для селективного отбора используют малораспространенный селективный агент - метотрексат. К тому же данный способ также разработан для линий пшеницы зарубежной селекции.
Таким образом, задача создания эффективной методики трансформации, пригодной для широкого круга генотипов пшеницы, особенно отечественной селекции, сохраняет свою актуальность.
Дополнительные сложности в работе по разработке такой методики возникают в связи с тем, что большинство разработанных методик осуществлены на модельных сортах с высоким регенерационным и трансформационным потенциалом и требуют дополнительных экспериментальных доработок для внедрения полученных результатов в производство. Это обусловило необходимость перехода от работы с модельными генотипами к использованию продуктивных коммерческих сортов, большинство из которых, как выяснилось, трансформируются значительно хуже, чем лабораторные. Не являются исключением в этом смысле и сорта пшеницы российской селекции.
Недавно было показано положительное влияние пиклорама (ауксин подобного вещества) на индукцию каллусообразования пшеницы (Gorbatyuk I.R. et al. 2015). В нашем методе был впервые использован пиклорам для повышения образования морфогенного каллуса у незрелых зародышей пшеницы отечественных сортов.
С учетом всего вышеописанного при разработке настоящего изобретения ставилась задача создания эффективного способа получения трансгенных растений пшеницы, пригодного для широкого круга перспективных в коммерческом отношении отечественных сортов как яровых, так и озимых. Ожидаемым техническим результатом было повышение эффективности и унификация процедуры трансформации.
Раскрытие изобретения
Настоящее изобретение представляет собой разработанный эффективный способ регенерации трансгенных растений пшеницы. Растения, полученные данным способом, являются фенотипически нормальными и полностью фертильными. Трансгенная вставка целевого гена передается потомству в соответствии с законами Менделя.
Эффективную регенерацию трансгенных побегов данный способ обеспечивает, если в качестве мишени для трансформации используются незрелые зародыши с морфогенным каллусом, полученные от растений-доноров после холодового шока. Морфогенный каллус получают на среде, содержащей пиклорам. Для введения чужеродной ДНК применяют биобаллистический способ - прямое введение генов с помощью пушки PIG (particle inflow gun). Также может быть использована любая генная пушка, например фирмы Biorad или DuPont. Перед баллистикой экспланты выдерживают на осмотической среде с мальтозой. Трансформированные клетки размножают на среде для пролиферации. Селективный отбор трансформированных побегов начинают на этапе регенерации побегов. Укоренение побегов проводят при пониженных температурах на средах с селективным агентом. Данная система трансформации может быть использована с различными маркерными системами отбора, в том числе селекция с помощью гербицидов, таких как глифосат и биалафос (фосфинотрицин), а также антибиотиками, такими как канамицин, гигромицин.
В зависимости от поставленной задачи в способе по изобретению могут использоваться различные генетические конструкции. Для создания растений, устойчивых к различным гербицидам, может быть проведена трансформация генами, определяющими устойчивость к глифосату (ген epsps), фосфинотрицину (ген bar), для повышения устойчивости к абиотическим стрессам введения генов транскрипционных факторов, таких как bZIP, DREB, MYB/MYC, NAC и WRKY. Для создания растений пшеницы, устойчивой к насекомым, могут использоваться гены семейства Bt и для устойчивости к грибным заболеваниям - гены дефензинов, такие как MtDef4. Для контроля экспрессии в трансгенных растениях могут быть использованы злакоспецифические (Act-1, Ubi) и индуцибельные промоторы типа rd29A и WRKY71.
Представленная система получения трансгенных растений пшеницы занимает от 2-х до 3-х месяцев. Частоты трансформации новой системы в 2-3 раза выше, чем методы, используемые в настоящее время в других лабораториях.
Данное изобретение относится к способу получения растений пшеницы, содержащих чужеродную ДНК, включающему следующие стадии: а) низкотемпературную обработку растений-доноров; б) культивирование эксплантов на среде для индукции каллусообразования; в) осмотическую обработку эксплантов перед трансформацией; г) введение в клетки эксплантов чужеродной ДНК с использованием пушки PIG (particle inflow gun); д) пролиферацию трансформированных клеток без селективного отбора; е) регенерацию и селективный отбор трансгенных побегов; ж) укоренение побегов на среде с селективным агентом при пониженной температуре.
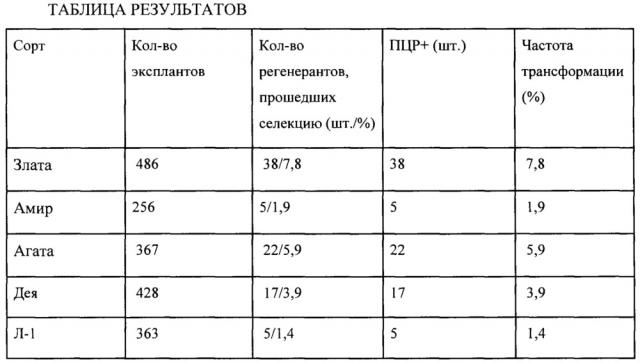
Методика была использована на яровых и озимых сортах мягкой пшеницы отечественной селекции - Злата, Амир, Агата, Дея и Л-1. Эффективность трансформации оказалась высокой для всех исследуемых сортов, независимо от генотипа составила от 1,4 до 7,8%. Данный показатель свидетельствует о высокой эффективности предлагаемого способа.
Краткое описание рисунков
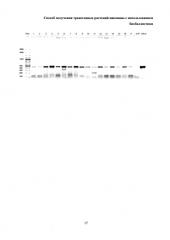
Рисунок - Электрофоретический анализ ПЦР-продуктов на наличие гена bar в побегах пшеницы сорта Злата, трансформированных ДНК с геном bar.
Дорожки: 1-17 - ПЦР на препаратах ДНК из трансформированных линий; #2bar - положительный контроль, продукт ПЦР на плазмидной ДНК (0,1 нг/реакцию), использованной для трансформации растений; UnP - отрицательный контроль ПЦР на препаратах ДНК из нетрансформированных растений; 100bp - маркер размера (GeneRuler 100bp, ThermoScientific).
Осуществление изобретения
Использование качественных растений-доноров является необходимым условием для получения эффективной регенерации побегов in vitro. Растения могут быть выращены как в открытом грунте, так и в условиях искусственного климата. Помимо обязательного предохранения растений от таких заболеваний, как мучнистая роса, карликовая ржавчина, корневые гнили, и насекомых (паутинный клещ, тля, трипсы и т.д.), должны быть созданы оптимальные условия вегетации (в условиях искусственного климата) - качественное освещение, водоснабжение, почвенные субстраты, удобрения, влажность и качество воздуха.
Для введения генетического материала в клетки была использована пушка для биобаллистики - PIG (particle inflow gun), но может быть приспособлена любая другая генная пушка, при дополнительной отработке баллистических параметров.
Для отбора трансгенных побегов можно воспользоваться различными селективными системами отбора, в том числе системами селекции с помощью гербицидов, таких как глифосат и биалафос (фосфинотрицин), а также антибиотиков, таких как канамицин, гигромицин. В примерах, приведенных ниже, был использован плазмидный вектор pUBar, несущий кассету экспрессии гена bar под контролем промотора Ubi1-гена, кукурузы и Tnos терминатора гена нопалинсинтазы.
Для подтверждения интеграции гетерологичной последовательности в геном пшеницы может быть использован любой способ выделения растительной ДНК с последующим ПЦР-анализом.
Методика
1. Холодовой шок для использованных эксплантатов: низкотемпературная обработка растений-доноров. Собирают незрелые колосья пшеницы на 10-14 день после опыления. Срезанные колосья помещают срезанными концами в воду в холодильную камеру при 4±2°С на 48 ч.
2. Состав сред и условия культивирования
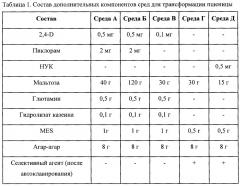
Растительный материал культивировался при температурах в диапазоне от 4 до 25°С, либо в темноте, либо на свету, с 16-часовым фотопериодом (16/8 - день/ночь). Для освещения использовали лампы Osram L36/77 FLUORA и F36W/33 Cool White. В состав всех питательных сред входили макро- и микросоли MS (Murashige Т. & Skoog F. 1962), витамины В5 (Gamborg O.L. et al., 1968), фитогормоны и углеводы (Таблица 1). pH среды доводили до 5,8 перед автоклавированием. Стерилизацию среды осуществляли в автоклаве при давлении 1.2 атмосферы в течение 15 минут.
3. Стерилизация и культивирование эксплантов на среде для индукции каллусообразования
Незрелые зерновки вышелушивают из колосков и стерилизуют 70%-ным этиловым спиртом 6 мин. Промывают стерильной дистиллированной водой 3 раза по 5 мин.
Зародыши размером 0,7-1,5 мм изолируют и помещают на среду А для индукции каллусообразования щитком вверх, по 50 шт. на чашку Петри (9 см), и культивируют 14-18 дней в темноте при 23±2°С до образования каллуса.
В процессе каллусообразования происходит образование двух типов каллусов - морфогенного каллуса (МК) и неморфогенного каллуса (НМК). НМК представляет собой рыхлые, белые, сильно обводненные массы клеток, характеризующиеся высокой скоростью обводнения и увеличения массы и отсутствием морфогенеза, МК - плотный, желтоватый, медленно увеличивающийся в массе каллус, представленный плотно сцепленными между собой меристемными глобулами. На 7 и 14 день после культивирования проводят визуальную оценку образующегося каллуса, МК оставляют вместе с зародышем и используют для трансформации, а НМК отсекают и изымают из культуры in vitro (ВАЖНО не отделять зародыш от морфогенного каллуса, а оставлять их вместе).
4. Осмотическая обработка эксплантов перед трансформацией
Перед трансформацией зародыши с каллусом выкладывают на осмотическую среду (Б), содержащую в качестве осмотического агента мальтозу (120 г/л). Экспланты располагают в центре чашки Петри в виде кольца диаметром 40 мм по 30-40 шт./чашку и выдерживают 4-6 часов до баллистики и 20-24 часа после.
5. Биобаллистическая трансформация эксплантов
Стерилизация микрочастиц: Для бомбардировки используют вольфрамовые микрочастицы М10 (Sylvania Chemical/Metals), размер частиц в смеси варьирует 0,1-7 мкм, наибольшее количество частиц 80% имеет размер 0,4-2 мкм. Навеску микрочастиц весом 50 мг стерилизуют спиртом (500 мкл 96% спирта) в течение 15 мин. Осаждение частиц проводят на центрифуге при 14000 об/мин в течение 6-8 мин. Промывание частиц проводят три раза стерильной водой. Конечный объем смеси частиц в воде составляет 500 мкл.
Преципитация ДНК:
1. В стерильный эппендорф поместить 25 мкл смеси частиц, предварительно смесь ресуспендировать и отбор брать из нижней части эппендорфа;
2. Добавить 5 мкл ДНК, ресуспендировать;
3. Добавить 25 мкл 2,5 М CaCl2 ресуспендировать;
4. Немедленно добавить 5-10 мкл 0,1 М спермидина, ресуспендировать до стадии выпадения смеси частиц в осадок;
5. Эппендорф поместить на лед на 5 мин;
6. Отобрать пипеткой 50 мкл смеси из надосадка, не затронув частицы;
7. Для выстрела использовать 2,5 мкл смеси (приготовленной смеси 15 мкл должно хватить на 4-5 выстрелов по 2,5 мкл).
Исходные параметры баллистической трансформации:
1. Объем используемого газа при выстреле - 6 см3;
2. Сечение ячейки рассекающего фильтра - 500 мкм;
3. Отрицательное давление вакуума в камере при выстреле - 30 мм ртутного столба;
4. Расстояние от источника частиц до ткани мишени 12-17 см;
5. Давление гелия - 0,6-0,7 МПа = 6-7 атм (1 мегапаскаль [МПа] = 9.869 физическая атмосфера [атм]).
6. Каждая чашка обстреливается дважды.
После первого выстрела каллусы переворачивают и снова выкладывают по кругу диаметром 40 мм.
Генетическая конструкция для баллистической трансформации должна содержать селективную ДНК-последовательность, которая позволяет проводить селективный отбор трансформированных побегов.
6. Пролиферация трансформированных клеток
После трансформации (через 20-24 часа) каллусы переносят на среду (В) для пролиферации каллуса на 3 недели в темноте при 23±2°С. Если в течение этих трех недель наблюдается начало побегообразования, то зародыши с каллусом переносят на среду для регенерации с селективным агентом раньше истечения срока пролиферации.
7. Регенерация и селективный отбор трансгенных побегов
Зародыши с каллусом (не разделяя) помещают на селективную среду Г для регенерации и селекции побегов на 3 недели, при освещении 5000 лк и температуре 23±2°С.
8. Укоренение побегов на среде с селективным агентом при пониженных температурах
Образующиеся в процессе селекции зеленые побеги помещают в пробирки со средой Д для укоренения при освещении 5000-10000 лк температуре 20±2°С. Укоренившиеся побеги пересаживают в перлит во влажную среду для адаптации на 1-2 недели при 15-17°С. Адаптированные растения переносят в почву до полного созревания в условиях теплицы.
Побеги озимых сортов должны проходить этап яровизации, после переноса их в перлит. Для этого растения выдерживают при температуре 3±2°С в течение 6 недель при освещении 5000 лк.
9. Отбор трансгенных растений
Выделение ДНК. Тщательно растереть растительную ткань (количество, равное 2-3 листовым дискам, выдавленным крышкой Eppendorf) в жидком азоте. Суспендировать в 250 мкл буфера [0,2 М Tris-HCl pH 9,0; 0,4 М LiCl; 25 mM EDTA; 1% SDS]. Центрифугировать в течение 10 минут на микроцентрифуге на максимальной скорости. Отобрать 175 мкл супернатанта в новую пробирку и добавить 175 мкл изопропанола. Перемешать содержимое, перевернув пробирку 4-5 раз. Центрифугировать на максимальной скорости в течение 15 минут. Высушить осадок, удалив супернатант и оставив пробирку в перевернутом состоянии на фильтровальной бумаге на 30 минут. Добавить 110 мкл стерильной воды и растворять при комнатной температуре в течение 30 минут на встряхивателе. Осадить остаточный клеточный дебрис центрифугированием в течение 5 минут. 100 мкл раствора геномной ДНК перенести в новую пробирку и добавить 70 мкл фенола, насыщенного трис-буфером pH-8,0, поместить во встряхиватель, а затем оставить на 5 минут на столе. Центрифугировать на максимальной скорости в течение 10 минут. 90 мкл верхней фазы перенести в новую пробирку и добавить 9 мкл ЗМ ацетата натрия (рН-6,0) и 250 мкл этанола, перемешать переворачиванием 10 раз. Поставить в морозилку не менее чем на 20 минут при -20°С. Центрифугировать на максимальной скорости в течение 10 минут, отобрать остатки пипеткой. Добавить 125 мкл этанола 70%, поставить в морозилку не менее чем на 10 минут при -20°С. Центрифугировать на максимальной скорости в течение 10 минут, затем пипеткой отобрать жидкость максимально, осадок подсушить 5-10 минут. Осадок растворить в 50 мкл стерильной воды.
ПЦР-анализ образцов ДНК. Для проведения ПЦР используют ДНК-амплификатор (Bio-Rad Т100 Termocycler). Условия проведения ПЦР: денатурация 95°С - 4 мин, 35 циклов (94°С - 30 сек, 55°С - 30 сек, 72°С - 45 сек) и окончательная достройка - 7 мин. В качестве матрицы используют выделенные образцы геномной ДНК, в качестве прамеров - bar1 (5'-TCAACCACTACATCGAGACAAG-3') и bar2 (5'-TGAAGTCCAGCTGCCAGAAACC-3').
Состав реакционной смеси для ПЦР (на одну микропробирку):
- Праймеры - по 1 мкл каждого (10 мкМ);
- 10Х Taq-буфер - 2,5 мкл;
- 10 мМ dNTP - 0,5 мкл;
- 25 мМ MgCl2 - 2 мкл;
- Taq полимераза - 0,2 мкл (1 ед.);
- ДНК-матрица - 2 мкл;
- Н2О - до 25 мкл.
Для центрифугирования используют настольную микроцентрифугу (Eppendorf 5415С) с максимальной скоростью вращения ротора 14000 об/мин. Термостатирование образцов осуществляют в сухом термостате (Eppendorf Termomixer).
Анализ продуктов ПЦР осуществляют методом электрофореза в агарозном геле с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 мин при комнатной температуре) и фотографированием полученной картины в ультрафиолетовом свете (длина волны - 260-280 нм) цифровым фотоаппаратом. Обработку оцифрованной информации проводят при помощи пакета Adobe Photoshop 7.0.
Заключение о встраивании в геном растения чужеродного гена делают на основании появления продукта ПЦР с ожидаемым (в зависимости от используемых специфических праймеров) размером.
Далее приведены конкретные примеры осуществления изобретения, которые не могут рассматриваться как ограничивающие его объем.
Пример 1. Получение трансгенных растений яровой пшеницы сорта Злата, содержащих ген bar
Растения пшеницы сорта Злата срезали на 10 день после опыления. Срезанные колосья в количестве 40 шт. помещали в сосуды с водой и в течение 2 суток выдерживали в холодильной камере при температуре 4°С. После холодового шока из колосьев вышелушивали незрелые зерновки в количестве 600 шт. Зерновки стерилизовали согласно Методике. Выделение незрелых зародышей проводили с помощью скальпеля под стереомикроскопом при увеличении 10Х. Зародыши размером 0,7-1,5 мм изолировали и помещали на среду А щитком вверх, по 50 шт. на чашку Петри (9 см), и культивировали в темноте при 23°С до образования каллуса. На 7 и 15 день НМК удаляли, а МК оставляли вместе с зародышем. На 16-й день культивирования экспланты (зародыши с МК) переносили на осмотическую среду Б по 30 шт на чашку Петри за 6 часов до трансформации. Для трансформации было отобрано 486 эксплантов. Перед обстрелом экспланты выкладывали в виде круга с диаметром - 4 см и производили обстрел каллусов при помощи баллистической пушки PIG. Условия баллистики приведены в Методике. После трансформации через 24 часа каллусы переносили на среду В и культивировали в темноте в течение 18 дней при температуре 23°С. Размноженный каллус переносили на среду Г для регенерации с селективным агентом - фосфинотрицином в концентрации 5 мг/л и культивировали 25 дней, с пересадкой на свежую селективную среду через 12 дней после начала селекции. Образующиеся в процессе селекции зеленые побеги помещали в пробирки со средой Д для укоренения с селективным агентом (3 мг/л фосфинотрицина) и культивировали при освещении 5000 лк и температуре 22°С. Укоренившиеся побеги пересаживали в перлит для адаптации на 2 недели при 15°С. Адаптированные растения переносили в сосуды (V=4 л) с почвой до полного созревания в условиях теплицы. В процессе селекции было получено 112 зеленых побегов, из которых 38 укоренилось. Все побеги были проверены на наличие гена bar методом ПЦР.
Пример 2. Получение трансгенных растений яровой пшеницы сорта Амир, содержащих ген bar
Растения пшеницы срезали на 12 день после полного опыления колоса. Срезанные колосья в количестве 35 шт ставили в сосуды с водой и выдерживали в холодильной камере при температуре 4-5°С в течение 2 суток. После холодового шока из колосьев вышелушивали незрелые зерновки в количестве 390 шт. Зерновки стерилизовали по вышеприведенной Методике. Выделение незрелых зародышей проводили так же, как в Примере 1. Выделенные зародыши размером от 0,7 до 1,5 мм переносили на среду А, щитком вверх, в количестве 60 шт./чашку Петри и культивировали в течение 16 дней в темноте при температуре 23±2°С до образования каллуса. МК оставляли вместе с зародышем и использовали для трансформации, НМК удаляли на 8 и 15 сутки культивирования. Трансформацию проводили на 17 день после начала культивирования и проводили как описано в Методике и Примере 1. Для трансформации было отобрано 256 эксплант. После трансформации через 21 час каллусы с осмотической среды переносили на среду для пролиферации каллуса. Образованные побеги через 20 дней переносили на среду для регенерации с селективным агентом. Образующиеся в процессе селекции зеленые побеги в количестве 67 шт. помещали в пробирки со средой для укоренения при освещении 5000 лк, температуре 23°С. Укоренившиеся 5 побегов пересаживали в перлит во влажную среду для адаптации на 16 дней при 15°С. Адаптированные растения переносили в сосуды (V=2 л) с почвой до полного созревания в условиях теплицы.
Пример 3. Получение трансгенных растений яровой пшеницы сорта Эстер, содержащих ген bar
После цветения и опыления на 11 день пшеничные побеги длиной 40 см срезали и колосья в количестве 50 шт, в течение 2 суток выдерживали в холодильной камере при температуре 4°С. После холодового шока из колосьев вышелушивали незрелые зерновки в количестве 600 шт. Стерилизацию и выделение проводили, после этого зерновки стерилизовали 70% этанолом, непрерывно помешивая в течение 6 минут и промывая стерильной водой трижды по 5 минут. Выделение незрелых зародышей проводили с помощью скальпеля под стереомикроскопом при увеличении 10Х. Выделенные зародыши размером от 0,8 до 1,7 мм переносим в чашки Петри на среду А, щитком вверх, в количестве 50 шт. Чашки с зародышами размещают в климакамере и культивируют в течение 18 дней в темноте при температуре 24±2°С до образования каллуса. НМК отсекали на 6 и 15 сутки, МК оставляли вместе с зародышем и использовали для трансформации. На 17 день эксплантаты, используемые в эксперименте, в количестве 510 шт., переносили на осмотическую среду по 40 шт на чашку Петри и производили обстрел каллусов при помощи баллистической пушки. Экспланты выкладывали на среду по кругу диаметром 40 мм. Обстреливали дважды. После трансформации через 20 часов каллусы переносили на среду для пролиферации каллуса в темноте. Образованные побеги через 17 дней переносили на среду для регенерации с селективным агентом - фосфинотрицином в концентрации 5 мг/л и культивировали 40 дней с пересадкой на свежую селективную среду. Образующиеся в процессе селекции зеленые побеги, в количестве 70 шт., помещали в пробирки со средой для укоренения при освещении 5000 люкс и температуре 20°С. Укоренившиеся побеги, в количестве 5 шт., пересаживали в перлит во влажную среду для адаптации на 12 дней при 16°С. Адаптированные растения переносили в сосуды (V=4 л) с почвой до полного созревания в условиях теплицы.
Пример 4. Получение трансгенных растений пшеницы сорта Агата, содержащих ген bar
Пшеничные побеги длиной около 30 см срезали после цветения и опыления на 12 день. Срезанные колосья в количестве 40 шт ставили в сосуды с водой и в течение 2 суток выдерживали в холодильной камере при температуре 4°С и после холодового шока из колосьев вышелушивали незрелые зерновки, в количестве 430 шт. После этого зерновки стерилизовали 70% этанолом, выделение незрелых зародышей проводили с помощью скальпеля под стереомикроскопом при увеличении 10Х. Выделенные зародыши размером от 0,8 до 1,4 мм переносим в чашки Петри на среду А, щитком вверх, в количестве 60 шт. Чашки с зародышами размещают в климакамере и культивируют в течение 18 дней в темноте при температуре 24±2°С до образования каллуса. Образовавшийся морфогенный каллус оставляли вместе с зародышем и использовали для трансформации, неморфогенную часть отсекали и убирали из эксперимента. Далее в эксперименте было задействовано 367 эксплантов. На 18 день эксплантаты, используемые в эксперименте, переносили на осмотическую среду по 30 шт на чашку Петри в форме круга диаметром 40 мм, и производили обстрел каллусов при помощи баллистической пушки. После трансформации через 20 часов каллусы переносили на среду для пролиферации каллуса в темноте, каждые 3 недели. Образованные побеги через 20 дней переносили на среду для регенерации с селективным агентом (5 мг/л фосфинотрицина). Образующиеся в процессе селекции зеленые побеги помещали в пробирки со средой для укоренения при освещении 5000 лк температуре 20°С, всего было получено 83 побега данного сорта. Из них укоренилось 22 побега. Укоренившиеся побеги пересаживали в перлит во влажную среду для адаптации на 15 дней при 15°С. Адаптированные растения переносили в сосуды (V=2 л) с почвой до полного созревания в условиях теплицы.
Пример 5. Получение трансгенных растений пшеницы сорта Дея, содержащих ген bar
После цветения и опыления на 12 день пшеничные побеги длиной 40 см срезали и помещали в сосуды с водой и в течение 2 суток выдерживали в холодильной камере при температуре 4°С. После холодового шока из 50 срезанных колосьев вышелушивали незрелые зерновки, в количестве 600 шт. После этого зерновки стерилизовали 70% этанолом и выделяли незрелые зародыши с помощью скальпеля под микроскопом при увеличении 10Х. Выделенные зародыши размером от 0,7 до 1,4 мм переносили в чашки Петри на среду А, щитком вверх, в количестве 60 шт. Чашки с зародышами размещали в климакамере и культивировали в течение 16 дней в темноте при температуре 24±2°С до образования каллуса. Морфогенный каллус оставляли вместе с зародышем и использовали для трансформации, НМК удалялся на 10 сутки. На 16 день эксплантаты, используемые в эксперименте (428 шт.), переносили на осмотическую среду по 30 шт на чашку Петри в кольцо диаметром 40 мм и производили обстрел каллусов при помощи баллистической пушки дважды. После трансформации через 23 часа каллусы переносили на среду для пролиферации каллуса в темноте. Образованные побеги через 17 дней переносили на среду для регенерации с селективным агентом - фосфинотрицином, 5 мг/л. Образующиеся в процессе селекции 55 зеленых побегов помещали в пробирки со средой для укоренения при освещении 7000 лк температуре 17°С. Укоренившиеся побеги пересаживали в перлит во влажную среду для адаптации на 2 недели при 15°С (12 шт.). Затем побеги проходили этап яровизации после переноса их в почву. Для этого растения выдерживали при температуре 2-5°С в течение 42 дней при освещении 7000 лк. Адаптированные растения переносили в сосуды (V=10 л) до полного созревания в условиях теплицы.
Пример 6. Получение трансгенных растений пшеницы линии Л1, содержащих ген bar
После цветения и опыления на 11 день пшеничные побеги длиной 30 см срезали. Срезанные колосья в количестве 50 шт ставили в сосуды с водой и в течение 2 суток выдерживали в холодильной камере при температуре 4°С. После холодового шока из колосьев вышелушивали незрелые зерновки, в количестве 500 шт. Затем зерновки стерилизовали 70% этанолом, непрерывно помешивали в течение 6 минут по приведенной выше методике и трижды промывали стерильной водой по 5 минут. Выделяли незрелые зародыши с помощью скальпеля под микроскопом при увеличении 10Х. Выделенные зародыши размером от 0,8 до 1,5 мм переносили в чашки Петри на среду А щитком вверх в количестве 50 шт. Чашки с зародышами размещали в климакамере и культивировали в течение 17 дней в темноте при температуре 24±2°С до образования каллуса. Морфогенный каллус оставляли вместе с зародышем и использовали для трансформации, в количестве 363 шт. На 17 день эксплантаты, используемые в эксперименте, переносили на осмотическую среду по 30 шт на чашку Петри, диаметр кольца 40 мм, и производили обстрел каллусов при помощи баллистической пушки. Обстрел проводили дважды, после первого раза каллусы переворачивали и укладывали на прежнее место. После трансформации через 20 часов каллусы переносили на среду для пролиферации каллуса в темноте. Образованные побеги через 15 дней переносили на среду для регенерации с селективным агентом в концентрации 5 мг/л фосфинотрицина. Образующиеся в процессе селекции зеленые побеги (35 шт.) помещали в пробирки со средой для укоренения при освещении 7000 лк температуре 17°С. Было укоренено 5 побегов. Укоренившиеся побеги пересаживали в перлит во влажную среду для адаптации на 2 недели при 16°С. Затем побеги проходили этап яровизации после переноса их в почву. Для этого растения выдерживали при температуре 2-5°С в течение 40 дней при освещении 7000 лк. Адаптированные растения переносили в сосуды (V=10 л) до полного созревания в условиях теплицы при повышенной влажности.
Литература
1. Breiman A.G.D. 1995. Wheat evaluation // Israel J Plant Sci. - T. 43. - C. 58-95.
2. Vasil V. et al. Herbicide resistant fertile transgenic wheat plants obtained by microprojectile bombardment of regenerable embryogenic callus // Nature Biotechnology. - 1992. - T. 10. - №.6. - C. 667-674.
3. Weeks J.Т., Anderson O.D., Blechl A.E. Rapid production of multiple independent lines of fertile transgenic wheat (Triticum aestivum) // Plant Physiology. - 1993. - T. 102. - №.4. - C. 1077-1084.
4. Chen W.P. et al. Introduction and constitutive expression of a rice chitinase gene in bread wheat using biolistic bombardment and the bar gene as a selectable marker // Theoretical and Applied Genetics. - 1998. - T. 97. - №.8. - C. 1296-1306.
5. Uze M., Potrykus I., Sautter C. Single-stranded DNA in the genetic transformation of wheat (Triticum aestivum L.): transformation frequency and integration pattern // Theoretical and Applied Genetics. - 1999. - T. 99. - №.3-4. - C. 487-495.
6. Jordan M.C. Green fluorescent protein as a visual marker for wheat transformation // Plant Cell Reports. - 2000. - Т. 19. - №.11. - C. 1069-1075.
7. Wright M. et al. Efficient biolistic transformation of maize (Zea mays L.) and wheat (Triticum aestivum L.) using the phosphomannose isomerase gene, pmi, as the selectable marker // Plant cell reports. - 2001. - T. 20. - №.5. - C. 429-436.
8. Pellegrineschi A. et al. The effect of pretreatment with mild heat and drought stresses on the explant and biolistic transformation frequency of three durum wheat cultivars // Plant Cell Reports. - 2002. - T. 20. - №.10. - C. 955-960.
9. Greer M.S., Kovalchuk I., Eudes F. Ammonium nitrate improves direct somatic embryogenesis and biolistic transformation of Triticum aestivum // New biotechnology. - 2009. - T. 26. - №. 1. - C. 44-52.
10. Tassy C. et al. Biolistic transformation of wheat: increased production of plants with simple insertions and heritable transgene expression // Plant Cell, Tissue and Organ Culture (PCTOC). - 2014. - T. 119. - №.1. - C. 171-181.
11. С., Jones H.D., L. Biolistic-and Agrobacterium-mediated transformation protocols for wheat // Plant Cell Culture Protocols. - 2012. - C. 357-384.
12. US 6153812 A (2000-11-28). Rapid and efficient regeneration of transgenic wheat plants.
13. US 5610042 A (1997-03-11). Methods for stable transformation of wheat.
14. Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiologia plantarum. - 1962. - T. 15. - №.3. - C. 473-497.
15. Gamborg O.L., Miller R.A., Ojima K. Nutrient requirements of suspension cultures of soybean root cells // Experimental cell research. - 1968. - T. 50. - №.1. - C. 151-158.
16. Gorbatyuk I.R. et al. Effect of synthetic auxin like growth regulators on callus regenerative ability of common wheat Vc. Zymoyarka // Biotechnologia Acta. - 2015. - T. 8. - №.1.
Способ получения трансгенных растений пшеницы методом биобаллистики, включающий в себя холодовой шок (низкотемпературную обработку растений-доноров), культивирование эксплантов перед трансформацией на среде для индукции каллусообразования, при этом среда содержит пиклорам, осмотическую обработку эксплантов перед трансформацией, при этом экспланты помещают на среду с высоким осмотическим давлением, чтобы вызвать плазмолиз, введение в клетки эксплантов чужеродной ДНК с использованием пушки PIG (particle inflow gun), пролиферацию трансформированных клеток без селективного отбора, регенерацию и селективный отбор трансгенных побегов, укоренение побегов на среде с селективным агентом при пониженной температуре, отличающийся тем, что для индукции каллусообразования у незрелых зародышей используют холодовой шок, где низкотемпературную обработку свежесобранных колосьев растений-доноров осуществляют при +4°C в течение 48 часов, для индукции каллусообразования у незрелых зародышей используют модифицированную питательную среду, содержащую 0,5 мг 2,4-D, 2 мг пиклорама, 40 г мальтозы, 0,5 г глютамина, 0,1 г гидролизата казеина, перед трансформацией в течение 4-6 часов и после трансформации в течение 20-24 часов экспланты выдерживают на осмотической среде, содержащей 120 г/л мальтозы, после этого клетки экспланта проходят этап размножения (пролиферации) на питательной среде без селективного агента, укоренение побегов проводят на селективной среде и при пониженной температуре.