Способ молекулярного маркирования, основанный на микросателлитных локусах, предназначенный для идентификации генотипов березы
Иллюстрации
Показать всеИзобретение относится к областям молекулярной биологии и генетики растений, в частности к способу молекулярно-генетической идентификации растений березы на основе микросателлитных (SSR) локусов. Способ включает выделение ДНК из исследуемых образцов, проведение ПЦР, электрофоретическое разделение продуктов амплификации ДНК, документирование результатов ПЦР, определение длин амплифицированных фрагментов ДНК путем сравнения со стандартами молекулярной массы, получение таблицы многолокусных генотипов по микросателлитным локусам, сравнение полученных генотипов с генотипами исходных растений с целью установления идентичности особей и оценку вероятности встречаемости мультилокусных генотипов и случайного совпадения неродственных или родственных генотипов. Изобретение позволяет осуществлять надежную и достоверную идентификацию генотипов березы на индивидуальном уровне. Изобретение может быть использовано для широкого спектра видов рода Betula, являясь, таким образом, универсальным. 4 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Изобретение относится к молекулярной биологии и генетике растений, в частности к способу молекулярно-генетической идентификации особей березы на основе генетических маркеров - микросателлитных локусов. Предложенное изобретение позволяет осуществлять надежную и достоверную идентификацию генотипов березы на индивидуальном уровне и может быть использовано для широкого спектра видов рода Betula, являясь, таким образом, универсальным.
Микросателлитные локусы представляют собой участки дезоксирибонуклеиновой кислоты (ДНК), содержащие простые, короткие тандемно повторяющиеся моно-, ди-, три-, тетра- и пентануклеотидные мотивы, которые локализованы в геномах большинства видов эукариот. Отсюда их альтернативные названия - локусы с простыми повторами последовательностей (SSR, от английского Simple Sequence Repeat) или короткие тандемные повторы (STR, от английского Short Tandem Repeats). Микросателлитные маркеры могут быть локализованы в транскрибируемых или не транскрибируемых участках генома. Микросателлитные маркеры наилучшим образом подходят для идентификации и дискриминации (различения) индивидуальных генотипов, поскольку содержат большое число аллелей (у древесных растений до 10-20 и более на локус) и возможность использовать наборы локусов позволяет получать уникальные генетические «портреты» особей с крайне низкой вероятностью случайного повторения (от 10-4 до <10-15 в зависимости от числа локусов и аллелей) (Brown et al., In methods of genome analysis in plants, Ed. P.P. Jauhar, N.-Y., London, Tokyo, 1996, P. 147-159).
В качестве экономических преимуществ использования микросателлитных маркеров можно отметить, что их анализ, основанный на применении полимеразной цепной реакции (ПЦР), не требует высокого количества и качества матричной ДНК (10-100 нг на реакцию). Благодаря использованию специфических длинных ПЦР-праймеров достигается высокая воспроизводимость результатов микросателлитного анализа. При дальнейшем совершенствовании технологии возможно увеличение производительности анализа путем применения мультиплексных реакций (амплификация нескольких локусов с меченными флуоресцентными метками праймерами в одной пробирке) и автоматизации скрининга.
На данный момент нет запатентованных технических решений по идентификации генотипов березы, однако известно много запатентованных способов молекулярно-генетической идентификации генотипов других видов растений, основанных на микросателлитных маркерах (главным образом, плодово-ягодных культур). Значительно меньше внимания уделено способам молекулярно-генетической идентификации лесных древесных видов растений. Так, известна российская заявка на изобретение № RU 2012119341, «Способ молекулярно-генетической идентификации популяций древесных видов растений», наиболее близкая к нашему изобретению, в которой предложен способ молекулярно-генетической идентификации популяций древесных видов растений, характеризующийся тем, что в молекулярно-генетическую формулу и штрих код, помимо идентификационных фрагментов ДНК разного размера (ISSR), амплифицированных в результате ПЦР, вносят и другие структурные изменения геномов, такие как делеции, дупликации, однонуклеотидные замены (SNP - Single Nucleotide Polymorphism), выявленные при сравнительном анализе нуклеотидных последовательностей после секвенирования геномной ДНК. Однако возможность использования данного способа для идентификации генотипов березы не оценивалась, а также не оценивалось использование микросателлитных локусов для генетической идентификации особей березы.
Кроме того, способ основан на использовании ISSR-маркеров, относящихся к мультилокусным маркерам, которые, как правило, имеют неизвестную локализацию в хромосоме и используются для молекулярной паспортизации сортов/пород, исследовании генетического разнообразия, а также для филогенетических исследований (Хлесткина, Вавиловский журнал генетики и селекции, 2013, Т. 17, №4, С. 1044-1054). Именно для достижения этих целей данный способ предложен Боронниковой с соавторами. В предложенном нами способе в основу легло использование монолокусных SSR-маркеров, что позволяет осуществлять идентификацию генотипов на индивидуальном уровне и осуществлять отбор элитных генотипов.
Задачей предлагаемого изобретения является обеспечение достоверной и надежной генетической идентификации генотипов березы на основе применения высокоизменчивых микросателлитных локусов.
Поставленная задача достигается за счет использования набора эффективных и стабильных молекулярных маркеров, позволяющих выявить высокий уровень полиморфизма ДНК, получить четко воспроизводимые результаты.
Схема применения разработанного способа идентификации приведена на фиг. 1. Основным ее функциональным компонентом является набор протестированных пар праймеров для ПЦР-амплификации микросателлитных локусов.
Предлагаемый способ реализуется следующим образом:
1. Производится отбор растительного материала для ДНК-анализа. В качестве материала используются вегетативные ткани листьев или почек.
2. Осуществляется выделение ДНК из растительной ткани по стандартным методам с использованием цетилтриметиламмониумбромида (СТАВ) (Devey et al., Theor. Appl. Genet, 1996, V. 92, P. 673-679, Doyle J.J., Doyle J.L., Focus, 1990, V. 12, P. 12-15).
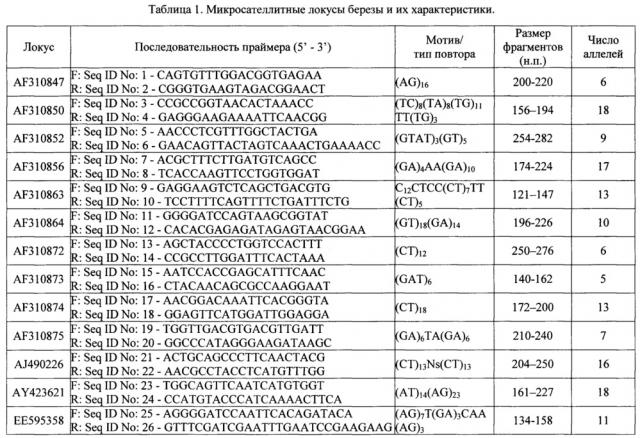
3. Проводится ПЦР-амплификация со специфичными праймерами для микросателлитных локусов (табл. 1). Используются 13 пар праймеров и следующие режимы амплификации: для большинства микросателлитных локусов серии AF применяется режим ПЦР (табл. 2), включающий предварительную денатурацию ДНК при 94°C в течение 4 мин и 30 циклов, состоящих из 60 с денатурации при 94°C, отжига при x°C и элонгации 1 мин 15 с при 72°С. авершающая элонгация проводится 10 мин при температуре 72°C с последующим охлаждением реакционной смеси до 4°C. Для ряда локусов серии AF (AF310872, AF310874, AF310856), а также для серий AJ, AY и ЕЕ режим ПЦР включает предварительную денатурацию ДНК при 94°C в течение 3 мин и 30 циклов, состоящих из 30 с денатурации при 94°C, отжига при x°C и элонгации 1 мин. 15 с при 72°C. Завершающая элонгация проводится 10 мин при температуре 72°C с последующим охлаждением реакционной смеси до 4°C.
1. Проводится фрагментный анализ ПЦР-продуктов (амплификатов) с помощью электрофореза в вертикальных блоках 6% полиакриламидного геля (ПААГ) в трис-ЭДТА-боратной буферной системе. После электрофореза гели окрашиваются в водном растворе бромистого этидия и визуализируются в УФ-свете.
2. Графические изображения гелей (электрофореграммы) перехватываются с помощью фото- или видеосистемы гель-документации и сохраняются на магнитные носители информации, и обрабатываются в графических редакторах. Размер амплифицированных фрагментов определяется с помощью соответствующего программного обеспечения. В качестве стандартного маркера длины используется ДНК плазмиды pBR322 Е. coli, обработанная эндонуклеазой рестрикции HpaII, или аналогичный маркер молекулярного веса для фрагментного анализа в диапазоне 50-300 пар нуклеотидов (п.н.).
3. Проводится составление таблицы многолокусных генотипов по микросателлитным локусам. Длины амплифицированных фрагментов микросателлитных локусов (в парах оснований) заносятся в электронную таблицу MS Excel, по два столбца на локус (табл. 3). В случае отсутствия генотипа по какому-либо локусу (пропуск данных) указывается «0».
4. Осуществляется сравнение полученных генотипов с генотипами исходных растений с целью установления идентичности особей (визульно или с помощью свободно распространяемой надстройки для MS Excel - GenAlEx - текущей версии 6.5 или более поздней) (Peakall, Smouse, Mol. Ecol. Notes, 2006, V. 6, P. 288-295; Peakall, Smouse, Bioinformatics, 2012, V. 28, P. 2537-2539).
5. Проводится оценка вероятности встречаемости мультилокусных генотипов и случайного совпадения неродственных или родственных генотипов.
Техническим результатом, достигаемым при реализации настоящего изобретения, является надежная, статистически достоверная идентификация генотипов березы, при этом действие изобретения распространяется на все виды березы, произрастающие на территории РФ: Betula pendula (В. verrucosa), В. platyphylla, В. lenta, В. pubescens, В. dalecarlica, В. microphylla, В. dahurica, В. costata, В. lanata, В. ermanii, В. fruticosa, В. nana, В. humilis, В. papyrifera, В. lutea, В. medwedewii, В. raddeana, В. platyphylla, В. nigra, В. maximowiczii, В. baschkirica, В. gmelinii, В. saksarensis, В. shmidtii, а также на другие виды семейства Betulaceae.
Зависимость PI и PIsibs от числа используемых локусов (см. чертеж) наглядно демонстрирует, что практически нулевая вероятность случайного совпадения генотипов достигается уже при использовании первых шести локусов. Использование всех 13 локусов намного перекрывает заявленную достоверность и статистическую значимость анализа. Максимально возможная вероятность совпадения генотипов равна 1,3⋅10-5 (примерно одно совпадение на 75000 сравнений).
Предлагаемое изобретение является промышленно применимым и может быть использовано для идентификации генотипов березы с целью создания быстрорастущих и высокопродуктивных березовых плантаций на основе элитных генотипов.
Анализ известных способов молекулярно-генетической идентификации генотипов различных видов березы, в том числе и элитных генотипов, проведенный по патентной документации, показал, что совокупность существенных признаков заявляемого способа неизвестна из уровня техники, следовательно, он соответствует такому условию патентоспособности изобретения как «новизна».
Примеры электрофореграмм, демонстрирующих полиморфизм длин амплифицированных фрагментов микросателлитных локусов, приведены на фиг. 3, 4.
Краткое описание чертежей.
Фиг. 1. Схема применения способа молекулярного маркирования для идентификации генотипов березы.
Фиг. 2. Зависимость вероятность случайного совпадения генотипов от числа используемых микросателлитных локусов.
Фиг. 3. Электрофореграмма локуса AJ490226 образцов березы из природной популяции. Дорожки: 1-8, 10-15, 17-28 - образцы 1-26; дорожки 9, 16 - маркер длин фрагментов ДНК.
Фиг. 4. Электрофореграмма локуса AF310873 элитных клонов березы. Дорожки: 1 - маркер длин фрагментов ДНК; 2 - Кс06-1, 3 - Кб81-1, 4 - tr-1, 5 - tr-2, 6 - бч1, 7 - Кб761, 8 - бп3ф1-1, 9 - бб31-1, 10 - бп4а-1, 11 - бп1б-1, 12 - №4, 13 - бб4б-1, 14 - 66-150-10, 15 - Дрб-1.
1. Способ молекулярно-генетической идентификации генотипов березы на основе микросателлитных (SSR) локусов, заключающийся в выделении ДНК из исследуемых образцов, проведении ПЦР, электрофоретическом разделении продуктов амплификации ДНК, документировании результатов ПЦР с помощью системы гель-документации, определении длин амплифицированных фрагментов ДНК путем сравнения со стандартами молекулярной массы, получении таблицы многолокусных генотипов по микросателлитным локусам, сравнении полученных генотипов с генотипами исходных растений с целью установления идентичности особей и оценки вероятности встречаемости мультилокусных генотипов и случайного совпадения неродственных или родственных генотипов, отличающийся тем, что амплификацию ДНК проводят по следующему набору 13 микросателлитных локусов с использованием фланкирующих их праймеров:
2. Способ по п. 1, отличающийся тем, что способ основан на применении универсального набора генетических маркеров, пригодных для достоверной идентификации всех видов березы (Betula), произрастающих на территории РФ: В. pendula (В. verrucosa), В. platyphylla, В. lenta, В. pubescens, В. dalecarlica, В. microphylla, В. dahurica, В. costata, В. lanata, В. ermanii, В. fruticosa, В. nana, В. humilis, В. papyrifera, В. lutea, В. medwedewii, В. raddeana, В. platyphylla, В. nigra, В. maximowiczii, В. baschkirica, В. gmelinii, В. saksarensis, В. shmidtii, а также других видов семейства Betulaceae.
3. Способ по п. 1, отличающийся тем, что пригоден для идентификации элитных генотипов березы, культивируемых с помощью микроклонального размножения или иными способами размножения, и любых прочих генотипов березы.
4. Способ по п. 1, отличающийся тем, что для 13 локусов используется 3 режима амплификации фрагментов ДНК.
5. Способ по п. 1, отличающийся тем, что именно такая комбинация 13 микросателлитных локусов обеспечивает статистически достоверную идентификацию любого генотипа березы, а максимально возможная вероятность совпадения генотипов равна 1,3·10-5 (примерно одно совпадение на 75000 сравнений).