Способ анализа структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лабораторной диагностике, и может быть использовано для анализа структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных. Для этого осуществляют забор препарата(ов). Затем проводят исследование препаратов под микроскопом. После чего фотографируют препараты с использованием одинакового освещения и увеличения микроскопа. Получают фотографии одинакового размера. При этом участки фотографии, содержащие иммунопозитивный компонент, окрашиваются в коричневый цвет и его оттенки, а иммунонегативные - окрашиваются в сине-фиолетовый и оттенки синего или серого цветов. Получают на каждой фотографии несколько иммунопозитивных участков с различной интенсивностью окрашивания вещества. После чего в программе фотошоп убирают иммунопозитивное окрашивание и распечатывают полученные образцы на цветном фотопринтере на прозрачную пленку. Далее через каждый образец пропускают световой поток фиксированной интенсивности. Часть светового потока при этом поглощается препаратом, а оставшиеся световые потоки измеряют люксметром. При этом получают минимальную величину светового потока F min с неубранными иммунопозитивными участками и максимальную величину светового потока F0 с убранными иммунопозитивными участками, для всех фотографий. Затем вычисляют среднее арифметическое значение F min и F0. После чего рассчитывают поглощение светового потока в образце F искомое. И при увеличении F искомого по сравнению с контролем делают вывод об усилении синтеза структурных белков в межклеточном веществе соединительной ткани шейки матки у животных. Изобретение позволяет проводить анализ структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных. 5 ил., 2 пр.
Реферат
Изобретение относится к медицине, а именно к морфологии, и может быть использовано для анализа структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных путем оценки поглощения светового потока структурами межклеточного вещества соединительной ткани, выявленных при проведении иммуногистохимического метода (ИГХ) с использованием моноклональных антител.
Иммуногистохимический метод - это вид морфологических исследований, основанных на реакции «антиген-антитело», позволяющих выявить локализацию того или иного клеточного или тканевого компонента (антигена) in situ посредством связывания его с мечеными антителами.
Использование ИГХ позволяет дать как качественную оценку (при идентификации необходимых структур) ряду патоморфологических процессов, так и, в ряде случаев, провести его количественный анализ (индекс пролиферации и т.д.).
Известна компьютерная программа количественного анализа «Морфология 5.0» для ядерных и цитоплазматических маркеров (М.Ю. Смирнова, Л.Х. Джемлиханова, И.Н. Костючек, И.М. Кветной, Д.А. Ниаури, М.А. Пальцев, 2010).
Известная программа не позволяет проводить анализ межклеточных структур.
Провести его относительную количественную оценку можно лишь при сравнении степени интенсивности экспрессии (окрашивания) и по занимаемой площади. На сегодняшний день существует полуколичественный метод оценки интенсивности экспрессии, при этом оценка осуществляется «на глаз» в баллах https://www.mdanderson.org…).
Наиболее богата межклеточным веществом соединительная ткань.
Универсальность соединительной ткани определяется широким распространением ее в организме, где она образует строму внутренних органов, основу кожи, связки, сухожилий, апоневрозы, оболочки мышц и т.д.
Как известно, основным белком межклеточного вещества соединительной ткани является коллаген. Коллаген - ярко выраженный полиморфный белок. В настоящее время известно около 30 типов коллагена.
Тип коллагена, в свою очередь, определяется той ролью, которую он играет в конкретном органе или ткани. ИГХ позволяет идентифицировать тип коллагена или другие структурированные элементы межклеточного вещества. Однако для оценки течения некоторых патологических процессов качественный анализ не всегда достаточен, требуется и количественный его анализ.
Задачей изобретения является создание способа анализа структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных путем оценки поглощения светового потока указанными структурами, экспрессируемыми моноклональными антителами, которое пропорционально их содержанию в исследуемом гистологическом срезе.
Предлагаемый способ включает в себя следующие операции:
1. Получают образец ткани исследуемого органа и его фиксируют в 10% забуференном формалине.
2. Осуществляют проводку материала в гистологическом процессоре замкнутого типа с вакуумом Leica ASP 300 (формалин - 30 мин, формалин -30 мин, спирт 1 - 45 мин, спирт 2 - 45 мин, спирт 3 - 60 мин, спирт 4 - 60 мин, спирт 5 - 3 часа, спирт 6 - 5 часов, ксилол - 60 мин, ксилол - 90 мин, парафин 1 - 60 мин, парафин 2-60 мин, парафин 3 - 2 часа).
3. Заливают материал в парафиновые блоки и нарезают гистологические срезы на роторном микротоме, фиксированной толщины - 4 мкм.
4. Осуществляют постановку ИГХ-реакции с одношаговой системой визуализации (Система визуализации BioGenex (QD 630-ХАK) Super Sensitive one - step Polymer - HRP kit|DAB (1000 тестов)).
Постановка осуществляется согласно общепринятым методам ИГХ (см. Иммуногистохимические методы: Руководство / Ed. by George L. Kumar, Lars Rudbeck.: DAKO / Пер. с англ. под ред. Г.А. Франка и П.Г. Малькова. - М., 2011. - 224 с).
Протокол иммуногистохимической реакции, предлагаемый компанией Dako.
a. Приготовить парафиновые срезы на стеклах, покрытых поли-L-лизином, провести депарафинирование и регидратацию в TBS (Трис солевой буферный раствор). (Dako TBS, S196830, добавить 0,05% Tween 20 (Твин 20 улучшает отмывку и уменьшает неспецифическое фоновое окрашивание)).
b. Удалить избыток жидкости вокруг срезов и капнуть 1% р-р перекиси водорода 10 мин.
c. Промыть в TBS и удалить избыток жидкости вокруг срезов.
d. Нанести первичные антитела (мышиные или кроличьи). Инкубировать 30 мин при комнатной температуре во влажной камере.
e. Промыть в TBS и удалить избыток жидкости вокруг срезов.
f. Нанести вторичные антитела (смесь антимышиных или антикроличьих биотинилированных антител). Инкубировать 15-30 мин при комнатной температуре во влажной камере.
g. Промыть в TBS и удалить избыток жидкости вокруг срезов.
h. Нанести конъюгированный с пероксидазой стрептавидин. Инкубировать 15-30 мин при комнатной температуре во влажной камере.
i. Промыть в TBS и удалить избыток жидкости вокруг срезов.
j. Провести гистохимическое выявление пероксидазной активности с раствором DAB 5-10 мин (ULTRAVISION QUANTO DETECTION SYSTEM HRP DAB 3,3'DIAMINOBENZIDINE).
DAB - это часто используемый хромоген при иммунопероксидазном окрашивании.
Принцип окрашивания: Пероксидаза разрушает молекулу Н2O2 и ее остатки взаимодействуют с DAB. Продукты реакции преципитируются с комплексом антиген-антитело, окрашивая его в коричневый цвет и его оттенки.
Shan-Rong Shi, James Guo, Richard J. Cote, Lillian Young, Debra Hawes, Yan Shi, Sandra Thu, and Clive R. Taylor, Applied Immunohistochemistry & Molecular Morphology, vol 7, 201-208, 1999.
k. Промыть в воде.
l. Докрасить ядра гематоксилином Майера 1-2 мин.
Гематоксилин Майера обеспечивает визуализацию ядер клеток в срезах (парафиновых, криостатных, вибротомных, изготовленных на замораживающем микротоме) и цитологических препаратах. Гематоксилин предназначен для использования в качестве ядерного красителя при постановке иммуноцитохимических реакций в сочетании с различными типам и хромогенов.
В результате окраски гематоксилином ядра клеток приобретают синий либо сине-фиолетовый цвет.
m. Промыть срезы в проточной воде.
n. Провести дегидратацию в восходящей батарее спиртов.
о. Заключить срезы в канадский бальзам.
5. Оценивают приготовленные гистологические препараты по общепринятой методике ИГХ с помощью световой микроскопии.
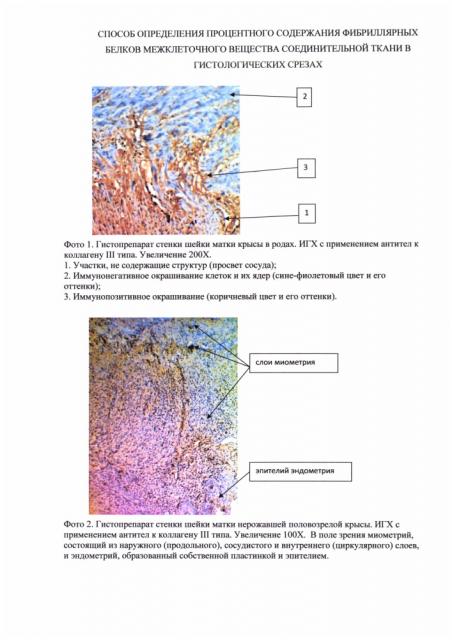
В полученном материале исследования (фото 1) четко выявляют следующие участки: 1 - не содержащие структур; 2 - иммунонегативные; 3 - иммунопозитивные.
Участок №1 - не содержащий структур. Он может быть представлен просветом кровеносного сосуда (не окрашивается).
Участок №2 - иммунонегативный, представлен клеточными элементами ткани, но не содержащий искомое вещество. Он может быть представлен цитоплазмой клеток и аморфным веществом (при окрашивании дают сероватый и серовато-голубоватый оттенок) и ядрами клеток (воспринимают гематоксилин и окрашиваются в синий и фиолетовый оттенки).
Участок №3 - иммунопозитивный, представлен структурами, экспрессирующими искомый белок (например, коллагены I, II, III, IV, VI, типов или др.), окрашивая его в коричневый цвет и его оттенки.
6. Фотографируют микропрепарат (сходные участки на одинаковом увеличении). Не пользуются обрезкой или кадрированием. Площадь в исследуемых объектах должна быть одинаковая при дальнейшем сравнении образцов. Таким образом, получают фотографию нативного препарата.
7. Печатают полученный образец нативного препарата на цветном фотопринтере на прозрачную пленку. Образцы должны быть фиксированного размера (в данном случае мы использовали 90×70 мм).
8. Работают в программе Photoshop.Убирают иммунопозитивное окрашивание. Для этого пипеткой выбирают иммунопозитивный участок (окрашенный в коричневый цвет). Далее заходят в изображение… регулировки… замена цвета. Выставляют параметры Мах: разброс (200) и в разделе замена: тон (180), насыщенность (200), яркость (200). Нажимают ок и сохраняют.
Получают фотографию препарата, содержащего только участки 1 и 2 (с иммунонегативным компонентом).
9. Печатают полученный образец (с иммунонегативным компонентом) на цветном фотопринтере на прозрачную пленку. Образцы должны быть фиксированного размера (в данном случае использовали 90×70 мм).
10. Оценивают поглощение светового потока фиксированной интенсивности при прохождении через образцы с помощью люксметра.
10. Анализируют полученные данные при сравнении образцов с нативного препарата и с иммунонегативным компонентом.
Таким образом, поставленная задача решается путем измерения величины поглощения светового потока экспрессируемым веществом межклеточного матрикса соединительной ткани в гистологических срезах. Это позволяет судить об изменении и отклонении содержания исследуемого вещества в тканях органа или его отделах при разных физиологических или патологических состояниях.
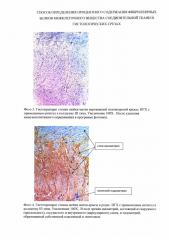
Изобретение иллюстрируется фотографиями, где на фото 1 - гистопрепарат стенки шейки матки крысы в родах (при оценивании ИГХ-реакции). На фото 2 (образец нативного препарата) - гистопрепарат стенки шейки матки нерожавшей интактной половозрелой крысы, на фото 3 (образец с иммунонегативным компонентом) - гистопрепарат стенки шейки матки нерожавшей интактной половозрелой крысы после удаления иммунопозитивного окрашивания в программе фотошоп, на фото 4 (образец нативного препарата) - гистопрепарат стенки шейки матки крысы в родах. На фото 5 (образец с иммунонегативным компонентом) - гистопрепарат стенки шейки матки крысы в родах после удаления иммунопозитивного окрашивания в программе фотошоп.
Исследование выполнено на белых беспородных крысах. Объектом исследования служила шейка матки на уровне сфинктера. Животные содержались в виварии, уход за ними осуществляли по нормам и правилам обращения с лабораторными животными (Западнюк И.П., 1983), в соответствии с «Международными рекомендациями по проведении медико-биологических исследований с использованием животных» (1985), с правилами лабораторной практики в Российской Федерации (приказ МЗ РФ от 19.06.2003 №267) и законом «О защите животных от жестокого обращения» гл. V, ст. 104679-ГД от 01.12.1999.
Примеры использования способа на практике.
Пример №1.
Определение процента поглощения светового потока в гистологических срезах тканей органа - шейки матки половозрелой крысы с иммуногистохимическим типированием в ней коллагена III типа (крыса в возрасте 6 мес - 1 года, ранее не рожала, интактная, использована в качестве контроля). Для повышения точности способа для исследования взято 10 половозрелых крыс. Гистологические препараты готовились по вышеописанной методике.
1. Каждый гистологический препарат в четко заданном участке, исследуемом под микроскопом, фотографируют, используя для всех объектов одинаковое увеличение и освещение микроскопа. При этом получают фото нативного препарата, содержащего все участки 1-3 (см. стр. 5, 6). Участок, содержащий иммунопозитивный компонент (окрашивается в коричневый цвет и его оттенки) и иммунонегативный (окрашивается в сине-фиолетовый и оттенки синего или серого цветов).
2. Выбирают фото для последующего анализа и распечатывают на прозрачную пленку.
В дальнейшем замеряют показатели люксметра данного образца (нативный образец, содержащий и иммунонегативный и иммунопозитивный компонент), обозначаем, как F min (фото 2).
3. В выбранном ранее фото 2 в программе Photoshop убирают иммунопозитивное окрашивание (фото 3).
4. Распечатывают полученный образец на цветном фотопринтере на прозрачную пленку.
В дальнейшем замеряют показатели люксметра данного образца (образец с иммунонегативным компонентом обозначают как F0 (фото 3)).
5. Далее через каждый образец (нативный и с иммунонегативным компонентом) пропускают световой поток фиксированной интенсивности, он составлял 38500 люксов. Часть светового потока при этом поглощается препаратом. Оставшиеся световые потоки измеряют люксметром: получают F min и F0. Так делают для всех объектов (n=10). Высчитывают среднее арифметическое.
F min (среднее) = 27200 люксов
F0 (среднее) = 28900 люксов
Производят вычисления. Разница между показателями есть световой поток, поглощенный искомым веществом - F искомое.
F искомое = F0 (среднее) - F min (среднее) = 28900 - 27200 = 1700 люксов
6. Высчитывают процент поглощения светового потока искомым веществом (коллагеном III типа).
F искомое / F0 (среднее) × 100% = 1700/28900×100=5,88%
Пример №2.
Определение процента поглощения светового потока в гистологических срезах тканей органа - шейки матки половозрелой крысы при физиологическом состоянии, а именно родах, с иммуногистохимическим типированием в ней коллагена III типа. Исследовались 10 крыс. Гистологические препараты готовились по вышеописанной методике.
1. Гистологический препарат в четко заданном участке, исследуемом под микроскопом, фотографируют, используя для всех объектов одинаковое увеличение и освещение микроскопа.
2. Выбирают фото для последующего анализа и распечатывают на прозрачную пленку.
В дальнейшем замеряют показатели люксметра данного образца (нативный образец, содержащий и иммунонегативный и иммунопозитивный компонент), обозначаем как F min (фото 4).
3. В выбранном ранее фото 4 в программе Photoshop убирают иммунопозитивное окрашивание (фото 5).
4. Распечатывают полученный образец на цветном фотопринтере на прозрачную пленку.
В дальнейшем показатели люксметра данного образца (образец, с иммунонегативным компонентом обозначаем как F0 (фото 5)).
5. Далее через каждый образец (нативный и с иммунонегативным компонентом) пропускаем световой поток фиксированной интенсивности, у нас он составлял 38500 люксов.
Часть светового потока при этом поглощается препаратом. Оставшиеся световые потоки измеряют люксметром: получают F min и F0. Так делают для всех объектов (n=10). Высчитывают среднее арифметическое.
F min (среднее) = 25700 люксов
F0 (среднее) = 28500 люксов
Производят вычисления. Разница между показателями есть наше вещество - F искомое.
F искомое = F0 (среднее) - F min (среднее)=28500 - 25700=- 2800 люксов
6. Высчитывают процент поглощения светового потока искомым веществом (коллагеном III типа) в шейке матки на момент родов.
F искомое / F0 (среднее) × 100% = 9,83%.
Как известно, степень поглощения светового потока через вещество пропорциональна его плотности, следовательно, данный способ позволяет оценить изменения количественного содержания одного и того же вещества в одном и том же органе или его участке по величине поглощения светового потока.
Таким образом, сравнивая показатели процента поглощения светового потока в одном и том же участке одного и того же органа, но при разных физиологических или патологических состояниях, можно оценить динамику изменения в нем искомого вещества межклеточного матрикса соединительной ткани, например определить усиление синтеза структурных белкой в межклеточном веществе соединительной ткани шейки матки у животных.
Так, например, проведенное исследование коллагена III типа в шейке матки крыс показало, что при родах в ней по сравнению с интактной шейкой практически в 2 раза увеличивается поглощение светового потока искомым веществом, следовательно, это может быть обусловлено увеличением синтеза коллагена III типа в межклеточном веществе соединительной ткани. Можно предположить, что этот процесс лежит в основе полноценной готовности шейки матки к ее раскрытию и, соответственно, родам.
Данную методику можно использовать для количественной оценки содержания и динамики изменения иного типа коллагена, эластина и других структурных белков межклеточного вещества. Также можно устанавливать зависимость содержания их в зависимости от возраста и при патологических состояниях - травмах (для оценки течения регенераторного процесса).
В качестве объекта исследования может быть выбран любой орган.
Способ анализа структур межклеточного вещества соединительной ткани в гистологических срезах шейки матки у животных, содержащий забор препарата(ов) по методике, принятой для иммуногистохимических исследований, исследование препаратов под микроскопом, фотографирование с использованием одинакового освещения и увеличения микроскопа с получением фотографий одинакового размера, при этом участки фотографии, содержащие иммунопозитивный компонент, окрашиваются в коричневый цвет и его оттенки, а иммунонегативные - окрашиваются в сине-фиолетовый и оттенки синего или серого цветов, получают на каждой фотографии несколько иммунопозитивных участков с различной интенсивностью окрашивания вещества, распечатывают фотографии на цветном фотопринтере на прозрачную пленку, после чего в программе фотошоп убирают иммунопозитивное окрашивание и распечатывают полученные образцы на цветном фотопринтере на прозрачную пленку, далее через каждый образец пропускают световой поток фиксированной интенсивности, часть светового потока при этом поглощается препаратом, а оставшиеся световые потоки измеряют люксметром: получают минимальную F min с неубранными иммунопозитивными участками и максимальную F0 с убранными иммунопозитивными участками величину светового потока для всех фотографий, вычисляют среднее арифметическое значение F min и F0, после чего рассчитывают поглощение светового потока в образце по формуле: (F0 - F min) : F0 × 100% = F искомое, и при увеличении F искомого по сравнению с контролем делают вывод об усилении синтеза структурных белков в межклеточном веществе соединительной ткани шейки матки у животных.