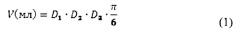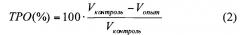Фотосенсибилизатор для лечения онкологических заболеваний и способ его получения
Иллюстрации
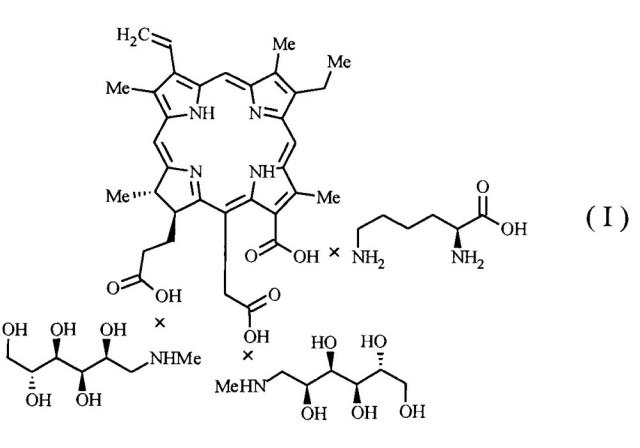
Показать всеГруппа изобретений относится к области фармакологии, а именно к фотосенсибилизаторам на основе хлорина е6. Фотосенсибилизатор для лечения онкологических заболеваний содержит соль хлорина е6 с N-метил-D-глюкамином (меглумином) и L-лизином в мольных соотношениях 1:2:1 и имеет структурную формулу (I):
Также раскрыт способ получения фотосенсибилизатора для лечения онкологических заболеваний, который заключается в добавлении к хлорину е6 расчетных количеств N-метил-D-глюкамина (C7H17NO5) и L-лизина (C6H14N2O2), необходимых для образования соли формулы (I), с последующей фильтрацией полученного раствора двойной соли хлорина е6. Группа изобретений обеспечивает повышенную фотоиндуцированную активность фотосенсибилизатора при проведении фотодинамической терапии онкологических заболеваний. 2 н. и 3 з.п. ф-лы, 1 ил., 2 табл., 5 пр.
Реферат
Группа изобретений относится к области фармакологии, а именно к фотосенсибилизаторам (далее ФС) на основе хлорина е6.
В настоящее время в России зарегистрирован целый ряд ФС для фотодинамической терапии (ФДТ). Так, Аласенс представляет собой гидрохлорид 5-аминолевулиновой кислоты; он в результате метаболизма в организме превращается в протопорфирин IX, который и служит в качестве ФС. Его существенным недостатком является короткая длина волны возбуждения ~ 630 нм, что обуславливает неглубокое проникновение возбуждающего света в ткани и ограничивает применение Аласенса опухолями незначительного размера.
ФС класса фталоцианинов Фотосенс представляет собой смесь натриевых солей сульфированного фталоцианина алюминия. Его длина волны возбуждения ~ 675 нм позволяет возбуждающему свету глубже проникать в ткани, что обеспечивает терапию несколько по глубине опухолей. Его существенным недостатком является длительное время выведения из организма.
Наибольшее распространение для ФДТ опухолевых заболеваний нашли ФС на основе хлорина е6 (длина волны возбуждения ~ 660 нм), получаемого из природного хлорофилла - Фотолон (RU 2152790), Радахлорин (RU 2183956) и Фотодитазин (RU 2276976, RU 2367434). Первые два представляют собой фармакологические формы солей хлорина е6 со щелочными металлами. Последний представляет собой соль с N-метил-D-глюкамином (меглумином) и щелочным металлом в мольном соотношении 1:2:1.
Кроме того, предложены фотосенсибилизаторы для ФДТ заболеваний, вызванных агентами бактериальной и грибковой природы. Так, Радахлорин предложено использовать для терапии гнойного гайморита (RU 2228775). Однако большинство предложенных фотосенсибилизаторов для так называемой антимикробной ФДТ имеют в своей структуре положительно заряженные структурные элементы для лучшего связывания с оболочкой патогенных клеток, как правило, аминные или аммонийные группы. К таковым относятся катионные фотосенсибилизаторы класса хлоринов (RU 2416614, RU 2536966, RU 2565450), бактериохлоринов (RU 2397172, RU 2479585), фталоцианинов (RU 2282647). Еще одним ФС является Фотодитазин (RU 2276976), в структуре которого, в отличие от других ФС, имеются две молекулы меглумина. О меглумине известно, что он обладает доказанной способностью индуцировать синтез раннего интерферона альфа-типа, обладающего выраженным противовирусным действием, подавляет размножение вирусов на ранних сроках инфекционного процесса, снижая инфекционность вирусного потомства, приводя к образованию дефектных вирусных частиц, повышая неспецифическую резистентность организма в отношении вирусных инфекций, тем самым решая задачу противовирусного воздействия разрабатываемого препарата. Однако, имея в составе меглумин, как противовирусный агент, данный препарат остается близким к анионному (имея только две аминные группы), вследствие чего не обладает тропностью к бактериальным и вирусным частицам. Таким образом, вопросы противовирусной и антибактериальной эффективности данного препарата не решены, т.к. известно, что только катионные ФС тропны к бактериальным и вирусным агентам.
Нами решалась задача создать комплексный ФС для ФДТ онкологических заболеваний, в частности местнораспространенных опухолей.
Достигаемым техническим результатом является повышение фотоиндуцированной активности ФС in vitro и in vivo при проведении ФДТ онкологических заболеваний, что достигается за счет дополнения противоопухолевого действия выраженной антибактериальной активностью, что позволяет повысить в целом эффективность ФДТ.
Большинство местнораспространенных опухолей сопровождаются перитуморальным воспалением, что требует применения новых комбинированных ФС, которые одновременно обладают противоопухолевым и антибактериальным эффектами.
Поставленная задача решается тем, что за счет включения в молекулу фотосенсибилизатора L-лизина число катионных центров повышается в два раза, что придает молекуле возможность целевой доставки в очаги воспаления (бактериального). Молекула ФС согласно изобретению содержит хлорин е6 с N-метил-D-глюкамином (меглумином) и L-лизином в мольных соотношениях 1:2:1 и имеет структурную формулу (I):
ФС формулы (I) совмещает фотодинамическую активность хлорина е6 и повышенную селективность в отношении бактериальных патогенов благодаря наличию четырех катионных центров в структуре, два из которых обеспечиваются аминогруппами меглумина и два - двумя аминогруппами лизина.
Также нами разработан оригинальный способ получения ФС, содержащего соль, имеющую структурную формулу (I), который заключается в том, что хлорин е6 растворяют в воде в присутствии расчетных количеств N-метил-D-глюкамина (меглумина) и L-лизина, обеспечивающих образование соли структурной формулы (I), компоненты которой: хлорин е6, N-метил-D-глюкамин (меглумин) и L-лизин, содержатся в мольных соотношениях 1:2:1.
Полученный раствор двойной соли хлорина е6 фильтруют и далее, в зависимости от требуемой лекарственной формы ФС, либо расфасовывают в виде готового к употреблению раствора, либо лиофилизируют в присутствии стабилизирующих добавок с целью получить твердую лекарственную форму, пригодную для длительного хранения и приготовления из нее других лекарственных форм. Как показали испытания, раствор ФС в воде стабилен в течение длительного времени в отсутствие света и атмосферного воздуха.
В качестве добавок, стабилизирующих образующуюся в ходе лиофилизации таблетку ФС, можно использовать большинство фармакологически приемлемых и разрешенных для внутривенного введения полимеров и углеводов. При этом соль хлорина e6 и добавку предпочтительно использовать в весовом соотношении от 1:0,5 до 1:3,0. Среди полимеров лучшим по параметрам однородности, механической прочности таблетки и длительности хранения ФС оказался поливинилпирролидон, среди углеводов - мальтоза.
Предлагаемый фотосенсибилизатор может быть использован для фотодинамической терапии различных онкологических заболеваний, например опухолей мочеполовой системы, пищеварительной системы, дыхательной системы, кожи и мягких тканей, головы и шеи.
Изобретение иллюстрируется следующими примерами.
Пример 1. В растворе 2,61 г N-метилглюкамина и 0,98 г L-лизина в 500 мл апирогенной воды растворяют 4,00 г хлорина е6. Раствор фильтруют через мембранный фильтр с размером пор 0,2 мкм, объем фильтрата доводят апирогенной водой до объема 1 л, после чего фотосенсибилизатор (I) расфасовывают в стерильную тару. Спектр разбавленного водой в 500 раз фотосенсибилизатора (I) при рН 9, измеренный в кювете с длиной оптического пути 1 см, приведен на фиг. 1. UV-VIS, λmax, нм (отн. ед.): 653 (0,49), 604 (0,06), 542 (0,05), 506 (0,13), 403 (1,84).
Пример 2. Растворяют 0,38 г поливинилпирроли дона в 100 мл фотосенсибилизатора (I), приготовленного по примеру 1, раствор фильтруют через мембранный фильтр с размером пор 0,2 мкм и лиофилизируют. Таблетка сухого фотосенсибилизатора (I) содержит до 5% влаги и не рассыпается при умеренном встряхивании. Электронный спектр поглощения растворенного в воде сухого фотосенсибилизатора (I) аналогичен спектру из примера 1.
Пример 3. Растворяют 1,15 г мальтозы в 100 мл фотосенсибилизатора (I), приготовленного по примеру 1, раствор фильтруют через мембранный фильтр с размером пор 0,2 мкм и лиофилизируют. Таблетка сухого фотосенсибилизатора (I) содержит до 5% влаги и не рассыпается при умеренном встряхивании. Электронный спектр поглощения растворенного в воде сухого фотосенсибилизатора (I) аналогичен спектру из примера 1.
Пример 4. Изучали фотодинамическую активность ФС (I) in vivo на самках мышей линии СВА с привитой на нижней конечности подкожно опухолью Эрлиха. Раствор ФС (I) 0,76% по примеру 1 или растворы той же концентрации, полученные растворением лиофилизата по примеру 2 или 3, вводят в хвостовую вену на шестой день инокуляции за 2 или 4 часа до проведения сеанса ФДТ в дозах 1,0-10,0 мг/кг. Через 2 или 4 часа опухоль облучают, предварительно депилировав кожу над опухолью. Для облучения использовали диодный лазер "Лахта-Милон" (Россия) с длиной волны 662 нм и выходной мощностью 0,7 Вт. Плотность мощности облучения составляла 0,2-0,3 Вт/см2, плотность световой энергии 120 Дж/см2. После сеанса ФДТ за животными наблюдали 20 дней.
Эффективность ФДТ оценивают по изменению объема опухоли (V) с перитуморальным воспалением и значениям торможения роста опухоли (ТРО), которые рассчитывают по формулам (1) и (2):
где D1, D2 и D3 - три взаимно перпендикулярных размера опухоли, включая область перитуморального воспаления.
Установлено, что облучение опухолей в отсутствие ФС формулы (I) не приводит к подавлению их роста. В то же время при однократном проведении ФДТ с использованием ФС формулы (I) наблюдались высокие значения ТРО (до 100%) на протяжении всего времени наблюдения (Табл. 1).
Пример 5. С целью оценки антибактериального эффекта, фотосенсибилизатор по формуле (I) исследовали in vitro для фотоинактивации клинических штаммов двух видов бактерий Staphylococcus aureus и Escherichia coli, которые выращивали в бульоне в течение 16 ч при 37°С и инкубировали 2 ч в растворе с известной концентрацией ФС по формуле (I), после чего помещали в физиологический раствор, облучали излучением с длиной волны 662 нм и плотностью энергии ~ 30 Дж/см2 и высевали на питательный агар. Результаты сведены в таблицу 2. Результаты свидетельствуют о высокой антибактериальной активности, что подтверждает возможность эффективно использовать ФС при наличии бактериального перитуморального воспаления.
Таким образом, разработанный нами фотосенсибилизатор обладает высокой фотоиндуцированной активностью in vitro и in vivo и может быть использован для лечения методом ФДТ онкологических заболеваний, в том числе с наличием перитуморального (бактериального) воспаления.
1. Фотосенсибилизатор для лечения онкологических заболеваний, отличающийся тем, что содержит соль, имеющую структурную формулу (I):
компоненты которой: хлорин е6, N-метил-D-глюкамин (меглумин) и L-лизин, содержатся в мольных соотношениях 1:2:1.
2. Способ получения фотосенсибилизатора для лечения онкологических заболеваний, состоящий в том, что хлорин е6 растворяют в воде в присутствии расчетных количеств N-метил-D-глюкамина (меглумина) и L-лизина, необходимых для образования соли, структурной формулы (I), приведенной в п. 1, компоненты которой: хлорин е6, N-метил-D-глюкамин (меглумин) и L-лизин, содержатся в мольных соотношениях 1:2:1, полученный раствор двойной соли хлорина е6 фильтруют.
3. Способ по п. 2, отличающийся тем, что в полученный раствор двойной соли хлорина е6 вносят добавку, стабилизирующую соль хлорина е6 во время лиофилизации, и лиофилизируют раствор.
4. Способ по п. 3, отличающийся тем, что в качестве добавки, стабилизирующей соль хлорина е6 во время лиофилизации, используют поливинилпирролидон или мальтозу.
5. Способ по п. 3, отличающийся тем, что соль хлорина е6 и добавку используют в весовом соотношении от 1:0,5 до 1:3,0.