Способы детектирования 5т4-положительных циркулирующих опухолевых клеток и способы диагностики 5т4-положительного рака у млекопитающего
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована при диагностике 5Т4-положительного рака. Способы по изобретению включают тестирование образца крови от млекопитающего, где образец крови содержит популяцию клеток, закрепление образца крови на подложке, детектирование в образце крови наличия или отсутствия ядросодержащих клеток с использованием первого маркера, детектирование наличия или отсутствия в образце крови экспрессии на клетке второго маркера, детектирование в образце крови наличия или отсутствия экспрессии на клетке третьего маркера, детектирования в образце крови наличия или отсутствия экспрессии на клетке четвертого маркера, где четвертый маркер представляет собой человеческий антиген 5Т4 и анализ первого, второго, третьего и четвертого маркеров в популяции клеток для распознавания и характеристики циркулирующих опухолевых клеток. Использование изобретений позволяет выявить антиген 5Т4 на циркулирующих опухолевых клетках, провести морфологическую классификацию их молекулярной характеристики для скринига, мониторинга и ведения пациентов с раком. 3 н. и 28 з.п. ф-лы, 4 ил., 1 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в целом, относится к способу детектирования 5Т4-положительных циркулирующих опухолевых клеток у млекопитающего и к способам диагностики 5Т4-положительного рака у млекопитающего.
УРОВЕНЬ ТЕХНИКИ
Человеческий антиген 5Т4 экспрессируется при многочисленных типах рака и по существу отсутствует в нормальных тканях. Недавно были разработаны высокоаффинные моноклональные антитела, которые специфически связываются с антигеном 5Т4, и с антителами к 5Т4 были конъюгированы цитотоксические агенты с образованием конъюгатов антитело-лекарственное средство для применения в лечении 5Т4-положительного рака (патенты США №8044178 и 8309094). Из этого следует, что оценка экспрессии 5Т4 может представлять собой полезный подход для идентификации пациентов с 5Т4-положительным раком. Один подход будет состоять в выявлении антигена 5Т4 на циркулирующих опухолевых клетках (СТС) у пациентов с раковым заболеванием.
Циркулирующие опухолевые клетки были обнаружены в периферической крови пациентов с раками эпителиального происхождения в ультранизких концентрациях (Kraeft et al., Clin Cancer Res 10: 3020-3028, 2004). Было показано, что число этих клеток коррелирует с результатом для групп пациентов с метастатическим раком молочной железы с прогрессирующим на момент взятия образцов заболеванием (Cristofanilli et al., N Engl J Med 351: 781-791, 2004). По этой причине их характеристика представляет значительный биомедицинский интерес для понимания того, как эти клетки могут перемещаться по кровотоку к анатомически отдаленным районам и вызывать метастатическое заболевание. Следовательно, определение СТС, ассоциированных с 5Т4-положительным раком, может обеспечить ценное диагностическое средство для идентификации пациента.
В настоящее время СТС выявляют и анализируют, главным образом, с помощью иммуноцитохимических маркеров, таких как EpCam, и путем применения окрашивания ядер DAPI (4ʹ,6-диамидино-2-фенилиндол), флуоресцентного красителя, который прочно связывается с А-Т-богатыми областями ДНК. Хотя эти подходы были успешными при подсчете и распознавании СТС, они отличаются от стандартных цитопатологических подходов, так как они пренебрегают корреляцией со стандартным морфологическим окрашиванием, от которого зависит диагностическая патология. Это создает трудности при сравнении СТС с опухолевыми клетками из других очагов, полученными путем рутинных диагностических процедур. Хотя способность выявлять СТС потенциально может помочь в диагностике и индивидуализированном лечении рака и способствовать эффективности лечения, понимание биологии СТС может быть усовершенствовано путем включения стандартных цитопатологических методов. В данной области техники существует необходимость применения детальной визуализации СТС с высоким разрешением с традиционными методами диагностики патологии окрашиванием и светлопольной микроскопией для подтверждения потенциальной возможности выполнения стандартной цитопатологической диагностики циркулирующих 5Т4-положительных клеток карциномы и ускорения внедрения клинической диагностики с использованием 5Т4-положительных СТС.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном воплощении настоящего изобретения предложен способ детектирования 5Т4-положительных циркулирующих опухолевых клеток у млекопитающего, предположительно имеющего 5Т4-положительный рак, включающий тестирование образца крови от субъекта, где образец крови содержит популяцию клеток; закрепление образца крови на подложке; детектирование в образце крови наличия или отсутствия первого маркера, который избирательно связывается с ядросодержащими клетками; детектирование в образце крови наличия или отсутствия второго маркера, который связывается с циркулирующими опухолевыми клетками; детектирование в образце крови наличия или отсутствия третьего маркера, который связывается с популяцией клеток или субпопуляцией популяции клеток, которые не определены как опухолевые клетки; детектирование в образце крови наличия или отсутствия четвертого маркера, который избирательно связывается с циркулирующими опухолевыми клетками, где указанный четвертый маркер представляет собой человеческий антиген 5Т4; и анализ популяции клеток, выявленной при помощи первого, второго, третьего и четвертого маркеров, для распознавания и характеристики циркулирующих опухолевых клеток.
В другом воплощении способ детектирования наличия или отсутствия 5Т4-положительных циркулирующих опухолевых клеток у млекопитающего, предположительно имеющего 5Т4-положительный рак, указывает на наличие ранней стадии 5Т4-положительного рака, на состояние отсутствия болезни или на состояние неопределяемого заболевания у млекопитающего.
В другом воплощении наличие или отсутствие циркулирующих опухолевых клеток в образце крови служит контролем лечения во время лечения 5Т4-положительного рака или выздоровления от рака.
В другом воплощении популяция клеток представляет собой смешанную популяцию клеток, подложка представляет собой плоскую подложку, микроструйное устройство или картридж, который несет обогащенную популяцию клеток.
В другом воплощении закрепление тестируемого образца на подложке формирует биологический монослой.
В другом воплощении популяцию клеток анализируют по деталям ядра, контуру ядра, наличию или отсутствию ядрышек, качеству цитоплазмы или количеству цитоплазмы, где указанный анализ проводят с использованием DAPI.
В другом воплощении популяцию клеток анализируют путем определения интактных клеток с высоким ядерно-цитоплазматическим отношением, интактных клеток с низким ядерно-цитоплазматическим отношением, ранних апоптотических клеток или поздних апоптотических клеток и распознавания циркулирующих опухолевых клеток.
В другом воплощении первый маркер, второй маркер, третий маркер и четвертый маркер представляют собой флуоресцентные маркеры.
В другом воплощении первый маркер представляет собой цитологический краситель для распознавания циркулирующих опухолевых клеток по морфологии, размеру или ядерно-цитоплазматическому отношению.
В другом воплощении цитологический краситель представляет собой DAPI.
В другом воплощении цитологический краситель представляет собой краситель Райта-Гимзы (Wright-Giemsa).
В другом воплощении второй маркер или третий маркер представляет собой клеточноспецифичный маркер.
В другом воплощении клеточноспецифичный маркер представляет собой цитокератин, CD45, М30, хемокиновый рецептор, CXCR1 (С-Х-С хемокиновый рецептор 1), CXCR4, CD44, CD24, VEGFR-1 (рецептор фактора роста эндотелия сосудов-1), VEGFR-2, VEGFR-3, EGFR (рецептор эпидермального фактора роста) или HuR (человеческий антиген R).
В другом воплощении детектирование наличия первого маркера, наличия второго маркера, наличия третьего маркера или наличия четвертого маркера дополнительно включает анализ популяции клеток путем прикрепления клеток к подложке, сканирование популяции клеток на подложке и визуализацию клеток путем цифровой микроскопии с использованием перемещения.
В другом воплощении детектирование 5Т4-положительных циркулирующих опухолевых клеток в образце крови указывает на наличие 5Т4-положительного рака, где указанный рак выбран из группы, состоящей из карцином мочевого пузыря, молочной железы, шейки матки, колоректальной карциномы, карцином эндометрия, почки, печени, легкого, пищевода, яичника, предстательной железы, поджелудочной железы, кожи, желудка и семенника. Предпочтительно, указанный рак выбран из группы, состоящей из колоректальной карциномы, карцином молочной железы, поджелудочной железы и немелкоклеточной карциномы легкого.
В другом воплощении в изобретении предложен способ диагностики 5Т4-положительного рака у млекопитающего, который предположительно имеет 5Т4-положительный рак, включающий тестирование образца крови от субъекта, где образец крови содержит популяцию клеток; закрепление образца крови на подложке; детектирование в образце крови наличия или отсутствия первого маркера, который избирательно связывается с ядросодержащими клетками; детектирование в образце крови наличия или отсутствия второго маркера, который связывается с циркулирующими опухолевыми клетками; детектирование в образце крови наличия или отсутствия третьего маркера, который связывается с популяцией клеток или субпопуляцией популяции клеток, которые не определены как опухолевые клетки; детектирование в образце крови наличия или отсутствия четвертого маркера, который избирательно связывается с циркулирующими опухолевыми клетками, где указанный четвертый маркер представляет собой человеческий антиген 5Т4; и анализ и количественная оценка популяции клеток, выявленной при помощи первого, второго, третьего и четвертого маркеров, для распознавания и характеристики циркулирующих опухолевых клеток.
В другом воплощении в изобретении предложен способ, где указанное количественное определение человеческого антигена 5Т4 на циркулирующих опухолевых клетках применяют для генерирования Η-индекса (H-score), где указанный Η-индекс применяют для выбора популяции пациентов с 5Т4-положительным раком, и где указанные циркулирующие опухолевые клетки охарактеризованы с применением оптимизированного 4-цветного анализа 5Т4.
В другом воплощении в изобретении предложен способ скрининга конъюгата антитело-лекарственное средство для лечения 5Т4-положительного рака у млекопитающего, который предположительно имеет рак, включающий введение терапевтически эффективного количества конъюгата антитело-лекарственное средство субъекту, предположительно имеющему рак; тестирование образца крови от субъекта до или после лечения лекарственным средством-кандидатом, где образец крови содержит популяцию клеток, предположительно содержащую 5Т4-положительные циркулирующие опухолевые клетки; закрепление образца крови на подложке; детектирование в образце крови наличия или отсутствия первого маркера, который избирательно связывается с ядросодержащими клетками; детектирование в образце крови наличия или отсутствия второго маркера, который связывается с циркулирующими опухолевыми клетками; детектирование в образце крови наличия или отсутствия третьего маркера, который связывается с популяцией клеток или субпопуляцией популяции клеток, которые не определены как опухолевые клетки; детектирование в образце крови наличия или отсутствия четвертого маркера, который избирательно связывается с циркулирующими опухолевыми клетками, где указанный четвертый маркер представляет собой человеческий антиген 5Т4; и анализ популяции клеток, выявленной при помощи первого, второго, третьего и четвертого маркеров, для распознавания циркулирующих опухолевых клеток в образце крови до лечения конъюгатом антитело-лекарственное средство по сравнению с образцом крови после лечения конъюгатом антитело-лекарственное средство, где изменение в соотношении 5Т4-положительных циркулирующих опухолевых клеток и 5Т4-отрицательных циркулирующих опухолевых клеток в образце крови после лечения по сравнению с соотношением 5Т4-положительных и 5Т4-отрицательных циркулирующих опухолевых клеток в образце крови до лечения может показывать эффективность конъюгата антитело-лекарственное средство в уменьшении 5Т4-положительных циркулирующих опухолевых клеток, где указанное соединение-конъюгат антитело-лекарственное средство представляет собой aHTH-5T4-A1-mcMMAF.
В другом воплощении в изобретении предложен способ детектирования 5Т4-положительных циркулирующих опухолевых клеток у млекопитающего, предположительно имеющего 5Т4-положительный рак, включающий тестирование образца крови от субъекта, где образец крови содержит популяцию клеток; закрепление образца крови на подложке; детектирование в образце крови наличия или отсутствия первого маркера, который избирательно связывается с ядросодержащими клетками, где указанный первый маркер представляет собой DAPI; детектирование в образце крови наличия или отсутствия второго маркера, который связывается с циркулирующими опухолевыми клетками, где указанный второй маркер представляет собой цитокератин; детектирование в образце крови наличия или отсутствия третьего маркера, который связывается с популяцией клеток или субпопуляцией популяции клеток, которые не определены как опухолевые клетки, где указанный третий маркер представляет собой CD45; детектирование в образце крови наличия или отсутствия четвертого маркера, который избирательно связывается с циркулирующими опухолевыми клетками, где указанный четвертый маркер представляет собой человеческий антиген 5Т4; и анализ популяции клеток, выявленной при помощи первого, второго, третьего и четвертого маркеров, для распознавания и характеристики циркулирующих опухолевых клеток.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
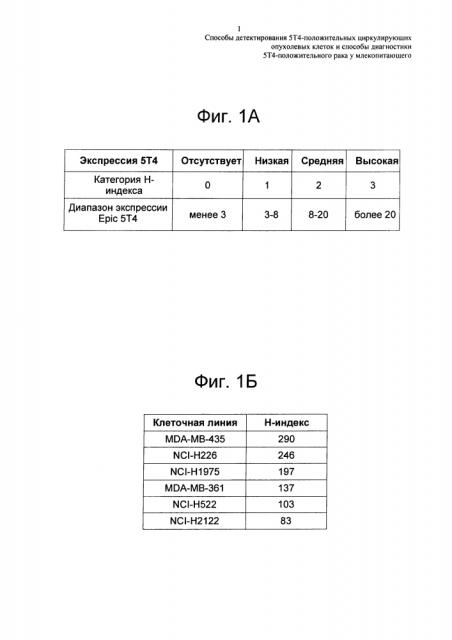
На Фиг. 1а показано сравнение диапазона экспрессии 5Т4, применяемое в расчете Н-индекса.
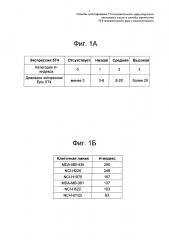
На Фиг. 1б представлены калибровочные клеточные линии, отображающие пороговые значения, установленные для низкого, среднего и высокого уровня экспрессии 5Т4 при немелкоклеточном раке легкого (NSCLC).
На Фиг. 2а показана диаграмма разброса данных экспрессии 5Т4 как для единичных СТС, так и для кластеров СТС в образцах от пациентов с NSCLC, проанализированных с помощью оптимизированного 4-цветного диагностического анализа 5Т4.
На Фиг. 2б показаны данные по 17 образцам от пациентов с NSCLC, проанализированных с помощью оптимизированного 5Т4 4-цветного диагностического анализа и Η-индексы, рассчитанные с использованием калибровочных клеточных линий.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, как обычно понимает специалист в данной области техники, к которой принадлежит данное изобретение. Хотя любые способы и материалы, похожие или эквивалентные таковым, описанным здесь, могут быть применены на практике для тестирования настоящего изобретения, предпочтительными материалами и способами являются описанные здесь. В описании и формуле настоящего изобретения будет применяться следующая терминология.
5Т4 относится к онкофетальному антигену 5Т4, 72 кДа сильногликозилированному трансмембранному гликопротеину, содержащему 42 кДа негликозилированный кор (смотрите патент США №5869053). Человеческий 5Т4 экспрессируется при многочисленных типах рака, включая карциномы мочевого пузыря, молочной железы, шейки матки, ободочной кишки, эндометрия, почки, легкого, пищевода, яичника, предстательной железы, поджелудочной железы, кожи, желудка и яичек, но не ограничиваясь ими. Было показано, что высокоонкогенные клетки, также называемые раковыми стволовыми клетками или клетками, инициирующими опухоль, имеют высокие уровни экспрессии 5Т4 (WO2010/111659). Антитела против 5Т4 включают антитела, которые специфически связываются с человеческим антигеном 5Т4 (смотрите патент США No.8044178).
Термин "биологический монослой" относится к образцу крови, который может находиться на различных стадиях выделения или очистки клеток. Например, биологический монослой может быть частично очищенным и содержать одноядерные и другие клетки, после того как прошел лизис эритроцитов.
Выражение "сортировка популяции клеток перед закреплением образца на подложке" относится к удалению субпопуляции популяции клеток из образца, например образца крови. Сортировка может осуществляться путем избирательного лизиса клеток и центрифугирования субфракции клеток. Также сортировка может осуществляться с использованием флуоресцентного маркера клеток и сортировки клеток с активированной флуоресценцией. Сортировка клеток по клеточным маркерам может осуществляться в форме положительного отбора на циркулирующие опухолевые клетки или в форме отрицательного отбора для удаления неопухолевых клеток.
"Подложка" держит тестируемый образец, например образец крови, содержащий клетки, закрепленные для детектирования и анализа. В одном аспекте подложка может быть плоской. Еще в одном аспекте подложка может иметь некоторую кривизну.
Термины "субъект", "млекопитающее" или "пациент" относятся к любому пациенту-млекопитающему или субъекту, к которому можно применять способы по данному изобретению. "Млекопитающее" относится к пациентам-людям и приматам, не являющимся людьми, а также к экспериментальным животным, таким как кролики, крысы и мыши, и другим животным. В иллюстративном воплощении настоящего изобретения для идентификации субъектов-пациентов, подлежащих лечению в соответствии со способами по данному изобретению, применяют общепринятые способы скрининга для определения факторов риска, ассоциированных с целевым или предполагаемым заболеванием или состоянием, например 5Т4-положительным раком, или для определения статуса существующего заболевания или состояния у субъекта. Эти способы скрининга включают, например, общепринятые обследования для определения факторов риска, которые могут быть ассоциированы с целевым или предполагаемым заболеванием или состоянием. Эти и другие рутинные способы позволяют клиническому специалисту отобрать пациентов, нуждающихся в терапии с применением способов и композиций по данному изобретению.
Термины "образец крови", "препарат крови", "тестируемый образец" и "проба крови" применяют взаимозаменяемо, и они определены как количество крови, взятой или полученной от субъекта, обычно путем венепункции или чрескожного прокалывания вены острым негнущимся тонким зондом или канюлей, несущими гибкий пластиковый катетер, или стальной иглой, соединенной со шприцом или катетером, для применения в медицинских тестах, включая диагностические анализы.
"Рак", "злокачественная опухоль", "солидная опухоль" или "гиперпролиферативное заболевание" применяют как термины-синонимы, и они относятся к любому из ряда заболеваний, которые характеризуются неконтролируемой, патологической пролиферацией 5Т4-положительных клеток, способностью пораженных 5Т4-положительных клеток распространяться локально или через кровоток и лимфатическую систему к другим частям тела (то есть метастазировать), а также любым из ряда характерных структурных и/или молекулярных признаков.
"Первый маркер", "второй маркер", "третий маркер" и "четвертый маркер" распознают циркулирующую опухолевую клетку по цитологическому окрашиванию или по клеточноспецифичному маркеру. Первый маркер представляет собой цитологический краситель, включая DAPI, краситель Райта-Гимзы или другие цитологические красители, известные в данной области техники, но не ограничиваясь ими. Смотри, например, B.F. Atkinson, Atlas of Diagnostic Cytopathology. 2nd Edition, W.B. Saunders Company, Ed., 2003, включенный сюда посредством ссылки во всей своей полноте. Второй и третий маркеры представляют собой клеточноспецифичные маркеры, включая маркеры на цитокератин, CD45, М30, хемокиновый рецептор, CXCR1, CXCR4, CD44, CD24, изоформы рецептора фактора роста эндотелия сосудов (VEGFR-1, VEGFR-2, VEGFR-3), рецептор эпителиального фактора роста (EGFR) или фактор стабильности иРНК HuR, но не ограничиваясь ими. Четвертый маркер относится к антигену 5Т4.
Эти маркеры распознают различные типы клеток, включая клетки гематопоэтического происхождения, цитокератины на эпителиальных клетках, клетки рака молочной железы, клетки рака предстательной железы, CD44, рецепторы клеточной поверхности, распознающие гиалуроновую кислоту, хемокиновые рецепторы, такие как CXCR1 или CXCR4.
Термин "сортировка" в отношении клеток, как он используется здесь, относится как к механической сортировке клеток, что может быть выполнено с применением, например, клеточного сортера с активацией флуоресценции, так и к анализу клеток на основании экспрессии маркеров клеточной поверхности, например анализа FACS (сортировка клеток с активацией флуоресценции) в отсутствие сортировки.
"Анализ популяции клеток по деталям ядра, контуру ядра, наличию или отсутствию ядрышек, качеству цитоплазмы или количеству цитоплазмы" и "анализ популяции клеток путем оценки интактных клеток с высоким ядерно-цитоплазматическим отношением, интактных клеток с низким ядерно-цитоплазматическим отношением, ранних апоптотических клеток или поздних апоптотических клеток и распознавания циркулирующих опухолевых клеток" может осуществляться с применением методик и аналитических методов как описано в В.F. Atkinson, там же.
"Контроль терапии рака или выздоровления от рака" относится к диагностическим тестам in vivo или in vitro для определения стадии развития рака или эффективности определенного способа лечения рака.
Термин "циркулирующие опухолевые клетки (СТС)" относится к интактным опухолевым клеткам или кластерам опухолевых клеток, которые являются положительными по пан-цитокератину и отрицательными по CD45. СТС также включают клетки, которые являются положительными по 5Т4 и отрицательными по CD45; клетки, которые являются положительными как по пан-цитокератину, так и по 5Т4, и отрицательными по CD45; и клетки, которые морфологически совместимы со злокачественными клетками. Способы для классификации и детектирования СТС были описаны ранее (WO 2011/028905, WO 2011/050103 и US 2009/0317836, включены сюда посредством ссылки).
"Η-индекс" представляет собой взвешенный показатель, который суммирует процентное содержание СТС внутри каждой категории (низкой, средней и высокой), умноженное на их относительные величины категории, с получением показателя от 0 до 300.
В данной области техники известно несколько способов детектирования циркулирующих опухолевых клеток. Низкий уровень концентрации злокачественных эпителиальных клеток в образцах крови, приблизительно одна на 106-107 всех ядросодержащих клеток, делает их трудными для детектирования. Были попытки выявлять и подсчитывать несколькими методами, включая ПЦР (полимеразная цепная реакция), проточную цитометрию, основанные на визуализации иммунологические подходы, иммуномагнитные методы, микроструйные методы и технологию микрочипов.
Например, в системе AdnaTest Breast Cancer® применяется полимеразная цепная реакция с обратной транскрипцией (RT-PCR) для детектирования циркулирующих опухолевых клеток (AdnaGen AG, Langenhagen, Germany; OncoVista, Inc., San Antonio, TX). Характерной чертой этого теста является процедура СТС-обогащения, в которой применяется запатентованная смесь иммуномагнитных шариков, покрытых одним из трех антител к антигенам поверхности эпителия. Затем число СТС опосредованно определяют с помощью метода полуколичественной RT-PCR.
CellSearch System™ (Veridex LLC, Warren, NJ) была разработана для целей детектирования СТС в цельной крови. CellSearch system включает метод смешивания образца крови с железными частицами, покрытыми антителом, которое связывается с эпителиальными клетками. Затем эпителиальные клетки отличают от лейкоцитов антителами, которые были помечены флуоресцентным красителем таким образом, чтобы раковые клетки можно было легко отличить и подсчитать.
OncoQuick™ (Greiner Bio-One-, Inc. Longwood, FL) представляет собой другую систему тестирования, которая была разработана для детектирования циркулирующих опухолевых клеток. Эта система представляет собой усиленную систему градиента плотности, которая совмещает центрифугирование в градиенте плотности и методы, основанные на иммунологических.
Способ подсчета числа СТС в пробе от пациента, включающий пропускание указанной пробы через микроструйное устройство, которое избирательно обогащает одной или более чем одной циркулирующей опухолевой клеткой, описан в заявке на патент США №2010/0233693, включенной сюда посредством ссылки. Микроструйное устройство может обогатить одной или более чем одной СТС на основании размера, сродства, способности к деформации или формы.
Способ выделения и анализа СТС с использованием микроканального устройства описан в заявке на патент США №2010/0255479. Этот способ подходит для захвата биологических мишеней из раствора путем предварительного мечения или предварительного смешивания образца, содержащего СТС, с партнером связывания, который специфически связывается с клетками, усиливая захват СТС в микроканальном устройстве.
Каждый из вышеупомянутых способов детектирования циркулирующих опухолевых клеток требует этапа обогащения клетками. Отличительная особенность настоящего изобретения состоит в анализе без обогащения, который демонстрирует способность распознавать значительные количества СТС у большинства пациентов с 5Т4-положительным раком.
Один аспект настоящего изобретения в целом относится к способу детектирования 5Т4-положительных циркулирующих опухолевых клеток (СТС) у млекопитающего или способу диагностики ранней стадии 5Т4-положительного рака у млекопитающего. Настоящее изобретение дополнительно относится к способу скрининга соединения-кандидата лекарственного средства у млекопитающего для лечения 5Т4-положительного рака.
Предложен способ для детектирования 5Т4-положительных СТС у млекопитающего, который включает получение от млекопитающего, предположительно имеющего рак, образца крови, содержащего смешанную популяцию клеток, предположительно содержащую СТС, закрепление клеток крови и СТС на подложке для формирования биологического монослоя, детектирование в биологическом монослое первого маркера, который избирательно связывается с ядросодержащими клетками, детектирование в биологическом монослое второго маркера, который связывается с СТС, детектирование в биологическом монослое третьего маркера, который связывается со смешанной популяцией клеток или субпопуляцией смешанной популяции клеток, детектирование в биологическом монослое четвертого маркера, который избирательно связывается с 5Т4-положительными клетками, анализ популяции клеток, выявленной при помощи первого, второго, третьего и четвертого маркеров для распознавания СТС; наличие СТС в образце крови, указывающее на наличие 5Т4-положительного рака или ранней стадии 5Т4-положительного рака у млекопитающего. Наличие или отсутствие СТС в образце крови может указывать на наличие состояния отсутствия заболевания или состояния неопределяемого заболевания у млекопитающего.
Способ обеспечивает протокол прикрепления клеток для распознавания клеток эпителиального происхождения в образце крови в сочетании со способом детектирования 5Т4-положительных СТС в крови пациентов с раком. В этом протоколе живые белые клетки крови (WBC), например лейкоциты, и другие клетки в крови, отделяют на предметное стекло, например, в виде биологического монослоя. Лейкоциты включают Т-лимфоциты; моноциты, эозинофилы и нейтрофилы, вовлеченные в фагоцитоз; и, базофилы, вовлеченные в воспалительную реакцию, но не ограничиваются ими.
Этот способ дополнительно обеспечивает флуоресцентное мечение прикрепленных WBC и CTC на адгезивные предметные стекла со специальным покрытием. Клетки флуоресцентно метят первым маркером, который избирательно связывается с ядросодержащими клетками, где указанный маркер представляет собой DAPI, вторым маркером, который связывается с циркулирующими опухолевыми клетками, где указанный второй маркер представляет собой цитокератин (СК), неотъемлемый компонент СТС, с третьим маркером, который связывается с популяцией клеток или субпопуляцией популяции клеток, которые не определены как опухолевые клетки, где указанный третий маркер представляет собой CD45, и четвертым маркером, который избирательно связывается с циркулирующими опухолевыми клетками, где указанный четвертый маркер представляет собой человеческий антиген 5Т4. Затем предметное стекло сканируют на сайты флуоресценции и анализируют с помощью высокопроизводительного вычислительного процесса, который использует алгоритмы, которые оценивают клеточные параметры, определенные при помощи первого, второго, третьего и четвертого маркеров, для распознавания и характеристики циркулирующих опухолевых клеток.
Этот способ дополнительно обеспечивает способы, использующие флуоресцентную микроскопию, и протокол прикрепления клеток для исследования распространенности СТС у пациентов с 5Т4-положительным раком. Дополнительное преимущество этого способа предоставляет патоморфологу возможность перемещать и изучать интересующие клетки для патологического подтверждения и характеристики. В настоящем изобретении протокол дополнительно включает удаление покровного стекла и/или растворение водорастворимой закрепляющей среды на каждом флуоресцентно меченом предметном стекле и повторное окрашивание тех же самых клеток с использованием второго клеточного маркера, например стандартного красителя Райта-Гимзы, для обеспечения дополнительных возможностей проникновения в морфологию, размер и гетерогенность СТС. Известные CK+-индивидуальные редкие клетки и кластеры редких клеток, которые были локализованы путем высокопроизводительного вычислительного процесса и протокола прикрепления клеток, могут быть оценены морфологически. Хотя флуоресцентные изображения СТС помогли в подтверждении их распознавания, окрашивание Райта-Гимзы обеспечило дополнительную цитологическую информацию о СТС. В дополнительном аспекте изобретения способ может быть применен для оценки различных клеточных маркеров, которые являются специфическими либо для состояния заболевания, для клеточного типа, либо для состояния клеток.
Способность детектировать и характеризовать СТС потенциально может помочь в диагностике и индивидуализированном лечении пациентов с 5Т4-положительным раком. Вследствие их редкости, для исследования СТС требуются специальные способы. В настоящем изобретении предложен подход биопсии жидкой фазы (fluid phase biopsy), который дает возможность применения стандартных цитопатологических способов для детальной морфологической характеристики СТС в крови, полученной от пациентов с раком, и обеспечивает детали цитологических характеристик спектра СТС без применения обогащения, основанного на белках поверхности. Ядросодержащие клетки, выделенные из цельной крови, помещают на адгезивные предметные стекла, иммунофлуоресцентно метят и анализируют на наличие 5Т4-положительных СТС путем цифровой микроскопии. Сочетание этих методов с методами рутинного окрашивания дает возможность идентификации и оценки СТС с использованием световой микроскопии. Как показано с использованием общепринятых патоморфологических способов для наблюдения за этими клетками, СТС демонстрируют высокую степень плеоморфизма между пациентами (inter-patient) и у одного пациента (intra-patient) в препаратах цельной крови, и распознают интактные СТС как с высоким, так и с низким ядерно-цитоплазматическим отношением наряду с СТС, проявляющими признаки апоптоза. Морфологические наблюдения позволяют предположить, что полный спектр клеток, присутствующих в первичных и метастатических очагах опухоли, также можно наблюдать циркулирующими в крови, а также обеспечивают возможную основу морфологической классификации, в пределах которой можно изучать свойства субпопуляций клеток, вовлеченных в метастазирование.
Автоматизированная цифровая микроскопия. Координаты
предполагаемых клеток загружают в систему визуализации редких событий (rare-event imaging system, REIS), полностью автоматизированную систему сканирующей цифровой микроскопии. Компоненты аппаратного обеспечения REIS и запатентованное сканирующее программное обеспечение были детально описаны в другом источнике (Krivacic et al., Proc. Natl. Acad. Sci. USA 101: 10501-10504, 2004).
Измерения. Детектированные флуоресцентные объекты анализируют с помощью программного отбора для дифференцировки редких клеток от ложно положительных. Поскольку эти клетки обычно мельче, чем разрешение лазерного пятна (20 мкм), первый фильтр пропускает все объекты, которые меньше порога размера (20 мкм). Второй фильтр анализирует соотношение между интенсивностями флуоресценции от различных каналов для элиминации гомогенных агрегатов красителя, обычного артефакта иммунофлуоресцентного окрашивания.
Образец может быть подготовлен в виде биологического монослоя путем раскатки образца биологической жидкости, включая кровь или части крови от субъекта, но не ограничиваясь ими. В одном аспекте образец представляет собой монослой клеток. Жидкий образец обрабатывают флуоресцентным веществом, таким как маркерный краситель, который избирательно связывается с различными типами биологических молекул, которые могут находиться на поверхности или внутри клетки, такими как белки, нуклеиновые кислоты или другие молекулы, но не ограничиваясь им. Подходящие маркеры известны в данной области техники для маркировки нескольких различных типов клеток, представляющих клинический интерес, включая выбранные типы раковых клеток, эмбриональных клеток или других подходящих для рассмотрения клеток. Маркеры для многочисленных других клеток, таких как клетки мозга, клетки печени, а также клетки бактерий, могут быть разработаны среди других. Вещество испускает характерный сигнал, такой как флуоресценция или фосфоресценция, в ответ на выбранное возбуждающее облучение, такое как облучение с выбранной длиной волны или спектром света, рентгеновского облучения, облучение электронным пучком или тому подобное. Характерная люминесценция обычно имеет характерную длину волны или спектральный диапазон длин волн. В то время как окрашивание представляет собой преобладающий способ мечения, существуют другие методы, включая применение маркеров, известных как квантовые точки и зонды нано-частиц ДНК.
В другом аспекте изобретения предложен способ определения расположения редкой клетки, например 5Т4-положительной циркулирующей опухолевой клетки (СТС), внутри биологического монослоя. Смотри, например, заявку США №2004/0131241, включенную сюда посредством ссылки. Предметное стекло, которое несет по меньшей мере одну редкую клетку и имеет визирные метки, расположенные в положениях, которые образуют по существу правильный угол, помещают в держатель предметных стекол первой системы визуализации. Определяют первое координатное пространство системы визуализации, и обозначают координаты визирных меток в первом координатном пространстве. Определяют второе координатное пространство второй системы визуализации, и обозначают координаты визирных меток во втором координатном пространстве. Используя обозначенные координаты визирных меток первого координатного пространства, рассчитывают параметры преобразования координат. После этого обозначают координаты по меньшей мере одного объекта в первом координатном пространстве, и координаты этого объекта в первом координатном пространстве преобразуют в однозначно определяемые координаты во втором координатном пространстве, используя параметры преобразования координат.
Как только редкая клетка или СТС была локализована, покровное стекло может быть удалено с биологического слоя, или водорастворимая закрепляющая среда может быть растворена на каждом флуоресцентно окрашенном предметном стекле. Те же самые клетки могут быть повторно окрашены с использованием второго клеточного маркера, например стандартного окрашивания Райта-Гимзы для обеспечения проникновения в морфологию, размер и гетерогенность СТС. Известные цитокератин-положительные (CK+) единичные редкие клетки и кластеры редких клеток могут быть локализованы и оценены морфологически. Хотя флуоресцентные изображения СТС помогли в подтверждении их идентификации, окрашивание Райта-Гимзы обеспечило дополнительную информацию о СТС.
В дополнительном аспекте этот процесс может быть использован для оценки различных клеточных маркеров, которые являются специфическими или для заболевания, или для болезненного состояния, или для клеточного типа, или для состояния клетки. Способы по настоящему изобретению помогут характеризовать СТС. Они дают возможность высококачественной верификации СТС из крови, полученной от пациентов с 5Т4-положительным раком без обогащения, и обеспечивают возможность проникновения в морфологию и характеристики СТС.
Поиск редких метастатических СТС позволяет предположить, что многие СТС являются апоптотическими и неспособными к формированию метастазов и даже, по приблизительным подсчетам, только 1 диссеминированная раковая клетка из 10000 может образовывать метаста