Способ окисления аммиака и система, подходящая для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к неорганической химии и может быть использовано в химической промышленности для получения продуктов окисления аммиака. Система для окисления аммиака содержит реактор (3), оснащенный линией (120) подачи газовоздушной смеси и линией выпуска технологического газа. Внутри реактора (3) расположен катализатор (3с), содержащий по меньшей мере один оксид переходного металла, который не является оксидом платиновой группы. Система также содержит устройство для регуляции молярного отношения кислорода к аммиаку в реакционной газовой смеси до значений от 1,25 до 1,75 моль/моль посредством смешивания газового потока с содержанием О2<20% по объему с выбранным количеством аммиака. Содержащий кислород газовый поток может быть образован 1) с помощью устройства для разбавления воздушного потока газовым потоком (линия 220); 2) с помощью устройства для уменьшения содержания кислорода в содержащей кислород газовой смеси, предпочтительно в воздухе (линия 210); 3) при их комбинации. Температура полученного газа на выходе из слоя катализатора составляет от 700°С до 950°С. 2 н. и 28 з.п. ф-лы, 6 ил., 2 табл.
Реферат
Описание изобретения
Способ окисления аммиака и система, подходящая для его осуществления
Настоящее изобретение относится к улучшенному способу окисления аммиака до оксидов азота, который используется, в частности, в производстве азотной кислоты и капролактама. Настоящее изобретение также относится к улучшенной системе для получения продуктов окисления аммиака.
Уровень техники и постановка задачи
Каталитическое окисление аммиака (NH3) до оксидов азота NOx часто оказывается основной реакцией в крупнотоннажном производстве азотсодержащих основных материалов для химической промышленности. Здесь следует упомянуть производство азотной кислоты (HNO3) в качестве исходного материала, например, для производства азотсодержащих удобрений или производства гидроксиламина или гидроксиламмониевых солей для получения капролактама и, таким образом, полиамидов.
Следующие утверждения в отношении известного уровня техники, в качестве примера, относятся к производству HNO3 посредством каталитического окисления NH3.
Производство азотной кислоты является одним из самых хорошо разработанных способов химической технологии, который был доведен до промышленной пригодности после применения В. Оствальдом способа Габера-Боша для синтеза аммиака с применением платиновых катализаторов и того технического решения, которое все еще лежит в основе современного производства HNO3 даже в наши дни.
Первая промышленная система с применением платинового катализатора (гофрированных лент платиновой фольги) для производства 1500 тонн в год нитрата аммония была построена еще в 1906 г. в Герте под Бохумом. Вскоре (в 1909 г.) были выданы первые патенты на применение в качестве катализаторов тканых сеток на основе платины. Чуть позже для таковых стали применять сплавы с родием. И хотя применение этого катализатора сопряжено с большими инвестиционными расходами и безвозвратным расходом катализатора в способе окисления NH3 (платина выгорает), эти каталитические системы используют до настоящего времени, а в модифицированном виде (заказные тканые материалы) они все еще составляют уровень техники (смотри, Winnacker , Chemische Technik - Prozesse und Produkte, 5th Edition, Volume 3, Chapter 3, p. 248-275, Wiley-VCH Verlag GmbH & Co. KGaA).
В последнее время увеличилось применение сеток на основе металла платиновой группы с высоким содержанием Pd, поскольку они обеспечивают не только определенное снижение стоимости, но и уменьшают содержание веселящего газа (N2O), образование которого является нежелательным при окислении NH3, и который вызывает парниковый эффект.
Обычные размеры диаметра сетки на основе металла платиновой группы, которые натянуты внутри реактора окисления аммиака над широкой областью, часто называемой "горелкой", находятся в диапазоне от 0,5 до 5 м. Толщина сетчатой насадки обычно составляет от нескольких миллиметров до примерно двух сантиметров в зависимости от числа применяемых сеток.
Газовая смесь, обычно содержащая от примерно 9 до 12% по объему NH3 и воздух, проходит сквозь сетки, на которых устанавливается температура от примерно 800 до 950°С вследствие экзотермической природы реакции окисления. Посредством этого NH3 окисляется очень селективно до монооксида азота (NO) (см. ниже схема реакции 1), который затем окисляется в ходе протекания дальнейшего процесса до диоксида азота (NO2) (схема реакции 2) и, наконец, превращается в HNO3 при взаимодействии с водой в абсорбционной колонне (схема реакции 3).
Первичное окисление NH3 - целевая реакция:
.
Окисление NO:
.
Образование HNO3:
.
В результате брутто-реакция имеет вид:
.
Несмотря на то, что содержание O2 в воздухе для горения составляет 21% по объему и формально его вполне хватает, чтобы обеспечить полное превращение 10% по объему NH3 в HNO3, при промышленном производстве HNO3 после каталитического окисления NH3, но при этом перед подачей в абсорбционную колонну, в технологический газ вводят дополнительное количество атмосферного кислорода (вторичный воздух), чтобы увеличить скорость окисления NO и, следовательно, скорость образования HNO3 в абсорбционной колонне. Остаточное содержание кислорода в отходящем газе на выходе из абсорбционной колонны обычно составляет от примерно 1 до 5% по объему.
Согласно современным представлениям о реакции первичного окисления (см. Handbook of Heterogeneous Catalysis, 2nd Edition, Volume 5, 2008, Chapter 12.2.7.1, p. 2582, WILEY-VCH Verlag GmbH & Co. KGaA, 2008) при горении NH3 на поверхности катализатора необходимо высокое парциальное давление кислорода, чтобы подавить образование азота и веселящего газа, не представляющих ценности вторичных продуктов. Данное наблюдение согласуется со стехиометрическими соотношениями образования N2 и N2O (см. схемы реакции 5 и 6 ниже), для которых необходимо меньше кислорода по сравнению с образованием NO (схема реакции 1).
Первичное окисление NH3 - вторичные реакции:
;
.
Образование NO2, для которого согласно схеме реакции (7) потребовалось бы повышенное количество кислорода, не происходит на катализаторе на основе металла платиновой группы.
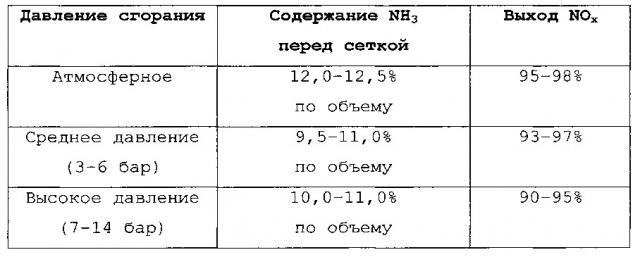
Селективность образования вторичных продуктов или NOx зависит также от общего рабочего давления при окислении NH3. Чем выше давление, тем ниже выход NOx. Значения выхода NOx, которые удается достичь в уровне техники с применением различных вариантов способа (при различных значениях давления сгорания), приведены в следующей таблице (взятой из , Chemische Technik - Prozesse und Produkte, 5th Edition, Volume 3, Chapter 3, p. 248-275, Wiley-VCH Verlag GmbH & Co. KGaA).
Однако единственным недостатком катализаторов на основе металла платиновой группы является их низкая стойкость при высокой рабочей температуре примерно 900°С. При широко применяемом давлении сгорания вследствие выгорания благородного металла расход катализатора составляет от примерно 0,04 до 0,4 г Pt/т HNO3, так что катализатор приходится периодически обновлять через определенные промежутки времени каждые от примерно 3 до 15 месяцев в зависимости от давления сгорания. Это приводит к довольно значительным затратам, даже если часть выгоревшей платины извлекают с применением различных систем улавливания (например, сеток на основе Pd).
Чтобы устранить эти недостатки, неоднократно пытались разработать альтернативные каталитические материалы на основе оксидов металлов, в частности, с целью экономии платины. Обзор множества разных попыток применять оксидные катализаторы приведен в Sadykov et al., Appl. Catal. General A: 204 (2000), p. 59-87. Так, в Восточной Европе применяли каталитические системы на основе легированных оксидов железа, нередко в комбинации с сетками на основе металла платиновой группы, при этом в Западном полушарии предпочтительно применяли системы на основе оксида кобальта.
Однако ни одна из этих попыток создать не содержащие металлической платины катализаторы окисления NH3 так до настоящего времени и не получила признания в промышленности, поскольку подобные катализаторы обладают низкой селективностью в отношении образования NO по сравнению с высоко селективными катализаторами на основе металла платиновой группы, а в современных системах производства HNO3 стоимость продукта более чем на 70% складывается из стоимости NH3.
Во многих случаях потенциально активные не содержащие благородный металл катализаторы на основе оксидов переходных металлов также с течением времени подвергаются значительной деактивации в условиях их применения, которая обусловлена не только эффектами спекания под действием высоких термическим напряжений, но нередко и (частичным) восстановлением оксидов посредством NH3 до соответствующих оксидов с более низкой валентностью, которые обычно обладают низкой активностью и селективностью в отношении образования NO. Можно упомянуть, например, восстановление MnO2 и Mn2O3 до Mn3O4, восстановление CuO2 до CuO, восстановление α-Fe2O3 до Fe3O4 и FeO или хорошо известное восстановление высокоактивного Co3O4 до менее активного СоО.
Чтобы предотвратить подобную деактивацию в случае промышленного применения катализаторов на основе Co3O4 для окисления NH3 в ректоре с неподвижным слоем катализатора от Incitec Ltd., Австралия, слой катализатора периодически перекладывали, чтобы остаточным кислородом из задней части слоя катализатора провести обратное окисление катализатора, подвергшегося восстановлению под действием высокой концентрации NH3 в передней части слоя катализатора. Та же самая идея также рассматривается в соответствующих работах авторов Schmidt-Szalowski et al. (см. статью: Appl. Catal. А: General 177 (1998), p. 147-157), которые сообщали об окислении NH3 на катализаторах на основе Co3O4 в псевдоожиженном слое. Они считали, что при вихревом перемешивании частиц катализатора в нижней части псевдоожиженного слоя под действием кислорода постоянно происходит обратное окисление образующегося СоО.
Неоднократно подвергалась исследованию еще одна возможность подавить деактивирующее восстановление оксидов посредством их легирования, иначе говоря, посредством стабилизации вышеупомянутых бинарных оксидов иными оксидами металлов, которые с трудом подаются восстановлению, однако это легирование часто сопровождается понижением удельной активности, как описано Sadykov et al. в статье: Appl. Catal. General A: 204 (2000) p. 59-87. Можно упомянуть в качестве примера легирование α-Fe2O3 с применением Al2O3, которое послужило основой для создания двухступенчатых каталитических систем, разработанных в 1970-ых годах в СССР для окисления NH3 в комбинации с пониженным количеством обычных сетчатых катализаторов на основе Pt/Rh. Оксиды переходных металлов можно также превратить посредством легирования иными оксидами металлов в тройные смешанные оксиды, имеющие разную кристаллическую структуру, в которой высшие степени окисления переходных металлов обладают, в принципе, низкой способностью к восстановлению. Можно упомянуть, в частности, перовскитовые структуры, которые отличаются высокой активностью в отношении образования NO и высокой химической стойкостью.
Например, в US 4812300 А заявляют катализаторы на основе смешанного оксида для окисления аммиака перовскитового типа, имеющие общую формулу АВО3±δ, где А представляет собой щелочные металлы, щелочноземельные металлы, лантаноиды или актиноиды, В представляет собой один или несколько элементов из IB, IVB-VIIB и VIII групп. Считают, что для этих катализаторов характерны равновесные парциальные давления кислорода более 10-15 бар при 1000°С, так что возможен хороший перенос решеточного кислорода к молекуле NH3 без нарушения структурной целостности перовскита. Испытание катализаторов было проведено в данном документе в аппарате или в условиях температурно-программируемого восстановления (TPR) при атмосферном давлении, а также при концентрации NH3 3,3% по объему и содержании кислорода 6,7% по объему в гелии. Особенно предпочтительные перовскитовые катализаторы содержат лантан и/или стронций в качестве элемента положения А и кобальт, никель и/или марганец в качестве элемента положения В.
В WO-99/25650 А1 описано устройство для окисления NH3, в котором предпочтительно используют катализаторы на основе смешанного оксида, образованные из редкоземельных металлов и кобальта. В качестве примера описано окисление 10% NH3 по объему в воздухе при атмосферном давлении с применением смешанного оксида лантана/церия/кобальта (атомное отношение La:Се:Со=8:2:10).
В US 3888792 А для окисления NH3 описано применение оксида Co3O4, легированного редкоземельными металлами, который, считается, обладает более высокой селективностью и более высокой стойкостью по сравнению с чистым Co3O4. Испытание выбранных образцов проводили при объемном отношении NH3/воздух, равном 1/10, и атмосферном давлении. При длительном испытании в течение свыше 900 часов с применением легированного Се Co3O4, при котором промежуточное давление также повышали до 7 бар, при этом выход NOx всегда составлял более 90%.
В WO 2009/028949 А1 описаны катализаторы на основе смешанного оксида для получения NO посредством проведения реакции в газовой смеси, состоящей из NH3 и O2, причем эти катализаторы имеют общую формулу А3-хВх09-y. А и В выбирают из группы, в состав которой входят металлы Mn, Cr, Со, Fe и Al. Эти катализаторы подвергали испытанию при атмосферном давлении с применением газовой смеси с составом, включающим 10% NH3 в воздухе по объему или 10% NH3 по объему, 18% O2 по объему и 72% аргона по объему. Максимальное значение селективности в отношении образования NOx, составляющее 96%, достигали при применении смешанного оксида, имеющего состав Mn1,5Co1,5О4.
В качестве дополнительного примера можно привести US 3962138 А. В нем заявляются катализаторы для окисления NH3, которые состоят из 60-95% Со3O4, 5-15% Al2O3 и 0-25% оксида тория, церия, цинка или кадмия. Формованные катализаторы подвергали испытанию в реакторе с диаметром 10 см под давлением 4-5 бар с применением газовой смеси, содержащей 10% NH3 в воздухе по объему. При применении самых лучших катализаторов, каждый из которых содержал 10% ThO2, после эксплуатации в течение 400 часов был достигнут выход NOx, равный примерно 93-95%. Добавление Al2O3 и ThO2 привело к значительному увеличению выхода NOx и срока службы катализатора.
В DE 102012000419 А1 раскрыто низкотемпературное окисление аммиака при производстве азотной кислоты посредством пропускания содержащего аммиак и кислород потока газа над нагретым до температуры менее 500°С неподвижным слоем частиц катализатора на основе оксида LaSrCo и последующего охлаждения газового потока, содержащего оксид азота. Эта реакция описана на примере реакции, протекающей в потоке газа, который содержит 5% по объему диоксида углерода, 5% по объему воды, 10% по объему кислорода, 200 частей на миллион аммиака и азот в качестве остальной части.
В заявке WO 2006/010904 А1 приведено описание способов окисления, которые проводят на селективных перовскитных катализаторах. Эти катализаторы содержат висмут и/или лантаноиды, за исключением самого лантана. В качестве модельной реакции описано окисление аммиака в воздухе.
В DE 19903616 А1 описан способ получения оксидов азота, характеризующихся низкой степенью окисления, посредством каталитического окисления аммиака в смеси с воздухом и паром на катализаторе окисления. Упоминаются катализаторы, содержащие благородные металлы, или катализаторы, содержащие оксиды металлов.
В заявке WO 01/49603 А1 описан катализатор, содержащий оксид церия и оксид марганца, а также оксид магния, алюминия, цинка или кальция и активатор, для селективного окисления аммиака кислородом до динитрооксида N2O. Реакция протекает при относительно низкой температуре, не превышающей 250°С.
В DE 2148707 А описан катализатор окисления аммиака до оксидов азота. Этот катализатор состоит, главным образом, из оксида кобальта и характеризуется удельной площадью поверхности в диапазоне от 0,1 до 7 м2/г и пористостью при отношении объем/вес в диапазоне от 1 до 15%.
В US-A-5849257 описан способ получения оксидов азота, при котором осуществляют реакцию аммиака с кислородом в присутствии пара на катализаторе на основе оксида меди/марганца. Этот катализатор характеризуется определенным рентгеновским спектром.
В ЕР 0384563 В1 описан способ окисления аммиака в присутствии катализатора на основе оксида кобальта, легированного литием.
В US 2013/0039828 A1 описана структура катализатора, который подходит для окисления аммиака и отличается гибким размещением катализаторных блоков. Катализаторы могут содержать металлы платиновой группы или другие металлы.
В научной публикации [J. Catal. 276 (2010) 306-313] авторы Biausque и Schuurmann описывают механизм высокотемпературного окисления NH3 до NO на катализаторе на основе LaCoO3. Для его изучения были проведены различные исследования, в том числе с изменением содержания O2 и NH3, причем в одной из серий испытаний, начиная с концентрации NH3 3% по объему, меняли содержание кислорода в диапазоне от 10% до 40% по объему, а в другой серии испытаний, начиная с концентрации кислорода 20% по объему, меняли содержание NH3 в диапазоне от 1% до 5% по объему. Что касается достигаемого выхода NOx, то было обнаружено отрицательное влияние на него парциального давления O2 и положительное влияние парциального давления NH3. Иначе говоря, по мере увеличения парциального давления O2 и уменьшения парциального давления NH3 наблюдалось увеличение образования N2 и N2O, что противоречит характеру поведения платиновых катализаторов для окисления NH3.
В статье Catal. Lett. (2011) 141: 1215-8 авторы Tianfeng Hou et al. описывают каталитическое окисление аммиака до монооксида азота в присутствии перовскитовых катализаторов типа на основе LaMnO3 и LaVO4.
Во многих случаях из приведенного выше описания уровня техники исследуют окисление NH3 в воздухе, как в традиционном способе Оствальда, или в примерах практического осуществления устанавливают соответствующее объемное отношение O2/NH3 величиной по меньшей мере 1,9. Кроме того, почти во всех случаях проведенные исследования или опубликованные данные ограничиваются атмосферными условиями, при которых обеспечивают гораздо большую селективность в отношении образования NO, которую следовало бы ожидать при повышенных давлениях.
Тем не менее, высокие значения выхода NOx, ожидавшиеся от применения Pt/Rh сетчатых катализаторов, не достигнуты. Так же обстоит дело, в частности, и с высокими значениями пропускной способности по NH3, иначе говоря, при высокой начальной концентрации величиной 10% по объему и повышенном рабочем давлении, которые выгодны и привычны для промышленного производства благодаря уменьшению размеров аппарата и оптимальной адаптации к последующей абсорбции NO/NO2. Таким образом, выход NOx обычно уменьшается при повышении концентрации или при повышении (парциального) давления аммиака. В частности, так обстоит дело и для известных катализаторов на основе оксида, такого как, например, Co3O4 (смотри, например, Andrew, S.P.S.; Chinchen, G.C., "The loss in selectivity of a cobalt oxide ammonia oxidation catalyst" in "Studies in surface science and catalysis"; 6 (1980), p. 141-148, (Catalyst deactivation : proceedings of an international symposium, Antwerp, October 13-15, 1980)), который по сравнению с катализаторами на основе металла платиновой группы проявляет значительно меньшую активность. Высокое парциальное давление аммиака способствует протеканию нежелательных вторичных и последующих реакций, которые приводят к образованию N2 или N2O.
Несмотря на все усилия, катализаторы на основе оксидов переходных металлов для окисления NH3 не нашли применения в крупнотоннажном производстве, за исключением упомянутой удачной комбинации катализаторов на основе оксидов железа с сетками на основе благородного металла.
Сетчатые катализаторы на основе Pt/Rh все еще используют, за редким исключением. Как было упомянуто выше, различные варианты осуществления способа или системы могут отличаться друг от друга по рабочему давлению при горении NH3 (атмосферное давление/среднее давление/высокое давление) и по превалирующему уровню давления при абсорбции NOx в абсорбционной колонне (см. также , Chemische Technik - Prozesse und Produkte, 5th Edition, Volume 3, Chapter 3, p. 248-275, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005; Thiemann, M., Scheibler, E., Wiegand, K. W. Nitric Acid, Nitrous Acid, and Nitrogen Oxides, Wiley-VCH Verlag GmbH & Co. KGaA, 2000).
В настоящее время особое значение приобрели так называемый способ единого давления, при котором среднее давление или высокое давление используют как при горении NH3, так и при абсорбции NOx, и так называемый способ двойного давления, при котором горение NH3 осуществляют при среднем давлении, а абсорбцию NOx осуществляют при высоком давлении. Ранее применяемые традиционные системы, в которых горение проводили при атмосферном давлении, а абсорбцию при среднем давлении, в настоящее время почти полностью вытеснены способами с единым давлением и двойным давлением, которые более экономичны в случае большой мощности производства.
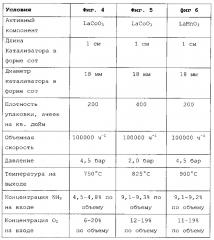
На фиг. 1 показана упрощенная технологическая схема типичной системы единого среднего давления.
Системы для производства HNO3 обычно содержат испаритель NH3, предназначенный для получения газообразного NH3, воздушный компрессор, предназначенный для получения сжатого воздуха, реактор окисления NH3, предназначенный для установки сетчатых катализаторов на основе Pt, со встроенным охладителем технологического газа, различные теплообменники или охладители и конденсаторы, предназначенные для дальнейшего охлаждения технологического газа или для нагревания остаточного газа, выходящего из абсорбционной колонны, абсорбционную колонну, предназначенную для абсорбции NOx и образования HNO3, реактор, предназначенный для (каталитического) удаления остаточного NOx, и необязательно N2O из остаточного газа, и турбину остаточного газа, предназначенную для регенерации энергии из остаточного газа при его расширении и выбросе в атмосферу. В системах двойного давления между реактором окисления NH3 и абсорбционной колонной находится дополнительная ступень сжатия, предназначенная для сжатия технологического газа до давления, при котором производят абсорбцию.
Цель изобретения
Целью настоящего изобретения является обеспечение улучшенного способа окисления NH3 с применением катализаторов на основе оксидов переходных металлов и системы, подходящей для его осуществления, которые отличаются более высокими выходами NOx по сравнению с выходами, обеспечиваемыми на подобных катализаторах до настоящего времени. Кроме того, указанный способ отличается более продолжительным сроком службы катализаторов и более низкой стоимостью катализаторов.
Описание изобретения
Указанная цель достигается посредством обеспечения способа окисления аммиака кислородом, при котором соотношение O2 к NH3 в реакционной газовой смеси, подаваемой на катализатор, регулируют до значения, значительно меньше традиционного отношения 1,9 моль/моль, чтобы обеспечить высокий выход NOx, и в котором используют катализаторы, отличающиеся от коммерчески доступных катализаторов на основе металла платиновой группы, применяемых до настоящего времени.
Неожиданно было обнаружено, что при применении катализаторов на основе металлов, не относящихся к платиновой группе, иначе говоря, катализаторов на основе выбранных оксидов переходных металлов, например, таких, как LaCoO3 или LaMnO3, выход полезного продукта NOx может значительно возрасти, если содержание кислорода или отношение O2/NH3 в реакционной газовой смеси отрегулировать так, чтобы почти весь кислород вступал в реакцию с аммиаком согласно реакциям первичного окисления (схемы реакции 1, 5, 6 и 7) и чтобы в полученной газовой смеси оставалось лишь небольшое количество остаточного кислорода или не оставалось его совсем. Большой избыток кислорода, обычно создававшийся до настоящего времени, оказывает в данном случае отрицательное воздействие.
Было обнаружено, что в результате уменьшения содержания кислорода или молярного отношения кислорода к аммиаку перед подачей реакционной газовой смеси в слой катализатора можно увеличить выход NOx до значений, которые удавалось обеспечить только при применении катализаторов на основе металла платиновой группы (сеток на основе Pt/Rh), даже при повышенном парциальном давлении NH3, то есть, при повышенном полном давлении, или при повышенной концентрации NH3.
Соответственно, настоящее изобретение относится к способу окисления аммиака кислородом в присутствии катализаторов, содержащих по меньшей мере один оксид переходного металла, который не является оксидом металла платиновой группы, при этом отношение молярных количеств кислорода к аммиаку на входе для реакционной газовой смеси в слой катализатора регулируют до значений, меньше или равных 1,75 моль О2/моль NH3.
Обычно молярное отношение кислорода к аммиаку, которое подлежит регуляции согласно настоящему изобретению, находится в диапазоне от 1,25 до 1,75 моль О2/моль NH3. В частности, молярное отношение составляет в диапазоне от 1,30 до 1,75 моль О2/моль NH3, особенно предпочтительно отношение регулируют в диапазоне от 1,35 до 1,60 моль О2/моль NH3, наиболее предпочтительно отношение регулируют в диапазоне от 1,35 до 1,50 моль О2/моль NH3.
При реализации предпочтительного варианта осуществления способа согласно настоящему изобретению отношение молярных количеств кислорода к аммиаку в реакционной газовой смеси на входе в слой катализатора выбирают так, чтобы оно превышало в диапазоне от 0,1 моль O2/моль NH3 до 0,4 моль О2/моль NH3 оптимальное молярное отношение, причем оптимальное молярное отношение представляет собой отношение молярных количеств кислорода к аммиаку реакционной газовой смеси на входе в слой катализатора, при котором обеспечивается максимальный выход NOx.
Особенно предпочтительно отношение молярных количеств кислорода к аммиаку на входе в слой катализатора превышает на от 0,05 моль O2/моль NH3 до 0,3 моль О2/моль NH3 оптимальное отношение, особенно предпочтительно превышает на от 0,025 моль O2/моль NH3 до 0,25 моль O2/моль NH3 оптимальное отношение.
Оптимальное молярное отношение O2/NH3 или оптимальное содержание кислорода можно определить посредством проведения серии соответствующих испытаний в конкретно заданных условиях способа, то есть с применением выбранного катализатора в определенной системе при определенной объемной скорости и скорости потока, при определенной температуре на входе и на выходе, при определенном давлении и с применением определенной реакционной среды, содержащей кислород, и определенное количество аммиака. При этом для постоянной концентрации NH3 концентрацию кислорода на входе в слой катализатора выбирают так, чтобы соответствующее молярное отношение O2/NH3 находилось в диапазоне между минимальным значением отношения O2/NH3, например, 1,25 моль/моль, и максимальным значением отношения O2/NH3, например, 1,75 моль/моль, это отношение предпочтительно меняют с выбранным шагом, например, с шагом, меньше или равным 0,1 моль O2/моль NH3, и в каждом случае определяют достигаемый выход NOx. Молярное отношение кислорода к аммиаку, при котором обеспечивается максимальный выход NOx при иных постоянных условиях проведения реакции, представляет собой оптимальное отношение кислорода к аммиаку.
В другом предпочтительном варианте осуществления способа согласно настоящему изобретению отношение молярных количеств кислорода к аммиаку реакционной газовой смеси на входе в слой катализатора регулируют до значений, меньших или равных 1,75 моль O2/моль NH3, предпочтительно до значений, меньших или равных 1,60 моль O2/моль NH3 и особенно предпочтительно до значений, меньших или равных 1,50 моль O2/моль NH3, причем содержание кислорода в полученном газе на выходе из слоя катализатора составляет по меньшей мере 0,3% по объему, предпочтительно по меньшей мере 0,4% по объему и особенно предпочтительно по меньшей мере 0,5% по объему.
В предпочтительном варианте осуществления этого предпочтительного варианта способа согласно настоящему изобретению молярное отношение O2/NH3, которое пригодно согласно настоящему изобретению, меньше или равно 1,75 моль O2/моль NH3 или содержание кислорода в реакционной газовой смеси на входе в слой катализатора, которое пригодно согласно настоящему изобретению, обусловлено содержанием кислорода в полученном газе на выходе из слоя катализатора в том смысле, что молярное отношение O2/NH3, которое пригодно согласно настоящему изобретению, или - при заданной концентрации NH3 на входе - содержание кислорода на входе в слой катализатора, которое пригодно согласно настоящему изобретению, выбирают так, чтобы содержание кислорода в полученной газовой смеси на выходе из слоя катализатора находилось в диапазоне от 0,3% по объему до 10,0% по объему, предпочтительно в диапазоне от 0,4% по объему до 6,0% по объему и особенно предпочтительно в диапазоне от 0,5 по объему до 4,0% по объему, наиболее предпочтительно в диапазоне от 0,3% по объему до 2,0% по объему, в частности, от 0,4% по объему до 2,0% по объему, наиболее предпочтительно в диапазоне от 0,5% по объему до 1,5% по объему.
Отношение O2/NH3, которое пригодно согласно настоящему изобретению, можно практически отрегулировать для конкретно заданных условий способа, то есть при применении выбранного катализатора в определенной системе при определенной объемной скорости и скорости потока, при определенной температуре на входе и на выходе, при определенном давлении и с применением определенной реакционной среды, содержащей кислород и аммиак, таким образом, например, что, начиная от заранее установленного отношения O2/NH3, например, начиная от ранее принятого отношения O2/NH3 1,9 моль/моль или, в частности, начиная с отношения O2/NH3 1,75 моль/моль, при фиксированном количестве аммиака, уменьшают содержание кислорода на входе в слой катализатора до тех пор, пока в полученном газе на выходе из слоя катализатора не будут присутствовать или не будут обнаружены упомянутые выше низкие значения содержания кислорода.
Содержание NOx и O2 на выходе из слоя катализатора можно определять способами, известными специалистам в данной области. Например, содержание NOx можно определять с помощью ИК/УФ-анализаторов с применением измерительных ячеек для нагретого газа. Подходящими анализаторами являются, например, многокомпонентные FT-IR анализаторы или однокомпонентные системы со множеством ИК- или УФ-каналов. В качестве альтернативы, можно измерять содержание NOx с помощью хемилюминесцентного анализатора, оснащенного на входе конвертором для восстановления NO2 до NO. Содержание кислорода предпочтительно в том числе можно измерять нагретым анализатором для измерения парамагнетизма или с помощью циркониевого датчика.
Содержание кислорода в полученном газе на выходе из слоя катализатора можно также определить арифметически как разность между содержанием кислорода в реакционной газовой смеси на входе в слой катализатора и расходом кислорода в слое катализатора. Расход кислорода в слое катализатора находят исходя из концентраций компонентов N2, NO, NO2 и N2O на выходе или по значениям селективностям образования этих продуктов из аммиака и концентрации NH3 на входе с применением соответствующих стехиометрических отношений O2/NH3 согласно уравнениям (1), (5), (6) и (7).
Способ согласно настоящему изобретению предпочтительно осуществляют при значениях абсолютного давления от 1 до 10 бар, особенно предпочтительно при значениях абсолютного давления от 1,5 до 6 бар, наиболее предпочтительно при значениях абсолютного давления от 2 до 5 бар.
Концентрация NH3 на входе в реактор окисления по способу согласно настоящему изобретению предпочтительно составляет от 1 до 17% по объему, особенно предпочтительно от 4 до 15% по объему, в частности, составляет от 7 до 14% по объему. Верхний предел содержания NH3 предпочтительно определяется нижним пределом детонации смесей NH3/кислород, который зависит также от других возможных компонентов газа, таких, например, как пар.
При химическом превращении на катализаторах каждого объемного процента аммиака в газовой смеси по объему высвобождается определенное количество тепла, которое в случае реакционной смеси NH3 с воздухом в адиабатических условиях соответствует повышению температуры между реакционной смесью и получаемой смесью примерно на 68 K. В том случае, когда температура подаваемой на вход смеси, содержащей аммиак и кислород, задается системой, следовательно, температура в потоке технологического газа на выходе из катализатора окисления зависит от концентрации аммиака в газовой смеси на входе в катализатор окисления.
Катализатор, применяемый согласно настоящему изобретению, проявляет свою наивысшую способность предпочтительно в более низком температурном диапазоне, чем катализаторы на основе металла платиновой группы. Температура на выходе из слоя катализатора, например, из упаковки формованных изделий катализатора, подлежит регуляции согласно настоящему изобретению предпочтительно от 700°С до 950°С, особенно предпочтительно от 750°С до 850°С (ее измеряют на выходе газовой смеси из слоя катализатора, в случае нескольких слоев катализатора на выходе из последнего слоя катализатора). Это может достигаться посредством регулирования температуры реакционной газовой смеси на входе и/или концентрации аммиака в реакционной газовой смеси.
Более свободное пространственное расположение в упаковке формованных изделий катализатора, применяемой согласно настоящему изобретению по сравнению с каталитическими сетками на основе металла платиновой группы обеспечивает политропный режим работы в результате пространственного рассеяния или отвода теплоты реакции. Это может достигаться, например, посредством охлаждения стенок реактора или посредством размещения интегрированных охлаждающих устройств в упаковке катализатора.
Как уже упоминалось, высокая активность формованных изделий катализатора позволяет понизить температуру реакции или температуру «проскока» и тем самым понизить температуру реакционной газовой смеси, содержащей NH3 и кислород, на входе в (первый) слой катализатора, например, в упаковку формованных изделий катализатора. Данная температура на входе может составлять от 20°С до 300°С, предпочтительно от 50°С до 200°С, особенно предпочтительно от 50°С до 150°С.
Катализаторы
По способу согласно настоящему изобретению в принципе можно применять любые катализаторы, которые содержат в качестве активного компонента по меньшей мере один оксид переходного металла, который не является оксидом металла платиновой группы.
В контексте данного описания металл платиновой группы представляет собой элемент из 8-10 групп 5-го и 6-го периодов Периодической системы, то есть элементы из группы Ru, Rh, Pd, Os, Ir и Pt.
В тех рабочих условиях, в которых осуществляют способ согласно настоящему изобретению, то есть при отношении NH3/O2, отрегулированном согласно настоящему изобретению при значении, которое превышает на от 0,1 моль O2/моль NH3 до 0,4 моль O2/моль NH3 оптимальное молярное отношение, катализаторы, применяемые согласно настоящему изобретению, неожиданно обеспечивают более высокий выход NOx по сравнению с выходом NOx, достигаемым при применении традиционных способов окисления аммиака, при которых отношение молярных количеств кислорода и аммиака реакционной газовой смеси на входе в катализатор составляет по меньшей мере 1,9 моль O2/моль NH3.
Соответственно, в тех рабочих условиях, в которых осуществляют способ согласно настоящему изобретению, катализаторы, применяемые согласно настоящему изобретению, обеспечивают выход NOx, который сопоставим или даже превышает выход NOx для способа Оствальда при применении коммерчески доступных катализаторов на