Фосфинсодержащие каликсареновые лиганды, способ их получения и применения
Иллюстрации
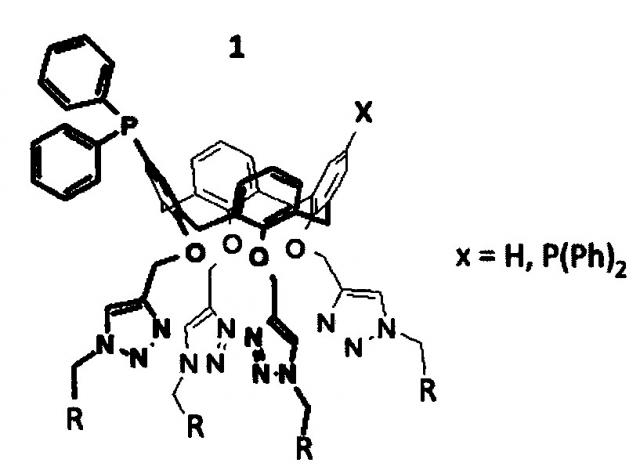
Показать всеИзобретение относится к получению и использованию для каталитического гидроформилирования олефинов фосфинсодержащих лигандов общей формулы:
где R выбран из групп COOH, CONHC(CH2OH)3 или солюбилизирующих групп, содержащих от 4 до 12 гидроксильных групп. Указанные лиганды получают путем модификации бромзамещенного каликсарена по реакции Арбузова с последующим пропаргилированием полученного фосфиноксидсодержащего каликсарена до получения соответствующих пропаргилсодержащих каликсаренов, которые модифицируют с использованием трис(бензоилоксиметил)метиламида 2-азидоэтановой кислоты до получения соответствующего триазолсодержащего каликсарена, после чего проводят восстановление фенилсиланом с последующим гидролизом. Предложен новый эффективный способ получения новых лигандов с улучшенной растворимостью в спиртах и размером молекулы более 2 нм, что делает более эффективным процесс получения альдегидов и ацеталей в реакциях каталитического гидроформилирования, а также позволяет отделять каталитический комплекс от продуктов реакций с возможностью повторного использования. 4 н. и 5 з.п. ф-лы, 5 пр.
Реферат
Область техники
Изобретение относится к области получения фосфинсодержащих лигандов на основе каликсаренов с размером молекулы более 2 нм и обладающих растворимостью в спиртовых средах. Изобретение также относится к способу синтеза и использования лигандов в металлокомплексном катализе, например гидроформилировании линейных олефинов С4-С20. При этом размер молекулы катализатора, получаемого при взаимодействии металлокомплекса с лигандом, позволяет производить отделение гомогенных катализаторов от исходных олефинов, а также продуктов реакции - альдегидов, ацеталей и спиртов путем мембранной нанофильтрации. Изобретение может быть использовано в нефтехимии и органическом синтезе для проведения каталитических процессов (гидрирование, гидроформилирование и др.) с последующим отделением катализатора в мембранных реакторах.
Уровень техники
Металлокомплексный катализ позволяет проводить синтез многочисленных соединений, однако, существует проблема отделения катализатора от образующихся продуктов. Эта задача является актуальной для широкого круга процессов, основанных на гомогенном катализе, в том числе, для гидроформилирования. Традиционные способы отделения катализатора от продуктов в гидроформилировании имеют существенные недостатки. В таких процессах отделение полученных продуктов от катализатора используются традиционные подходы, предполагающие их отгонку. Остаток, содержащий катализатор и свободный лиганд, возвращается в реактор. Условия, создающиеся в испарителе (высокая температура и низкое парциальное давление монооксида углерода), способствуют дезактивации металлокомплекса. Причиной такой дезактивации, по-видимому, является образование неактивных или менее активных соединений родия и разложение лиганда. Перспективным способом отделения гомогенных металлокомплексных катализаторов от продуктов реакции является мембранная нанофильтрация (I.F.J. Vankelecom. Chem. Rev. 102 (2002), 3779; P. Marchetti, M.F. Jimenez Solomon, G. Szekely, A.G. Livingston. Chem. Rev. 114 (2014), 10735; А.В. Волков, Г.А. Корнеева, Г.Ф. Терещенко. Успехи химии. 77 (2008), 1053).
Отсутствие фазовых переходов при нанофильтрации обеспечивает низкую энергоемкость этой технологии по сравнению с традиционными дистилляционными методами разделения (P. Vandezandea, L.E.M. Geversb and I.F.J. Vankelecom. Chem. Soc. Rev. 37 (2008), 365; А.В. Волков, Г.А. Корнеева, Г.Ф. Терещенко. Успехи химии. 77 (2008), 1053; P. Marchetti, M.F. Jimenez Solomon, G. Szekely, A.G. Livingston. Chem. Rev. 114 (2014), 10735).
В настоящее время известны способы отделения катализаторов от продуктов реакции с применением мембран (US 6252123 В1, опубликовано 26.06.2001, кл. B01D 61/02, B01D 61/14, B01D 71/02, B01J 31/40, B01J 37/00, С07С 45/50, С07С 45/78). Как правило, в этих случаях способы выделения и частичной рециркуляции переходных металлов и (или) их каталитически активных комплексных соединений из реакционной смеси путем комбинации по меньшей мере одностадийного мембранного разделения и адсорбции, причем поток, содержащий катализатор, включающий переходный металл, с помощью по меньшей мере одной одноступенчатой стадии мембранного разделения разделяется на поток ретентата, обогащенный по содержанию переходного металла, который снова подается в реакционную смесь, и поток пермеата, обедненный по содержанию переходного металла, и далее этот поток пермеата, обедненный по содержанию переходного металла, подается на стадию адсорбции (DE 102009001230, опубликовано 02.02.2010, кл. C01G 55/00). Каталитическая система также может отделяться от реакционной смеси путем фильтрования под давлением через полупроницаемую мембрану.
Для достижения высокой степени удержания родиевых катализаторов и лигандов, используемых в гидроформилировании олефинов, при мембранной фильтрации необходимо использование высокомолекулярных катализаторов с массой от нескольких тысяч дальтон (Нефтехимия, 1992, Т. 32, №3, С 200-207). В этом случае удается достигнуть концентрацию родия в пермеате составила 20 миллиардных массовых долей (Fang J., Jana R., Tunge J.A., Subramaniam B. // App. Catal. A: Gen. 2011, vol. 393, p. 294; Xie Z., Fang J., Subramaniam B. // React. Eng. Kinet. Catal. 2013, vol. 59, №11, p. 4287). Применение олигосилоксановых лигандов, модифицированных дифенилфосфиновыми группами с массой 12000 г/моль, обеспечивает концентрацию в пермеате менее 2 миллионных массовых долей (Zhuanzhuan Xie, Geoffrey R. Akien, Bibhas R. Sarkar, Bala Subramaniam, and Raghunath V. Chaudhari nd. Eng. Chem. Res., 2015, 54 (43), p. 10656). При использовании обычных катализаторов, таких как трис-(п-пропилфенил)фосфин, трис-октилфосфин и др., достигается лишь 90-95% выделение катализатора (US 5395979 А, опубликовано 07.03.1995, кл. B01J 31/24, B01J 31/40, B01J 38/48, С07В 61/00, С07С 45/50, С07С 47/02). Так, при нанофильтации для отделения гидридо-трис(трифенилфосфин)карбонила родия (I) результаты по удерживанию катализатора составляют лишь 93% (Razak N., Shaharun M.S., Mukhtar H., Taha M.F. // Sains Malaysiana. 2013, vol. 42, №4, p. 515). Таким образом, успешное использование нанофильтрации через мембраны требует разработки способов увеличения размеров лигандов и соответствующих комплексов.
Из уровня техники известны методы синтеза фосфиновых лигандов с молекулярной массой молекулы более 1000 Дальтон и их использование в гидроформилировании олефинов С4 - С20 с последующим отделением катализатора от продуктов методом нанофильтрации (WO 2010057099 A1, опубликовано 20.05.2010, кл. B01J 31/1658; B01J 31/1683; B01J 31/185; B01J 31/4053; B01J 31/4061; С07С 45/50; С07С 45/78; US 5395979 (А), опубликовано 03.07.1995, кл. B01J 31/24; B01J 31/40; B01J 38/48; С07В 61/00; С07С 45/50; С07С 47/02, US 5817884(A) опубликовано 06.10.1998, кл. B01D 61/02; B01J 31/02; B01J 31/22; B01J 31/24; B01J 31/28; B01J 31/40; B01J 38/00; С07В 61/00; С07С 45/50; С07С 45/78; С07С 47/02; С07С 47/34; C07F 9/50). Данные изобретения описывают способы получения фосфиновых лигандов для гидроформилирования с последующим отделением катализатора или свободного лиганда от продуктов реакции способом нанофильтрации, при этом они не описывают использование каликсаренов в качестве лигандов.
По технической сущности и результату наиболее близким к предлагаемому изобретению является изобретение US 5717126 (А), опубликовано 10.02.1998, кл. B01J 31/28; С07В 61/00; С07С 45/50; С07С 47/02; C07F 15/00; C07F 9/6571; C07F 9/6574 описывает применение модифицированных фосфиновыми группами каликсаренов в гидроформилировании олефинов, однако они не подразумевают создания спирторастворимых лигандов с массой более 1000 Дальтон, что необходимо для отделения гомогенного каталитического комплекса от продуктов реакции и его повторного использования.
Раскрытие изобретения
Задачей настоящего изобретения является синтез объемных фосфинсодержащих спирторастворимых лигандов с размером молекулы, превышающим 2 нм, для использования полученных лигандов в гидроформилировании олефинов С4 - С20.
Поставленная задача решается полученным фосфинсодержащим каликсареновым лигандом общей формулы:
где R выбран из группы, включающей СООН, CONHC(СН2ОН)3 или солюбилизирующие группы, содержащие от 4 до 12 гидроксильных групп.
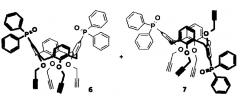
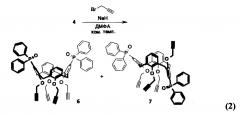
Поставленная задача также решается способом получения фосфинсодержащего каликсаренового лиганда, заключающимся в том, что бромзамещенный каликсарен модифицируют по реакции Арбузова до получения фосфиноксидсодержащего каликсарена, который пропаргилируют до получения пропаргилсодержащего каликсарена формул 6, 7 или 8:
затем пропаргилсодержащий каликсарен 6, 7 или 8 модифицируют введением триазольного фрагмента с использованием трис(бензоилоксиметил)метиламида 2-азидоэтановой кислоты до получения триазолсодержащего каликсарена формул 9 или 10:
полученный триазолсодержащий каликсарен восстанавливают фенилсиланом с последующим гидролизом до получения фосфинсодержащих лигандов общей формулы 11 или 12:
При этом реакцию Арбузова осуществляют путем смешения бромзамещенного каликсарена с хлоридом никеля, взятого в мольном отношении от 0,1:1 до 0,5:1 относительно бромзамещенного каликсарена, и дифениловым эфиром, взятым в мольном соотношении к бромзамещенному каликсарену, равном от 5:1 до 30:1; с дальнейшим перемешиванием получаемой смеси в течение 5-15 минут при температуре от 150 до 180°С, затем к полученному объему реакционной смеси прибавляют раствор О-изопропилдифенилфосфинита, взятого в мольном отношении от 1,5:1 до 3:1 по отношению к бромзамещенному каликсарену, растворенному в 10-50-кратном мольном избытке дифенилового эфира, взятого по отношению к бромзамещенному каликсарену, и ведут реакцию в течение 3-8 часов при температуре 130-180°С при перемешивании.
Затем полученную смесь охлаждают, а затем разбавляют СН2Cl2, взятым в мольном отношении от 50:1 до 1000:1 по отношению бромзамещенному каликсарену, прибавляют водный раствор Na2S2O3 с концентрацией от 10 до 20%, мольное соотношение Na2S2O3 от 3:1 до 10:1 по отношению к бромзамещенному каликсарену, и интенсивно перемешивают смесь в течение 2-4 ч, далее органический слой отделяют, а водный промывают 10-30-кратным объемным избытком CH2Cl2, объединенные органические вытяжки промывают 2-4-кратным объемным избытком 2 н. HCl и воды, профильтровывают через бумажный фильтр и растворитель упаривают в вакууме водоструйного насоса. К полученному раствору прибавляют гексан, взятый в объеме, превышающем объем дифенилового эфира не менее чем в два раза, выпавший осадок отфильтровывают, высушивают и хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Получают фосфиноксидсодержащие каликсарены формул 4 или 5.
Пропаргилирование фосфиноксидсодержащего каликсарена проводят следующим образом: смешивают с 10-30-кратным мольным избытком сухого ДМФА с получением суспензии, затем к суспензии добавляют гидрид натрия в мольном отношении от 0,1:1 до 0,5:1 относительно фосфиноксидсодержащего каликсарена, перемешивают смесь в течение 30-90 мин, затем к смеси добавляют раствор пропаргилбромида в толуоле с концентрацией 70-90%, взятого в отношении от 8:1 до 15:1 по отношению к фосфиноксидсодержащему каликсарену, реакционную смесь перемешивают при комнатной температуре в закрытой колбе в течение 30-60 ч, при этом при перемешивании осторожно прибавляют воду, взятую в 3-5-кратном объемном избытке по отношению к объему смеси, и продукты реакции экстрагируют CH2Cl2 5 раз объемом, равным объему реакционной смеси, объединенные органические вытяжки промывают водой, профильтровывают через бумажный фильтр и упаривают растворитель в вакууме водоструйного насоса, после чего остаток хроматографируют, получают пропаргилсодержащие каликсарены 6, 7 или 8.
Модификацию трис(бензоилоксиметил)метиламидом 2-азидоэтановой кислоты проводят следующим образом: путем ее смешения с пропаргилсодержащим каликсареном 6, 7 или 8, взятым в мольном соотношении от 1:1 до 5:1 по отношению к каликсарену, затем добавляют абсолютированный толуол, взятый в 50-100-кратном мольном избытке по отношению к каликсарену, далее прибавляют CuI⋅Р(OEt)3, взятый в мольном отношении от 0,1:1 до 0,5:1 по отношению к каликсарену, полученную смесь кипятят при перемешивании в течение 5-10 часов, к остатку после выпаривания растворителя прибавляют 5-10-кратный объемный избыток CH2Cl2, раствор промывают 2 н. раствором HCl, равным объему реакционной смеси, полученные органические вытяжки промывают водой, профильтровывают через бумажный фильтр и упаривают растворитель в вакууме водоструйного насоса, остаток хроматографируют.
Триазолсодержащие каликсарены 9 или 10 смешивают с 100-300-кратным мольным избытком абсолютного толуола, фенилсиланом, взятым в мольном отношении от 50:1 до 100:1 относительно соединения 9 или 10, смесь кипятят в атмосфере аргона в течение 40-60 часов, растворитель выпаривают в вакууме при комнатной температуре, остаток растворяют в 2-4-кратном по отношению к объему остатка избытке CH2Cl2, прибавляют метанол, взятый в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, выпавший осадок отфильтровывают, растворяют в смеси этанола и тетрагидрофурана 2:1 по объему, взятой в 5-10-кратном избытке по отношению к объему реакционной смеси, и прибавляют к 85-95% водному раствору КОН, взятому в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, раствор перемешивают 10-20 ч при комнатной температуре. Полученные органические вытяжки выпаривают в вакууме, к остатку прибавляют 5 н. раствор HCl в 5-10-кратном избытке по отношению к объему реакционной смеси, выпавший осадок отфильтровывают, промывают водой, взятой в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, диэтиловым эфиром, взятым в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, и высушивают на воздухе, получают фосфинсодержащие лиганды 11 или 12.
Также поставленная задача решается способом получения альдегидов гидроформилированием олефинов с использованием лигандов по п. 1, характеризующимся тем, что в автоклаве смешивают этиловый спирт (А), ацетилацетонатодикарбонил родия Rh(acac)(CO)2 (Б), при соотношении Б:А от 1:6000 до 1:10000 в массовых долях, лиганд по п. 1 (В), при соотношении В:Б от 1:1 до 5:1 в мольных долях, линейный олефин ряда С4 - С20, (Г) при соотношении Г:Б от 500:1 до 5000:1 в мольных долях; создают в автоклаве давление синтез-газа (СО/Н2=1:1) 0,1-10 МПа, нагревают смесь до 30-120°С, при этом синтез ведут при перемешивании магнитной мешалкой при 500-1000 об/мин в течение 3-10 часов, при этом получают каталитический комплекс родия с объемным лигандом и основной продукт - альдегид, после завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа, затем отделяют каталитический комплекс родия с объемным лигандом посредством мембранной нанофильтрации от смеси альдегида с растворителем.
Поставленная задача также решается способом получения ацеталей гидроформилированием олефинов с использованием лигандов по п. 1, характеризующимся тем, что в автоклаве смешивают этиловый спирт (А), ацетилацетонатодикарбонил родия Rh(acac)(CO)2 (Б), при соотношении Б:А от 1:6000 до 1:10000 в массовых долях, лиганд по п. 1 (В), при соотношении В:Б от 1:1 до 5:1 в мольных долях, линейного олефина ряда С4 - С20, (Г) при соотношении Г:Б от 500:1 до 5000:1 в мольных долях, 70% раствор серной кислоты (Д) при соотношении Б:Д от 30:1 до 100:1; затем создают в автоклаве давление синтез-газа (СО/Н2=1:1) 0,1-10 МПа, нагревают смесь до 30-120°С, ведут синтез при перемешивании магнитной мешалкой при 500-1000 об/мин в течение 3-10 часов, при этом получают каталитический комплекс родия с объемным лигандом и основной продукт - ацеталь, после завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа, затем отделяют каталитический комплекс родия с объемным лигандом посредством мембранной нанофильтрации от смеси ацеталя с растворителем.
Предпочтительно нанофильтрацию проводить следующим образом: смесь, содержащую спирт, исходный олефин, альдегид или ацеталь и каталитический комплекс, помещают в устройство для нанофильтрации, содержащее мембрану, нерастворимую в альдегидах и олефинах, имеющую размер пор 2 нанометра, каталитический комплекс используют повторно, растворитель (А) удаляют посредством упаривания, на выходе получают альдегид.
Техническим результатом является разработка способа синтеза объемных фосфинсодержащих лигандов на основе каликсаренов и способа получения альдегидов гидроформилированием олефинов С4 - С20 в спиртовых средах с многократным использованием родийсодержащего каталитического комплекса.
В структуре синтезированных лигандов содержится один или два дифенилфосфиновых фрагмента, что позволяет использовать эти соединения в качестве лигаднов в металлокомплексном катализе. За счет присутствия в структуре лиганда гидроксильных фрагментов достигается растворимость лигандов в спиртах.
Полученные соединения имеют размер молекулы, превышающий 2 нм, что позволяет отделять каталитический комплекс от продуктов реакций, проводимых в условиях гомогенного катализа методом нанофильтрации, и использовать каталитический комплекс повторно.
В структуре лигандов содержатся солюбилизирующие группы, что позволяет проводить реакции гомогенного катализа в полярных средах, при этом выход реакции гидроформилирования олефинов (70-95%) и селективность по линейному альдегиду (н/изо=2-4) сопоставимы с данными, получаемыми при использовании в гидроформилировании олефинов описанных в литературе макромолекулярных лигандов.
Осуществление изобретения
Спектры ЯМР 1Н, 13С и 31Р регистрировали на приборе Bruker Avance 400, химические сдвиги приведены в шкале δ относительно ТМС (1Н и 13С) и 85%-ной Н3РО4 (31Р); при отнесении сигналов в спектрах использовали данные корреляций COSY и спектров ЯМР 13С APT. Спектры 2D-DOSY для ядер 1 н. регистрировали на приборе Bruker Avance 600 с использованием импульсной последовательности ledbpgp2s21 со стимулированным спиновым эхом, градиентными импульсами магнитного поля синусоидальной формы и задержкой, компенсирующей влияние продольных вихревых токов; силу тока градиентной катушки изменяли ступенчато (64 шага) от 2 до 95% максимальной (10 А); максимальная величина градиента магнитного поля (при токе 10 А) G=53.5 Гаусс/см, временная задержка для диффузии 40 мс, длительность градиентных импульсов 2 мс, релаксационная задержка 1 с; обработку полученного массива диффузионных данных осуществляли с использованием программного пакета Bruker XWinNMR 3.5.
ESI масс-спектры высокого разрешения были получены на приборе Thermo Scientific LTQ Orbitrap. Температуры плавления определяли на приборе Stuart SMP3 и не корректировали.
Анализ состава смесей продуктов каталитических реакций осуществляли методом газожидкостной хроматографии на хроматографе HP G1530A с пламенно-ионизационным детектором, капиллярной колонкой (30 м), заполненной фазой SE-30, при программировании температуры от 60 до 230°С, газ-носитель - гелий.
Коммерчески доступные реагенты использовали без дополнительной очистки. Растворители очищали и абсолютировали в соответствии со стандартными методиками [«Лабораторная техника органической химии» под ред. Б. Кейла, изд. «МИР», 1966]. Синтезы осуществляли в соответствии с опубликованными методиками, а именно этил-2-азидоацетата (Shi, F.; Waldo, J.P.; Chen, Y.; Larock, R.C. Org. Lett. 2008, 10, 2409), азидоуксусной кислоты (Choi, I.; Kim, Y.-K.; Min, D.-H.; Lee, S.; Yeo, W-S. J. Am. Chem. Soc. 2011, 133, 16718), О-изопропил-дифенилфосфинита (Shintou, Т.; Kikuchi. W.; Mukaiyama T. Bull. Chem. Soc. Jpn. 2003, 76, 1645), соединения 18 (Dohmen, M. P. J.; Pereira, A.M.; Timmer, J. M. K.; Benes, N.E.; Keurentjes J. T. F. J. Chem. Eng. Data 2008, 53, 63) и каликсаренов 3 (, D.Т.; Klimosch, S.; Schatz, J. Tetrahedron Lett. 2008, 49, 5800), 4 (Casnati, A.; Fochi, M.; Minari, P.; Pochini, A.; Reggiani, M.; Ungaro, R.; Reinhoudt, D.N. Gazz. Chim. Ital. 1996, 126, 99).
Каталитические эксперименты проводили в стальном автоклаве емкостью 25 мл, снабженном магнитной мешалкой и устройством для термостатирования. В автоклав загружали [Rh(cod)2]BF4 (0.8 мг, 0.002 ммоль), октен-1 (0.3 мл, 1.9 ммоль), этиловый спирт и рассчитанную массу лиганда (см. табл. 1). Автоклав дважды продували аргоном, заполняли синтез-газом (СО/Н2 1:1) до давления 5.0 МПа, нагревали до 80°С и выдерживали при этой температуре 3 ч при постоянном перемешивании. Анализ состава смесей продуктов реакций проводили в присутствии внутреннего стандарта - н-нонана.
Синтез объемных фосфинсодержащих спирторастворимых лигандов осуществляют следующим образом:
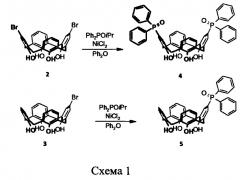
1) Модификации исходных бромзамещенных каликсаренов 2 [Casnati, A.; Fochi, М.; Minari, P.; Pochini, A.; Reggiani, М.; Ungaro, R.; Reinhoudt, D.N. Gazz. Chim. Ital. 1996,126, 99] или 3 [(a) Wang, J.; Gutsche, C.D. Struct. Chem. 2001, 12, 267. (b) Csokai, V.; , A.; , В.; , G.; , G.; Bitter, I. Org. Lett. 2004, 6, 477. (с) , A.; E.; Bitter, I. Tetrahedron 2004, 60, 5041. (d) Bitter, I.; Csokai, V. Tetrahedron Lett. 2003, 44, 2261. (e) Csokai, V.; , A.; Bitter, I. Tetrahedron Lett., 2003, 44, 4681] по реакции Арбузова путем смешения соединений бромзамещенных каликсаренов 2 или 3 и
- хлорида никеля, взятого в мольном отношении от 0,1:1 до 0,5:1 относительно соединений 2 и 3;
- растворителя - дифенилового эфира, взятого в мольном соотношении к соединениям 2 и 3, равном от 5:1 до 30:1;
с дальнейшим перемешиванием получаемой смеси в течение 5-15 минут при температуре от 150 до 180 градусов Цельсия (объем данной смеси - далее объем реакционной смеси). Затем прибавляют раствор О-изопропилдифенилфосфинита, взятого в мольном отношении от 1,5:1 до 3:1 по отношению к соединениям 2 и 3, растворенного в 10-50-кратном мольном избытке по отношению с соединениям 2 и 3 дифенилового эфира, и ведут реакцию в течение 3-8 часов при температуре 130-180 градусов Цельсия при перемешивании. После охлаждения реакционную смесь разбавляют CH2Cl2 (взятым в мольном отношении от 50:1 до 1000:1 по отношению к соединениям 2 и 3), прибавляют водный раствор Na2S2O3 с концентрацией от 10 до 20%, мольное соотношение Na2S2O3 от 3:1 до 10:1 по отношению к соединениям 2 и 3, и интенсивно перемешивают смесь в течение 2-4 ч. Органический слой отделяют, водный промывают 10-30-кратным объемным избытком CH2Cl2. Объединенные органические вытяжки промывают 2-4-кратным объемным избытком 2 н. HCl и воды, профильтровывают через бумажный фильтр и упаривают растворитель в вакууме водоструйного насоса. К полученному раствору прибавляют гексан, взятый в объеме, превышающем объем дифенилового эфира не менее чем в два раза. Выпавший осадок отфильтровывают, высушивают на воздухе и хроматографируют (элюент - СН2Cl2-EtOH в градиенте концентраций). Получают фосфиноксидсодержащие каликсарены 4 и 5 (схема 1).
Фосфиноксидсодержащие каликсарены 4 или 5 смешивают с 10-30-кратным мольным избытком сухого ДМФА с получением суспензии, затем к суспензии добавляют гидрид натрия в мольном отношении от 0,1:1 до 0,5:1 относительно соединений 4 и 5, перемешивают смесь в течение 30-90 мин, затем к смеси добавляют раствор пропаргилбромида в толуоле с концентрацией 70-90%, взятого в отношении от 8:1 до 15:1 по отношению к соединениям 4 и 5 (объем данной смеси - далее объем реакционной смеси). Реакционную смесь перемешивают при комнатной температуре в закрытой колбе в течение 30-60 ч. При перемешивании осторожно прибавляют воду, взятую в 3-5-кратном объемном избытке по отношению к объему смеси, и продукты реакции экстрагируют CH2Cl2 (5 раз, объемом, равным объемому реакционной смеси). Объединенные органические вытяжки промывают водой, взятой в 2-3-кратном объеме по отношению к объему органической фазы, профильтровывают через бумажный фильтр и упаривают в вакууме водоструйного насоса. Остаток хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Получают пропаргилсодержащие каликсарены 6, 7 и 8 (схема 2 и схема 3).
Пропаргилсодержащие каликсарены 6, 7 или 8 последовательно смешивают с
трис(бензоилоксиметил)метиламидом 2-азидоэтановой кислоты (соединение 11, способ получения приведен на схеме (6), взятым в соотношении от 1:1 до 5:1 по отношению соединениям 6, 7 или 8;
абсолютированным толуолом, взятым в 50-100-кратном мольном избытке по отношению к соединениям 6, 7 или 8;
CuI⋅P(OEt)3, взятом в мольном отношении от 0,1:1 до 0,5:1 по отношению к соединениям 6, 7 или 8;
далее смесь кипятят при перемешивании в течение 5-10 часов (объем данной смеси - далее объем реакционной смеси). К остатку после выпаривания растворителя прибавляют 5-10-кратный объемный избыток (по отношению к объему реакционной смеси) CH2Cl2, раствор промывают 2 н. раствором HCl, равным объему реакционной смеси. Органические вытяжки промывают равным объему органической фазы объемом воды, профильтровывают через бумажный фильтр и упаривают в вакууме водоструйного насоса. Остаток хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Получают защищенные триазолсодержащие каликсарены 9 или 10 (схема 4).
Полученные триазолсодержащие каликсарены 9 или 10 смешивают с 100-300-кратным мольным избытком (по отношению к соединениям 9 и 10) абсолютного толуола, фенилсиланом, взятым в мольном отношении от 50:1 до 100:1 относительно соединения 9 или 10, смесь кипятят в атмосфере аргона в течение 40-60 часов (объем данной смеси - далее объем реакционной смеси). Растворитель выпаривают в вакууме при комнатной температуре, остаток растворяют в 2-4-кратном объемном избытке (по отношению к объему реакционной смеси) CH2Cl2, прибавляют метанол, взятый в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси. Выпавший осадок отфильтровывают, растворяют в смеси этанола и тетрагидрофурана (2:1 по объему), взятой в 5-10-кратном избытке по отношению к объему реакционной смеси, и прибавляют к 85-95% водному раствору КОН, взятому в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси. Раствор перемешивают 10-20 ч при комнатной температуре. Органические растворители упаривают в вакууме водоструйного насоса, к остатку прибавляют 5 н. раствор HCl в 5-10-кратном избытке по отношению к объему реакционной смеси. Выпавший осадок отфильтровывают, промывают водой, взятой в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, диэтиловым эфиром, взятым в отношении от 1:1 до 3:1 по отношению к объему реакционной смеси, и высушивают на воздухе. Получают фосфинсодержащие лиганды 11 или 12 (схема 5).
Синтез азида 13 осуществляли из N-защищенного трис(гидроксиметил)аминометана по известной методике [, R.; , Т.; , М.; P.; V. J. Fluorine Chem. 2007, 128, 179] (схема 6):
2) За счет использования получаемых по пункту 1 объемных спирторастворимых лигандов 11 и 12 на основе каликсаренов в гидроформилировании олефинов С4 - С20 для получения альдегидов и ацеталей. Способ получения альдегидов включает: смешивание в автоклаве этилового спирта (А), ацетилацетоната дикарбонила родия Rh(acac)(CO)2 (Б), при соотношении Б:А от 1:6000 до 1:10000 в массовых долях, спирторастворимого лиганда 11 или 12 (по п. 1) (В), при соотношении В:Б от 1:1 до 5:1 в мольных долях, линейного олефина ряда С4 - С20, (Г) при соотношении Г:Б от 500:1 до 5000:1 в мольных долях; создание в автоклаве давления синтез-газа (СО/Н2=1:1) 0,1-10 МПа, нагрев смеси до 30-120°С, при этом синтез ведут при перемешивании магнитной мешалкой при 500-1000 об/мин в течение 3-10 часов, при этом образуются каталитический комплекс родия с объемным лигандом и основной продукт - альдегид. После завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа. Затем отделяют каталитический комплекс родия с объемным лигандом посредством мембранной нанофильтрации от смеси альдегида с растворителем. Для этого смесь, содержащую спирт, исходный олефин, альдегид и каталитический комплекс, помещают в устройство для нанофильтрации, содержащее мембрану, выполненную из сополимера 1-триметилсилил-1-пропина (ТМСП) и 1-(3,3,3-трифторпропилдиметилсилил)-1-пропина (ТФПС), с долей свободного объема 19-21% и нерастворимую в альдегидах и олефинах, имеющую размер пор 2 нанометра. Каталитический комплекс используют повторно. Растворитель (А) удаляют посредством упаривания, на выходе получают альдегид.
Способ получения ацеталей включает: смешивание в автоклаве этилового спирта (А), ацетилацетоната дикарбонила родия Rh(acac)(CO)2 (Б), при соотношении Б:А от 1:6000 до 1:10000 в массовых долях, спирторастворимого лиганда 11 или 12 (по п. 1) (В), при соотношении В:Б от 1:1 до 5:1 в мольных долях, линейного олефина ряда С4 - С20, (Г) при соотношении Г:Б от 500:1 до 5000:1 в мольных долях; 70% раствора серной кислоты (Д) при соотношении Б:Д от 30:1 до 100:1; создание в автоклаве давления синтез-газа (СО/Н2=1:1) 0,1-10 МПа, нагрев смеси до 30-120°С, при этом синтез ведут при перемешивании магнитной мешалкой при 500-1000 об/мин в течение 3-10 часов, при этом образуются каталитический комплекс родия с объемным лигандом и основной продукт - ацеталь. После завершения реакции автоклав охлаждают, сбрасывают давление синтез-газа. Затем отделяют каталитический комплекс родия с объемным лигандом посредством мембранной нанофильтрации от смеси ацеталя с растворителем. Для этого смесь, содержащую спирт, исходный олефин, ацеталь и каталитический комплекс, помещают в устройство для нанофильтрации, содержащее мембрану, выполненную из сополимера 1-триметилсилил-1-пропина (ТМСП) и 1-(3,3,3-трифторпропилдиметилсилил)-1-пропина (ТФПС), с долей свободного объема 19-21% и нерастворимую в альдегидах и олефинах, имеющую размер пор 2 нанометра. Каталитический комплекс используют повторно. Растворитель (А) удаляют посредством упаривания, на выходе получают ацеталь.
Пример 1.
Получение лигандов 11 и 12.
5,17-Бис(дифенилфосфорил)-25,26,27,28-тетра-гидроксикаликс[4]арен 4. Каликсарен 2 (1.46 г, 2.5 ммоль), NiCl2 (0.065 г, 0.5 ммоль) и дифениловый эфир (30 мл) перемешивают 10 мин при 160°С, прибавляют раствор О-изопропилдифенилфосфинита (1.46 г, 6.0 ммоль) в дифениловом эфире (15 мл) и перемешивают реакционную смесь при 160°С в течение 5 ч. После охлаждения реакционную смесь разбавляют CH2Cl2 (50 мл), прибавляют водный раствор Na2S2O3 (15%, 25 мл) и интенсивно перемешивают смесь в течение 2 ч. Органический слой отделяют, водный промывают CH2Cl2. Объединенные органические вытяжки промывают 2 н. HCl и водой, профильтровывают через бумажный фильтр и концентрируют при пониженном давлении. К полученному раствору прибавляют гексан, выпавший осадок отфильтровывают, высушивают и хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Выход 1.92 г (93%, белое кристаллическое вещество), т.пл. 258-260°С (этанол). Спектр ЯМР 1H (CDCl3, 400 МГц); δ, м.д. (J, Гц): 10.15 (4Н, уш. с, ОН); 7.67-7.59 (8Н, м, Н Ph); 7.56-7.50 (4Н, м, H Ph); 7.47-7.36 (12Н, м, Н Ar, H Ph); 6.86 (4Н, д, 3J=7.5, Н Ar); 6.66 (2Н, т, 3J=7.5, Н Ar); 4.21 (4Н, уш. с, ArCH2Ar); 3.52 (4Н, уш. с, ArCH2Ar).
5-Дифенилфосфорил-25,26,27,28-тетрагидрокси-каликс[4]арен 5. Получают аналогично соединению 4 из каликсарена 3 (1.67 г, 3.3 ммоль), NiCl2 (0.044 г, 0.33 ммоль), О-изопропилдифенилфосфинита (0.98 г, 3.96 ммоль) и дифенилового эфира (54 мл) Выход 1.96 г (95%, белое кристаллическое вещество), т.пл. 166-168°С (гексан). Спектр ЯМР 1Н (CDCl3, 400 МГц), δ, м.д. (J, Гц): 10.21 (4H, ш.с, ОН); 7.67-7.59 (4Н, м, H Ph); 7.55-7.48 (2Н, м, Н Ph); 7.46-7.39 (4Н, м, Н Ph); 7.39 (2Н, д, JPH=11.9, Н Ar); 7.11 (2Н, д, 3J=7.6, Н Ar); 7.06 (2Н, д. д, 3J=7.6, 4J=1.5, Н Ar); 6.88 (2Н, д. д, 3J=7.6, 4J=1.5, Н Ar); 6.79 (1Н, т, 3J=7.6, Н Ar); 6.71 (2Н, т, 3J=7.6, Н Ar); 4.24 (4Н, уш. с, ArCH2Ar); 3.56 (4Н, уш. с, ArCH2Ar). Спектр ЯМР 13С (CDCl3, 100 МГц), δ, м.д. (J, Гц): 152.6 (д, JPC=3.0, С Ar); 149.0, 148.3 (С Ar); 133.2 (д, JPC=10.8, СН Ar); 132.6 (д, JPC=104.3, С Ph); 132.1 (д, JPC=10.0, CH Ph); 131.8 (д, JPC=2.7, CH Ph); 129.2, 129.1, 128.9 (СН Ar); 128.6 (д, JPC=13.2, С Ar); 128.3 (д, JPC=12.2, СН Ph); 128.1, 128.0, 127.5 (С Ar); 124.8 (д, JPC=108.0, С Ar); 122.5, 122.1 (СН Ar); 31.6, 31.5 (ArCH2Ar). Спектр ЯМР 31Р (CDCl3, 162 МГц), δ, м.д.: 30.1 (Р=O). ESI-MS m/z: 625.2145 [М+Н]+ для С40Н34О5Р (625.2138).
5,17-Бис(дифенилфосфорил)-25,26,27,28-тетра(2-пропинилокси)каликс[4]арен 6 (в смеси с соединением 7). К суспензии каликсарена 4 (1.14 г, 1.38 ммоль) в сухом ДМФА (35 мл) прибавляют NaH (60%, 0.33 г, 8.3 ммоль). Смесь перемешивают в сухой атмосфере в течение 1 ч. При перемешивании прибавляют пропаргилбромид (80% раствор в толуоле, 1.19 мл, 11.0 ммоль). Реакционную смесь перемешивают при комнатной температуре в закрытой колбе в течение 48 ч. При перемешивании осторожно прибавляют воду (80 мл) и продукты реакции экстрагируют CH2Cl2 (5×30 мл). Объединенные органические вытяжки промывают водой, профильтровывают через бумажный фильтр и упаривают при пониженном давлении. Остаток хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Выход (в смеси с соединением 7, 4:1) 0.92 г (68%, желто-коричневое твердое вещество). Спектр ЯМР 1H (CDCl3, 400 МГц, приведены только сигналы соединения 13), δ, м.д. (J, Гц): 7.72-7.62 (8Н, м, H Ph); 7.60-7.36 (16Н, м, Н Ar, Н Ph); 6.38 (2Н, т, 3J=7.5, Н Ar); 6.24 (4Н, д, 3J=7.5, Н Ar); 5.03 (4Н, д, 4J=2.4, ОСН2); 4.59 (4Н, д, 2J=13.5, ArCH2Ar); 4.51 (4Н, д, 4J=2.4, ОСН2); 3.19 (4Н, д, 2J=13.5, ArCH2Ar); 2.49 (2Н, т, 4J=2.4, ССН); 2.44 (2Н, т, 4J=2.4, ССН). Спектр ЯМР 31Р (CDCl3, 162 МГц, приведен только сигнал соединения 13), δ, м.д.: 29.3 (Р=O). ESI-MS m/z: 977.3163 [М+Н]+ для C64H51O6P2 (977.3155).
5-Дифенилфосфорил-25,26,27,28-тетра(2-пропинилокси)каликс[4]арен 8. Получают аналогично соединению 6 из каликсарена 5 (1.32 г, 2.12 ммоль), NaH (60%, 0.51 г, 12.7 ммоль), пропаргилбромида (80% в толуоле, 1.83 мл, 17.0 ммоль) и сухого ДМФА (40 мл). Выход 1.26 г (77%, желто-коричневое кристаллическое вещество), т.пл. 117-119°С (этанол). Спектр ЯМР 1Н (CDCl3, 400 МГц), δ, м.д. (J, Гц): 7.47-7.41 (2Н, м, Н Ph); 7.31-7.20 (8Н, м, Н Ph); 7.02-6.97 (2Н, м, Н Ar); 6.78 (2Н, д, JPH=12.3, Н Ar); 6.73-6.70 (6Н, м, Н Ar); 6.68 (2Н, д, 3J=7.5, Н Ar); 6.47 (1H, т, 3J=7.5, Н Ar); 4.96 (2Н, д. д, 2J=16.2, 4J=2.4, OCH2); 4.90 (2H, д. д, 2J=16.2, 4J=2.4, ОСН2); 4.68 (2Н, д, 4J=2.4, ОСН2); 4.67 (2Н, д, 4J=2.4, ОСН2); 4.64 (2Н, д, 2J=13.4, ArCH2Ar); 4.63 (2Н, д, 2J=13.4, ArCH2Ar); 3.27 (2Н, д, 2J=13.4, ArCH2Ar); 3.15 (2Н, д, 2J=13.4, ArCH2Ar); 2.50 (1Н, т, 4J=2.4, ССН); 2.47 (2Н, т, 4J=2.4, ССН); 2.46 (1Н, т, 4J=2.4, ССН). Спектр ЯМР 13С (CDCl3, 100 МГц), δ, м.д. (J, Гц): 157.6 (д, JPC=3.1, С Ar); 155.0, 154.6, 136.3, 135.9 (С Ar); 135.0 (д, JPC=13.2, С Ar); 134.5 (С Ar); 132.7 (д, JPC=11.3, СН Ar); 132.5 (д, JPC=103.5, С Ph); 131.7 (д, JPC=9.7, СН Ph); 131.2 (д, JPC=2.8, СН Ph); 128.6, 128.4 (СН Ar); 128.0 (д, JPC=12.0, CH Ph); 127.8 (CH Ar); 125.8 (д, JPC=106.7, С Ar); 123.8, 123.3 (СН Ar); 80.6, 79.9, 79.3 (ССН); 75.4, 75.0, 74.8 (ССН); 61.8, 61.8, 60.6 (ОСН2); 31.9, 31.7 (ArCH2Ar). Спектр ЯМР 31Р (CDCl3, 162 МГц), δ, м.д.: 28.5 (Р=O). ESI-MS m/z: 777.2768 [М+Н]+ для C52H42O5P (777.2764).
5,17-Бис(дифенилфосфорил)-25,26,27,28-тетра[1-трис(бензоилоксиметил)метиламинокарбонилметил-4-триазолилметокси]каликс[4]арен 9. Смесь каликсаренов 6 и 7 (0.49 г, 0.5 ммоль), азида 13 (1.29 г, 2.5 ммоль), CuI⋅Р(OEt)3 (0.03 г, 0.08 ммоль) и толуола (30 мл) кипятят при перемешивании 7 ч. К остатку после выпаривания растворителя прибавляют CH2Cl2, раствор промывают 2 н. HCl. Органические вытяжки промывают водой, профильтровывают через бумажный фильтр и упаривают при пониженном давлении. Остаток хроматографируют (элюент - CH2Cl2-EtOH в градиенте концентраций). Выход 0.79 г (52%, желтое кристаллическое вещество), т.пл. 163-165°С (этанол). Спектр ЯМР 1Н (CDCl3, 400 МГц), δ, м.д. (J, Гц): 8.05 (2Н, ш.с, Н ArTrz); 8.01-7.80 (26Н, м, Н ArTrz, Н ArPh); 7.71-7.60 (10Н, м, Н Ph); 7.55-7.20 (54Н, м, Н Ar, Н Ph, NH); 6.27 (2Н, т, 3J=7.6, Н Ar); 6.05 (4Н, д, 3J=7.6, Н Ar); 5.15 (4Н, с, NCH2); 4.98 (4Н, с, NCH2); 4.90 (4Н, с, OCH2Trz); 4.81 (12Н, с, CH2OBz); 4.80 (12Н, с, CH2OBz); 4.65 (4Н, с, OCH2Trz); 4.25 (4Н, ш.д, 2J=13.1, ArCH2Ar); 3.02 (4Н, ш.д, 2J=13.1, ArCH2Ar). Спектр ЯМР 31Р (CDCl3, 162 МГц), δ, м.д.: 29.6 (Р=O). ESI-MS m/z: 1521.4914 [М+2Н]2+ для C172H148N16O34P2 (1521.4904).
5-Дифенилфосфорил-25,26,27,28-тетра[1-трис(бензоилоксиметил)метиламинокарбонилметил-4-триазолилметокси]каликс[4]арен 10. Получают аналогично соединению 9 из каликсарена 8 (0.55 г, 0.7 ммоль), азида 13 (1.81 г, 3.5 ммоль), CuI⋅P(OEt)3 (0.04 г, 0.11 ммоль) и толуола (35 мл). Выход 1.02 г (51%, желтое кристаллическое вещество), т. пл. 153-155°С (этанол). Спектр ЯМР 1Н (CDCl3, 400 МГц), δ, м.д. (J, Гц): 7.98-7.82 (28Н, м, H ArTrz, H Ph); 7.67 (2Н, с, H ArTrz); 7.49-7.33 (20Н, м, H Ph); 7.32-7.19 (28Н, м, H Ph, NH); 6.81 (2Н, д, 3J=7.6, Н Ar); 6.67 (2Н, д, JPH=12.0, Н Ar); 6.55 (2Н, д, 3J=7.6, Н Ar); 6.54 (2Н, т, 3J=7.6, Н Ar); 6.43 (2Н, д, 3J=7.1, Н Ar); 6.35 (1Н, т, 3J=7.1, Н Ar); 5.08 (2Н, с, NCH2); 5.07 (2Н, с, NCH2); 5.01 (4Н, с, NCH2); 4.91 (4Н, с, OCH2Trz); 4.84 (4Н, с, OCH2Trz); 4.83 (24Н, с, CH2OBz); 4.26 (2Н, д, 2J=13.2, ArCH2Ar); 4.15 (2Н, д, 2J=13.2, ArCH2Ar); 3.03 (2Н, д, 2J=13.3, ArCH2Ar); 2.82 (2Н, д, 2J=13.3, ArCH2Ar). Спектр ЯМР 31Р (CDCl3, 162 МГц), δ, м.д.: 28.7 (Р=O). ESI-MS m/z: 1421.4705 [М+2Н]2+ для C160H139N16O33P (1421.4709).
5,17-Бис(дифенилфосфанил)-25,26,27,28-тетра(1-карбоксиметил-4-триаз