Способ регенерации хлоридного электролита при электрохимической переработке отработавшего ядерного топлива
Иллюстрации
Показать всеИзобретение может быть использовано при электрохимической переработке отработавшего ядерного топлива (ОЯТ) реакторов на быстрых нейтронах. Способ характеризуется тем, что в расплавленный электролит на основе эвтектической смеси хлоридов лития и калия после выделения из него актинидов, лантанидов и щелочноземельных металлов добавляют хлорид переходного металла, в качестве которого используют дихлорид кадмия, при этом процесс ведут при температурах не выше 350°С. Изобретение позволяет снизить расход энергии. 7 ил., 2 табл.
Реферат
Изобретение относится к способам регенерации солевого электролита и может быть использовано при электрохимической переработке отработавшего ядерного топлива (ОЯТ) реакторов на быстрых нейтронах.
В настоящее время электрохимическая регенерация ОЯТ в солевых расплавах рассматривается как один из перспективных способов извлечения урана и плутония из отработавшего топлива [1-4]. При безводной электрохимической переработке электронопроводящих металлического, нитридного, карбидного топлив, в расплав солевого электролита, например эвтектической смеси хлоридов лития и калия (LiCl-KCl), под действием постоянного электрического тока переходят в виде ионов электроотрицательные элементы: щелочные, щелочноземельные металлы, лантаниды и актиниды разного изотопного состава с различным временем жизни. Актиниды и лантаниды последовательно выводятся из электролита, осаждаясь на жидком или твердом металлическом катоде в порядке возрастания их электроотрицательности. Образующиеся в результате ядерных реакций радиоизотопы щелочноземельных металлов (особенно, стронция) и цезия, переходящие в расплавленный электролит в ионном виде при электрохимическом растворении отработавшего уран-плутониевого топлива (см. таблица 1) из-за близости своих электродных потенциалов восстановления с потенциалами восстановления лития и калия базового электролита-растворителя не могут быть удалены из него электрохимическим путем, как более электроположительные актиниды и лантаниды.
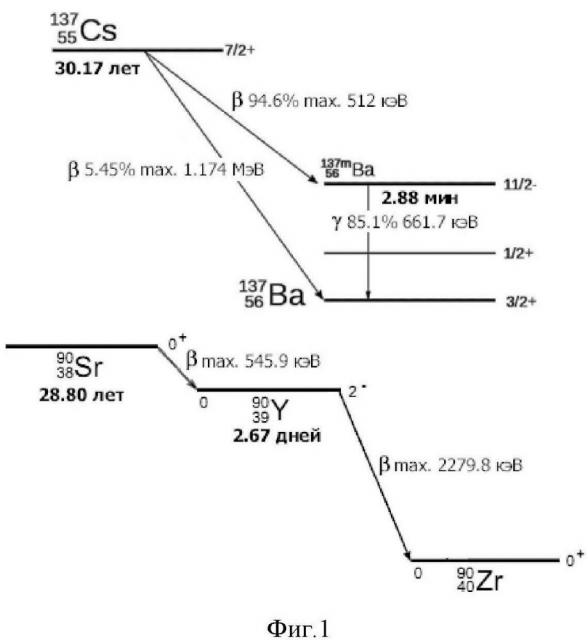
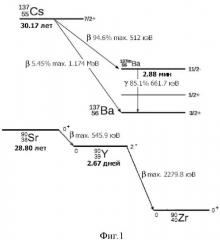
Их накопление в электролите в течение электрохимического восстановления и разделения актинидов и лантанидов являются препятствием для длительного использования электролита, поскольку эти изотопы подвержены β-распаду (см. фиг. 1) с большим выделением энергии (тепла), приводящему к перегреву электролита, сопровождающемуся нежелательными для электрохимической переработки явлениями: изменению свойств и большим отклонениям от оптимального технологического режима, существенного возрастания летучести электролита и жидкометаллического катодного материала (например, кадмия), а также коррозионной активности солевого расплава в отношении конструкционных материалов.
При осуществлении процесса электрохимической регенерации ОЯТ с получением его основных компонентов - урана и плутония, возвращающихся в топливный цикл, приходится особое внимание уделять предотвращению накопления в электролите 137Cs из-за его достаточно большой концентрации и радиационной активности. Как показывают расчеты, для того чтобы избежать упомянутых выше негативных последствий и для обеспечения нормативов безопасного обращения с радиоактивными веществами, необходимо периодически проводить регенерацию электролита с целью удаления или существенного уменьшения в нем концентрации цезия при накоплении около 10 мол.% его соединений (в основном, хлорида цезия - CsCl).
Известно несколько подходов к очистке расплавленного электролита на основе эвтектической смеси хлоридов лития и калия (LiCl-KCl)эвт от растворенных в нем соединений цезия. Один из них основан на последовательной комплексной переработке растворенных в этом расплаве хлоридов лантанидов, стронция и цезия [5-8]. Трихлориды лантанидов и иттрия осаждаются в виде оксихлоридов, оксидов или фосфатов, стронций в виде фосфата или карбоната, а цезий в результате процесса волоксидации (окисления летучих продуктов деления) при испарении или вакуумной дистилляции хлоридного расплава. При очевидных достоинствах комплексной переработки ОЯТ в целом предлагаемый процесс сепарации цезия, хлорид которого по своей летучести близок к соли-растворителю (расплаву эвтектики LiCl-KCl), недостаточно обоснован и экспериментально доказан. Более того, для его осуществления необходимо существенное повышение температуры (выше 900°C) [8], приводящее к упомянутым выше негативным последствиям.
Другой подход, связанный с переработкой ОЯТ в расплаве эвтектики LiCl-KCl, основан на явлении зонной кристаллизации, обеспечивающей очистку расплавленного электролита-растворителя от накопленного хлорида цезия после выделения химическим или электрохимическим способом актинидов, лантанидов и стронция. Он реализуется на практике различными путями. В частности, для отделения CsCl от эвтектики LiCl-KCl был использован вертикальный метод нормальной направленной кристаллизации (метод Бриджмена), в котором расплав находился в реторте (тигле), помещенной в печь с тремя температурными зонами: нижняя зона с температурой T=400÷450°C, средняя (адиабатическая) - с T=325÷355°C, верхняя - с T=250÷295°C [9-13]. Фактически в верхней зоне формировался слиток солевой смеси LiCl-KCl-CsCl с меньшей концентрацией хлорида цезия, чем в исходном расплаве. Большая его часть скапливалась в нижней части реторты. Используя многократную перекристаллизацию, удалось получить солевые слитки, содержащие от 55 до 88 мас. % эвтектики LiCl-KCl. Эффективность предложенного метода сепарации CsCl от базового электролита зависела от многих параметров процесса: скорости перемещения реторты (тигля) в печи, разности температур ее нижней и верхней зон, высоты реторты (тигля), массы солевого образца, концентрации CsCl в эвтектике LiCl-KCl. Подобные решения проблемы сепарации хлорида цезия, основанные на принципе зонной кристаллизации, реализованы в методе Чохральского [14] и в так называемом методе «холодного пальца (cold finger)» [15].
Предложен также метод, использующий для осуществления очистки расплава эвтектики LiCl-KCl от CsCl процессы окклюзии, адсорбции и ионного обмена в цеолитах [16-18]. Расплав LiCl-KCl-CsCl находился при 550°C в равновесии с цеолитом марки 4А на основе ортосиликата алюминия, пропитанным окклюдированной солью. Не описывая подробно процессы ионного обмена, обеспечивающего двукратное уменьшение концентрации хлорида цезия в расплаве, нужно отметить существенный недостаток этого способа переработки загрязненного расплавленного электролита LiCl-KCl, заключающегося в необходимости захоронении достаточно большого количества цеолита, содержащего β-активный 137Cs.
Запатентован способ электрохимической ионной сепарации в расплавленных солях, который, по мнению авторов, может быть потенциально «вписан» в существующую электрохимическую схему, использующуюся (разрабатываемую) в настоящее время для безводной переработки ядерных отходов в солевых расплавах [19-20]. Главной идеей этого способа является использование для регенерации загрязненного, в частности, хлоридом цезия расплавленного электролита LiCl-KCl ионопроводящих керамик, которые являются селективными для катионов очищаемого расплава (Li+ и K+) и примеси (Cs+). Так как эти керамики, как правило, проявляют селективные свойства относительно катионов, необходима компенсация зарядов перенесенных через керамику ионов. Это достигается либо путем реакции окисления-восстановления хлора, либо добавлением в электродные пространства электрохимического устройства специально подобранных катионов или анионов, выполняющих роль доноров. В качестве материалов ионопроводящих мембран предложены химически инертные, с точки зрения авторов этого изобретения, по отношению к расплаву LiCl-KCl-CsCl при 500-650°С калийпроводящий KSICON (калий-цирконий ортофосфат) и литийпроводящие LLTO (литий-лантан танталат) и LBLTO (литий-барий-лантан танталат). Процесс проводится в гальваностатическом режиме при разности потенциалов 200 мВ и плотности тока 100 мА/см2. Рассмотренный способ может обеспечить достаточно хорошую очистку расплава LiCl-KCl от CsCl, однако он сложен аппаратурно, связан с дополнительным расходом энергии на осуществление электрохимического процесса, сопряжен с накоплением и захоронением израсходованных мембран, содержащих радиоактивный Cs.
Задача настоящего изобретения заключается в снижении расхода энергии, несопряженности с накоплением и захоронением израсходованных мембран, содержащих радиоактивный Cs, аппаратурной простоте.
Авторами заявленного изобретения на примере расплава LiCl-KCl-CsCl рассмотрен, проверен и предложен простой и экономичный способ регенерации расплавленного солевого электролита LiCl-KCl, использующегося для электрохимической переработки отработавшего ядерного топлива. Способ характеризуется тем, что в расплавленный электролит на основе эвтектической смеси хлоридов лития и калия после выделения из него актинидов, лантанидов и щелочноземельных металлов добавляют хлорид переходного металла, в качестве которого используют дихлорид кадмия, при этом процесс ведут при температурах не выше 350°С.
Предложенный способ, как и большинство разработанных к настоящему времени способов освобождения расплава LiCl-KCl от примесей хлорида цезия, основан на принципе селективной кристаллизации компонентов расплавленной смеси LiCl-KCl-CsCl [9-15]. Способ иллюстрируется рисунками, где на фиг. 1 показана схема 3-распада изотопов 137Cs и 90Sr (для сравнения) и выделения энергии (тепла); на фиг. 2 изображена нижняя часть герметичной кварцевой реторты с загруженными компонентами солевой смеси LiCl-KCl-CsCl+CdCl2; на фиг. 3 (а,b,с) показаны фазовые превращения в солевых композициях LiCl-KCl-CsCl+CdCl2; на фиг. 4 - изменение теплового потока (DSC) и массы (TG) для образца эвтектической смеси хлоридов лития и калия (- опыт №1, - опыт №2); на фиг. 5 - фото с изображением формирования близкого по составу к эвтектике LiCl-KCl твердого солевого слитка; на фиг. 6 представлен график, иллюстрирующий отношение концентраций (мас. %) лития и цезия в солевом слитке; на фиг. 7 представлены изображения делительных колонок I и II для непрерывной регенерации расплавленного электролита на основе эвтектики LiCl-KCl; в таблице 1 приведен изотопный состав цезия и стронция (для сравнения) облученного нитридного топлива; в таблице 2 приведено отношение концентраций (мас. %) лития и калия (CLi/CK) в твердом солевом слитке на разных стадиях регенерации смеси LiCl-KCl в расплавах, содержащих CdCl2.
Испытаниям была подвергнута солевая смесь на основе эвтектики LiCl-KCl следующего состава: (LiCl (39.3) - KCl (53.1) - CsCl (7.6). В нее добавляли эквивалентную мольной концентрации CsCl навеску дихлорида кадмия для снижения температуры регенерации расплава LiCl-KCl и повышения эффективности и скорости процесса удаления примеси CsCl из солевого расплава за счет его связывания в комплексное соединение CsCdCl3 [21]. Компоненты солевой смеси тщательно готовили, чтобы исключить присутствие в них оксидных и других нежелательных примесей. Хлориды калия и цезия (х.ч.) сушили под разрежением, постепенно повышая температуру до 873 K в течение суток. Далее соли переплавляли, дополнительно чистили методом зонной перекристаллизации и хранили до использования в сухом боксе. Хлорид лития (х.ч.) сушили под разрежением, постепенно меняя температуру в течение двух суток. Первые 24 часа хлорид лития сушили при постепенном повышении температуры до 473 K, следующие 24 часа температуру повышали до 673 K. Затем соль плавили и через расплав барботировали газообразный хлор для удаления возможной примеси Li2O. После этого соль выливали в кварцевый стакан и помещали в сухой бокс. Хлорид кадмия (ч.д.а.) сушили в слабом токе хлора при температурах от 373 K до 423 К в течение двух часов. Затем загружали его в алундовый тигель, плавили в пробирке из кварцевого стекла в атмосфере аргона и дополнительно обрабатывали газообразным хлором. Все подготовительные операции по приготовлению смесей солей проводили в сухом перчаточном боксе под атмосферой сухого чистого азота.
Взвешенные в инертных условиях необходимые количества подготовленных таким образом солей были помещены в герметичные ампулы (пробирки) из прозрачного плавленого кварца (фиг. 2), которые затем были погружены в электрическую печь сопротивления с точно регулируемой приборами «Варта» ТП-7034 и контролируемой милливольтметром температурой, датчиком которой служила калиброванная хромель-алюмелевая термопара.
После расплавления в инертной атмосфере высокочистого аргона солевая смесь выдерживалась в определенном температурном режиме в течение 4-6 часов. Этот режим устанавливался после исследования фазовых равновесий образца солевой композиции с помощью термоанализатора STA 449С Jupiter® фирмы NETZSCH (Германия). Результаты исследования показаны на фиг. 3. Из рисунков видно, что в этой четырехкомпонентной системе четко наблюдается, по крайней мере, три фазовых превращения с характерными пиками при определенных температурах, причем наиболее мощный пик при 345°С близок к температуре кристаллизации (352°С) эвтектической бинарной смеси LiCl-KCl (фиг. 4), которая является основным электролитом-растворителем в устройствах для электрохимической переработке ОЯТ в солевых расплавах и которую периодически необходимо освобождать от накопленного и растворенного в ней β-активного 137Cs.
Из полученных термограмм ясно, что выдерживая рассматриваемую солевую композицию в изотермических условиях при температуре несколько ниже температуры плавления эвтектической смеси LiCl-KCl, мы сможем перевести ее в твердое состояние и отделить от расплава, в котором будут концентрироваться примеси (в нашем случае CsCl и CdCl2). Мы выбрали рабочую температуру 333±2°С. Она обеспечила кристаллизацию солевой смеси, близкой по составу к эвтектике LiCl-KCl, которая из-за своей малой плотности формировалась в виде твердого солевого слитка в верхней части сосуда с солевой композицией, что видно на фиг. 5.
Анализы химического состава верхней (твердой) и нижней (расплавленной) частей помещенной в реторте солевой композиции, проведенные для солевых образцов LiCl-KCl-CsCl и LiCl-KCl-CsCl+CdCl2, показали, что даже после однократной выдержки их при температуре 333°С количество цезия в твердом солевом слитке становится в несколько раз меньше, чем в исходных солевых композициях, что можно видеть из графика на фиг. 6, где в качестве меры изменения концентраций взято отношение массовых процентов лития и цезия в солевом слитке.
Из графика, представленного на фиг. 6, следует, что в выбранном изотермическом режиме (~330°С) необходима дополнительная очистка солевого слитка от цезия, чтобы приблизить его состав к эвтектике LiCl-KCl. Подобная необходимость отмечалась и в упомянутых прежде работах [9-15]. Также четко виден положительный эффект добавления в смесь хлоридов лития, калия и цезия дихлорида кадмия, который сказывается не только на возможности существенно снизить рабочую температуру процесса регенерации эвтектики (на 200-300°С) по сравнению с известными способами, использующими принцип зонной перекристаллизации, но и увеличить скорость процесса за счет эффекта комплексообразования, о чем свидетельствует более крутая ветвь изменения отношения концентраций в случае солевой системы LiCl-KCl-CsCl+CdCl2.
На графике (фиг. 6) также приведены данные, полученные нами в упомянутых рабочих режимах при последовательной переработке солевых слитков, отделенных от жидкой фазы. Благодаря относительно низкой рабочей температуре применяемого нами способа регенерации разделить твердую и жидкую фазы удаётся простыми способами: либо декантацией, либо пропуская жидкость в самом опыте через фильтр 1 из кварцевой крошки (фиг. 7). В последнем случае очистку можно проводить непрерывно в системе кристаллизатор-приемная емкость, снабженной разделяющей эти сосуды заглушкой 2. Этот прием является основой для создания очень простого устройства для регенерации расплавленного электролита 3, который легко вписывается в систему комплексной переработки ОЯТ.
Еще одним свидетельством в пользу предложенного способа регенерации расплавленного электролита на основе эвтектики LiCl-KCl является сохранение соотношения концентраций лития и калия в твердом солевом слитке на разных стадиях регенерации, отраженное в таблице 2.
Приведенные результаты испытания предлагаемого способа сепарации от электролита LiCl-KCl накопившихся в нем при электрохимической переработке отработавшего ядерного топлива (ОЯТ) токсичных радиоактивных изотопов цезия с большим периодом полураспада показали, что он может быть проведен при более низких рабочих температурах и при большей скорости сегрегации компонентов, сохраняя высокую степень разделения, с использованием более простых приемов и аппаратуры для проведения процессов, чем в известных способах, использующих для этого принцип зонной перекристаллизации.
Источники информации
1. Т. SATOH, Т. IWAI and Ya. ARAL Electrolysis of Burnup-Simulated Uranium Nitride Fuels in LiCl-KCl Eutectic Melts // Journal of Nuclear Science and Technology, 2009, Vol. 46, No. 6, p. 557-563.
2. К.M. GOFF, R.W. BENEDICT, K.L. HOWDEN, G.M. TESKE, and T.A. JOHNSON. Pyrochemical Treatment of Spent Nuclear Fuel // Proceedings of GLOBAL 2005 (Tsukuba, Japan, Oct 9-13, 2005), Paper No. 364.
3. H. HAYASHI, T. SATO, H. SHIBATA, M. KURATA, T. IWAI, and Ya. ARAL Pyrochemical treatment of spent nitride fuels for MA transmutation // Science China Chemistry, 2014 Vol. 57 No. 11: 1427-1431.
4. В.В. Смоленский1, А.В. Новоселова, А.Г. Осипенко, Я.M. Лукьянова. Коэффициенты разделения U/La и U/Nd в расплавленной системе Ga-In/3LiCl-2KCl // Расплавы, 2015, №1, с. 49-54.
5. Eung-Ho Kim, Geun-Il Park, Yung-Zun Cho, Hee-Chul Yang. A New Approach to Minimize Pyroprocessing Waste Salts Through a Series of Fission Product Removal Process // Nuclear Technology, 2008, Vol. 162, No. 2, pp. 208-218.
6. Нее Chul Eun, Нее Chul Yang, Yung Zun Cho, Han Soo Lee, In Tae Kim. Vacuum distillation of a mixture of LiCl-KCl eutectic salts and RE oxidative precipitates and a dechlorination and oxidation of RE oxychlorides // J. Hazard. Materials, 2008, Vol. 160, pp. 634-637.
7. Eun H.C., Cho Y.Z., Choi J.H., Kim J.H., Lee Т.К., Park H.S., Kim I.Т., Park G.I. Study on a regeneration process of LiCl-KCl eutectic based waste salt generated from the pyrochemical process // Proc. GLOBAL 2013: International Nuclear Fuel Cycle Conference - Nuclear Energy at a Crossroads (Salt Lake City, UT, United States, 29 Sep - 3 Oct 2013) 1633 p.
8. H.C. Eun, Y.Z. Cho, S.M. Son, Т.К. Lee, H.C. Yang, I.T. Kim, H.S. Lee. Recycling of LiCl-KCl eutectic based salt wastes containing radioactive rare earth oxychlorides or oxides J. Nucl. Materials, 2012, Vol. 420, pp. 548-553.
9. (Cho Y.Z., Yang H.C, Park G.H., Lee H.S. Kim I.T., 2008. Treatment of LiCl-KCl waste salt delivered from pyroprocessing of spent nuclear fuel // In: Proceedings of the 2nd International Pyroprocessing Research Conference. Jeju, Korea.
10. Cho, Y.Z., Park, G.H., Lee, H.S., Kim, I.T. Concentration of cesium and strontium elements involved in a LiCl waste salt by a melt crystallization process // Nucl. Technol., 2010, Vol. 171, pp. 325-334.
11. A.N. Williams, S. Phongikaroon, M.F. Simpson. Separation of CsCl from a ternary CsCl-LiCl-KCl salt via a melt crystallization technique for pyroprocessing waste minimization // Chemical Engineering Science, 2013, Vol. 89, pp. 258-263.
12. Cho Y.Z. et al. Eutectic (LiCl-KCl) Waste Salt Treatment by Sequential Separation Process // Nucl. Eng. Technology, 2013, Vol. 45, No. 5, pp. 675-682.
13. A.N. Williams, M. Pack, S. Phongikaroon. Separation of strontium and cesium from ternary and quaternary lithium chloride-potassium chloride salts via melt crystallization // Nucl. Eng. Technology, 2015, Vol. 47, pp. 867-874.
14. J.H. Lee, G.H. Oh, H.S. Lee et al. CsCl Separation from a LiCl-KCl mixture Using a Crystallization Approach // WM2008 Conference, February 24-28, 2008, Phoenix, AZ, http://www.wmsym.org/archives/2008/pdfs/8100.pdf
15. J.R. Versey, S. Phongikaroon, M.F. Simpson. Separation of CsCl from LiCl-CsCl Molten Salt by Cold Finger Melt Crystallization // Nucl. Eng. Technology, 2014, Vol. 46, pp. 395-406.
16. Lexa, D., Johnson, I. Occlusion and Ion Exchange in the Molten (Lithium Chloride-Potassium Cholride-Alkali Metal Chlorides) Salt+Zeolite 4A System with Alkali Metal Chlorides of Sodium, Rubidium, and Cesium // Metallurgical and Materials Transactions B, 2001, Vol. 32B, pp. 429-435.
17. Simpson, M.F., Yoo, T.S., Benedict, R.W., Phongikaroon, S., Frank, S., Sachdev, P., and Hartman, K. Srategic Minimization of High Level Waste from Pyroprocessing of Spent Nuclear Fuel. (Boise, Idaho 2007), Proc. of Global 2007.
18. Yoo, T.S., Frank, S.M., Simpson, M.F., Hahn, P.A., Battisti, T.J., and Phongikaroon, S. Salt-Zeolite Ion Exchange Equilibrium Studies for a Complete Set of Fission Products in Molten LiCl-KCl // Nuclear Technology, 2010, Vol. 171, pp. 306-315.
19. E.D. Spoerke, J. Ihlefeld, K. Waldrip, J.S. Wheeler, H.J. Brown-Shaklee, L.J. Small, D.R. Wheeler. Electrochemical Ion Separation in Molten Salts // Patent US 2015/0267316 A1.
20. L.J. Small, E.D. Spoerke, D.R. Wheeler. Electrochemical Ion Separation in Molten Salts // Patent US 2016/0196888 A1.
21. J. Janz et al. Molten Salts: Volume 4, Part 2, Chlorides and Mixtures / J. Phys. Chem. Ref. Data, 1975, Vol. 4, No. 4, pp. 975-977.
Способ регенерации хлоридного электролита при электрохимической переработке отработавшего ядерного топлива, характеризующийся тем, что в расплавленный электролит на основе эвтектической смеси хлоридов лития и калия после выделения из него актинидов, лантанидов и щелочноземельных металлов добавляют хлорид переходного металла, в качестве которого используют дихлорид кадмия, при этом процесс ведут при температурах не выше 350°С.