Способ интраоперационного выявления инвазии опухоли поджелудочной железы в стенку прилежащего магистрального сосуда
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, и может быть использовано для интраоперационного выявления инвазии опухоли поджелудочной железы в стенку сосуда. Проводят визуализацию жидкости под ультразвуковым контролем, введенной интраоперационно в перивазальное пространство, максимально близко к месту предполагаемой инвазии опухоли в стенку сосуда. При отсутствии инвазии стенки сосуда опухолью клетчаточные и соединительнотканные прослойки между стенкой сосуда и пораженным органом заполняются вводимым составом. В случае поражения стенки сосуда расслаивания между видимым краем опухоли и стенкой сосуда не происходит. Способ позволяет точно и качественно выявить инвазию опухоли поджелудочной железы в стенку прилежащего магистрального сосуда, рационально составить план операции за счет визуализации жидкости под ультразвуковым контролем, введенной интраоперационно в перивазальное пространство. 5 з.п. ф-лы, 8 ил., 2 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к хирургии, и может быть использовано для интраоперационной диагностики поражения слоев стенки сосуда опухолевым процессом.
Способ включает введение в перивазальное пространство, максимально близко к месту предполагаемого поражения, жидкости методом ползучего инфильтрата с последующей оценкой ее распространения под ультразвуковым контролем (УЗК). Наиболее широкое применение изобретение найдет в хирургии, а именно хирургии гепатопанкреатодуоденальной зоны (ГПДЗ), для выявления инвазии опухоли в стенку магистрального сосуда.
Уровень техники
Неуклонный рост заболеваемости раком поджелудочной железы (ПЖ), высокая смертность и частое бессимптомное течение на ранних стадиях заболевания определяют высокие требования к точности дифференциальной диагностики и оценке резектабельности опухоли [Бурдюков М.С., Нечипай A.M. Эндоскопическая ультрасонография в диагностике злокачественных новообразований органов панкреатобилиарной зоны // Клиническая эндоскопия. 2009. Т. 1. №18. С. 36-44; Давыдов М.И., Ганцев Ш.Х. Онкология: учебник. М.: ГЭОТАР-Медиа, 2010. 920 с.; Степанов CO., Казакевич В.И., Митина Л.А., Сидоров Д.В., Прозорова Э.В. Ультразвуковое исследование в диагностике и стадировании солидных опухолей поджелудочной железы // Ультразвуковая и функциональная диагностика. 2014. №2. С. 13-26; Фисенко Е.П., Ветшева Н.Н., Пономарь С.А., Татаркина М.А. Ультразвуковая диагностика внутрипротоковой папиллярно-муцинозной опухоли поджелудочной железы // Ультразвуковая и функциональная диагностика. 2012. №6. С. 81-87]. Благодаря прогрессу медицинских технологий и внедрению в клиническую практику различных инструментальных методов исследования, таких как ультразвуковое исследование (УЗИ), трансабдоминальное (ТАУЗИ), эндоскопическое (ЭУЗИ), лапароскопическое (ЛУЗИ), интраоперационное (ИОУЗИ), спиральная компьютерная томография (СКТ), магнитно-резонансная томография (МРТ), ангиография (АГ), диагностика различных очаговых поражений гепатопанкреатобилиарной зоны улучшилась. Однако сохраняющееся количество эксплоративных лапаротомий у пациентов с опухолями ПЖ и ГПДЗ, связанных с инвазией опухоли в магистральные сосуды, указывает на необходимость достоверной оценки распространенности опухолевого процесса на стенки магистральных сосудов как на дооперационном, так и на интраоперационном этапе [Keleg S., Buchler P., Ludwig R. et al. Invasion and metastasis in pancreatic cancer // Mol. Cancer. 2003. V. 2. P. 14-21].
Опухоли ПЖ в большинстве своем не проявляют себя какими-либо клиническими симптомами вплоть до достижения ими относительно крупных размеров. Вместе с тем уже на начальных этапах опухолевого роста часто имеются признаки инфильтрации окружающих железу анатомических структур с поражением магистальных сосудов, среди которых верхние брыжеечные артерия и вена, чревный ствол, общая и собственная печеночная артерия, воротная вена, венозный конфлюэнс, что является причиной эксплоративных и паллиативных вмешательств [Савельева Т.В. Методические основы спиральной компьютерной томографии у пациентов с опухолевым поражением поджелудочной железы // Вестник Санкт-Петербургского университета. 2008. №11. С. 148-154].
Радикальные операции при раке головки ПЖ выполнимы в среднем не более чем у 10% пациентов. В последние годы увеличился процент пациентов, которым выполняются панкреатодуоденальные резекции (ПДР), дистальные резекции, тотальные дуоденопанкретэктомии за счет того, что современные методы визуализации позволяют в большом количестве случаев исключить инвазию опухоли в сосуды на дооперационном этапе, дифференцировав от воспалительного процесса вокруг опухоли, что ранее интерпретировалось как инвазия опухоли. Наравне с этим увеличивается число операций с резекцией магистральных сосудов при выявленной инвазии. Таким образом, процент пациентов, которым выполняются радикальные операции, доходит в настоящее время по данным разных авторов до 18-24% [Bao P.Q., Johnson J.C., Lindsey Е.Н. et al. Endoscopic ultrasound and computed tomography predictors of pancreatic cancer resectability // J. Gastrointest. Surg. 2008. V. 12. No. 1. P. 10-16; Забежинский Д.А. Комбинированное лечение больных резектабельным раком поджелудочной железы: Автореф. дис.канд. мед. наук. М., 2009. 30 с.]. Однако достоверное выявление распространения опухолевого процесса на магистральные сосуды принципиально остается проблемной задачей, влияющей на интраоперационную тактику. [Mori Н. New insight of pancreatic imaging: from «unexplored» to «explored» // Abdom. Imaging. 2010. V. 35. No. 2. P. 130-133].
Несмотря на повышение чувствительности дооперационных (ТАУЗИ, ЭУЗИ, СКТ, МРТ, АГ) и интраоперационных (ИОУЗИ, ЛУЗИ) методов диагностики, количество пациентов, у которых до момента мобилизации панкреатодуоденального комплекса остается до конца неясно имеется ли истинное врастание опухоли в стенку сосуда или нет, остается высоким. Недостаточно высокая точность диагностики прорастания опухолью магистральных и органных сосудов до момента мобилизации комплекса органов с опухолью является одной из причин незапланированных паллиативных операций и эксплораций [Ravikumar R., Sabin С, Abu Hilal М. et al. Portal vein resection in borderline resectable pancreatic cancer: a United Kingdom multicenter study // J. Am. Coll. Surg. 2014. V. 218. No. 3. P. 401-411]. Учитывая низкий общий процент резектабельных опухолей ПЖ и ГПДЗ, значительное увеличение риска при выполнении резекции крупных сосудов, актуальным является интраоперационная окончательная диагностика инвазии опухоли в сосуд до начала выполнения мобилизации панкреатодуоденального комплекса согласно принципам абластики.
УЗИ часто оказывается первым методом диагностики при обследовании пациентов с образованием ПЖ. Этот метод позволяет доступно, мобильно и безопасно оценить распространенность процесса, провести мультипроекционное и мультипозиционное исследование в реальном масштабе времени, оценить качественные и количественные характеристики кровотока [Ветшева Н.Н., Кармазановский Г.Г., Степанова Ю.А. Инструментальные методы диагностики в оценке сосудистой инвазии при опухолях поджелудочной железы // Медицинская визуализация. 2013. №4. С. 136-139]. В 90-е годы прошлого столетия точность трансабдоминального ультразвукового исследования в выявлении сосудистой инвазии не превышала 50% [Портной Л.М., Жаров И.Н., Араблинский А.В., Легостаева Т.Б. Современные методы лучевой диагностики объемных заболеваний гепатопанкреатодуоденальной области // Вестник рентгенологии и радиологии. 1991. №5. С. 69-74; Харченко В.П., Чхиквадзе В.Д., Кузьмин И.В. Вклад Московского НИИ диагностики и хирургии в развитие отечественной хирургии и онкологии // Вестник рентгенологии и радиологии. 1994. №2. С. 46-49]. Появление новых ультразвуковых сканеров с высокой разрешающей способностью и широкое распространение допплерографических методик позволили повысить диагностическую точность метода до 70-87% [Кубышкин В.А., Вишневский В.А., Айрапетян А.Т. Дифференциальная диагностика рака головки поджелудочной железы // Хирургия. Журнал им. Н.И. Пирогова. 2000. №11. С. 19-23; Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007. 448 с.]. УЗИ может выявить вовлеченность исследуемого сосуда в опухолевый или периопухолевый процесс, но не всегда позволяет дифференцировать врастание опухоли в стенку сосуда от вовлечения ее в воспалительный процесс вокруг опухоли [Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М.: Мед. Практика-М, 2003. 386 с.].
При ЭУЗИ приближение ультразвукового датчика к исследуемой зоне дает возможность детально исследовать структуру поджелудочной железы, включая главный панкреатический проток, внепеченочные желчные протоки, близлежащие магистральные сосуды [Rosch Т., Dittler H.J., Strobel К. et al. Endoscopic ultrasound criteria for vascular invasion in the staging of cancer of the head of the pancreas: a blind reevaluation of videotapes // Gastrointest. Endosc. 2000. V. 52. No. 4. P. 469-477; Helmstaedter L., Riemann J.F. Pancreatic cancer - EUS and early diagnosis // Langenbecks Arch. Surg. 2008. V. 393. No. 6. P. 923-927.]. В настоящее время по данным метаанализа, проведенного в 2013 г.[Nawaz Н., Fan C.Y., Kloke J. et al. Performance characteristics of endoscopic ultrasound in the staging of pacreatic cancer: a meta-analysis // JOP. 2013. V. 14. No. 5. P. 484-497], чувствительность ЭУЗИ в оценке сосудистой инвазии составляет 85%, а специфичность - 91%. Критериями оценки сосудистой инвазии при этом являются перипанкреатические коллатеральные вены вокруг опухоли с тромбозом одной из основных вен, опухоль в просвете сосуда, неровность контура сосуда и отсутствие гиперэхогенной прослойки между сосудом и опухолью. Наименее точно диагностируют при ЭУЗИ прорастание в селезеночные артерию и вену, а наиболее точное совпадение до- и интраоперационных данных получают при исследовании верхней брыжеечной и воротной вен [Нечипай A.M., Бурдюков М.С., Юричев И.Н., Романенко Н.В. Эндоскопическая ультрасонография в диагностике инвазии опухоли поджелудочной железы в магистральные сосуды // Анналы хирургической гепатологии. 2010. Т. 15. №2. С. 72-80].
При обзоре литературы способов интраоперационной диагностики сосудистой инвазии при опухолях поджелудочной железы нами выявлено не было. Интраоперационно прорастание опухолью стенки магистрального сосуда определяют пальпаторно в ходе мобилизации, что не всегда отвечает принципам абластики, а также с помощью ИОУЗИ и ВСУЗИ. С появлением новой аппаратуры и высокочастотных датчиков для проведения ИОУЗИ удалось расширить границы применения ультразвуковой методики и внедрить данное исследование в повседневную работу крупных медицинских институтов и центров. Однако повсеместное использование ИОУЗИ затруднено. При этом чувствительность и специфичность метода в плане диагностики опухолевой инвазии не достигает 100%, что вполне естественно. Дополнительную сложность верификации истинной инвазии представляет воспалительный инфильтрат вокруг опухоли, который затруднительно однозначно трактовать при ИОУЗИ. В последние годы разработана аппаратура и техника ВСУЗИ, при котором эхолокацию проводят датчиком в виде катетера, который вводят в исследуемый сосуд интраоперационно. При применении внутрисосудистого ультразвукового исследования существуют определенные трудности. Во время исследования достаточно просто визуализировать места слияния сосудов, но трудно ориентироваться на протяжении сосуда. По данным A. Nakao, Т. Kaneko [Nakao A., Kaneko Т. Intravascular ultrasonography for assessment of portal vein invasion by pancreatic carcinoma // World J. Surg. 1999. V. 23. No. 9. P. 892-895], чувствительность, специфичность и общая точность внутрисосудистого ультразвукового исследования в оценке инвазии воротной вены равны 99,6, 92,3 и 94,5%. Однако внутрисосудистое ультразвуковое исследование является дорогим и агрессивным методом, связанным с инвазией в просвет сосуда через его стенку. Его рекомендуется применять только в случаях, в которых различие между компрессией и прорастанием сосуда не может быть верифицировано никакими другими методами исследования [Nakao A., Kaneko Т. Intravascular ultrasonography for assessment of portal vein invasion by pancreatic carcinoma // World J. Surg. 1999. V. 23. No. 9. P. 892-895].
Раскрытие изобретения
Задачей изобретения является визуальное выявление процесса расхождения края опухоли и стенки сосуда в зоне подозрительной на инвазию с целью определения ее опухолевой инвазии.
Техническим результатом является повышение точности выявления инвазии опухоли поджелудочной железы в стенку прилежащего магистрального сосуда в процессе проведения операции, в т.ч. за счет дифференцирования врастания опухоли в стенку сосуда от вовлечения ее в воспалительный процесс вокруг опухоли. Это позволяет повысить качество интраоперационной диагностики и хирургического лечения сложной хирургической патологии, отказаться от неоправданных вмешательств, рационально составить план операции, интраоперационно верифицировать опухолевую инвазию стенки сосуда, скорректировать тактику вмешательства на магистральных сосудах.
Поставленная задача решается путем интраоперационного введения жидкости методом ползучего инфильтрата в перивазальное пространство, максимально близко к месту поражения, с последующим контролем за ее распространением под УЗК. В случае отсутствия истинного поражения стенки магистрального сосуда опухолью клетчаточные и соединительно-тканные прослойки между стенкой сосуда и пораженным органом заполняются вводимым составом, что достоверно визуализируется с помощью УЗ-сканера. В случае поражения стенки магистрального сосуда расслаивания и расхождения краев опухоли и стенки сосуда не происходит.
Краткое описание чертежей
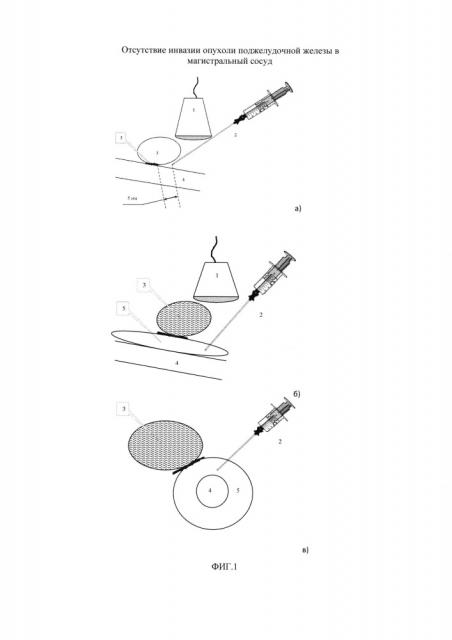
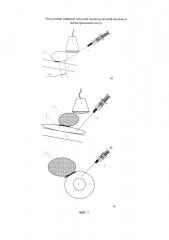
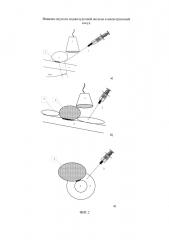
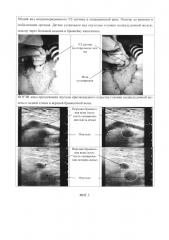
Изобретение поясняется схемами. На фиг. 1 представлена общая схема при отсутствии инвазии опухоли ПЖ в магистральный сосуд, а именно в воротную вену. Позициями на фигурах обозначены: 1 - УЗ-датчик, 2 - пункционная игла, 3 - опухоль головки поджелудочной железы, 4 - воротная вена, 5 - введенный раствор. На фиг. 1а представлен общий план проводимой манипуляции, на фигурах 1б и 1в видно, что введенный раствор расслаивает клетчаточное и соединительно-тканное пространство между опухолью головки поджелудочной железы (3) и воротной веной (4), что достоверно визуализируется с помощью УЗ-сканера (1). На фиг. 2 представлена общая схема при наличии инвазии опухоли головки ПЖ в магистральный сосуд, а именно в воротную вену. На фиг. 2а представлен общий план проводимой манипуляции, на фиг. 2б и 2в видно, что введенный раствор обтекает место инвазии, расслаивания и расхождения краев опухоли и стенки сосуда не происходит. Схемам соответствуют интраоперационные фотографии, показывающие возможность реализации заявленного способа - фиг. 3. В частности, на фиг. 3 представлены две фотографии общего вида интраоперационного УЗ-датчика в операционной ране (до ревизии и мобилизации органов), датчик установлен над опухолью головки поджелудочной железы, осмотр проведен через большой сальник и брыжейку кишечника. На фиг. 3 представлены также изображения ИОУЗИ зоны предлежания опухоли крючковидного отростка головки поджелудочной железы к задней стенке в верхней брыжеечной вены.
Осуществление изобретения
Способ осуществляют следующим образом.
Интраоперационно в перивазальное пространство, максимально близко к зоне предполагаемой инвазии края опухоли в стенку прилежащего магистрального сосуда, пункционной иглой Chiba 20-22G в околоопухолевые ткани, жировую клетчатку под УЗК одномоментно вводят не менее 10 мл стерильной жидкости, достигая тугой инфильтрации тканей в зоне соприкосновения опухоли и стенки магистрального сосуда в одном слое.
Введенный раствор в случае интактности стенки магистрального сосуда опухолью заполняет клетчаточные и соединительно-тканные прослойки между стенкой сосуда и опухолью, что достоверно визуализируется по данным ИОУЗИ в режиме реального времени. В случае прорастания опухоли в стенку магистрального сосуда введенный раствор распространяется вокруг зоны истинной инвазии, а расслаивания клетчаточного пространства в зоне инвазии не происходит.
УЗ-датчик располагают полипозиционно и полипроекционно по отношению к длине или поперечному срезу сосуда в зависимости от конфигурации зоны инвазии. При этом при отсутствии инвазии эхогенность стенки и величина просвета магистрального сосуда не изменены, локального повышения линейной скорости кровотока (ЛСК) нет. В случае инвазии эхогенность стенки магистрального сосуда повышена, величина просвета сосуда изменена, отмечается локальное повышение ЛСК, либо кровоток не регистрируется вовсе.
Интраоперационно кончик иглы располагается в непосредственной близости от стенки магистрального сосуда и края опухоли. Стенка сосуда вследствие естественной пульсации смещается от 1 до 3 мм (в зависимости от вида сосуда - артерия или вена). Край опухоли вместе с органом также смещается от давления диафрагмы в результате передаточного смещения от ИВЛ, на которой находится пациент во время операции. Наш опыт показал, что в целях предотвращения повреждения иглой стенки сосуда и опухоли, в качестве расстояния для определения места вкола пункционной иглы целесообразнее выбирать интервал 4-5 мм от зоны предполагаемой инвазии.
В качестве вводимого раствора могут быть использованы любые однородные стерильные жидкости: дистиллированная вода, кристаллоидные растворы (хлорид натрия, дисоль, трисоль). Однако с клинической целесообразностью больным опухолями БПДЗ, подвергающимся резекции ткани ПЖ, в водимую жидкость необходимо добавлять лидокаин, оказывающий профилактический эффект в отношении послеоперационного панкреатита.
Изобретение поясняется следующими примерами практического использования заявляемого способа.
Больной М, 54 года, поступил с клинико-инструментальной и лабораторной картиной механической желтухи. При дообследовании выявлена внутри- и внепеченочная билиарная гипертензия, обусловленная раком головки ПЖ. Явления механической желтухи были купированы путем чрескожной чреспеченочной микрохолецистостомии. Пациенту начато обследование в целях предоперационной подготовки. По данным ТАУЗИ органов брюшной полости ПЖ с нечеткими, неровными контурами, в головке лоцируется объемное гипоэхогенное образование с нечеткими, неровными контурами, размерами 2,8×3,0 см, при ЦДК с кровотоком в ткани образования, тело 2,1 см, хвост 2,7 см, эхоструктура диффузно неоднородна. Вирсунгов проток 0,6 см, гомогенный. Воротная вена 1,0 см. Объемное образование интимно прилежит к воротной вене. При МСКТ органов брюшной полости с внутривенным контрастированием поджелудочная железа - головка 3,0 см, тело 2,9 см, хвост 2,9 см. Структура паренхимы в области головки неоднородна за счет гиподенсивных участков, один из которых отчетливо визуштизируется по нижнему краю, диаметром до 2,1 см. Аорта и нижняя полая вена без патологии. Головка ПЖ с объемным образованием интимно прилежит к воротной вене, стенка на протяжении 10 мм четко не дифференцируется - нельзя исключить прорастание. Больной был оперирован в плановом порядке. По данным интраоперационной ревизии в паренхиме головки ПЖ определяется плотное опухолевое образование. Головка ПЖ плотно припаяна к воротной вене. По описанной выше методике, максимально близко к головке ПЖ в перивазальное пространство было введено 10 мл физиологического раствора с лидокаином 2%-2,0 мл, достигая тугой инфильтрации тканей. При ИОУЗИ введенный раствор расслоил клетчаточные пространства между головкой ПЖ и воротной веной, прорастание опухоли в стенку сосуда исключено. Гидропрепаровка ПЖ и стенки воротной вены значительно облегчила последующую мобилизацию комплекса органов с опухолью и тунелирование между воротной веной и тканью ПЖ. Произведена пилоросохраняющая ПДР. Послеоперационный период протекал без осложнений. Пациент выписан на 17-е сутки послеоперационного периода.
Больная Т., 66 лет, поступила с клинико-инструментальной и лабораторной картиной механической желтухи. При дообследовании выявлена внутри- и внепеченочная билиарная гипертензия, обусловленная раком головки ПЖ. Явления механической желтухи были купированы путем чрескожной чреспеченочной микрохолецистостомии. Пациентка обследована. По данным ТАУЗИ органов брюшной полости ПЖ с четкими, неровными контурами, в головке лоцируется объемное образование с нечеткими, неровными контурами, размерами 2,5×2,5 см, сниженной эхогенности, тело 1,5 см, хвост 2,6 см, эхо-структура диффузно неоднородна. Вирсунгов проток расширен до 0,6 см, гомогенный. Воротная вена 1,0 см. При МСКТ органов брюшной полости с внутривенным контрастированием поджелудочная железа - головка 3,1 см, тело 1,2 см, хвост 2,5 см. В головке поджелудочной железы определяется гиподенсивная зона неправильно-округлой формы, с нечеткими контурами, размером до 20 мм. При контрастном усилении данная зона не накапливает контрастный препарат. Аорта и нижняя полая вена без патологии. Головка ПЖ с объемным образованием интимно прилежит к верхней брыжеечной вене и к верхней брыжеечной артерии. Стенки указанных сосудов на протяжении 12 мм и 6 мм в зоне предлежания опухоли не дифференцируется - нельзя исключить прорастание. После купирования явлений механической желтухи пациентка была оперирована. В плане операции были предусмотрены сосудистые этапы вмешательства на верхних брыжеечных сосудах ввиду предполагаемой инвазии стенок сосудов опухолью. По данным интраоперационной ревизии в паренхиме головки поджелудочной железы определяется плотное опухолевое образование. Головка поджелудочной железы плотно припаяна к верхней брыжеечной вене и к верхней брыжеечной артерии. По описанной выше методике, максимально близко к головке ПЖ в перивазальное пространство было введено 20 мл физиологического раствора с лидокаином 2%-2,0 мл, достигая тугой инфильтрации тканей в одном слое. При ИОУЗИ расслоения клетчаточных пространств между опухолью головки ПЖ и верхней брыжеечной веной не получено, однако произошло расслоение тканей и расхождение края опухоли и стенки верхней брыжеечной артерии. Таким образом выявлено прорастание опухоли в стенку верхней брыжеечной вены, а верхняя брыжеечная артерия оказалась интактной. Эти данные были подтверждены дальнейшей мобилизацией комплекса органов с опухолью. Произведена пилоросохраняющая ПДР, краевая резекция стенки верхней брыжеечной вены с первичным швом. Вмешательство на верхней брыжеечной артерии не потребовалось. Осложнений в послеоперационном периоде отмечено не было. Пациентка выписана на 20-е сутки послеоперационного периода.
Таким образом, использованный способ позволил улучшить качество интраоперационной диагностики, составить рациональный план радикальной операции путем отказа от резекции участка магистрального сосуда, что позволило уменьшить сроки и тяжесть послеоперационного периода и сократить стоимость лечения.
1. Способ интраоперационного определения инвазии опухоли поджелудочной железы в стенку прилежащего магистрального сосуда, включающий однократное введение с помощью пункционной иглы в перивазальное пространство прилежащего к опухоли сосуда стерильной жидкости в объеме, необходимом для достижения тугой инфильтрации тканей в зоне соприкосновения опухоли и стенки магистрального сосуда с последующим УЗ контролем за ее распространением и при выявлении заполнения вводимой жидкостью клетчаточных и соединительно-тканных прослоек между стенкой сосуда и пораженным органом, делают вывод об отсутствии поражения стенки магистрального сосуда опухолью, а при выявлении сохранения расстояния между краями опухоли и стенкой прилежащего магистрального сосуда делают вывод о поражении опухолью стенки магистрального сосуда.
2. Способ по п. 1, характеризующийся тем, что жидкость содержит лидокаин.
3. Способ по п. 1, характеризующийся тем, что жидкость вводят в объеме не менее 10 мл.
4. Способ по п. 1, характеризующийся тем, что вкол иглы при введении жидкости осуществляют на расстоянии 4-5 мм от зоны предполагаемой инвазии.
5. Способ по п. 1, характеризующийся тем, что в качестве жидкости используют стерильную дистиллированную воду или кристаллоидные растворы.
6. Способ по п. 5, характеризующийся тем, что в качестве кристаллоидных растворов используют хлорид натрия или дисоль или трисоль.