Левоизовалерилспирамицин ii, препараты, способ приготовления и употребления
Иллюстрации
Показать всеИзобретение относится к получению и применению в фармацевтической промышленности кристаллического левоизовалерилспирамицина II формулы (I):
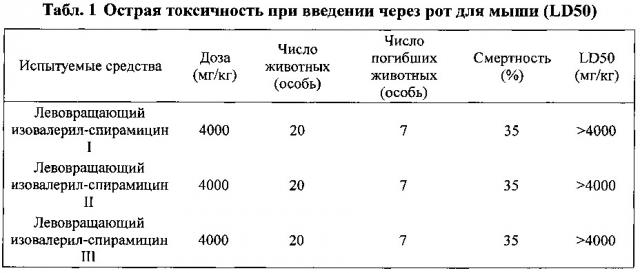
характеризующегося температурой плавления 120°С-128°С и дифракцией рентгеновских лучей, измеренной с применением излучения Cu-Kα с пиками при 2θ=10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5°, причем при растворении указанного кристаллического соединения в хлороформе при 25°С и концентрации 0,02 г/мл угол оптического вращения [α]D составляет -55°-61°. Способ получения указанного кристаллического соединения включает растворение твердого левоизовалерилспирамицина II в смеси абсолютного метилового спирта, безводного ацетона и абсолютного этилового спирта в соотношении 1:0.1-10:0.5-1, добавлении дистиллированной воды при перемешивании, охлаждении до 5°С-15°С до получения указанных кристалловического соединения левоизовалерилспирамицина II. Предложен новый эффективный способ получения новой кристаллической формы, пригодной для эффективного получения лекарственных противоинфекционных препаратов. 5 н. и 14 з.п. ф-лы, 5 ил., 10 табл., 56 пр.
Реферат
Техническая область
Изобретение относится к новым макролидным антибиотикам в генной инженерии, и особенно левовращающему изовалерил-спирамицину II, его кристаллам, фармацевтическим препаратам, способам приготовления и употреблению в противоинфекционных средствах.
Техническая среда
Макролидные антибиотики занимают важное место в клинике, обладают хорошей активностью в отношении грамм-положительных бактерий и микоплазмы, также действуют на грамм-отрицательные бактерии, обладают благоприятной антибактериальной активностью и проницаемостью тканей в отношении распространяющихся токсоплазмов, легионелл и других трудно контролируемых возбудителей, при пероральном употреблении быстро поглощаются с редкими неблагоприятными действиями, в принципе не оказывают отрицательное воздействие на функцию печени и почки, обладают также потенциальной иммунологической регуляцией, в девяностых годах прошлого года считались соперником β-лактамных препаратов при лечении инфекционных заболеваний дыхательных путей взрослых.
Хиральность (Chirality) - основное свойство трехмерных предметов, является одним из основных свойств природы. В качестве важной основы жизненной деятельности, почти все биологические макромолекулы, как протеин, полисахарид, нуклеиновая кислота, ферменты и т.д., хиральные, и эти макромолекулы, как правило, исполняют важную физиологическую функцию внутри тела. Под хиральными лекарствами (chiral drug) понимаются пары оптических антиподов, являющихся зеркальными отражениями друг друга и полученных после ввода хирального центра в молекулярную структуру лекарства. Эти оптические антиподы обладают принципиально аналогичными физико-химическими свойствами, отличаются только оптической активностью, откуда и выделились R (правовращающие) или S (левовращающие), рацемические. За последние 20 лет углубленные изучения в фармацепии доказали различную стерео специфичность (stereoselectivity) антиподов лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства. Антиподы хиральных лекарств, имеющие повышенную активность, называют оптимальными антиподами (Eutomer); а антиподы, имеющие низкую активность или не имеющие активности, называют неактивными антиподами (Distomer). В большинстве случаев, неактивные антиподы не дают эффективности, но они еще частично нейтрализуют эффективность оптимальных антиподов, иногда даже вызывают серьезные токсичные и побочные реакции, что доказало сложность в разнице эффективности лекарственных средств и значительное отличие терапевтического индексантипод одного антипода от его рацемата, как всем известно, что терапевтическая эффективность синтомицина DL-(+-) составляет только половину хлорамфеникола D(-); а активность L-изомера пропранолола (propranolol) в 100 раз больше чем D-изомер; (-) метадон представляет собой сильное болеутоляющее средство, а (+) не действующее. Сильно отличается и токсичность, например, оба антипода талидомида (thalidomide) обладают аналогичным успокаивающим действием в отношении мышей, но только S(-) изомер и его метаболит обладают зародышевой токсичностью и тератогенезом; кетамин -широкораспространенные наркотические и болеутоляющие средства, но они дают галлюцинацию и другие побочные действия. Изучения показали, что S(+) дает эффект в 3-4 раза больше R(-), а токсичные и побочные действия явно связаны с последним. Значительное различие в терапевтической эффективности хиральных лекарств стимулировало развитию работ по разработке, разделению и анализу хиральных лекарств. Применение техники «Хиральность» позволило удалять из лекарственных средств составы, не дающие эффекта или имеющие токсичные и побочные действия, производить чистые хиральные лекарственные вещества, имеющие структуру с одним направлением, что позволило повышать чистоту состава препарата, быстро проявлять терапевтическую эффективность и сокращать курс лечения. В связи с этим, разработка хиральных лекарств стала одним из новых направлений в разработке новых лекарственных средств мира. Правительства и крупные фармацевтические фирмы начали вносить большие средства в разработку хиральных лекарственных препаратов, хирального сырья и хиральных интермедиатов, чтобы завоевать фармацевтический рынок мира хиральных лекарственных веществ. Более того, с непрерывным улучшением хиральной технологии и быстрым распространением жидкостной хроматографии была продвинута работа по разделению, анализу и определению антиподов хиральных лекарств. Хиральные моноэнантиомерные средства получили широкое применение. Карримицин (Carrimycin) - дериват спирамицина нового поколения, разработанный с помощью генной инженерии, носил первоначальное название «Biotechspiramycin», также биотехмицин, Biotechmycin [патент. №: ZL 97104440.6]. Согласно «Принципу выбора названий лекарственных препаратов Китая» в результате технической проверки и изучения Государственной фармакопейной комиссией Китая было принято решение переименовать Biotechspirarnycin в Карримицин (Carrimycin), название на английском языке «Carrimycin». С точки зрения химической структуры основным составом Карримицин (Carrimycin) является 4''-изовалерил-спирамицин, включающий 4''-изовалерил-спирамицины I, II, III, кроме этого, Карримицин (Carrimycin) содержит и примерно 6 видов спирамицином с ацилированной 4-оксигруппой, поэтому он носит общее химическое название «4''-ацилированный спирамицин».
Химическая структура основного состава Карримицин (Carrimycin) показана на (1):
Где: Р в изовалерил-спирамицине I выбирают из Ч;
Р в изовалерил-спирамицине II выбирают из СОСН3;
R в изовалерил-спирамицине III выбирают из СОСН2СН3.
Карримицин (Carrimycin) представляет собой шестнадцатичленные макролидные антибиотики, механизм действия заключается в сочетании с тельцем Паладе бактерий для ингибирования синтеза белков.
Результаты фармакокинетических исследований показали, что в Карримицине (Carrimycin) самыми активными составами являются изовалерил-спирамицины I, II, III. После поступления в организм карримицин (Carrimycin) быстро метаболирует с образованием спирамицина, расчет суммы AUC0-t материнских средств - изовалерил-спирамицинов I, II, III и активных метаболитов - спирамицинов I, II, III показал, что при пероральном применении абсолютная биодоступность составляет в среднем 91,6%. По источникам, абсолютная биодоступность спирамицина при пероральном применении для человека составляет в пределах 30-40% (Frydman AM et al JAntimicrob Chemother. 1988, 22 (suppl B): 93-103). Чем доказано, что структура изовалерил-спирамицина в значительной степени улучшила биологическую доступность активного вещества - спирамицина. Разовый прием Карримицина (Carrimycin) медленно дает эффект, T1/2 в пределах 23-27 ч.
Результаты теста in vitro показали, что Карримицин (Carrimycin) хорошо воздействует на грамм-положительные бактерии, особенно некоторые лекарственноустойчивые микробы (к примеру, золотистый стафилококк, стойкий к β-лактаму, золотистый стафилококк, стойкий к эритромицину и т.д.), не имеет заметной перекрестной устойчивости к подобным лекарственным средствам. Тем временем, обладает хорошей антибактериальной активностью в отношении микоплазмы и хламидии, части грамм-отрицательных бактерий, обладает благоприятной антибактериальной активностью и проницаемостью тканей в отношении токсоплазм, легионеллы, а также потенциальной иммунологической регуляцией. Антибактериальная активность внутри организма превосходит активность вне организма (ZL 200310122420.9). Клинические исследования показали, что прием таблеток Карримицин (Carrimycin) в течение 5-7 дней по 200 мг. - 400 мг. в день, дает положительные эффекты в лечении острого бактериального фарингита и острого гнойного тонзиллита, вызванного streptococcus pyogenes; бактериального хронического синусита и острого бронхита, вызванного сенситивными бактериями; не сильной пневмонии, вызванной пневмококком, гемофильной палочкой и микоплазмой пневмония; негонококкового уретрита, вызванного микоплазмой, хламидией; инфекции кожи и мягких тканей, периодонтита, тимпанита и других инфекционных болезней, вызванных сенситивными бактериями. Общий коэффициент полезного действия составляет 92,68%.
Клинические исследования показали, что Карримицин (Carrimycin) является безопасным и эффективным для перорального применения антибиотиком. Тем не менее, Карримицин (Carrimycin) является многокомпонентным лекарственным средством, полученным в результате ферментации, его дальнейшее отделение и очистка оказывается очень трудно. В настоящее время создание высокоэффективной жидкостной хроматографии позволяет отделить образцы Карримицин (Carrimycin) от ацилированных спирамицинов, например, степень отделения изовалерил-спирамицин II от изобутирил-спирамицина III, степень отделения изобутирил-спирамицин II от пропионил-спирамицина III, степень отделения пропионил-спирамицина III от его предыдущих малых компонентов, степень отделения пропионил-спирамицина II от ацетилспирамицина III более 1,5, установленной Китайской фармакопеей; а степень отделения ацетилспирамицин III от его предыдущих малых компонентов составляет 1,2.
В результате многочисленных исследований, регулирования и оптимизации условий культивирования и ферментации изобретателем был получен левовращающий Карримицин (Carrimycin), который обладает более благоприятной противоинфекционной активностью.
В настоящее время применяется высокоэффективная жидкостная хроматография для определения 9 видов ацилированных спирамицинов Карримицина (Carrimycin), в т.ч. общее содержание изовалерил-спирамицинов (I+II+III) не менее 60%, общее содержание ацилированных спирамицинов не менее 80%. В отношении многокомпонентного антибиотика, полученного в результате ферментации, трудно достигать критерия контроля качества средств для инъекций среди химикатов, но в отношении тяжелых больных или больных, которым не подходит пероральное применение лекарства, инъекция дает результаты быстро, ввиду этого, разработка однокомпонентного препарата изовалерил-спирамицина имеет очень глубокий смысл. В результате дальнейших исследований левовращающего Карримицина (Carrimycin) был получен однокомпонентный левовращающий изовалерил-спирамицин I чистотой до 98% (масс.).
Общее описание изобретения
Первый объект изобретения относится к левовращающему изовалерил-спирамицину II.
Второй объект изобретения относится к препаратам, содержащим левовращающий изовалерил-спирамицин II.
Третьим объектом изобретения является способ приготовления левовращающего изовалерил-спирамицина II.
Четвертым объектом изобретения также является употребление левовращающего изовалерил-спирамицина II.
Пятым объектом изобретения также являются кристаллы левовращающего изовалерил-спирамицина II, а также препараты, содержащие указанные виды кристалла.
Для осуществления цели изобретения приняли следующие технические решения:
Изобретение относится к левовращающему изовалерил-спирамицину II, химическая структура указанного левовращающего изовалерил-спирамицина II приведена в (II),
Удельная постоянная вращения составляет [α]D=-55° - -61°, предпочтительно -57° - -59° (С=0,02 г/мл, СНСl3, 25°С, λ=589,3 нм); точка плавления 120-128°С, предпочтительно 123-125°С;
Изобретение относится к препаратам левовращающего изовалерил-спирамицина II, отличающимся тем, что указанные препараты содержат изовалерил-спирамицин II, фармацевтическую соль изовалерил-спирамицина II, фармацевтически приемлемые для изовалерил-спирамицина II и вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли изовалерил-спирамицина II вспомогательные материалы. Чистота указанного изовалерил-спирамицина II более 90 масс. %, предпочтительная чистота более 95 масс. %, более предпочтительная чистота - более 98 масс. %.
Первый предпочтительный вариант изобретения: препараты изобретения могут быть жидкими, твердыми, полутвердыми или газообразными; указанный жидкий препарат выбирают среди раствора для инъекции, трансфузионной среды, раствора, микстуры, сахарного сиропа, настойки, золи, ароматизированной воды, глицеринового раствора, коллоидального раствора, слизи, взвеси или эмульсии; указанный твердый препарат выбирают среди порошка для инъекций, лиофилизированного порошка, таблеток, желатиновых капсул, порошка, пилюль или пленок; указанный полутвердый препарат выбирают среди мази, пластыри, свечи; суппозитория, экстракта, желатинирующего вещества; указанный газообразный препарат выбирают среди аэрозоли или распыляемого раствора, предпочтительны раствор для инъекций, порошок для инъекций и лиофилизированный порошок для инъекций.
Второй предпочтительный вариант изобретения: единичные дозы изовалерил-спирамицина II, содержимого в препаратах изобретения, составляют 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг.
Третий предпочтительный вариант изобретения: в препаратах массовый процент левовращающего изовалерил-спирамицина II составляет 10-95%, предпочтительно 50-95%, более предпочтительно 75-95%.
Изобретение также относится к препаратам, содержащим левовращающий изовалерил-спирамицин II.
Указанные препараты включают раствор для инъекций, порошок для инъекций или лиофилизированный порошок для инъекций, приготовленный из изовалерил-спирамицина II и, по крайней мере, одного среди лимоннокислоты, адипиновой кислоты, малеиновой кислоты.
В т.ч. мольное отношение левовращающего изовалерил-спирамицина II к лимоннокислое составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина II к адипиновой кислоте составляет 1:0,8-1,2, мольное отношение левовращающего изовалерил-спирамицина II к малеиновой кислоте составляет 1:0,8-1,2.
Изобретение также относится к способу приготовления левовращающего изовалерил-спирамицина II, включающему приготовление левовращающего Карримицина (Carrimycin), очистку левовращающего изовалерил-спирамицина II.
В т.ч. процесс приготовления левовращающего Карримицина (Carrimycin) включает культивирование клонированного штамма WSP-195 бактерий, продуцирующих спирамицин, с содержанием гена 4''-изовалерил-трансферазы, биологическое сбраживание и экстрагирование сбраживаемой жидкости; сбраживание при уровне рН 6,0-9,0, предпочтительно 6,0-8,0, более предпочтительно 6,0-7,5, зависимость уровня рН от времени показывала три непрерывных этапа, первый этап удовлетворяет уравнению y1=k1x1+6,0, где 0,0227≤k1≤0,1364, 0<x1<22; второй этап удовлетворяет уравнению y2=k2x2+b2, где -0,0735≤k2<0, 6,5<b2≤10,62, 22≤x2≤56, третий этап удовлетворяет уравнению y3=k3x3+b3, где 0<k3≤0,0078, 6,06≤b3<6,5, 56≤х3≤120. Регулировали и оптимизировали условия культивирования и сбраживания, особенно регулировали уровень рН в процессе сбраживания с помощью средства для регулирования уровня рН, чтобы зависимость уровня рН от времени в процессе сбраживания показывала три непрерывных этапа, каждый из этапов удовлетворяет определенному уравнению, таким образом, получали левовращающий Карримицин (Carrimycin) с оптической активностью. Получали левовращающий изовалерил-спирамицин II.
Предпочтительно, что условия биологического сбраживания: клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4''-изовалерил-трансферазы, культивировали в течение 8-15 сут при рН 6,5-7,5 и 28~38°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, СаСО3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, СаСО3 0,5%, рыбный пептон 0,3% и KH2РO4 0,05%, культивировали в течение 40-80 ч при рН 6,5-7,5 и 25~30°С, далее засевали прививочную дозу 0,1-20% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, СаСО3 0,5%, KН2РO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%, культивировали в течение 72-120 ч при рН 6,5-7,5 и 26~30°С, таким образом, получали сбраживаемую жидкость;
В качестве указанного средства для регулирования уровня рН выбирают, по крайней мере, один среди соляной кислоты, уксусной кислоты, нашатырного спирта, каустической соды, гидроокиси калия.
Предпочтительно, что экстрагирование биологически сбраживаемой жидкости по следующим шагам: обрабатывали полученную сбраживаемую жидкость сернокислым алюминием для получения фильтрата, регулировали уровень рН фильтрата до 8,5-9,0, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaH2PO4 соответственно, экстрагировали водой рН 2,0-2,5 для получения водофазного экстракта, регулировали уровень рН до 4,5-5,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень рН фильтрата до 8,5-9,0, осаждали, орошали очищенной водой для получения влажного вещества, далее осушали и получали левовращающий Карримицин (Carrimycin).
В т.ч. для регулирования уровня рН применяли, по крайней мере, одну среди соляной кислоты, уксусной кислоты, лимоннокислоты, каустической соды, гидроокиси калия, натрия гидрокарбоната, углекислого натрия.
В т.ч. подробный процесс очистки изовалерил-спирамицина II включает: очистку образцов левовращающего Карримицина (Carrimycin) хроматографическим разделением, градиентную элюцию хроматографической колонной ODS с помощью ацетонитрила и буферного раствора уксуснокислого аммония, выделение целевого пика состава левовращающего изовалерил-спирамицина II.
Предпочтительно, что в процессе очистки левовращающего изовалерил-спирамицина II, принимали припрепаративную высокоэффективную жидкостную хроматографию, ультрафиолетовый контроль, регистрировали ультрафиолетовую спектрограмму. Собирали образцы согласно времени выдержки левовращающего изовалерил-спирамицина II - 43,34 мин.
Более предпочтительно, что в процессе очистки левовращающего изовалерил-спирамицина II, очищали собранный левовращающий изовалерил-спирамицин II от ацетонитрила вращающим испарением, потом экстрагировали этилацетатом, удаляли этилацетат из экстракта испарением, получали пастообразные образцы; перерастворяли полученные образцы петролейным эфиром, удаляли петролейный эфир испарением, получали белые порошковые частицы левовращающего изовалерил-спирамицина II.
В т.ч. указанной подвижной фазой является смешанный растворитель ацетонитрила А и водного раствора уксуснокислого аммония рH=8,5, 150 мМ.
Конкретные условия очистки левовращающего изовалерил-спирамицина II: применяли линейный градиент: 0-60 мин, А: 25%-65%; 61-90 мин, А: 65%-90%.
Скорость потока: 260 мл/мин
Объем вводимого образца: 10 мл
Концентрация вводимого образца: 0.5 г/мл
Контрольная длина волны: 231 нм
Способ сбора: ультрафиолетовый пуск.
Изобретение относится к кристаллам левовращающего изовалерил-спирамицина II, порошковая рентгеновская дифракция, измеренная Cu-Kα-лучами, показывала характеристический пик при 2θ, равном, 10,0°, 11,6°, 16,4°, 17,3°, 19,1°, 21,2°, 22,1°, 22,7°, 26,4°, 26,9°, 27,5° и 31,5°. Диаграмма порошковой рентгеновской дифракции показана на Рис. 5.
Способ приготовления указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что сначала растворяют твердые частицы левовращающего изовалерил-спирамицина II в смеси растворителей безводного метанола, безводного ацетона и абсолютного этилового спирта, потом наливают очищенную воду с одновременным перемешиванием, после налива очищенной воды температура снижается до 5-15°С, при этом продолжают перемешивание до получения кристаллов левовращающего изовалерил-спирамицина II.
В т.ч. первое предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина II заключается в том, что объем вводимой очищенной воды в 2-9 раз больше суммы объема безводного метанола, абсолютного этилового спирта и безводного ацетона, предпочтительно 2,5-7,5 раза; скорость ввода очищенной воды 4-10 мЛ/мин, предпочтительно 6-8 мЛ/ мин.
Второе предпочтительное техническое решение по приготовлению кристаллов левовращающего изовалерил-спирамицина II заключается в том, что в примененной смеси растворителей отношение объема безводного метанола к объему безводного ацетона и к объему абсолютного этилового спирта составляет 1:0,1-10:0,5-1, предпочтительно 1:2-8:0,8-1.
Третье предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость перемешивания вводимой очищенной воды 30-60 р/мин, предпочтительно 45-60 р/мин; после ввода очищенной воды скорость перемешивания 10-30 р/мин, предпочтительно 10-20 р/мин.
Четвертое предпочтительное техническое решение по приготовлению указанных кристаллов левовращающего изовалерил-спирамицина II заключается в том, что скорость охлаждения после ввода очищенной воды 1-3°С/ч, предпочтительно 1-1,5°С/ч.
В элементарных ячейках различных форм молекулы имеют различную пространственную конфигурацию, конфирмацию и расположение, их растворимость тоже сильно отличается, препараты имеют различную скорость растворения внутри тела, что оказывало непосредственное воздействие на поглощение, распределение, экскрецию и метаболизм препаратов в теле, в результате чего различная биологическая доступность приведет к получению различных клинических эффектов. В изобретении проводили соответственное сравнение терапевтической эффективности приготовленных кристаллов левовращающего изовалерил-спирамицина I, кристаллов левовращающего изовалерил-спирамицина II или кристаллов левовращающего изовалерил-спирамицина III с эффективностью левовращающего изовалерил-спирамицина I, левовращающего изовалерил-спирамицина II или левовращающего изовалерил-спирамицина III, и было обнаружено, что терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина I, превосходит эффективность левовращающего изовалерил-спирамицина I, терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина II, превосходит эффективность левовращающего изовалерил-спирамицина II, терапевтическая эффективность приготовленных по изобретению кристаллов левовращающего изовалерил-спирамицина ПП, превосходит эффективность левовращающего изовалерил-спирамицина III.
Изобретение относится к препаратам кристаллов левовращающего изовалерил-спирамицина II, указанные препараты включают кристаллы изовалерил-спирамицина II, фармацевтическую соль кристаллов левовращающего изовалерил-спирамицина II, фармацевтически приемлемые для кристаллов изовалерил-спирамицина II вспомогательные материалы, или фармацевтически приемлемые для фармацевтической соли кристаллов изовалерил-спирамицина II вспомогательные материалы, чистота указанных кристаллов изовалерил-спирамицина II более 99 масс. %.
Изобретение относится также к употреблению изоамил-спирамицина II или его кристаллов, и его препаратов в приготовлении лечебных и/или профилактических средств против инфекционных заболеваний. Указанные инфекционные заболевания вызваны заражением грамм-положительными бактериями, золотистым Стафилококком, пневмококком, микоплазмой пневмония, хламидией пневмониз, уреаплазмой уреалитикум, трахоматозными хламидиями, streptococcus pyogenes, микрококком катаральным, нейссерией гонорея, гемофильной палочкой, легионеллой или анаэробными бактериями.
Изобретение относится также к употреблению изоамил-спирамицина II или его кристаллов, и его препаратов в приготовлении антибактериальных средств, указанные бактерии: пневмококк, стрептококк группы A, streptococcus pyogenes, энтерококк, золотистый стафилококк, эпидермальный стафилококк, микрококк катаральный, нейссерия гонорея, гемофильная палочка, колибацилла или кишечная палочка, энтеротоксигенные кишечные палочки, патогенная кишечная палочка, enteroinvasive escherichia coli, синегнойная палочка, клебсиелла пневмонии, протеус вульгарис, тифозная палочка, акинетобактерии, лимоннокислота, цитробактер, serratia marcescens, шигелла зонне, шигелла Флекснера, бацилла, tritirachium album; легионеллы, как легионеллезная пневмония, legionella gormanii, legionella bozemanii, legionella dumoffii, legionella jordanis, legionella micdadei; анаэробные бактерии, как бактероиды фрагилис, bacteroides thetaiotaomicron, бактероиды вульгатус, Bacteroides distasonis, bacteroides ruminicola, prevotella asaccharolyticus, prevotella oralis, палочка Плаута, fusobacterium russii, бифидобактерии, лактобацилла, пептострептококки, пропионибактерии акне, клостридии перфрингенс, дрожжеподобный гриб.
Ниже приведено подробное описание изобретения.
Изобретение относится к левовращающему изовалерил-спирамицину II, который получали путем регулирования и оптимизирования условий культивирования и сбраживания, а также строгого контролирования уровня рН раствора.
Левовращающие изовалерил-спирамицины I, II и III обладают повышенной антибактериальной активностью, стали новыми ассортиментами антибиотических средств для инъекций, что предоставило новую возможность для решения технической задачи по антибиотикоустойчивости в настоящее время.
В т.ч. метод определения удельной постоянной вращения левовращающих изовалерил-спирамицинов I, II и III: точно взвешивают указанный препарат, добавляют трихлорметан, растворяют и разбавляют до концентрации 20 мг/1 мл, определяют постоянную вращения калиброванным поляриметром с разрешением до 0,0001° с помощью D-линии спектра натрия (589,3 нм), длина 1 дм, температура 25°С.
Метод определения точки плавления левовращающих изовалерил-спирамицинов I, II или III: взвешивают сухой левовращающий изовалерил-спирамицин I, II или III в умеренном количестве, кладут в капилляр для определения точки плавления, повторяют определение три раза и принимают среднюю величину.
Изобретение также относится к препаратам, содержащим левовращающие изовалерил-спирамицины I, II или III. Составом препаратов являются левовращающий изовалерил-спирамицин I и фармацевтически приемлемые носили и/или вспомогательные материалы, в т.ч. частота изовалерил-спирамицинов I, II и III более 90 масс. %, предпочтительно более 95 масс. %, более предпочтительно более 98 масс. %.
Препараты, содержащие левовращающий изовалерил-спирамицин I, II или III или их кристаллы: предпочтительны раствор для инъекций, порошок для инъекций и лиофилизированный порошок для инъекций. Приготавливают раствор для инъекций или порошок для инъекций из препаратов, содержащих однокомпонентный левовращающий изовалерил-спирамицин I, II или III, чтобы левовращающий изовалерил-спирамицин I, II и III был быстро поглощен в организме человека и достигалась антиинфекционная функция.
Препараты изобретения, содержащие левовращающий изовалерил-спирамицин II, включают следующую единичную дозу: левовращающий изовалерил-спирамицин II 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг.
Препараты изобретения, содержащие кристаллы левовращающего изовалерил-спирамицина II, включают следующую единичную дозу: кристаллы левовращающего изовалерил-спирамицина II 10-1500 мг, предпочтительно 50-1000 мг, более предпочтительно 100-500 мг.
В препаратах изобретения, содержащих левовращающий изовалерил-спирамицин II, массовый процент левовращающего изовалерил-спирамицина II составляет 10-90%, предпочтительно 50-90%, более предпочтительно 75-90%.
В препаратах изобретения, содержащих кристаллы левовращающего изовалерил-спирамицина II, массовый процент кристаллов левовращающего изовалерил-спирамицина II составляет 10-90%, предпочтительно 50-90%, более предпочтительно 75-90%.
Препараты изобретения для приема внутрь могут содержать частоприменяемые воспринимающие средства, как святитель, заполняющие вещества, разбавитель, таблетки, мягчительные средства, дезинтегрант, краситель, приправы и смачиватель, при необходимости покрывают таблетки покровным слоем. В т.ч. применимые заполняющие вещества включают фибрин, маннитол, лактозу и другие подобные заполняющие вещества. Применимый дезинтегрант включает крахмал, поливиниловый пирролидин и дериваты крахмала, например гликолят натрий крахмал. Применимые мягчительные средства включают, например стеарат магния. Применимый смачиватель, приемлемый для лекарственных средств, включает додецил сульфата кантрия.
Твердые препараты для введения внутрь через рот приготавливают смешиванием, наполнением, таблетированием и другими распространенными методами.
Формы жидких препаратов для перорального приема, например водянистая или жирная взвесь, раствор, эмульсия, сахарный сироп или эликсир, или сухой продукт, который можно приготовить вместе с водой или другими подходящими носителями до его применения. Такие жидкие препараты могут содержать обычные добавки, например суспендирующие вещества, как сорбит, сахарный сироп, метилцеллюлоза, желатина, оксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеаринового алюминия или пищевой гидрированный жир, эмульсоры, например лецитин, дегидратационный сорбит-олеин или гуммиарабик, неводные носители (могут содержать пищевое масло), например миндальное масло, фракционированное кокосовое масло, как масляный эфир глицерида, пропиленгликоль или этиловый алкоголь; антисептики, например липид-n-гидроксибензойной кислоты или n-гидроксифенилмравьинопропиловый эфир или сорбиновая кислота, при необходимости могут содержать обычные ароматизирующее вещества или краситель.
Препараты для инъекций могут содержать любые обычные фармацевтические носители и/или воспринимающие средства, стабилизирующие вещества, антиоксиданты, комплексообразователь, а также фармацевтические антисептики, буферы или местно-анестезирующие средства и т.д. Применяют обычные методы приготовления.
Фармацевтически приемлемые носители, применяемые в препаратах изобретения, выбирают среди: маннитола, сорбита, пиросернистокислого натрия, бисульфита натрия, тиосульфата натрия, цистеина гидрохлорида, тиогликовой кислоты, метионина, витамина С, этилендиаминтетраацетата натрия, этилендиаминтетраацетата кальция-натрия, карбоната, ацетатаф, фосфата или его водного раствора, соляной кислоты, уксусной кислоты, серной кислоты, фосфорной кислоты, аминокислоты, хлористого натрия, хлористого калия одновалентных щелочных металлов, лактата натрия, ксилитола, мальтозы, глюкозы, фруктозы, декстрана, глицина, крахмала, сахарозы, лактозы, лактобиозы, маннитола, деривата кремния, фибрина и его деривата, соли альгиновой кислоты, желатина, поливинилового пирролидона, глицерина, полисорбата 80, агара, углекислого кальция, гидрокарбоната кальция, поверхностно-активного агента, полиэтиленгликоля, циклодекстрина, β-циклодекстрина, фосфатидных материалов, каолина, талькового порошка, стеаринового кальция, стеаринового магния, стеарата магния и т.д.
Способ применения и дозы препаратов определяют в зависимости от реального состояния пациента, можно внутреннее употребление или введение инъекцией 1-3 раза в день по 1-20 доз.
Эффективность изобретения:
(1) Левовращающий изовалерил-спирамицин I, левовращающий изовалерил-спирамицин II, левовращающий изовалерил-спирамицин III обладают благоприятными антибактериальными свойствами. Согласно современной мармакологии в связи с различной стереоспецифичностью антипода лекарственных веществ, они имеют различный аффинитет с рецепторами, в результате чего сильно отличаются фармакологические свойства, ввиду этого, левовращающий изовалерил-спирамицин I, левовращающий изовалерил-спирамицин II, левовращающий изовалерил-спирамицин III обладают очень большой фармакологической активностью.
(2) В элементарных ячейках различных форм молекулы имеют различную пространственную конфигурацию, конформацию и расположение, их растворимость тоже сильно отличаются, препараты имеют различную скорость растворения внутри тела, что оказывало непосредственное воздействие на поглощение, распределение, экскрецию и метаболизм препаратов в теле, в результате чего различная биологическая доступность приведет к получению различных клинических эффектов. Проводили сравнение терапевтической эффективности приготовленных по изобретению кристаллов левовращающих изовалерил-спирамицинов I, II или III с эффективностью левовращающих изовалерил-спирамицинов I, II или III, и было обнаружено, что терапевтическая эффективность приготовленных по изобретению кристаллов левовращающих изовалерил-спирамицинов I, II или III превосходит эффективность левовращающих изовалерил-спирамицинов I, II или III.
(3) Однокомпонентные реагенты для инъекций, содержащие левовращающий изовалерил-спирамицин I, II или III, однокомпонентные реагенты для инъекций, содержащие кристаллы левовращающего изовалерил-спирамицина I, II или III, предоставляли тяжелым больным и больным, которым не подходит введение лекарств через рот, возможность применения быстродействующих и приемлемых лекарственных форм.
(4) Однокомпонентные препараты, содержащие левовращающий изовалерил-спирамицин I, II или III, однокомпонентные препараты, содержащие кристаллы левовращающего изовалерил-спирамицина I, II или III, отличаются стабильной технологией производством и возможностью контроля качества, рассчитаны на масштабное промышленное производство.
Список рисунков
Рис. 1: Хроматограмма собранных ультрафиолетовым пуском левовращающих изовалерил-спирамицинов I, II и III по Примеру 1;
Рис. 2: Зависимость уровня рН от времени в процессе браживания по примеру 1 изобретения;
Рис. 3: Зависимость уровня рН от времени в процессе браживания по примеру 2 изобретения;
Рис. 4: Зависимость уровня рН от времени в процессе браживания по примеру 3 изобретения;
Рис. 5: Диаграмма порошковой рентгеновской дифракции левовращающего изовалерил-спирамицина II изобретения;
Настоящее изобретение поясняется с помощью нижеследующих примеров, которые нужно рассматривать как пояснительные, а не ограничивающие объем охраны изобретения.
Подробные примеры
Пример 1. Разделение и приготовление левовращающих изовалерил-спирамицинов I, II и III.
(1) Биологическое сбраживание: клонированный штамм WSJ-195 бактерий, продуцирующих спирамицин, с содержанием гена 4''-изовалерил-трансферазы, культивировали в течение 8-15 сут, при рН 6,5-7,5 и 28~38°С на наклонной питательной среде, содержащей муку из бобового жмыха 2%, глюкозу 1%, крахмал 3%, СаСО3 0,5%, NaCl 0,4% и агара 2%, засевали на питательную среду семени, содержащую муку из бобового жмыха 1,5%, крахмал 3,0%, NaCl 0,4%, СаСО3 0,5%, рыбный пептон 0,3% и КН2РО4 0,05%, культивировали в течение 40-80 ч при рН 6,5-7,5 и 25~30°С, далее засевали прививочную дозу 0,1-20% на питательную ферментационную среду, содержащую глюкозу 0,5%, крахмал 6,0%, сухие дрожжи 0,5%, рыбную муку 2,0%, NH4NO3 0,6%, NaCl 1,0%, СаСО3 0,5%, КН2РO4 0,05%, MgSO4 0,1%, бобовое масло 0,5% и противовспениватель 0,02%, культивировали в течение 72-120 ч при рН 6,5-7,5 и 26~30°С, таким образом, получали сбраживаемую жидкость;
В т.ч. строго контролировали уровень рН раствора путем регулирования и оптимизирования условий культирования и сбраживания, проводили сбраживание при уровне рН 6,0-9,0, время сбраживания составляет 120 ч, и зависимость уровня рН от времени показывала три непрерывных этапа, первый этап удовлетворяет уравнению y1=0,1364x1+6,0, где 0<x1≤22; второй этап удовлетворяет уравнению y2=-0,0735x2+10,64, где 22≤х2≤56; третий этап удовлетворяет уравнению y3=0,0078x3+6,06, где 56≤х3≤120, зависимость уровня рН от времени приведена на Рис. 2, таким образом, получали сбраживаемую жидкость.
(2) Экстрагирование биологически сбраживаемой жидкости: обрабатывали сбраживаемую жидкость, полученную по п. (1), сернокислым алюминием для получения фильтрата, регулировали уровень рН фильтрата до 8,5, экстрагировали бутилацетатом, промывали бутилацетатный экстракт обессоленной водой и 1% NaН2РO4 соответственно, экстрагировали водой рН 2,0 для получения водофазного экстракта, регулировали уровень рН до 4,5, удаляли остаточный бутилацетат возгонкой для получения водного экстракта, фильтровали, регулировали уровень рН фильтрата до 8,5, осаждали, орошали очищенной воды для получения влажного вещества, далее осушали и получали левовра