Высокоактивный катализатор с наночастицами железа для абсорбции сероводорода
Иллюстрации
Показать всеИзобретение относится к неорганическим сорбентам. Предложен сорбент, содержащий стабилизированный оксид и/или гидроксид железа (II). Оксид и/или гидроксид железа стабилизирован щелочным соединением, предпочтительно выбранным из гидроксидов калия, натрия и аммония. Сорбент свободен от хлоридных и сульфатных анионов. Предпочтительно частицы сорбента могут быть сформированы из сидерита. Изобретение расширяет ассортимент сорбентов на основе соединений железа, пригодных для удаления соединений серы, таких как H2S, из жидких и/или газообразных потоков, в частности из углеводородных потоков. 4 н. и 47 з.п. ф-лы, 6 ил., 12 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Область техники
[001] Это изобретение в целом относится к абсорбенту, который приспособлен для удаления сероводорода и других соединений серы из жидких и/или газообразных потоков и, в частности, к устойчивому оксиду и/или гидроксиду железа (II), который особенно приспособлен для абсорбции сероводорода и других соединений серы из жидких и/или газообразных потоков. Способы приготовления и использования абсорбента также раскрыты.
Предшествующий уровень техники
[002] Различные жидкие и/или газообразные потоки, включающие в себя потоки углеводорода, такие как жидкости природного газа ("NGL"), сырая нефть, кислотно-газовые смеси, газообразные и жидкие потоки двуокиси углерода, анаэробный газ, газ, образовавшийся при разложении отходов, геотермальный газ, и т.п., также часто содержат значительные количества соединений серы. Некоторые соединения серы, которые часто находятся в таких потоках, включают в себя сероводород, меркаптаны и диметилдисульфид. В частности, в случае углеводородных потоков, эти соединения серы обычно должны быть удалены, чтобы удовлетворить стандартам выбросов загрязняющих веществ и требованиям магистральных трубопроводов.
[003] Вследствие вредной, токсичной и коррозийной природы серосодержащих соединений, много различных продуктов и способов были ранее раскрыты для использования при удалении таких соединений из углеводородных потоков. Один из таких коммерчески доступных продуктов - реагент макрочастиц марки SULFATREAT®, который считается пригодным для удаления сероводорода и других серосодержащих загрязнителей из газов и жидкостей, включающих в себя, например, углеводородные топлива и геотермический пар для продажи производителям природного газа и т.п. Реагент SULFATREAT® является федеральной зарегистрированной торговой маркой "M-I" L.L.C., Houston,Texas и, в традиционной форме, Gas Sweetener Associates, Inc of Chesterfield, Missouri. Вещество SULFATREAT® имеет частное наименование, но предполагается, что оно содержит, прежде всего, частицы оксида железа, имеющие большую площадь поверхности. Губчатое железо - другой коммерчески доступный материал, состоящий из оксида железа, распределенного на древесной стружке, который используется для удаления серы в производственных процессах.
[004] Другой известный процесс для удаления сероводорода из углеводородных потоков - использование щелочного скруббера или модуля аминной очистки. Большинство этих процессов предполагает использование раствора щелочи, такой как гидроксид натрия (NaOH). По сравнению с этими процессами, раскрытая система устойчивого оксида и/или гидроксида железа (II) демонстрирует большую способность абсорбции серы при использовании того же самого количества и концентрации щелочных растворов.
[005] Патент США 5948269 и 8404031, и опубликованная заявка 2001/0005981 показывают использование солей железа для синтеза щелочных соединений железа, таких как гидроксид железа, для удаления H2S. В этих ссылках предпочтительно используется хлорид железа для производства щелочного железа посредством контакта со щелочной солью (натрий, кальций или магний). Эти щелочные соединения железа обычно представляют собой твердые сорбенты и не стабилизированы щелочной жидкостью. В результате они имеют меньшие значения загрузки серы и могут окисляться до соединения трехвалентного железа, как только удаляются из раствора. Например, патентная заявка США 2001/0005981 показывает значения загрузки серы между 14 и 90% (от 0,14 до 0,9 раз) исходя из содержания железа для единственного опыта. По сравнению с этими процессами, раскрытая система устойчивого оксида и/или гидроксида железа (II) более экономична, производит продукты с меньшим количеством примесей (анионы) и имеет возможность адсорбировать до 6 молей серы на моль железа.
[006] Другой коммерчески доступный продукт раскрыт в Патенте США, Номер 7744841 и 7943105. Этот абсорбент, как установлено, был особенно эффективным при абсорбции сероводорода, меркаптанов, диметилдисульфида и других содержащих серу соединений из различных флюидов, включающих в себя природный газ, потоки легких углеводородов, таких как жидкости природного газа, сырую нефть, кислотные газовые смеси, потоки жидкого и газообразного диоксида углерода, анаэробный газ, газообразовавшийся при разложении отходов, геотермические и другие содержащие серу потоки. Этот абсорбент может быть составлен из карбоната железа, наиболее предпочтительно гранулированного сидерита или порошкообразного сидерита, который экструдирован или иначе агрегирован, уплотнен или сформирован в шарики, таблетки или сферы, используя незначительное количество воды и, при необходимости, связующее вещество. Карбонат железа, используемый для формирования этих частиц, имеет обычно размер, где 90% проходит через экран 100 меш, что соответствуют приблизительно 150 микрометрам. Конечный абсорбент предпочтительно имеет размеры в пределах приблизительно от 4 и приблизительно до 12 меш, или приблизительно 1,7-4,7мм, и имеет глубокий красный цвет. Этот сорбент способен достичь загрузки серы 10-20% по весу сорбента (25-50%, исходя из содержания железа).
[007] Несмотря на коммерческий успех продуктов, охваченных Патентом США Номер 7744841 и 7943105, все же имеется потребность в улучшенном абсорбенте, который был бы способен к удалению соединений серы из жидких и/или газообразных потоков и, в частности, сероводорода, из углеводородных потоков.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[008] Изобретение предполагает получение устойчивого оксида и/или гидроксида железа (II). Предпочтительно эти оксиды и/или гидроксиды присутствуют как наночастицы с размерами в пределах 5-10 нанометров. Было обнаружено, что такие частицы могут быть сформированы при меньшей стоимости и с меньшим количеством примесей при использовании карбоната железа (FeCO3) из сидерита, по сравнению с известными технологиями получения из различных солей железа, таких как сульфаты и хлориды. Новые наночастицы, в частности, подходят для удаления соединений серы, таких как сероводород (H2S) из жидких и/или газообразных потоков.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[009] Файл патента, или заявки, содержит, по меньшей мере, один чертеж, выполненный в цвете. Копии этой публикации патента, или патентной заявки, с цветным чертежом(-ами) будут предоставляться ведомством после запроса и оплаты необходимой пошлины.
[0010] Для более полного понимания настоящего изобретения и для понимания его дополнительных преимуществ, необходимо обратиться к нижеследующему описанию, представляемому вместе с сопровождающими чертежами, на которых:
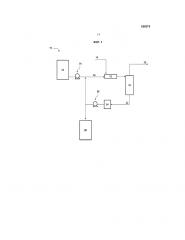
Фиг.1 изображает схему одной предпочтительной системы, которая может быть использована для контакта сорбента с жидким и/или газообразным потоком для удаления H2S или других соединений серы из флюидного потока;
Фиг.2 - изображение, полученное при просвечивающей электронной микроскопии устойчивого оксида и/или гидроксида железа (II) предпочтительного варианта реализации;
Фиг.3 - изображение получения и осаждения солей натрия во время удаления H2S из Примера 5;
Фиг.4 - изображение гранулированного карбоната железа, обожженного при стандартной температуре;
Фиг.5 - изображение устойчивого оксида и/или гидроксида железа (II) на подложке из оксида алюминия, гранулированного и обожженного при различных температурах; и
Фиг.6 - изображение жидкой фазы сидерита, прореагировавшего с 45%-ым раствором KOH при 40-50°C в течение 10-20 минут из Примера 9.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
[0011] Настоящее изобретение может быть лучше понято из нижеследующего обсуждения изготовления и использования конкретных предпочтительных вариантов реализации. Все раскрытые ниже данные, касающиеся времени, температуры, количества компонентов, концентрации в % по весу, и т.д. должны интерпретироваться как включающие в себя также все значения, лежащие в пределах соответствующей точности измерений, известной специалисту в данной области техники. Все раскрытые диапазоны должны интерпретироваться как включающие в себя также и все значения, лежащие в установленных пределах. Если иначе не заявлено, в предпочтительных вариантах реализации использовались различные материалы технического сорта.
[0012] В предпочтительном варианте реализации, новые устойчивые оксиды и/или гидроксиды железа (II) приготавливались из карбоната железа (карбонат железа (II) или FeCO3), и более предпочтительно из сидерита. Сидерит, главным образом, содержит карбонат железа, и обычно в естественном состоянии находится в комбинации с небольшим количеством кальция, магния или марганца. Для использования в соединениях и различных способах изобретения, сидерит может быть поставлен в форме кусков, гранул, или в форме мелко размолотого порошка. Если он поставляется в кусках, то куски желательно уменьшаются до гранул подходящего размера, или превращаются в порошок перед использованием. Хотя после чтения данного описания будет очевидно, что карбонат железа может быть синтезирован, использование карбоната железа, полученного из сидерита минеральной руды естественного происхождения, предпочтительно по экономическим причинам. Справочник Hawley's Condensed Chemical Dictionary (Двенадцатое Издание) сообщает, что руды сидерита естественного происхождения имеются в Штатах Вермонт, Массачусетс, Коннектикут, Нью-Йорк, Северной Каролине, Пенсильвания, Огайо и в Европе.
Представительный анализ сидерита
[0013] Обработанное соединение сидерита, имеющее объемную плотность 110 фунтов на кубический фут, удельную массу 3,63 и размер частиц 90% на 100 меш (число частиц на квадратный дюйм), характеризуется следующими результатами анализа:
| % по весу | |
| Fe (элементный) | 43,00% |
| FeCO3 | 86,87 |
| SiО2 | 5,50 |
| Al2O3 | 1,30 |
| CaO | 0,56 |
| MgO | 0,53 |
| S | 0,40 |
| Мn | 0,35 |
| Cu | 0,30 |
| Co | 0,02 |
| Cd | 0,0041 |
| Pb | 0,0001 |
| As | 0,00005 |
| Sb | 0,00005 |
| Fe2O3 | <1,0 |
[0014] Частицы исходного сидерита обычно характеризуются размерами 100 меш (приблизительно 150 микрометров), имеют светло-коричневый цвет и не образуют суспензии в водных или щелочных растворах, если только не используется перемешивание. При образовании суспензии в щелочных растворах при комнатной температуре, частицы сидерита устойчивы, поскольку их цвет остается тем же самым. Однако было обнаружено, что если частицы сидерита взвешены в щелочном растворе и также нагреты, по меньшей мере, до 40-50°C, то частицы постепенно темнеют, пока не станут черными. Если частицы будут удалены из щелочного раствора фильтрацией и вымыты с водой, то черный цвет частиц перейдет в коричневый.
[0015] Это доказывает, что карбонат железа в сидерите был преобразован в оксиды и/или гидроксиды железа (II), которые стабилизируются щелочным раствором. Оксид железа (II) представляет собой порошок черного цвета, который не растворим в воде, щелочи или спирте. Он также термодинамически неустойчив в воздухе при температурах ниже 575°C, и становится несоразмерным металлу и оксиду железа (III) (Fe3O4). Таким образом, оксиды железа (II) редко находятся в природе, поскольку они столь неустойчивы. Гидроксид железа (II) представляет собой порошок зеленого цвета (зеленая ржавчина), который часто кажется черным. Он не растворим в щелочи и очень неустойчив в воде, формируя FeOOH и H2 после реакции Шикорра. Важно отметить, что все формы гидроксидов железа (II) имеют различные атомные конфигурации; поэтому они могут иметь весьма разнообразные цветовые окраски. Хотя Fe3O4 также имеет темный цвет, это соединение устойчиво в воздухе и, таким образом, не представляет собой черные частицы, сформированные в предпочтительном варианте реализации. Хотя, в предпочтительном варианте реализации формируются оксиды и/или гидроксиды железа (II), предпочтительный вариант реализации может все же содержать некоторое количество карбоната железа (II), а также и другие соединения железа, включающие в себя соединения железа (III) (например закись железа) и/или смешанные оксиды, такие как Fe3O4.
[0016] В настоящее время предпочтительными щелочными растворами являются гидроксид калия (KOH), гидроксид натрия (NaOH) или гидроксид аммония (NH4OH). Для KOH, минимальная концентрация для реакции сидерита при 40-50°C в течение 10-20 минут составляет приблизительно 0,7М. Для его реакции и также абсорбции серы, предпочтительно иметь молярное отношение щелочи к железу, по меньшей мере, приблизительно 4:1, и более предпочтительно приблизительно от 4:1 и приблизительно до 6:1. Для других щелочных растворов, минимальная концентрация, температуры и молярные отношения могут быть отличными. Важно отметить, что когда использовался NaOH, не был необходим дополнительный нагрев для реакции сидерита, поскольку температура была поднята до 40-50°C в соответствии с экзотермической характеристикой концентрированного раствора NaOH.
[0017] Было обнаружено, что наноразмерные частицы устойчивого оксида и/или гидроксида железа (II) были особенно эффективны при удалении соединений серы, таких как H2S, из жидких и/или газообразных потоков. Конкретно, было установлено, что частицы имели загрузку серы, которая больше, чем 100% по весу железа. Это сравнивается с использованием плотно сжатого слоя отожженного сидерита, который обычно имеет загрузку серы приблизительно 10-20% от веса сорбента. Типичные каустические поглотители работают при низкой часовой объемной скорости жидкости (1-3 LHSV), чтобы иметь длительный контакт, в пределах 0,3-1 часов. В этом случае, система работала при более высоких объемных скоростях (20 LHSV), которые приводят ко времени контакта 0,05 часов, и при этом все еще происходит большая загрузка серы. В предпочтительном варианте реализации, система работала при комнатной температуре и атмосферном давлении, но дополнительное увеличение давления и температуры может улучшить процесс абсорбции. Возможности сорбента предпочтительного варианта реализации для работы при коротких временах контакта и окружающих температуры и давления, при одновременном обеспечении высокой загрузки серы, предоставляет существенное преимущество относительно типичных каустических скрубберов. Важно отметить, что время и площадь контакта могут быть значительно улучшены при использовании предпочтительной конструкции, обсуждаемой ниже.
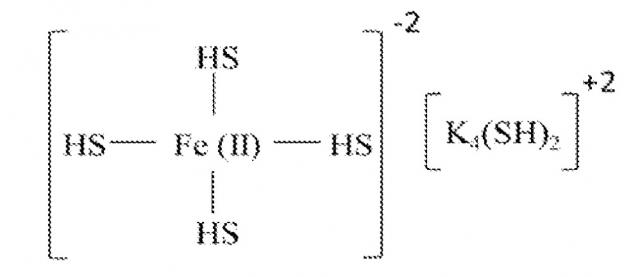
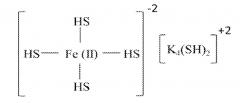
[0018] Не ограничиваясь рамками какой-либо теории, предполагается, что нижеследующая формула может объяснить особенно высокую абсорбцию H2S этими частицами:
Fe(CO3) + 6KOH → Fe(OH)4K4(OH)2 + K2CO3
K2CO3 + H2O → 2KOH + H2CO3
6KOH + 6H2S → 6KHS + 6H2O
Fe(OH)4K4(OH)2 + 6KHS → Fe(HS)4K4(HS)2 + 6KOH
Поскольку электронная конфигурация железа (II) - это 3d6, то он может удерживать до четырех HS- лигандов. Исходя из этой предложенной структуры, расчетная загрузка серой сорбента может быть приблизительно в 3,44 раза (344%) больше содержания железа по весу. Железо, до некоторой степени, может также реагировать с H2S непосредственно, образуя сульфид железа, как показано ниже:
mFeO/(Fe(ОН)2 + nH2S → lFeS + pH2O
где m, n, l и p могут быть любыми числами, которые балансируют уравнение. Разумно ожидать, что отработавший абсорбент может быть восстановлен различными методиками, такими как добавление каустики, нагревание, окисление, обдирка, реакция, и т.д. Отработавший абсорбент сульфида неопасен, поскольку он устойчив в присутствии кислорода при комнатной температуре и имеет конечное значение pH ниже 11.
[0019] В настоящее время предпочтительно, чтобы количество других потенциальных лигандов, таких как галогениды или мультидентатные лиганды, такие как хелатообразующие агенты, было бы минимизировано, или еще более предпочтительно - исключено в данном сорбенте. Железо является переходным металлом, который имеет способность формировать комплексы с различными координационными числами. В общем виде, число лигандов, с которыми переходной металл может связываться, - это 4, 5 или 6, причем 4 и 6 бывает наиболее часто. Для переходных металлов 4-го периода, таких как железо, предпочтительная форма, когда имеется 4 лиганда, это тетраэдрическая форма, и октаэдрическая - когда имеется 6 лигандов. Не ограничиваясь рамками какой-либо теории, в настоящем изобретении предполагается, что Fe+2 с 4-мя не спаренными электронами может связаться с четырьмя гидроксильными группами, когда имеется избыток каустики с pH фактором между 12 и 13. Как рассмотрено выше, эти гидроксильные группы, каждая, могут быть заменены HS- лигандами. Это косвенно поддерживается экспериментальными данными, показывающими 120%-ую и более загрузку серы по весу исходя из содержания железа. Эти не спаренные электроны могут рассматриваться как свободные узлы для связи с любым лигандом в суспензии. Присутствие солей, или других потенциальных лигандов в сорбенте, может занять, по меньшей мере, участок координационных узлов, которые можно было бы ожидать для значительного уменьшения способности сорбента удалять серу из флюида. Хотя молекулы воды также могут занимать координационный узел в растворе, такое взаимодействие слабее, чем взаимодействие с HS- лигандом и, таким образом, не считается вредным. Поэтому, в настоящее время считается предпочтительным иметь наименьшее количество примесей в растворе для способствованию обмену ОH- с HS-. По той же самой причине, в настоящее время не считается предпочтительным создание сорбента данного изобретения из солей железа, таких как хлорид железа (II), или, в другом случае, добавлять соединения, которые создавали бы лиганды в растворе, конкурирующие относительно координационных узлов.
[0020] Жидкий и/или газообразный поток может быть приведен в контакт с абсорбентом предпочтительного варианта реализации с помощью любого способа, известного в настоящее время или разработанного в будущем. Например, если поток находится в газообразной фазе, может быть использовано барботажное устройство для пропускания газа через щелочной раствор, в котором сорбент предпочтительного варианта реализации оказывается взвешенным. Этот катализатор может быть использован в периодическом и непрерывном реакторе с мешалкой, трубчатых проточных реакторах и проточных реакторах со слоем насадки, включающих в себя реакторы с любым типом течения (с основным потоком, с расщеплением потоков, с параллельным течением, с противоточном течением, и т.д.) и реакторы с любым типом конфигурации.
[0021] Схемное решение для одной предпочтительной системы, которая может быть использована для контакта абсорбента с жидким и/или газообразным потоком, содержащим H2S или другие соединения серы, показано на фиг.1. Система 10 составлена из статического реактора-смесителя 12. Сернистый жидкий и/или газообразный поток 14 и абсорбирующий поток 16 объединяются в реакторе-смесителе 12. По истечении достаточного времени контакта в реакторе-смесителе 12, поток проходит на сепаратор 18. Сепаратор 18 расщепляет поток на десульфурированный жидкий и/или газообразный поток 20, из которого соединения серы были удалены до требуемой или желаемой степени, и отработавший поток 22 сорбента. Отработавший поток 22 сорбента будет содержать и отработавший сорбент, и некоторый сорбент, который полностью не прореагировал с сернистым жидким и/или газообразным потоком в реакторе-смесителе 12. Отработавший поток 22 сорбента посылается в буферный резервуар 24. Насос 26 может быть использован для транспортировки потока отработавшего сорбента в резервуар 28 отработавшего сорбента или для повторного использования потока отработавшего сорбента - назад, на реактор-смеситель 12. Свежий сорбент также добавляется в реактор-смеситель 12, используя насос 30, из резервуара 32 хранения сорбента. Резервуар 32 хранения сорбента предпочтительно сконфигурирован с механизмом перемешивания, чтобы сохранять свежий абсорбент взвешенным в щелочном растворе.
[0022] В дополнение к удалению серы, процесс производства нового сорбента данного изобретения может также быть использован для производства устойчивого оксида и/или гидроксида железа (II) и для многочисленных других целей. Например, наночастицы железа устойчивого оксида и/или гидроксида железа (II) традиционно производятся из различных солей железа, таких как сульфаты и хлориды. Процесс, раскрытый здесь предоставляет альтернативный способ создания этих наночастиц железа, который более экономичен и позволяет производить продукты с меньшим количеством примесей (анионы). Эти частицы устойчивого оксида и/или гидроксида железа (II) могут быть использованы для различных применений, таких как производство магнетита (Fe3O4), который используется для магнитных носителей записи, таких как ленты или диски. Частицы устойчивого оксида и/или гидроксида железа (II) могут также использоваться для производства водорода, например, по реакции Шикорра, или в каталитических процессах, предполагающих гидрирование или дегидрогенизацию.
[0023] Кроме того, H2S высокой чистоты может быть восстановлен из отработавшего абсорбента с использованием различных методик, например, посредством добавления кислот, и использоваться для производства сернистых органических соединений. В той степени, в которой кислота, используемая в этом процессе, представляет собой серную кислоту, или другую сульфатную кислоту, другой получающийся продукт этой реакции будет сульфатом железа. Сульфат железа сам по себе может быть ценным продуктом для использования в удобрениях.
[0024] Изобретение может быть дополнительно понято посредством следующих примеров, которые предоставляются для иллюстрации, но не для ограничения изобретения.
Справочный пример 1
[0025] Контрольный раствор щелочи, составленный из 60 мл 1M раствора KOH, был введен в стеклянное барботажное устройство. Образец находился при комнатной температуре и атмосферном давлении. Поток в 20 стандартных кубических сантиметров в минуту (см3/мин) из 6000 частей на миллион (ppm) H2S в несущем азоте (N2) (6000 ppm H2S/N2) был пропущен через раствор каустика в барботажное устройство. Это соответствовало объемной скорости 20 LHSV. Выпускаемый газ анализировался газовым хроматографом (GC) для количественной оценки абсорбированного H2S. Холостой опыт выполнялся в течение 76 часов перед наблюдаемым прорывом H2S.
Пример 2
[0026] Один грамм сидерита (преимущественно FeCO3) был приведен в состояние суспензии перемешиванием в 60 мл 1М раствора KOH, используя магнитную мешалку, и нагревался до 40-50°C, пока цвет твердых частиц не изменялся от светло-коричневого до черного. Это занимало приблизительно 10-20 минут. После прекращения перемешивания, черные частицы осаждались на дне фляги, при наличии прозрачной жидкой фазы сверху. Из-за их магнитной природы, частицы также концентрировались вокруг стержня магнитной мешалки, когда они не перемешивались. Получающаяся суспензия была проанализирована с использованием просвечивающего электронного микроскопа, как показано на фиг.2. Это позволило заключить, что частицы имели в основном размеры в пределах 5-10 нанометров. Это свидетельствует, что большие частицы не только прореагировали до устойчивых оксидов и/или гидроксидов железа (II), но что они были также разъединены, образуя наночастицы железа.
[0027] Десять миллилитров получающейся суспензии были введены в стеклянное барботажное устройство, содержащее отработавший контрольный раствор каустики из Примера 1, и 6000 ppm H2S/N2 были пропущены через суспензию в соответствии с процедурой, сформулированной в Справочном примере 1. Не было заметно пика GC, связанного с H2S, в течение 20 часов - временная точка прорыва H2S. Таким образом, все 6000 ppm H2S были полностью удалены из потока в течение 20 часов (0,21 грамма серы). После 20 часов подвергания действию потока H2S образца сорбента в барботажном устройстве обнаруживалась твердая фаза на дне и прозрачная серовато-желтая жидкая фаза сверху. Черные твердые частицы были все еще сильно магнитными. Предполагая линейную корреляцию между временем до прорыва и молями KOH из Примера 1, если удаление H2S базируется исключительно на количестве KOH в образце Примера 2 (0,173 моля), то образец ожидаемо выдерживался только 12 часов до прорыва. Однако образец Примера 2, который включал в себя абсорбент данного изобретения, фактически выдерживался в течение 20 часов перед прорывом. Таким образом, Пример 2 показал существенное улучшение удаления серы относительно контрольного каустика, используемого в Примере 1.
[0028] Значение pH фактора для щелочного раствора в Примере 2 было измерено до и после добавления одного грамма сидерита. Оба значения pH были подобны - приблизительно 13. Это было подтверждено титрованием с HCl. Чтобы подтвердить потребление части KOH карбонатом железа из сидерита для формирования устойчивого оксида и/или гидроксида железа (II), больше сидерита было добавлено к щелочному раствору. В этом случае, когда концентрация сидерита увеличилась, различие pH фактора было большим, подтверждая то, что часть KOH была потреблена, чтобы сформировать устойчивый оксид и/или гидроксид железа (II). Важно отметить, что различие в pH факторе при добавлении одного грамма не было заметным из-за большого избытка KOH.
[0029] Жидкая фаза отработавшего катализатора была проанализирована в микроскопе. Наибольшая наблюдаемая частица имела размер 3 микрометра, однако большинство меньших частиц (в пределах нанометров) было ниже диапазона, который микроскоп мог измерить. Даже на наибольшем краю это означает, что исходные 150-микрометровые частицы были уменьшены в размере, по меньшей мере, в 50 раз.
[0030] Процентная загрузка серы сорбентом может быть вычислена следующим образом:
(грамм серы/грамм сорбента)×100% = ((20 см3/мин×(время в минутах)×(6,000/1,000,000)×32 г/моль)/(22,4 моль/л×1000×грамм сорбента))×100%
В типичной реакции, использующей плотные пакетированные слои формованного и отожженного сидерита, получающаяся загрузка серы на выходе должна быть между 10-20% (25-50%, исходя из содержания железа). Однако расчетная загрузка серы сорбентом, используемым в Примере 2, была между 120-300%, исходя из содержания железа. Эта загрузка серы определяется следующим образом: при добавлении 10 мл стабилизированного щелочью оксида и/или гидроксида железа (II), 0,0017 моля железа (0,066г) и 0,173 моля KOH были добавлены. Предполагая линейную корреляцию между временем прорыва и молями KOH из Примера 1, 0,173 моля KOH должны сохраняться в течение 12 часов. Это подразумевает, что железо абсорбировало H2S за 8 часов, показывая 120%-ую загрузку серы, основанную на содержании железа. Однако неизвестно, имеется ли линейная корреляция между временем прорыва и молями KOH. Поэтому рассматривая 20 часов абсорбции H2S сорбентом только, загрузка серы могла бы достигать 300%. Это значительно выше, чем было известно при использовании щелочного железа, так как в опубликованной в США заявке 20010005981, где сообщалось о значении загрузки серы между 14 и 90% (от 0,14 до 0,9 раз).
[0031] Кроме того, если нет перемешивания сорбента в стеклянном барботажном устройстве, часть черных твердых частиц падала на дно и не была непосредственно подвергнута потоку 6000 ppm H2S/N2. В результате фактическая масса сорбента, который реагировал в барботажном устройстве, могла быть намного меньше чем 0,165 грамма, с которых начиналось. Это может быть из-за присутствия твердой фазы, которая содержала черные частицы, все еще сильно магнитные. Это могло бы сделать загрузку серы еще выше, чем оцененное прежде значение.
Пример 3
[0032] Вторая добавка 10 мл сорбента, приготовленного тем же самым способом, как и сформулировано в Примере 2, была добавлена к отработавшему раствору каустика в барботажном устройстве после того, как выход был достигнут в Примере 2. Поток 6000 ppm H2S/N2 снова был пропущен через суспензию в соответствии с процедурой, сформулированной в Справочном примере 1, и система снова начала абсорбцию H2S. Важно отметить, что в этом случае временной ресурс сорбента составлял 10 часов до прорыва, что короче, чем первый раз. Следовательно, предполагается, что молярное отношение между OH- и Fe+2 должно предпочтительно быть, по меньшей мере, 4-6:1. Не претендуя на соответствие теории, в настоящее время предполагается, что это отношение вполне позволяет каустику преобразовать карбонат железа в сидерите в оксид/гидрооксид железа, а также стабилизировать его так, чтобы он мог затем абсорбировать H2S. Если отношение ниже, каустик может иметь возможность реагировать с сидеритом, но он не сможет иметь большой временной ресурс при абсорбции H2S. Кроме того, то, что щелочной раствор подвергался воздействию воздуха в течение нескольких дней между Примерами 2 и 3, возможно, также привело к сокращенному временному ресурсу сорбента, показанного в Примере 3. Не претендуя на соответствие теории, подвергание щелочного раствора воздействию воздуха в течение нескольких дней может привести к абсорбции CO2, образуя карбонаты калия, что снизит концентрацию OH-. Жидкая фаза отработавшего сорбента в Примерах 2 и 3 затем титровалась с HCl для количественной оценки содержания каустика в растворе. Во время титрования, производились газовые пузырьки и выпускались из жидкости. Газ был идентифицирован как H2S благодаря наличию запаха тухлого яйца. Кроме того, во время титрования, отработавший катализатор изменил цвет от светлого серовато-желтого до светлого зеленого. Это предполагает, что образовались хлориды железа (II) (FeCl2). Это предоставляет дополнительное свидетельство того, что начальный черный катализатор содержит соединения железа (II).
Пример 4
[0033] Как рассмотрено выше, когда устойчивый оксид и/или гидроксид железа (II) был подвергнут действию воды, цвет частицы изменялся спонтанно от черного до коричневого. После реакции Schikorr, формируется Fe3O4, когда гидроксиды Fe(II) подвергаются действию воды. Для исследования абсорбционной способности этих соединений железа, 60 мл воды и 5 мл устойчивого оксида и/или гидроксида железа (II) в щелочном растворе на 1М, созданном в соответствии с Примером 2, были добавлены в барботажное устройство. Затем поток 20 см3/мин 6000 ppm H2S/N2, был подан в барботажное устройство, и образец выдерживался приблизительно в течение 6 часов до того, как выход H2S был зарегистрирован в выпускаемом газе, используя GC. Значение pH фактора образца до абсорбции было 12,6, и 9,6 - после абсорбции. Цвет отработавшего образца в этом случае был зеленым и также имелся черный осадок на дне. В этом случае, снова предполагая линейную корреляцию между начальной концентрацией KOH и часами абсорбции, 5 мл 1М KOH ожидались как достаточные для 6 часов перед прорывом.
Поэтому, наночастицы Fe3O4 не казались обнаруживающими какую-либо абсорбционную способность для H2S. Важно учитывать, что нет доказательства относительно линейности корреляции между концентрацией KOH и временным ресурсом, и поэтому необходимо больше экспериментов, чтобы понять абсорбционную способность наночастиц Fe3O4. В настоящее время предполагается, что реакционная способность гидроксидов железа (II) к абсорбции серы намного выше, чем реакционная способность оксидов железа (II).
Пример 5
[0034] Пример 1 был повторен, но с использованием 20% (3,6M) раствора NaOH вместо KOH. Выпускаемый газ анализировался посредством GC для количественной оценки H2S, который был абсорбирован, как сформулировано в Примере 1. Важно отметить в этом случае, что в течении адсорбции H2S, малая растворимость солей натрия, таких как сульфид натрия (Na2S) и бисульфит натрия (NaHS), производились и накапливались на дне барботажного устройства, что делает этот рабочий процесс коммерчески неудобным. На Фиг.3 показано формирование и накопление солей в барботажном устройстве. После абсорбции приблизительно 7 грамм серы, которая продолжалась приблизительно 700 часов, весь раствор был преобразован в твердое вещество, что делало систему не действующей далее. Следовательно, другое преимущество сорбента данного изобретения заключается в том, что с данным соединением не так трудно работать.
[0035] Пример 2 был также повторен, используя NaOH вместо KOH для преобразования сидерита и абсорбции H2S. В этом случае, 7 граммов сидерита были добавлены к 60 мл водного раствора 20% (3,6M) NaOH при магнитном перемешивании, чтобы иметь молярное отношение каустика к железу приблизительно 6:1. После смешивания, черные частицы осаждались на дно фляги и собирались вокруг магнитного стержня. После того, как сидерит был преобразован в устойчивый оксид и/или гидроксид железа (II), он был введен в барботажное устройство, и поток 20 см3/мин из 6000 ppm H2S/N2 был подан, как описано в Примере 1. Выпускаемый газ анализировался посредством GC для количественной оценки H2S, который был абсорбирован, как сформулировано в Примере 1. В этом случае, после абсорбции также приблизительно выход 7 граммов серы за тот же самый период времени был зарегистрирован посредством GC. Отработавший сорбент имел другой вид относительно упомянутого выше контрольного образца. В этом случае, образец был, по меньшей мере, на 80% жидкость на выходе. Следовательно, другое преимущество сорбента данного изобретения заключается в том, что с данным соединением не так трудно работать.
[0036] В этом примере, сорбент данного изобретения, при стабилизации с NaOH вместо KOH, не приводил к увеличенной способности удаления серы по сравнению с контрольной каустикой NaOH. Однако сорбент данного изобретения действительно делает практичным удаление серы в коммерческом процессе. Контрольная каустика полностью отвердевает при удалении серы, что делает процесс не выполнимым в коммерческом масштабе. И напротив, сорбент данного изобретения оставался, по меньшей мере, на 80% жидкостью на выходе. Кроме того, в отличие от отработавшей каустики, отработавший материал, использующий сорбент данного изобретения, сохраняется, устойчив в воздухе, не опасен, и не имеет неприятного запаха. Отработавший сорбент также может быть легко использован для производства десорбированного сероводорода высокой чистоты для использования в химическом производстве с нефтеперерабатывающей специализацией. В процессе промышленного масштаба, контрольная каустика NaOH не может быть преобразована полностью в твердое вещество, как это сделано в данном Примере. Вместо этого было бы необходимо заменить каустику после того, как приблизительно 1-2 грамма серы были удалены, чтобы позволить продолжать ход процесса. И напротив, в варианте реализации сорбента данного изобретения, которое стабилизировано с NaOH, количество используемого сорбента все еще было бы пригодно для удаления всех 7 граммов серы в процессе промышленного масштаба. Таким образом, даже там, где теоретическая способность удаления серы приблизительно та же самая, сорбент данного изобретения все же предоставляет существенное преимущество относительно использования контрольной каустики NaOH, поскольку он не теряет существенный участок его теоретической способности удаления серы даже в масштабах промышленного процесса.
Справочный пример 6
[0037] В соответствии с принципами Патента США, Номер 7744841 и 7943105, порошкообразный сидерит был смешан со связующим и с водой для производства фасонных частиц. Конечный пр