Антиагрегантное средство
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к антиагрегантному средству. Антиагрегантное средство на основе полисахарида представляет собой олигохитозан с молекулярной массой 5 кДа или 10 кДа и степенью дезацетилирования 85%, полученный из хитозана краба путем его гидролиза сухим ферментным препаратом культуральной жидкости штамма мицелиального гриба Myceliophthora fergusii ВКМ F_3932D. Вышеописанное средство обладает высокой антиагрегантной активностью. 2 табл., 2 пр.
Реферат
Изобретение относится к области химико-фармацевтической промышленности, точнее, к веществам (на основе химически модифицированных природных источников) с антиагрегантной активностью.
Предшествующий уровень техники.
Для профилактики и лечения тромбозов, наряду с антикоагулянтными и фибринолитическими средствами используют и препараты, ингибирующие агрегацию тромбоцитов (антиагреганты или антитромбоцитарные средства). При развитии патологического процесса, активация тромбоцитов является основным фактором риска нарушений функционирования сердечно-сосудистой системы, что в результате приводит к тромбозам [Palur Ramkrishnan A.V. et al. Cardiovasc. Ther. 2017; 35(1):64-70.]. Антитромбоцитарная терапия входит в арсенал лекарственных средств для лечения заболеваний коронарных артерий или так называемой ишемической болезни сердца [Laine М. et al. World J Cardiol. 2016; 8(5):327-32].
Тромбоциты (небольшие, 2-4 мкм, безъядерные сферические кровяные пластины) играют центральную роль в остановке кровотечения в результате повреждения кровеносного сосуда и в развитии тромбоза [Heijnen Н., Van Der Sluijs P.J. Thromb. Haemost. 2015; 13:2141-2151]. В тромбоцитах есть несколько типов гранул: альфа (α) - гранулы, плотные гранулы и лизосомы. В результате взаимодействия с субэндотелиальными структурами в месте повреждения сосуда из гранул тромбоцитов высвобождается ряд активных соединений с проагрегантной активностью {тромбоксан А2, серотонин, аденозиндифос-фат (АДФ), тромбин}. Проагрегантный эффект этих соединений возрастает при некоторых патологических состояниях (диабет, гиперлипидемия, тромбоз коронарных артерий и т.д.), характеризующихся эндотелиальной дисфункцией, приводящей к снижению синтеза в сосудистой стенке вазодилятаторов и антиагрегантов [Osende J.I. et al. J. Thromb. Haemost. 2004. V2:492-498].
В α-гранулах хранятся адгезивные молекулы, такие как фактор фон Виллебранда и фибриноген, а также факторы роста, воспалительные и ангиогенные медиаторы, участвующие в воспалительных ответах и в появлении опухолей. АДФ хранится в плотных гранулах тромбоцитов, высвобождается после активации пластинок и ингибирует формирование циклического аденозинмонофосфата, активируя GPCRs (G protein coupled receptors) рецепторы тромбоцитов - P2Y1 и P2Y12. Активность других агонистов тромбоцитов в некоторой степени зависит от высвобождения АДФ [Offermanns S. et al. Nature. 1997; 389:183-186]. Конечный этап активации тромбоцитов - агрегация пластинок, вызванная перекрестным связыванием фибриногена с тромбоцитарным рецептором интегрином αIIbβ3 [Jackson S.P. Blood 2007; 109(12):5087-95].
Используемые в современной клинической практике антиагреганты в основном представлены синтетическими соединениями с разным механизмом действия (ингибиторы циклооксигеназы, антагонисты тромбоксановых рецепторов, антагонисты рецепторов P2Y12, ингибиторы фосфодиэстеразы, блокаторы рецепторов GP IIb/IIIа к фибриногену, антагонисты PAR рецепторов, агонист GLP1R (глюкагон подобный пептидный рецептор) [Eisen A. et al. JAMA Cardiol. 2016; 1(6):718-30; Tsoumani M.E. et al. Platelets. 2016; 27(8):812-820].
Ингибиторы АДФ-индуцированной агрегации тромбоцитов представлены тиено-пиридинами (ticlopidine, clopidogrel, prasugrel) и аналогами АДФ (ticagrelor и кангрелор [Keating G.M. Drugs. 2015; 75(12):1425-34]. Эти соединения являются антагонистами рецепторов тромбоцитов P2Y12 (ингибируют их активацию), а некоторые из них блокируют АДФ-индуцированное связывание фибриногена с мембранным гликопротеином IIb/IIIа.
Однако современные антитромбоцитарные лекарственные средства для профилактики и лечения инфаркта миокарда, ишемического инсульта и для лечения острого коронарного синдрома обладают рядом побочных эффектов: диспепсические расстройства, желудочно-кишечные кровотечения, поражение периферической нервной системы, аллергические реакции [Saeed О. Et al. Circ. Heart. Fail. 2016; 9(1):e002296; Liping Z. et al. Heart. Lung. Circ. 2015; 24(11):e180-3; Karkowski L. et al. Rev. Med. Interne. 2011.32(12):762-5]. A к аспирину и клопидогрелю наблюдаются случаи резистентности [Le Quellec S. et al. Thromb. Haemost. 2016; 116(4):638-50]. Эти обстоятельства ставят перед исследователями актуальную задачу поиска новых и безопасных средств, предназначенных для лечения и предупреждения тромботических поражений сосудов.
Некоторые полисахариды характеризуется широким спектром фармакологических эффектов и низкой токсичностью: пектины, альгинаты, фукоиданы, каррагинаны, ульваны, хитозаны [Barahonaa Т. et al. Bioactive Carbohydr. Diet. Fibre., 2014, 4, 125-138]. Ряд представленных соединений самостоятельно или опосредованно ингибируют активность ключевых факторов свертывающей системы крови [Tang L. et al. Int. J. Biol. Macromol. 2017; 94(Pt A):642-652; Xie J. et al. Crit. Rev. Food Sci. Nutr. 2016; 56 Suppl 1:S60-84]. Однако информация в отношении эффектов полисахаридов на процессы агрегации тромбоцитов противоречива. В одних случаях полисахариды показали проагрегантную активность [Gracher A. Et al. Carbohyd. Polym. 2016; 136:177-86.], в других, наоборот, демонстрировали антиагрегантные свойства [Souza R. et al. Carbohydr. Polym. 2015; 124:208-15; Sokolova E. et al. J. Biomed. Mater. Res. A. 2014; 102(5):1431-8; Wijesinghe W. et al. Carbohydr. Polym. 2012, 88, 13-20; Li B. et al. Molecules 2008, 13, 1671-1695; Prajapati V.D. et al. Carbohydr. Polym. 2014, 105, 97-112].
Zhu Z. и др. [Zhu Z. et al. Thromb Res 2010; 125:419-126.] показали, что фукоидан, выделенный из съедобной разновидности японской айвы (L. japonica), демонстрировал антитромбоцитарный эффект без антикоагулянтного; фукоиданы с большей молекулярной массой (Мм) 50 и 120 кДа ингибировали и агрегацию тромбоцитов, и коагуляцию плазмы.
Каррагинаны обладают антитромботическим действием, снижая скорость коллаген-индуцированной агрегации тромбоцитов и ингибируя адгезию пластинок, опосредованную коллагеновым рецептором тромбоцитов - гликопротеином VI. Антикоагулянтный эффект каррагинанов зависит от молекулярной массы и степени сульфатирования полисахарида [Соколова Е.В. "Взаимосвязь структуры и биологической активности каррагинанов красных водорослей Японского моря", автореф. канд. дис. май 2012, ФГБУН Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН]. В отличие от каппа-формы, лямбда- и йота-формы каррагенаны снижали индуцированную агрегацию тромбоцитов [Шокур О.А. и др. Тохоок. Мед. Ж. 2013, №2. С. 25-28].
Lassila R. и др. предполагают использовать для профилактики и лечения артериальных тромбозов композиции на основе подобных гепарину соединений; описанные композиции ингибируют индуцированную коллагеном агрегацию тромбоцитов в токе цельной крови [Patent US 8415324 В2, 2013; Inventors: Lassila R. et al.].
Композиции, содержащие мукополисахариды (состоящие из фрагментов сульфата дерматана, в которых остатки несульфатированной уроновой кислоты в процессе получения подвергались окислению периодной кислотой с разрывом углеродных связей при С2 и С3 атомах) и олигосахариды (получали деполимеризацией гепарина; Мм олигосахари-дов 3.5-1.0 кДа), показали антитромботическую и антитромбоцитарную активности. Одна из композиций ингибировала агрегацию тромбоцитов индуцированную коллагеном, ристоцетином и АДФ; гепарин в таких же условиях увеличивал АДФ-индуцированную агрегацию тромбоцитов [Patent WO 1990004607 А2, 1990; Inventors: G. Mascellani and P. Bianchini].
Олигосахарид [(M9G)2] из 20 моносахаридных единиц - сополимер, состоящий из маннопиранозных звеньев, соединенных β-D-(1→4) связью, и α-L-(1→4) глюкуроновых звеньев в соотношении 9:1 (40-60% карбоксильных функциональных групп при С2 атоме углерода эстерифицированы пропанолом, 2-пропанолом или метанолом и при С3 атоме углерода около 50% сульфатированы, таким образом общее количество органической серы в соединении составляло 7-13%) обладает антитромбоцитарной активностью. АДФ-индуцированная агрегация тромбоцитов после введения олигосахарида через рот крысам в дозах 250 и 500 мг/кг составила 36 и 43% [Patent US 5646130 А, 1997; Inventors: Guan Hua Shi].
S. Colliec-Jouault и др. выделяли фукан из Pheophyceae, а затем получали низкомолекулярный фукан с молекулярной массой (Мм) не >10 кДа. Внутривенное введение крысам низкомолекулярного фукана (в дозах 2,5 и 5 мг/кг) приводило к 35-40% ингибированию АДФ - индуцированной агрегации тромбоцитов [Patent US 6828307 B1l, 2004; Inventors: S. Colliec-Jouault et al.].
Полисахарид хитозан получают дезацетилированием глюкозаминогликана хитина. Хитин находят в экзоскелете ракообразных, кутикуле насекомых и клеточной стенке грибов. Хитозан - общий термин, используемый для описания линейных полисахаридов, состоящих из остатков глюкозамина и N-ацетил глюкозамина, связанных β (1→4) гликозидной связью и дезацетилированных больше чем на 50% [Хитозан. Под ред.: К.Г. Скрябина, С.Н. Михайлова, В.П. Варламова. М.: Центр Биоинженерия РАН, 2013. 593 С.ISBN 978-5-4253-0596-1].
Рядом авторов показано, что в зависимости от структурных параметров и источника сырья хитозан может обладать как проагрегантной активностью [Periayah М. et al. Int. J. Biol. Macromol. 2013, 52, 244-249; Lord M. et al. Biomaterials. 2011; 32(28):6655-62; Patent US 20130004474 A1, 2013; Inventors: W. Ouyang et al.; Chou TC et al. Biochem. Bio-phys. Res. Com. 2003; 302(3):480-3], так и антиагрегантной активностью. Полякова A.M. и др. показали, что инкубация тромбоцитов с хитозаном (структурные параметры не приведены) достоверно снижала степень их АДФ индуцированной агрегации всего на 11-18% [Полякова A.M. и др. Инфекц. болезни. 2005. Т. 3, №1. С. 44-47].
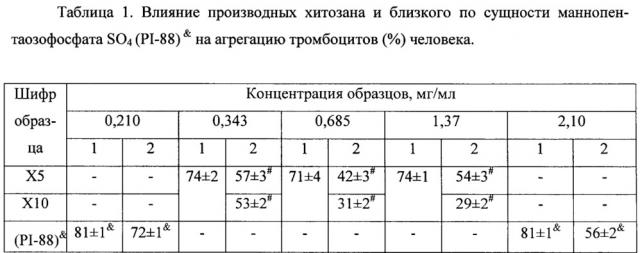
Наиболее близким по сущности и назначению к предлагаемому изобретению является сульфатированный олигосахарид (маннопентаозофосфат - SO4) с антитромботиче-ской активностью. Этот сахарид Cowden W. и Parish С. выделяли из дрожжей Pichia holstii [Patent US 6271215 B1 Aug.7 2001; Int. Cl. A61K 31/715; Sulfated oligosaccharides having anticoagulant/antithrombotic activity [Text]// Inventor W.B. Cowden, C.R. Parish // Appl. No.: US 09/380,899 Mar 11 1997; Assignee The Australian National University]. С помощью описанного в патенте метода авторы получили сульфатированный олигосахарид (общая формула олигосахарида может быть представлена как: R1-(Rx)n-R2, где R1, R2 и каждая Rx единица может быть представлена одним и тем же моносахаридным звеном либо различными, а соседние моносахаридные звенья связанными 1→2, 1→3, 1→4 и/или 1→6 гликозидными связями и число «n» может составлять от 1 до 6). В концентрациях 21, 210, 2100 мкг/мл маннопентаозофосфат - SO4 снижал АДФ-индуцированную агрегацию тромбоцитов человека до 74, 72 и 56%, соответственно.
Недостаток данного изобретения обусловлен невысокой величиной ингибиторной активности в отношении АДФ индуцированной агрегации тромбоцитов (снижалась на 30%). Кроме этого структура олигосахарида, отвечающая общей формуле, может быть представлена огромным набором олигосахаридов и разобраться какая из них ответственна за проявляемый биологический эффект является сложной задачей.
От прототипа заявляемое соединение отличается тем, что предлагаемое в нашей заявке соединение на основе олигохитозана в несколько раз эффективнее. Для достижения одинакового с сульфатом маннопентаозофосфата эффекта предлагаемого олигохитозана требуется в 3-6 раз меньше (таблица 1).
Целью изобретения является получение нового антиагрегантного средства на основе олигохитозана с Мм 5 кДа и 10 кДа и степенью дезацетилирования (СД) 85%, которое может быть использовано для профилактики и лечения сердечно-сосудистых заболеваний.
Поставленная цель достигается получением соединения со свойствами ингибитора АДФ индуцированной агрегации тромбоцитов человека. Выявлена высокая способность олигохитозана (Мм 5 и 10 кДа, СД 85%) ингибировать АДФ индуцированную агрегацию тромбоцитов человека в диапазоне плазменных концентраций от 0,34 мг/мл до 1,37 мг/мл.
Техническим результатом предлагаемого изобретения является расширение ассортимента антитромбоцитарных средств на основе полисахаридов с увеличенной активностью и повышение ингибиторной активности в отношении агрегации тромбоцитов человека, индуцированной АДФ.
Указанный технический результат достигается тем, что согласно изобретению предложено антитромбоцитарное средство на основе олигохитозана с Мм 5 и 10 кДа, и СД 85%, полученного из хитозана краба с Мм 1000 кДа и СД 85% (производство ЗАО "Биопрогресс", Щелково, Россия) путем ферментативного гидролиза. Гидролиз хитозана краба для получения антитромбоцитарного средства осуществляли по методике, описанной в работе Хасановой Л.М. и др. [Хасанова Л.М. и др. Прикл. Биох. Микробиол. 2014. Т. 50, №4. С. 422-428]. В результате получали водорастворимые олигохитозаны с ММ 5 кДа (Х5) и 10 кДа (X10), СД 85%.
Для проведения процесса гидролиза с целью получения различающихся по молекулярной массе образцов хитозана использовали сухой ферментный препарат (ФП), полученный лиофильным высушиванием культуральной жидкости штамма мицелиального гриба Myceliophthora fergusii BKM F_3932D (Всероссийская коллекция микроорганизмов при ИБФМ им. Г.К. Скрябина РАН) [Патент РФ №2361915 2008, Синицын А.П. и др].
Степень дезацетилирования образцов хитозана определяли двумя методами - кондуктометрическим титрованием согласно методике, представленной в работе [Lim S. et al. Advan. Chitin Sci. / Eds. M.G. Peter, A. Domard, R.A.A. Muzzarelli. Potsdam: University Potsdam, 2000. 454 p], и спектральным методом. Протонные спектры хитозана регистрировали на спектрометре Bruker АМХ 400 (Германия) с рабочей частотой по протону 400 МГц, при температуре 32°С. Образцы приготовлены в DC1. В качестве стандарта использовали 4,4-диметил-4-силапентансульфоновую кислоту.
Молекулярно массовые характеристики образцов хитозана определяли методом ВЭЖХ на приборе "Sykam", (Германия) с использованием колонки (7.8×300 мм) Ultrahydrogel 500 "Waters", (США) и предколонки GFC_4000 (5×2 мм) "Phenomenex", (США). В качестве элюента использовали 0.05 М уксусную кислоту с 0.15 М ацетатом аммония, рН5.1 [Лопатин С.А. Рыбная промышленность. 2010. №2. С. 82-85]. В качестве детектора использовали рефрактометр RI Detector К_2301. Данные обрабатывали с помощью программы "Мультихром" (Россия) версия 1.6 (© 1993-2001 Ampersand Ltd.).
Эксперименты по исследованию антиагрегационной способности соединений были выполнены с использованием венозной крови здоровых доноров, которую получали путем пункции кубитальной вены и стабилизировали 3,8%-ным раствором цитрата натрия в соотношении 9:1. Для приготовления богатой тромбоцитами плазмы кровь центрифугировали в течение 10 минут при 1000 об/мин, после чего верхний слой плазмы переносили в другую пробирку, а остаток повторно центрифугировали в течение 20 минут при 3000 об/мин для получения плазмы, бедной тромбоцитами. Агрегацию тромбоцитов исследовали на агрегометре фирмы Chrono-Log (Pensilvania, USA, Model 500) по методу G.Born [Born G.V. Nature. 1962. V. 194. №5. P. 927-929]. С этой целью в кювету прибора помещали 300 мкл богатой тромбоцитами плазмы. В качестве индуктора агрегации использовали раствор динатриевой соли аденозин-5'-дифосфата (АДФ; «Sigma-Aldrich»). Богатую тромбоцитами плазму человека инкубировали с исследуемыми соединениями или с буфером (0.05 М трис-HCl буфером, рН 7.4, содержащим 0.175 М NaCl), затем вносили АДФ (конечная концентрация 2⋅10-5 М). Агрегацию тромбоцитов определяли в течение 5 мин. Оптическим контролем служил такой же объем плазмы, не содержащей тромбоцитов (пропускание света бедной тромбоцитами плазмы принимали за 100%). О степени агрегации судили по максимальной величине пропускания света в кювете с богатой тромбоцитами плазмой после окончания реакции агрегации тромбоцитов. На агрегатограмме (кривой агрегации тромбоцитов) определяли максимальную амплитуду кривой агрегации (в %) и угол наклона кривой агрегации (отн. ед./мин), отражающий скорость развития агрегации тромбоцитов. Статистический анализ полученных данных проводили в соответствии с общепринятыми методами вариационной статистики с использованием критерия Манна - Уитни и программы Биостатистика.
Изобретение поясняется следующими примерами.
Пример 1. Образец хитозана X10 с Мм 10 кДа, СД 85% и индексом полидисперсности (ИП) 2.1 был получен ферментативной деполимеризацией хитозана краба с Мм 1000 кДа и СД 85% производства ЗАО "Биопрогресс" (Щелково, Россия). Условия получения: 1,0 г хитозана (Мм 1000 кДа, СД 85%) растворяли в течение 2 ч в 40 мл раствора 1М СН3СООН при перемешивании, затем добавляли 116 мл воды (рН 3,8). Полученный раствор хитозана подщелачивали раствором 1М NaOH до рН 5,4-5,6 (44 мл), термостати-ровали при 37±1°С, после чего добавляли 20 мг ФП (1 мг ФП содержал 0,063 мг белка). Соотношение фермент-субстрат составило 1/800. Гидролиз проводили в течение 2 часов. Ферментативную реакцию останавливали резким смещением значений рН до 8.5-9.5 с использованием раствора NH4OH (12%). Образовавшуюся суспензию продуктов реакции центрифугировали (5000 об/мин, 30 мин), осадок ресуспендировали в воде, диализовали против воды с трехкратной сменой. В качестве диализной трубки использовали полупроницаемую мембрану из регенерированной целлюлозы (25×16 мм, Мм=3.5 кДа). Раствор из диализной трубки лиофильно высушивали. Выход образца хитозана X10 составлял 50%.
Для получения образца хитозана Х5 с ММ 5 кДа, СД 85% и ИП 2.1 использовали методику ферментативного гидролиза, описанную выше, отличающуюся продолжительностью гидролиза. Время процесса составляло 6 ч. Выход лиофильно высушенного образца 25%.
Пример 2. Оценка антиагрегантной активности производных хитозана.
Эксперименты проводили следующим образом: в кювету, содержащую 300 мкл богатой тромбоцитами плазмы, добавляли 33 мкл раствора (растворитель - 0.05 М трис-НСl буфер, рН 7.4, содержащий 0.175 М NaCl) исследуемого соединения Х5 с Мм 5 кДа, СД 85% или X10 с Мм 10 кДа, СД 85% (конечная концентрация 0.343-1,37 мг/мл) и инкубировали полученную смесь в течение 5 мин при температуре 37°С. Процесс агрегации тромбоцитов индуцировали, добавляя 33 мкл раствора АФД (Sigma) в конечной концентрации 2⋅10-5 М (проведение опыта в последовательности "образец + плазма > инкубация + АДФ). В контрольных опытах богатую тромбоцитами плазму предварительно инкубировали с растворителем для исследуемого образца (0.05 М трис-HCl буфером, рН 7.4, содержащим 0.175 М NaCl) и после этого вносили индуктор агрегации тромбоцитов (проведение опыта в последовательности "буфер + плазма > инкубация + АДФ"), либо предварительно инкубировали богатую тромбоцитами плазму с раствором образца, а затем, вместо АДФ добавляли буфер (проведение опыта в последовательности "образец + плазма > инкубация + буфер").
При инкубации плазмы с образцами Х5 и X10 в концентрациях 0,343, 0,685 и 1,37 мг/мл отмечали достоверное снижение АДФ-индуцированной агрегации тромбоцитов до 56,58±3,02%, 41,67±3,39%, 54,38±2,73% и до 53,25±2,09%, 30,75±1,48%, 29,40±1,70%, соответственно (табл. 1), в сравнении с контролями. На кривой агрегации тромбоцитов наблюдали и достоверное снижение, в сравнении с контролем, скорости развития процесса (табл. 2).
Таким образом, олигохитозан с Мм 10 кДа в концентрации 1,37 мг/ мл снижал АДФ-индуцированную агрегацию тромбоцитов на 60%, а олигохитозан с ММ 5 кДа на 41% снижал АДФ-индуцированную агрегацию тромбоцитов в концентрации 0,685 мг/мл.
Примечание 1: Агрегация тромбоцитов при проведении опыта в последовательности "образец + плазма > инкубация + буфер": для 4* - 5,5±1,3%; для 5* - 0,25±0,17%;
1 - проведение опыта в последовательности "буфер + плазма > инкубация + АДФ;
2 - проведение опыта в последовательности "образец + плазма > инкубация + АДФ; # - р<0,05 - достоверность различий с показаниями в столбце 1; n=6.
Примечание 2: & - PI-88 (маннопентаозофосфат SO4) из патента US 6271215 B1 Aug.7 2001; Int. Cl. A61K 31/715; Sulfated oligosaccharides having anticoagu-lant/antithrombotic activity [Text]// Inventor W.B. Cowden, C.R. Parish // Appl. No.: US 09/380,899 Mar 11 1997; Assignee The Australian National University.
Примечание: Наклон кривой агрегации тромбоцитов при проведении опыта в последовательности "образец + плазма > инкубация + буфер": для Х5 - 3,67±1,86 отн. ед./мин; для Х10 - 2,50±0,72 отн. ед. / мин; проведение опыта в последовательности "буфер + плазма > инкубация + АДФ;
2 - проведение опыта в последовательности "образец + плазма > инкубация + АДФ; # - р<0,05 - достоверность различий с показаниями в столбце
Антиагрегантное средство на основе полисахарида, отличающееся тем, что оно представляет собой олигохитозан с молекулярной массой 5 кДа или 10 кДа и степенью дезацетилирования 85%, полученный из хитозана краба путем его гидролиза сухим ферментным препаратом культуральной жидкости штамма мицелиального гриба Myceliophthora fergusii BKM F_3932D.