Биомедицинский клеточный препарат
Иллюстрации
Показать всеИзобретение относится к медицине и касается биомедицинского клеточного препарата (БМПК), содержащего криоконсервированный антиген CD34+ после размораживания. БМПК содержит линии аллогенных гемопоэтических стволовых клеток CD133+, ко-экспрессирующих поверхностные маркеры стволовых клеток: CD34+, CD38+, и CD34+, ко-экспрессирующих CD38+, CD117+, которые составляют 2% клеточной массы БМКП, и дополнительно содержит лейкоконцентрат аутологичных мобилизованных мононуклеарных клеток человека, причем названные компоненты смешаны с биологически стабильной стерильной средой, при конечной концентрации клеток линии CD34+ и CD133+ (40÷100)⋅106 клеток/мл раствора. В качестве биологически стабильной стерильной среды использован 0,9% физиологический раствор натрия хлорида или гетерогенный биодеградируемый полимерный матрикс в необходимом количестве. Изобретение может быть использовано для протеом-основанной персонифицированной терапии первичных и метастатических опухолей головного мозга и востребовано в терапии ряда неврологических заболеваний. 1 з.п. ф-лы, 5 ил., 2 пр.
Реферат
Изобретение относится к получению биомедицинского клеточного препарата (БМКП) гемопоэтических стволовых клеток и может быть использовано для протеом-основанной персонифицированной терапии первичных и метастатических опухолей головного мозга и востребован в терапии ряда неврологических заболеваний.
Известен клеточный препарат, содержащий аутологичные гемопоэтические стволовых клетки экспрессирующие антиген SV40 (см. RU №2216336, МПК А61K 35/48, А61Р 25/00, 2003).
Недостаток этого решения - использование стволовых клеток, изъятых у пациента при пункции костного мозга, что является травматичным для пациента и достаточно трудным для медперсонала.
Известен также биомедицинский клеточный препарат (БМКП), содержащий криоконсервированный антиген CD34+ после размораживания (см. RU №2283119, МПК А61K 35/14, А61Р 25/00, 2006).
Биомедицинский клеточный препарат предназначен для лечения травматической болезни центральной нервной системы и не может быть использован для протеом-основанной персонифицированной терапии первичных и метастатических опухолей головного мозга.
Задачей, на решение которой направлено предлагаемое техническое решение, является обеспечение возможности использования биомедицинского клеточного препарата для протеом-основанной персонифицированной терапии первичных и метастатических опухолей головного мозга.
Технический результат, получаемый при решении поставленной задачи, выражается в обеспечении возможности использования биомедицинского клеточного препарата для протеом-основанной персонифицированной терапии первичных и метастатических опухолей головного мозга и возможности использования препарата в терапии ряда неврологических заболеваний.
Поставленная задача решается тем, что биомедицинский клеточный препарат, содержащий криоконсервированный антиген CD34+ после размораживания, отличается тем, что он содержит линии аллогенных гемопоэтических стволовых клеток CD133+, ко-экспрессирующих поверхностные маркеры стволовых клеток: CD34+, CD38+, и CD34+, ко-экспрессирующих CD38+, CD117+, которые составляют 2% клеточной массы БМКП, и дополнительно содержит лейкоконцентрат аутологичных мобилизованных мононуклеарных клеток человека, причем названные компоненты смешаны с биологически стабильной стерильной средой, при конечной концентрации клеток линии CD34+ и CD133+ (40÷100)⋅106 клеток/мл раствора, и в качестве биологически стабильной стерильной среды использован 0,9% физиологический раствор натрия хлорида или гетерогенный биодеградируемый полимерный матрикс в необходимом количестве. Кроме того, аутологичные мобилизованные мононуклеарные клетки лейкоконцентрата очищены в градиенте плотности фикола.
Сопоставительный анализ признаков заявленного решения с признаками прототипа и аналогов свидетельствует о соответствии заявленного решения критерию «новизна».
Совокупность признаков формулы изобретения обеспечивает решение поставленной задачи, при этом признаки отличительной части формулы изобретения решают следующие функциональные задачи:
Признак, указывающий, что БМКП «содержит линии аллогенных гемопоэтических стволовых клеток CD133+, ко-экспрессирующих поверхностные маркеры стволовых клеток: CD34+, CD38+, и CD34+, ко-экспрессирующих CD38+, CD117+», обеспечивает повышение эффективности восстановления нарушенного гемопоэза после химиотерапии или лучевой терапии при трансплантации костного мозга у онкологических больных, т.к. в чистом виде эти клетки не приживались в костном мозге реципиента и чистая культура клеток ГСК CD34+ была не способна обеспечивать восстановление поврежденного гемопоэза.
Признак, указывающий, что ГСК составляет «2% клеточной массы БМКП», обеспечивает терапевтическую эффективность препарата, при исключении опасности интенсификации процесса онкогенеза.
Признак, указывающий, что БМКП «дополнительно содержит лейкоконцентрат аутологичных мобилизованных мононуклеарных клеток человека», обеспечивает сбалансированность и эффективность терапевтической композиции основных компонентов биомедицинского клеточного препарата, причем использование аутологичных мобилизованных мононуклеарных клеток человека» повышает эффективность противоопухолевого эффекта биопрепарата.
Признак, указывающий, что компоненты БМКП смешаны «с биологически стабильной стерильной средой, при конечной концентрации клеток линии CD34+ и CD133+ (40÷100)⋅106 клеток/мл раствора» обеспечивает терапевтическую эффективность препарата.
Признак, указывающий, что «в качестве биологически стабильной стерильной среды использован 0,9% физиологический раствор натрия хлорида или гетерогенный биодеградируемый полимерный матрикс в необходимом количестве», конкретизируют возможный состав эффективной биологически стабильной стерильной среды.
Признак, указывающий, что аутологичные мобилизованные мононуклеарные клетки лейкоконцентрата очищены в градиенте плотности фикола», повышает эффективность противоопухолевой терапии.
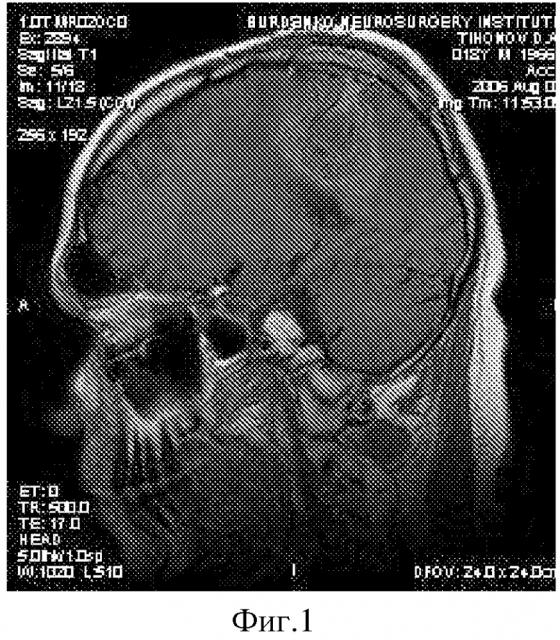
Заявленное изобретение иллюстрируется графическими материалами, где на фиг. 1 - фиг. 3 показана динамика МРТ пациента Г. с глиобластомой после лечения ППОП, при этом на фиг. 1 показана МРТ головного мозга, август 2006 г.; на фиг. 2 показана МРТ головного мозга, ноябрь 2006 г.; на фиг. 3 показана МРТ головного мозга, август 2007 г.; на фиг. 4 - фиг. 5 показана динамика PET сканирования головного мозга больного Г. с РФП 11C-metionin (все позитивные), при этом на фиг. 4 показана ПЭТ головного мозга в июле 2007 г.; на фиг. 5 показана ПЭТ головного мозга в январе 2009 г.
Заявленный биомедицинский клеточный препарат получают следующим образом.
Клеточный препарат изготавливают ex tempore путем смешивания в стерильных условиях размороженных клеток линии ГСК (CD34+) полученными из тканей костного мозга или лейкоконцентрата (ЛК) периферической крови (ПК) донора (компонент А), размороженного на водяной бане и отмытого от ДМСО криоконсервированного ЛК ПК пациента с мобилизованными собственными ГСК (компонент Б) с 0,9% физиологическим раствором NaCl (ФР) или (и) гетерогенным биополимерным матриксом (ГБПМ) (компонент В).
Соотношение компонентов в одной биодозе БМКП (А:Б:В) объемом не более 2-х мл составляет: компонент А - 4,5×105 - 1,5×106 клеток линии донорских ГСК (CD34+), совместимых по группе крови и иммунофенотипу с пациентом, компонент Б - 6,25×105 - 1×106 CD34+ мононуклеарных клеток (МНК) аутологичного ЛК ПК с содержанием собственных мобилизованных ГСК (СD34+) от 1 до 2% (6,25х103 - 1х104 CD34+ ГСК), компонент В - 2-3 мл ФР или с 1-2 мл ГБПМ (Г) до нужного количества (Quantum satis).
ГСК выделяют из свежего донорского биоматериала костного мозга (БКМ) или ЛК ПК с использованием технологии иммуносепарации в магнитном поле (Miltenyi Biotec, Germany), с помощью которой выделяют обогащенную суспензию клеток CD133+ и CD34+. В дальнейшем в течение 7-9 суток наращивают количество ГСК в 10-20 раз путем культивирования выделенных ГСК в среде, блокирующей их дифференцировку, отмывают 2-кратным центрифугированием с 0,9% ФРНХ от культуральной жидкости, делят на аликвоты по 1х106 ГСК и криоконсервируют и хранят при –196 °С.
ЛК ПК донора и пациента производят путем лейкоцитофереза с использованием подкожного введения Г-КСФ в течение 4-х дней. Аллогенный БКМ получают во время операции, проводимой под спинальной или эпидуральной анестезией путем трепанбиопсии костного мозга из грудины и подвздошных костей биосовместимого донора. В последующем из БКМ или ЛК ПК методом градиентного центрифугирования фракционируют общую массу клеток, получают суспензию мононуклеарных клеток, проводят анализ количества клеточных элементов, содержащихся в них, и иммунофенотипирование ГСК, стандартизацию и сертификацию полученного ЛК, криоконсервируют в жидком азоте с ДМСО в программном замораживателе и хранят при температуре – 196 °С.
Получение и криоконсервация компонента «А» БМКП.
Основной проблемой культивирования высокопластичных недифференцированных стволовых клеток (СК) с маркерами CD34+CD133+Lin- является их быстрый выход в дифференцировку, т.к. необходимо накопление, увеличение количества этих клеток без развития колоний дифференцированных клеток, при этом способность к последующей дифференцировке у таких культивируемых клеток должна быть сохранена по возможности в первоначальном виде. Ключевой задачей создания этого компонента является метод увеличения количества гемопоэтических недифференцированных стволовых клеток (СК) пациента ex vivo путем их выделения из крови или костного мозга пациента и культивирования в ростовой среде, содержащей смесь цитокинов, состоящей из фактора роста СК (SCF), лиганда тирозин киназы 3 из фетальной печени (Flt3L) и тромбопоэтина (ТРО), при этом указанная выше смесь цитокинов дополнительно содержит иономицин при следующем соотношении компонентов: SCF (50-150)·103 нг, ТРО (50-150)·103 нг, Flt3L (10-50)·103 нг, Иономицин (10-100)·103 нг на 1 мл ростовой среды.
Иономицин использован в качестве стимулирующего агента роста недифференцированных стволовых клеток в условиях ех vivo. Фактор роста СК (SCF) стимулирует пролиферацию СК, взаимодействуя со специфическим рецептором (протоонкогенный c-kit), обладающим тирозин-киназной активностью, индуцирует активацию киназы и трансфосфорилирование цепей рецептора. Flt3-лиганд (Flt3L) стимулирует пролиферацию гемопоэтических СК как и SCF. Flt3 представляет собой III класс рецептора тирозин киназы, экспрессированного на ранних предшественниках гемопоэтических СК. Тромбопоэтин (ТРО) - это гликопротеиновый гормон, который регулирует продукцию тромбоцитов стволовыми клетками костного мозга. В суспензионной культуре ТРО в комбинации с SCF стимулирует пролиферацию мультипотентных СК и повышает их количество.
Таким образом, ГСК человека выделяют из аллогенного костного мозга или мобилизованной периферической крови, или как вариант из крови, выделенной из пуповинной вены. Методом фракционирования в градиенте фикола из общей массы клеток получают суспензию мононуклеарных клеток, из которых выделяют обогащенную суспензию клеток CD133+ и CD34+. Полученную суспензию культивируют в среде Dulbecco M (IMDM) с добавлением инсулина и трансферрина, а также фактора роста стволовых клеток (SCF), лиганда тирозин киназы 3 из фетальной печени (Flt3L), тромбопоэтина (ТРО) и иономицина (Са2+ ionophore). Через 7-10 дней культивирования в выращенной клеточной суспензии содержится 80-92% клеток CD34+. Методика позволяет за короткий период времени вырастить 10-15-кратно увеличенное количество низкодифференцированных ГСК, которые могут быть использованы как компонент А биопрепарата.
Выделение и культивирование CD34+. Все процедуры проводятся в ламинарных шкафах класса II, расположенных в стерильном блоке с подачей воздуха по регламенту GMP, с использованием стерильной одноразовой пластиковой посуды и стерильных реагентов.
1. Транспортировку мешков с клетками костного мозга, мобилизованной крови или пуповинной крови осуществляют в термоконтейнерах ТермоКонт при комнатной температуре (18-25°С).
2. Забор клеток из мешка с мобилизованной кровью производят в ламинарном шкафу класса II, расположенном в стерильном блоке.
2.1. Клеточную взвесь забирают шприцем, прокалывая мембрану соединительной трубочки на мешке.
3. Получение фракции мононуклеарных клеток (МНК): клеточную взвесь, взятую шприцем, разводят в соотношении 1:4 фосфатным буферным раствором (PBS) без ионов кальция и магния (PBS Ca2+Mg2+ free) и затем наслаивают на градиентный раствор (d=1,077 г/мл, MP Biomedicals) в 50 мл пробирках.
3.1. Пробирки центрифугируют при 400g в течение 30 мин при 20°С.
3.2. В результате градиентного центрифугирования эритроциты и гранулоциты опускаются на дно пробирки, а фракция мононуклеаров в виде плотного кольца концентрируется между двумя слоями, на поверхности градиента.
3.3. Фракцию МНК отбирают пипеткой, разводят в свежем PBS и три раза отмывают центрифугированием в течение 10 мин при 300g и температуре 10°С.
4. Подсчет клеток и фенотипический анализ мононуклеарной фракции.
4.1. Для определения количества живых МНК к 20 мкл клеточной суспензии добавляют 20 мкл трипанового синего (Gibco). Подсчет клеток производят в гемоцитометре, пропорция живых клеток не должна быть ниже 95%.
4.2. Для оценки количества клеток CD34+ и CD133+ мононуклеарной фракции 0,1 мл клеточной суспензии окрашивают соответствующими антителами и определяют пропорцию ГСК в исходной клеточной взвеси на приборе FACSCalibur (Beckton Dickinson).
Пример 1. Данные фенотипического анализа мононуклеарных клеток в одном показательном эксперименте, проведенном на клетках донорского костного мозга (А), мобилизованной крови (Б) и пуповинной крови (В). Пропорция клеток СD34+ донора составляла 0,9% в костном мозге (А), 0,4% в мобилизованной периферической крови (Б) и 0,7% в пуповинной крови (В). Ко-экспрессия маркеров CD133 и CD34 наблюдается в 0,7% общей взвеси МНК костного мозга в 0,3% МНК периферической мобилизованной крови и в 0,3% МНК пуповинной крови.
5. Сепарация клеток CD133+ или CD34+ на колонках в магнитном поле по методике производителя (Myltenyi Biotec, Germany).
5.1. 0,5⋅109 МНК суспендируют в объеме 2,5 мл буфера, содержащего 0,5% бычьего сывороточного альбумина и 5% раствора антикоагулянтного цитрата декстрозы в растворе PBS (ACD-A буфер).
5.2. В суспензию клеток добавляют 500 мкл реагента, блокирующего Fc рецептор, и инкубируют в течение 5 мин при 4°С.
5.3. Затем в суспензию добавляют 500 мкл коллоидальных суперпарамагнитных микрошариков, конъюгированных с моноклональным мышиным античеловеческим антителом АС133.1 или анти-CD34+, и инкубируют в течение 25 мин при 4°С.
5.4. После инкубации в клетки добавляют 10 мл ACD-A буфера и центрифугируют при 400 g в течение 10 мин при температуре 4°С.
5.5. Надосадочную жидкость удаляют и осадок ресуспензируют в 5 мл ACD-A буфера и наносят на охлажденную колонку для позитивной селекции, которая находится в магнитном поле.
5.6. Колонку четыре раза промывают 2 мл охлажденного буфера ACD-A, удаляют из магнитного поля и поршнем выдавливают клетки CD133+ или CD34+ в стерильную пробирку.
5.7. Селекцию на колонке повторяют и подсчитывают количество клеток. Часть клеток (0,1 мл) отбирают для фенотипирования.
6. Оценка чистоты клеточной суспензии после выделения СК из трех источников: костного мозга, мобилизованной периферической крови и пуповинной крови показала, что в среднем степень очистки клеток CD133+ костного мозга в магнитном поле составляла 88,1±0,9% (n12), в мобилизованной крови равнялась 87,2±4,0% (n18) и в пуповинной крови оценивалась как 76,1±2,8% (n22). Соответственно процентное содержание клеток CD34+ после сепарации клеток костного мозга в магнитном поле составило 98,9±1,1%, клеток мобилизованной крови - 96,1±2,8%, клеток пуповинной крови - 97,1±1,2%.
Пример 2. Данные другого показательного эксперимента, где был проведен фенотипический анализ выделенных в магнитном поле клеток CD133+ и CD34+ из МНК костного мозга, мобилизованной крови и пуповинной крови. Общее количество CD34+ клеток после магнитной селекции, выделенных из костного мозга, составило 95,3%, из периферической крови 98,4% и из пуповинной крови 98,3%. Пропорция клеток CD34+, которые ко-экспрессируют CD133+, в клетках костного мозга составила 92,1%, в клетках мобилизованной периферической крови - 87,2%, а в клетках пуповинной крови 72,8%.
7. Фенотипические характеристики клеток. Клетки CD133+ ко-экспрессируют поверхностные маркеры стволовых клеток: CD34+ (98,6%±0,9%), CD38+ (85,1±4,8%). Клетки CD34+ ко-экспрессируют CD+ (86,8±0,1%), CD38+ (90,8±5,2%), CD117+ (33,6%±0,3).
Культивирование.
Пример 1-3. Жидкая культуральная система состоит из среды Искова в модификации Дульбекко (Iscove's modified Dulbecco's Medium IMDM, Gibco, UK) с добавлением 0,5 г/л бычьего сывороточного альбумина (Sigma Aldrich), 0,39 мкг/мл человеческого инсулина и 60 мкг/мл трансферрина (Gibco). В культуральную среду добавляют фактор роста стволовых клеток SCF, другое название c-Kit-ligand (c-KitL, R&D Systems), в концентрации 100 нг/мл, а также Flt3-ligand (Flt3L) в концентрации 20 нг/мл, (R&D Systems) и иономицин (Sigma Aldrich) в концентрации 0.1 мкМ/мл.
Способ культивирования.
Пример 4-5. Клетки культивируют при 37°С во влажной атмосфере с притоком 5% CO2. Свежую среду и цитокины добавляют каждый третий день. Время культивирования составляет 5-7 дней. Использованные факторы роста способствуют пролиферации стволовых клеток, при этом не нужно добавлять агенты, подавляющие дифференцировку. Получаемые суспензии стволовых клеток любого индивидуума могут быть сохранены в замороженном виде либо могут быть введены в БМКП непосредственно после культивирования и применены больным.
Получение, стандартизация и криоконсервация компонента «Б» БМКП.
Процедуру условно разделяют на две части.
Мобилизация стволовых клеток в периферическую кровь.
Для увеличения количества СК в периферической крови донор или пациент получает 8 инъекций Г-КСФ подкожно с интервалом в 10-12 часов в течение 4 дней. В первые три дня доза препарата составляет 2,5 мкг/кг, в последний день доза удваивается. Ежедневно производят общий анализ крови и на 4-5 день делается УЗИ брюшной полости.
Сбор ГСК и клеток-предшественников гемопоэза.
Проводят на 5 день от начала стимуляции Г-КСФ на сепараторе крови СОВЕ-Spectra с использованием одноразовой системы для сепарации и стандартных растворов. Длительность процедуры 3-4 часа в зависимости от веса донора, параметров анализа крови и т.п. Процедура включает забор крови из одной вены, обработку ее внутри сепаратора, забор определенного объема стволовых клеток и возврат остальных компонентов крови донору через другую вену. Венозный доступ осуществляется путем пункции 2-х периферических вен или через 2-просветный центральный катетер, установленный в подключичную вену на время проведения сеанса. Средний объем собранного материала 300-400 мл. Его оценивают по общему количеству ядерных клеток (ЯК) в сепарате и по количеству СD34+ клеток на килограмм веса больного. ЯК в сепарате определяют подсчетом в камере Горяева до проведения каких-либо манипуляций. Процент СD34+ клеток в клеточной суспензии, полученной в ходе цитофереза, определяют методом проточной цитофлуориметрии.
Определение ГСК и клеток – прогениторов гемопоэза.
Установление субпопуляционного состава CD34+ клеток проводят цитофлуориметрически, с применением метода тройной метки (одновременная окраска клеток антителами к 3 разным антигенам, нагруженными различными флуорохромными красителями).
Cтандартизация компонента «А» препарата.
Определение количества клеток-предшественниц проводят цитофлуориметрически, в прямой реакции иммунофлуоресценции (РИФ).
Проводится метод двойной метки, с одновременным окрашиванием клеточного субстрата моноклональными антителами к антигену CD34 + как основному маркеру клеток пула АМКС ПГ и к молекуле CD45- лейкоцитарному антигену, определяющему ГСК. Это позволяет сразу рассчитать соотношение количества CD34+ клеток и всех ГСК (CD45+) в материале. Для оценки уровней неспецифического связывания часть клеток окрашивают изотипическими контролями. В качестве изотипических контролей стандартно применяются мышиные иммуноглобулины IgG1 изотипа (IgG1), меченные красителями, аналогичными метке используемых моноклональных антител (PE, FITC, PerCP).
Подготовка клеточных проб. Перед постановкой реакции клетки ПК и цитаферезного продукта освобождают от примеси эритроцитов стандартной процедурой лизиса и последующей отмывкой в ЗФР-БСА и центрифугированием (5 минут) при 1000g. ЗФР-БСА можно заменить средой Хенкса или 199.
С выделенными клетками проводят прямую РИФ в 96-луночном планшете, при этом для определения количества клеток в любом материале используется панель из 3-х лунок: неокрашенные клетки; клетки, окрашенные изотипическими контролями с меткой, соответствующей метке использованных моноклональных антител (МКА); клетки, окрашенные одновременно МКА к антигенам CD34 и CD45.
Для определения количества CD34+ клеток оптимальными являются антитела к антигену CD34 клона HPCA-2 (8G12), изотипа IgG1.
Таким образом, стандартная панель имеет вид:
контроль IgG1 PE+ контроль IgG1FITC;
контроль IgG1 PE+ МКА к CD45 FITC;
МКА к CD34 PE (HPCA-2) + МКА к CD45 FITC.
Постановка РИФ.
В лунки вносятся клетки в количестве не менее 500 000 на лунку.
Далее в каждую лунку вносят коктейль антител в соответствии с панелью и аккуратно ресуспендируют пипеткой. Каждое МКА берут в количестве 10 мкл на лунку, суммарный объем МКА в лунке – 20 мкл.
Клетки инкубируют с антителами в течение 30 минут при 4 °С (нижняя полка обычного холодильника).
По окончании времени инкубации клетки дважды отмывают от несвязавшихся антител путем центрифугирования в течение 10-20 минут при 300g.
Клетки переносят в специальные пластиковые пробирки для анализа на проточном цитометре.
Объем клеточной суспензии в каждой пробирке доводят до 200-500 мкл путем добавления к клеткам ЗФР-БСА.
Анализ должен быть осуществлен сразу после постановки реакции.
Анализ и запись на проточном цитофлуориметре.
Оценку реакции выполняют на проточном, 5-параметровом, цитометре. CD34+ клетки в периферической крови представляют собой малую клеточную популяцию. Даже в условиях предварительной стимуляции кроветворения максимальная доля данных клеток составляет 1.0-3.0%. Поэтому при их подсчете в каждой анализируемой пробе накапливают не менее 20.000 клеточных событий.
Сбор и анализ клеток осуществляется в гейте CD45+ клеток, который включает все гемопоэтические клетки. В данном контексте гейт подразумевает область накопления событий, ограниченную определенными параметрами. Подсчет абсолютного числа CD45+клеток в мкл крови и цитоконцентрата проводят на основании числа лейкоцитов в гемограмме на день исследования.
Криоконсервирование СК крови и клеток предшественников гемопоэза.
Традиционный метод криоконсервирования заключается в добавлении криопротектора к клеточной суспензии в конечной концентрации 10% и процедуры стандартного замораживания на 1 град./мин до – 80 °С или –120 °С с использованием стандартных программ электронного программного замораживателя и хранением в жидком азоте или его парах.
Выделяют периферические клетки-предшественники гемопоэза. Сепарированные клетки концентрируют путем центрифугирования при скорости вращения центрифуги 2000 оборотов в минуту в течение 10 мин при +18 °С. С помощью ручного плазмоэкстрактора из контейнера максимально удаляется плазма, клетки остаются в объеме 40-60 мл.
В качестве криопротектора кроветворных клеток используют высокоочищенный диметилсульфоксид (ДМСО). К полученным клеткам добавляют при постоянном перемешивании равный объем полиглюкина с ДМСО. Смешивание ДМСО с полиглюкином происходит по типу экзотермической реакции с выделением умеренного количества тепла. Концентрация ДМСО в полиглюкине — 10-12%. Таким образом, его конечная концентрация в замораживаемом материале составит 5-6%. Применение полиглюкина позволило снизить количество ДМСО вдвое, до 5-6% конечной концентрации, так как полиглюкин обладает следующими свойствами: во-первых, способностью дезагрегировать клетки и тем самым улучшать проникновение криофилактика в клетки, во-вторых, полиглюкин (6% декстран) сам по себе является криофилактиком.
На следующем этапе обязательно производят подсчет ядросодержащих клеток, а также CD 34+клеток, подлежащих заморозке.
Оптимальная концентрация замораживаемых клеток составляет 40-100х106 клеток в мл.
В зависимости от конечного объема замораживаемого материала выбирается количество полимерных ампул (20 - 25) для глубокого программного замораживания. Далее клеточную взвесь переводят в эти термостойкие пластиковые пробирки.
После завершения цикла программного электронного замораживания пробирки с замороженным материалом переносят в хранилище для длительного хранения. Затем пробирки с замораживаемым материалом помещают в пары жидкого азота при температуре –165°-170°С, где они будут находиться до использования.
Эта методика реализует основные требования, предъявляемые к биоматериалу, подвергнутому криоконсервированию, а именно: максимальное сохранение жизнеспособности стволовых клеток; минимальный объем (100-120 мл) замораживаемого материала при максимальном количестве содержащихся клеток (до 100х106/мл), для ПК минимальный объем 50-60 мл; минимальное количество объема аутотрансплантата.
Получение компонента «В» БМКП.
В качестве биологической стабильной стерильной среды для получения БМКП используют стерильный 0,9% раствор NaCl, приготовленный в заводских условиях в ампулах по 10 мл или стерильный раствор во флаконе объемом 200 или 400 мл. Этот тип биологически стабильной стерильной среды применяют при изготовлении БМКП для цитотранфузий. Для получения формы БМКП, предназначенной для имплантаций, применяют гетерогенный биодеградируемый полимерный матрикс (ГБДМ), например разработанный нами (см. RU № 2249462) биополимерный матрикс, являющийся официальным медицинским изделием и разрешенный к клиническому применению в РФ или его аналог.
Подготовка к применению и применение БМКП.
Подготовка БМКП к трансфузии и его применение.
Осуществляют размораживание компонентов А,Б и В непосредственно перед использованием на водяной бане при температуре 37-40°С до момента перехода замороженного материала в жидкую фазу. Далее каждый используемый компонент центрифугированием при 1500 об/мин осаждают на дно центрифужной пробирки, удаляют надосадочную жидкость и заливают 1 мл 0,9% физиологического раствора NaCl или трансфузируют в гетерогенный биополимерный коллагеновый матрикс. Процедуру повторяют дважды. Каждый компонент препарата в после разморозки пригоден для использования в течение 6 ч после приготовления, после чего он подлежит утилизации.
Внутривенная или внутриартериальная трансфузия БМКП.
Внутривенное или внутриартериальное введение БМКП производят стандартным медленным болюсным введением от одной до 20 биодоз.
Интратекальное введение БМКП.
Интратекальное введение препарата должно производиться только в условиях реанимационного отделения. Трансфузия препарата осуществляется через люмбальный прокол, выполненный в типичном месте (в L3-L4 промежутке) под местной анестезией 1% раствора лидокаина. Затем забирают 3 мл ликвора и смешивают с одной или 2-мя биодозами клеточного препарата (максимальный объем до 3 мл), ресуспензируют клеточный препарат в ликворе и медленно вводят в субарахноидальное пространство. Накладывают асептическую повязку. При необходимости повторяют интратекальные трансфузии препарата, но не ранее чем через 7 дней после цитотранфузии. Для коррекции возможных аллергических реакций с профилактической целью делается однократное внутримышечное введение кортикостероидных препаратов (4 мг дексаметазона).
Основными критериями эффективности проведенного вмешательства является улучшение клинической симптоматики. Срок ожидаемого результата крайне индивидуален для каждого пациента и зависит от объема повреждения органа, давности травмы, степени компенсации нарушенных функций. Эффективность терапии варьирует от 1-3 дней до 12-16 месяцев после трансфузии, и оценивается клиническими шкалами и электрофизиологическими методами исследования (ЭКГ, церебральным картированием ЭЭГ, транскраниальной магнитной стимуляцией, соматосенсорными вызванными потенциалами и электонейромиографией, а также комплексным уродинамическим исследованием и т.д.).
Возможные осложнения и способы их устранения.
Нами не выявлен ни один факт осложнения, связанного с инфузиями БМКП в кровь и ликвор пациентов, что связано с применением аутологичного биоматериала и иммуносовместимого аллогенного материала, подобранного по иммунофенотипу крови. Однако теоретически возможны аллергические реакции на криопрофилактик ДМСО в случае недостаточной его отмывки перед употреблением. Способы устранения подобных аллергических реакций являются стандартными. Для профилактики возможных аллергических реакций пациента на трансфузию препарата целесообразно за 20 минут до манипуляции произвести однократное внутримышечное введение препарата «Дексаметазон» в дозе 4 мг/мл. Наличие возможных осложнений данного метода заставляет проводить интратекальные и интравентрикулярные трансфузии только в условиях реанимации стационарного отделения.
Оценка эффективности и безопасности БМКП.
Выявлена высокая эффективность применения БМПК при реабилитации онкологических больных после лучевой и химиотерапии, а также применении у ослабленных и геронтологических пациентов. Экономическая эффективность применения БМКП пациентам по сравнению только аутологичных ГСК в лейкоконцентрате мобилизованных мононуклеаров костного мозга очевидна и не вызывает сомнения. Возвращение пациентов после повреждений головного и спинного мозга к нормальной общественно-социальной деятельности, реабилитация онкологических больных после лучевой и химиотерапии, улучшение качества жизни ослабленных и геронтологических больных, даже при небольшом улучшении качества их жизни несет в себе большую экономическую целесообразность и социальную обоснованность как с учетом возобновления трудовой деятельности, так и с учетом уменьшения затрат на длительное и малоэффективное фармакологическое лечение и только физическую реабилитацию. Иллюстрацией этого положения могут стать примеры экспериментального применения изобретения в клинике.
Пример 1. Больной Б., 82 года поступил 15.05.10 в стационар с диагнозом «Периферический рак левого легкого Т2 Мо Nо», где диагноз злокачественного онкологического заболевания был подтвержден данными клинического обследования и параклинического исследования. При лучевой диагностике: на рентгенограммах легких от 19.05.10 г. в S6 нижней доле левого легкого фокус уплотнения легочной ткани размером около 4 см диаметром, который в прямой проекции наслаивается на корень легкого. Увеличения лимфоузлов не определялось. Слева также определялась плевродиафрагмальная шварта. Ширина срединной тени на уровне передних отрезков 3 ребер 7,3 см, выпота в плевральных полостях нет. В правом легком без патологии, КТ легких 20.05.10 – в S6 левого легкого определяется опухолевый узел 3,5 см в диаметре с лучистыми контурами – КТ картина периферического рака S6, КТ головного мозга от 24.05.2010 - выраженные проявления сосудистой энцефалопатии. Метастатических очаговых изменений не выявлено. УЗИ органов брюшной полости от 20.05.2010 – диффузные изменения печени и поджелудочной железы, жировая инфильтрация. Парапельвикальные кисты почек. Атеросклероз брюшной аорты. Атеросклероз, окклюзия левой ВСА. Радиоизотопное исследование костной системы от 25.05.2010 - на обзорных сцинтиграммах определяются очаги гиперфиксации РПФ в области передних отрезков 5,6 ребер справа, проксимального отдела правой плечевой кости, более характерные для травматических изменений в области позвоночника, в крупных суставах определяются признаки грубых дистрофических изменений. В других отделах скелета без изменений. ПЭТ от 27.05.2010 г. накопление РФП в S6 сегменте левого легкого, в других отделах скелета накопления РФП не выявлено. 26.05.10 проведена бронхоскопия – опухолевой патологии не выявлено, получено 10 стекол аспирата из S6 слева, при цитологическом исследовании которого от 26.05.10 выявлена аденокарцинома, БДУ умеренно дифференцированная. Спирометрия от 10.05.2010. Умеренное снижение 1 ст. легочных объемов. Умеренные обструкции, выраженное (2 ст.) снижение резервов вентиляции. РЭА (Раковый Эмбриональный Антиген) 2.2 мкг/л. В 10.00 час 5.06.2010 г. больной взят в операционную для резекции опухолевого узла нижней доли левого легкого, где после проведения мультимодальной комбинированной анестезии у больного в стерильных условиях из правой подвздошной кости взят аспират костного мозга в объеме 5мл и помещен в стерильный вакутаймер. Произведена нижняя лобэктомия слева. Из удаленной доли левого легкого в операционной произведена резекция опухолевого узла в 11 час 10 мин. Также интраоперационно проведено цитологическое исследование ткани части доли удаленного легкого, при котором диагноз аденокарциномы легких подтвержден. Часть опухолевого узла легкого взята на иммунохимическое и гистологическое исследование, другая часть изъята для изготовления персонифицированного противоопухолевого препарата (ППОП). Больной удовлетворительно перенес циторедуктивную операцию и переведен в отделение реанимации в 13 часов 5.06.2010 г. Через 3 суток для дальнейшего лечения в удовлетворительном состоянии был переведен из отделения реанимации в хирургическое отделение. Перед операцией пациента у его практически здорового родного сына (гаплоиндентичного по HLA, 46 лет) была произведена мобилизация гемопоэтических стволовых клеток (ГСК) с использованием колониестимулирующего фактора препарата «Граноцит» в течение 4 дней и 3.06.2010 у него осуществлен сбор мобилизованных ГСК. Биоматериал из опухоли и костного мозга пациента был направлен в течение 2-х часов после забора у пациента в культуральную лабораторию для исследований, где опухолевая ткань легкого в дальнейшем была ресуспендирована трипсином на клетки и проведена идентификация раковых стволовых клеток с маркером СD133+ и их иммуномагнитосепарация из культуральной взвеси опухолевых клеток. Из эксфузата костного мозга пациента иммуносепарацией на магнитных шариках выделяли СК с маркером СD34+ и СD133+. Выделенные РСК из опухоли легких и гемопоэтические стволовые клетки (ГСК) из костного мозга культивировались и из них готовились лизаты с использованием раствора Lysis Buffer 16 (1х107 клеток/мл) с протеазными ингибиторами. В дальнейшем в лаборатории онкопротеомики ФГБУ РОНЦ РАМН проведена масс-спектроскопия лизатов здоровых ГСК и РСК выделенных из клеток аденокарциномы легких. Результаты протеомного анализа ГСК и РСК были оценены с позиций теории управления систем и было установлено количество подобных белков ко всем картированным белкам МСК и РСК, выделенных из аденокарциномы (всего 5,8%). Данные сравнительного протеомного анализа были переданы в Департамент информационных исследований специализированного вычислительного центра для проведения математического моделирования. Путем анализа полученной матрицы подобия белков были установлены ключевые белки в протемном профиле РСК. С учетом крайне высоких показателей ключевых белков (КБ) в протемном профиле гаплоидентичных ГСК сына пациента было решено применить для создания регуляторных клеточных систем метод инверсии показателей КБ. Был проведен полный транскриптомный анализ ГСК пациента и в базе данных компании Affimetrix (USA) найден комплекс веществ «фактор роста фибробластов и преднизолон», которые способны выступить в качестве химического ремоделирующего агента и максимально ингибировать экспрессию ключевых белков в траснкриптомном профиле донора, при экспозиции ГСК с ними. В результате обработки ГСК был модифицирован протемный профиль гаплоидентичных ГСК путем инверсии ключевых белков в нем. Кокультивирование культуры клеток опухоли легкого больного с протеом-модифицированными ГСК сына пациента показало эффективность подавления опухолевого роста за неделю на +++ по сравнению с контролем (ГСК пациента). Осуществлена стандартная процедура криоконсервации клеток ГСК пациента и его сына, а также РСК опухоли пациента. 27.06.2010 г. больной в удовлетворительном состоянии был выписан из стационара под динамическое наблюдение онколога по месту жительства. При амбулаторном обследовании у онколога по месту жительства было решено 29.06.2010 выполнить ПЭТ пациента на предмет оценки эффективности проведенной циторедуктивной терапии, при котором было выявлено стойкое накопление РФП в зоне операционного рубца, других очагов накопления РФП выявлено не было. Учитывая старческий возраст, нестабильность системной гемодинамики и его выраженную соматическую ослабленность, специалистами онкологами были выставлены противопоказания к применению лучевой и химиотерапии. Больной был включен в программу экспериментальной персонифицированной противоопухолевой терапии (ППОТ). Было начато проведение внутривенного введения протеом-модифицированных ГСК, полученных от сына пациента. Трансфузии этих клеточных систем проводили внутривенно каждые в 2-3 недели в дозе 5х106 клеток. Проведено 20 внутривенных трансфузий ППОП.
Применение технологии персонифицированного клеточного противоопухолевого препарата в л