Мягкая лекарственная форма
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой ранозаживляющий состав, включающий в качестве действующего вещества наночастицы, а в качестве основы - полиэтиленгликоли, отличающийся тем, что в качестве действующего вещества дополнительно содержит йод в комплексе с поливинилпирролидоном, новокаин и наночастицы на основе железа Fe3O4 и FeC, в качестве водорастворимой основы используется смесь полиэтиленоксидов с молекулярными массами 400 и 1000 и спирт этиловый. Изобретение позволяет создать мягкую лекарственную форму на основе наночастиц железа для лечения термических поражений кожи и мягких тканей, осложненных инфекционным процессом, обладающую одновременно антисептическим действием за счет йодоформных групп, местноанестезирующим действием за счет наличия в составе новокаина и пролонгированным действием за счет наличия матрицы поливинилпирролидона. 5 табл.
Реферат
Изобретение относится к химико-фармацевтической промышленности, а именно к области производства наружных лекарственных форм, используемых для лечения ран с бактериальными и грибковыми инфекциями кожи, инфекционных дерматитов, трофических язв, пролежней, ожогов, ссадин, ран. Лекарственная форма может применяться при оказании хирургической, комбустиологической помощи, а также использоваться специалистами медицины катастроф при оказании медицинской помощи в условиях экстремальных ситуаций для лечения ран и ожогов во всех фазах раневого процесса путем нанесения на рану.
При ранах и ожогах возникает сосудисто-тканевая реакция организма, которая в дальнейшем приводит к воспалению, нарушению кровообращения и присоединению инфекции. Лечение больных с воспалительным процессом должно быть направлено на устранение очага патологии и заживлению раны [1].
В настоящее время известно множество мягких лекарственных форм для наружного применения при местном лечении ожогов, предотвращающих инфицирование раны.
Важным компонентом таких лекарственных форм является антисептическая составляющая. Самыми выраженными бактерицидными свойствами обладают препараты йода [2]. Их преимуществом является хорошая растворимость в воде и дешевизна.
На российском фармацевтическом рынке представлена мягкая лекарственная форма, содержащая в своем составе йод-мазь «Бетадин» (НД42-7629-02) [номер регистрационного удостоверения П N015282/02], производимая компанией ОАО "Фармацевтический завод ЭГИС". Препарат обладает хорошей антисептической активностью в отношении грамположительных и грамотрицательных бактерий и содержит в своем составе фармацевтическую субстанцию - повидон-йод, водорастворимую основу, воду очищенную, буферный компонент.
Другим представителем противоожоговых препаратов для местного применения на российском рынке является мазь - Стелланин (ФСП 42-0609-7769-06) [Номер регистрационного удостоверения ЛСР-002113/09] производителя ООО «Фармпрепарат». Это средство оказывает бактерицидное действие на многих грамположительных и грамотрицательных микроорганизмов, также ему присуще регенерационное действие. В своем составе данная мазь содержит диэтилбензимидазолиятрийодид, в качестве вспомогательных веществ: полимерную матрицу поливинилпирролидона, водорастворимую основу.
Данные препараты обладают хорошими антисептическими и ранозаживляющими свойствами. Однако при всех достоинствах их состав не является оптимальным для применения в комбустиологии и требует необходимости в создании высокоэффективных полифункциональных лекарственных средств, с улучшенным антибактериальным эффектом и доминирующим эффектом обезболивания.
Современными составами, обладающими репаративными свойствами, являются системы, содержащие в своем составе нанокомпоненты.
Наиболее близким к предлагаемому способу является изобретение по патенту RU 2296571 от 10.03.2010 [3], в котором раскрыт ранозаживляющий состав, включающий действующее вещество и основу, характеризующийся тем, что в качестве действующего вещества содержит наночастицы железа, а в качестве основы включает полиэтиленгликоли 400 и 1500 при следующем соотношении ингредиентов, г:
| Наночастицы железа | 0,001-1 |
| ПЭГ-400 | 30-95 |
| ПЭГ-1500 | до 100 |
Наночастицы на основе металлов являются одним из перспективных направлений для создания нового класса ранозаживляющих препаратов, поскольку наночастицы металлов обладают низкой токсичностью и пролонгированным действием. Кроме того, наночастицы железа проявляют выраженный антибактериальный эффект и входят в состав форменных элементов крови.
Однако данное изобретение не полностью соответствует современным требованиям, предъявляемым к таким композициям.
В связи с этим задачей данного изобретения является создание мягкой лекарственной формы, обладающей улучшенными ранозаживляющими свойствами.
Технический результат - создание мягкой лекарственной формы на основе наночастиц железа для лечения термических поражений кожи и мягких тканей, осложненных инфекционным процессом, обладающей одновременно антисептическим действием за счет йодоформных групп, местноанестезирующим действием за счет наличия в составе прокаина гидрохдорида и пролонгированным действием за счет наличия матрицы поливинилпирролидона.
Заявленный состав характеризуется высокой ранозаживляющей активностью, местным анестезирующим и пролонгированным действиями.
Указанный технический результат достигается тем, что создана мягкая лекарственная форма, содержащая лекарственное вещество на основе йода (йод в комплексе с поливинилпирролидоном (ПВП)), местный анестетик (новокаин), (фармацевтическая композиция Новокомб для изготовления лекарственных форм по патенту RU 2519090) и наночастицы на основе железа, полученные двумя разными способами.
Заявляется мягкая лекарственная форма, включающая в качестве действующего вещества наночастицы, а в качестве основы полиэтиленгликоли, отличающаяся тем, что в качестве действующего вещества дополнительно содержит йод в комплексе с поливинилпирролидоном, новокаин и наночастицы на основе железа Fe3O4 и FeC, в качестве водорастворимой основы используется смесь полиэтиленоксидов с молекулярными массами 400 и 1000 и спирт этиловый при следующем соотношении компонентов:
Йод 1,32 г, в том числе активный йод 6,45 мг
Новокаин 7,30 г
ПВП 35,38 г
Наночастицы FeC 0,1000 г
Наночастицы Fe3O4 0,1000 г
ПЭГ 400 - 35,00-40,00 г
ПЭГ 1000-8,00-10,00 г
Спирт этиловый 95% до 100,0 г.
Осуществление изобретения
Были получены мягкие лекарственные формы различного состава (таблица 1).
Мягкие лекарственные формы обычно получают в несколько стадий: подготовка основы, подготовка лекарственных веществ, их растворение, введение фармацевтических компонентов в основу и гомогенизация мази.
В настоящее время в литературе имеются разные способы получения суспензионной, эмульсионной и комбинированной мазей, включающие вышеперечисленные стадии. Однако все они применимы к производству мягких лекарственных форм, не требующих использования нанокомпонентов. Задачей данного изобретения является создание способа получения мягкой лекарственной формы с содержанием наночастиц. Поставленная задача была решена путем появления новых стадий при изготовлении мази - синтез наночастиц железа и способ их введения в основу.
1. Синтез наночастиц железа.
Существует огромное количество различных физических [4], физико-химических [5] и биотехнологических методов [6] получения наночастиц, содержащих 3d металлы. Наночастицы Fe3O4 и FeC (железо, покрытое углеродной оболочкой), используемые в данной работе, были получены левитационно-струйным методом в среде газа носителя (или иначе методом газофазного синтеза). Металл, в данном случае железо, разогревается высокочастотным магнитным полем до температуры в 2100°C, находясь в токе инертного газа-носителя, уносящего капли металла. При этом к газу-носителю дополнительно примешивается кислород (для получения оксидных наночастиц) или смесь углеводородов (для получения наночастиц, покрытых углеродной оболочкой). Полученные частицы имеют относительно небольшое распределение по размерам и свойствам, позволяющее применять их в самых различных областях [7].
2) Диспергирование наночастиц в основе мази. На весах лабораторных с ценой деления 0,001 отвешивали количество ПЭГ 400 35,00-40,00 г. Вносим наночастицы магнетита в раствор ПЭГ-400. Диспергируем смесь 3 раза по следующей схеме: в течение 30 секунд подвергаем раствор ультразвуковой обработке, затем перерыв - 1 минута, при постоянном контроле температуры, которая не должна превышать 40°C. Параметры диспергирования для диспергатора УЗ-генератора УЗГ 0.4, с титановым активатором погружного типа, частота которого 22 кГц при комнатной температуре, процесс диспергирования проходил с экзотермическим эффектом.
3) Приготовление спиртового раствора Новокомб.
Отвешиваем на аналитических весах 44,00 г субстанции «Новокомб» и 44,00 г спирта этилового (соотношение 1:1). Вследствие малой растворимости в воде йода, входящего в состав фармацевтической композиции растворяем навеску субстанцию в спирте и перемешиваем до полного ее растворения. Применение спирта в качестве растворителя также способствует значительному повышению антисептической активности мягкой лекарственной формы.
4) Приготовление мазевой основы. На весах лабораторных с ценой деления 0,001 отвешивали необходимые 8,00-10,00 г ПЭГ 1000. В емкость для плавления основы загружали отвешенное количество ПЭГ 1000, плавили в течение 10 мин при температуре 65±5°C. Нагрев емкости осуществляли на бане водяной лабораторной с электрическим подогревом. Температуру в водяной бане контролировали термометром. Полноту плавления контролировали визуально по отсутствию нерасплавленных кусков.
Применение в качестве основы смеси полиэтиленоксидов молекулярной массы 1000 и 400 приводит к повышению эффективности мази, поскольку они обладают гидрофильностью, что способствует высвобождению гноя и продуктов распада ткани из раны. Основа легко наносится на раневые поверхности, является химически инертной, способствует газообмену ткани, вследствие отсутствия образования пленки аналогичной мазям на ланолин-вазелиновой основе.
5) Смешивание ПЭГ-400 и наночастиц магнетита со спиртовым раствором "Новокомб". К смеси ПЭГ 400 с наночастицами железа вносим спиртовой раствор «Новокомб». Перемешиваем до однородной консистенции.
6) Получение мази. Охлажденную основу до 40-45°C смешивали со смесью Новокомба и наночастиц магнетита, полученной на стадии 4, и обрабатывали ультразвуком в течение 2 минут. Контроль равномерного распределения Новокомба в расплавленном концентрате осуществляли визуально по достижении однородной окраски основы.
Была проведена оценка антимикробной активности приведенных выше составов методом диффузии в агар.
Для постановки опытов были использованы стерильные чашки Петри диаметром 100 мм, которые были установлены на строго горизонтальную поверхность и заполнены плотной питательной средой в количестве 20 мл для создания оптимальной толщины слоя (4-5 мм). Перед посевом чашки со средой были подсушены в термостате для лучшей диффузии препаратов в питательную среду. Для посева были использованы культуры S. aureus, S. epidermidis, Pr. Mirabilis, P. aeruginosa, Corynebacterium, из которых готовят микробную взвесь, содержащую 1 млрд. микробных тел в 1 мл. Далее взвесь была нанесена на поверхность подсушенной питательной среды в объеме 1 мл. Посредством покачивания чашки культуру равномерно распределяли по поверхности среды с последующим отсасыванием избытка жидкости пипеткой. Засеянные чашки 5-10 мин подсушивали в боксе при комнатной температуре, а затем на поверхность среды с помощью стерильной петли наносили лекарственный препарат в виде мази и инкубировали в течение 24 часов (таблица 2).
Было проведено исследование ранозаживляющих свойств заявленных составов на наличие биологической активности на экспериментальной модели термического ожога.
В эксперименте были использованы белые беспородные крысы обоего пола массой 212,0-380,0 г. Животные были получены из питомника, прошли двухнедельный карантин и содержались в стандартных условиях вивария. В каждой экспериментальной группе было по пять животных (n=5). Животным вызвали термические ожоги площадью 4 см2. Повреждения наносили под действием ингаляционного наркоза - диэтилового эфира. Участок бедра, на который моделировали ожоговую травму, предварительно выбривали. Ожоговую травму вызывали контактным способом. Металлическую пластину опускали в кипящую воду (100-98°C), и затем накладывали на выбритый участок: время экспозиции составило 45 с. Степень ожога, согласно клинической классификации, составила ША и ШБ степени клинической классификации ожогов.
Оценку ранозаживляющего действия проводили по характеру клинического течения (появления струпа и время его отторжения) (таблица 3).
Все препараты наносили ежедневно, в течение всего периода эксперимента до полного заживления ран.
Наилучшей биологической активностью обладали мягкие лекарственные формы с содержанием наночастиц Fe3O4 1% и наночастиц FeC 1%, представленные в таблице 4.
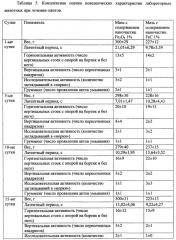
В дальнейших исследованиях была произведена оценка ориентировочно-исследовательского поведения на 5, 10, 15, 20 сутки наблюдения по методике «открытое поле». Особи тестировались 4-кратно с перерывами в 30 минут. Открытое поле - это площадка 3600 см2 в виде квадрата, и поделенная на меньшие квадраты размером 10×10 см, по периметру расположены стенки высотой 30 см. Время экспозиции животного в «открытом поле» составляло 3 минуты. Особь помещали в центр поля под затемненным колпаком на 15 с для адаптации крысы к обстановке. После чего фиксировали латентный период животного до его выхода с центрального круга. Затем регистрировали такие поведенческие акты, как вертикальную активность (число вертикальных стоек с опорой на бортик и без него), горизонтальную активность (число пересеченных квадратов), исследовательскую активность (количество заглядываний в «норки»), число проявления актов умывания (грумминга) (таблица 5).
Апробация предлагаемой мази на различных видах животных при лечении ран показала ее высокие ранозаживляющие свойства, что позволяет рекомендовать ее для лечения различных форм ран.
Срок хранения полученных мягких лекарственных форм составляет 1 год в прохладном, защищенном от света, недоступном для детей месте.
Список литературы
1. Мельникова О.А., Самкова И.А., Маханькова Л.А. Методика измерений и алгоритмы определения лекарственных веществ в многокомпонентных смесях // Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. - 2015. - Т. 29. - №.4 (201).
2. Ricardo Jorge Dinis-Oliveira, Felix Carvalho, Roxana Moreira, Jorge Brandao Proenca, et al., Clinical and forensic signs related to chemical burns: a mechanistic approach // Burns: journal of the International Society for Burn Injuries. - 2015. - T. 41. №4. C. 658-679.
3. Патент RU 2296571, МПК A61K 33/26, МПК B01J 19/10. Ранозаживляющий состав и способ его получения / Богословская О.А., Арсентьева И.П., Байтукалов Т.А., Ольховская И.П., Глущенко Н.Н., Фолманис Г.Э., заявитель и патентообладатель Открытое акционерное общество "Химико-фармацевтический комбинат "АКРИХИН" (ОАО "АКРИХИН").
4. J.W.М. Bulte и D.L. Kraitchman, «Iron oxide MR contrast agents for molecular and cellular imaging», NMR Biomed, т. 17, вып. 7, cc. 484-499, 2004.
5. H. Bin Na, I.C. Song, и Т. Hyeon, «Inorganic nanoparticles for MRI contrast agents», Adv. Mater., т. 21, вып. 21, cc. 2133-2148, 2009.
6. D. Mandal, M.E. Bolander, D. Mukhopadhyay, G. Sarkar, и P. Mukherjee, «The use of microorganisms for the formation of metal nanoparticles and their application)), Appl. Microbiol. Biotechnol., т. 69, вып. 5, cc. 485-492, 2006.
7. V.A. Tsurin, A.Y. Yermakov, M.A. Uimin, A.A. Mysik, N.N. Shchegoleva, V.S. Gaviko, и V.V. Maikov, «Synthesis, structure, and magnetic properties of iron and nickel nanoparticles encapsulated into carbon», Phys. Solid State, т. 56, вып. 2, cc. 287-301, 2014.
Ранозаживляющий состав, включающий в качестве действующего вещества наночастицы, а в качестве основы - полиэтиленгликоли, отличающийся тем, что в качестве действующего вещества дополнительно содержит йод в комплексе с поливинилпирролидоном, новокаин и наночастицы на основе железа Fе3O4 и FeC, в качестве водорастворимой основы используется смесь полиэтиленоксидов с молекулярными массами 400 и 1000 и спирт этиловый
при следующем соотношении компонентов:
| Йод 1,32 г, в том числе активный йод | 6,45 мг |
| Новокаин | 7,30 г |
| ПВП | 35,38 г |
| Наночастицы FeC | 0,1000 г |
| Наночастицы Fе3O4 | 0,1000 г |
| ПЭГ 400 | 35,00-40,00 г |
| ПЭГ 1000 | 8,00-10,00 г |
| Спирт этиловый 95%-ный | до 100,0 г |