Мицелярный комплекс липоевой кислоты с карнозином для защиты млекопитающих от окислительного стресса
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фармацевтике, и может быть использовано для подавления окислительного стресса у млекопитающих. Антиоксидантный комплекс по изобретению представляет собой комплекс карнозина с α-липоевой кислотой, полученный путем смешивания α-липоевой кислоты с водным раствором карнозина в эквимолярном соотношении. Применение по изобретению касается применения указанного антиоксидантного комплекса для защиты млекопитающих от окислительного стресса. Использование изобретений позволяет получить водорастворимый стабильный при физиологических условиях комплекс, обладающий повышенной эффективностью и большей устойчивостью к гидролизу сывороточной карнозиназой по сравнению с входящими в него компонентами. 2 н. и 2 з.п. ф-лы, 3 ил., 2 табл., 6 пр.
Реферат
Изобретение относится к области фармацевтики и медицины и касается антиоксиданта для подавления окислительного стресса у млекопитающих и его применения для защиты млекопитающих от окислительного стресса.
Начиная с 70-х годов, в медицинской литературе появилось большое число исследований, посвященных взаимосвязи между свободными радикалами и различными патофизиологическими изменениями в организме и старением, что привело к возникновению термина «свободно-радикальные заболевания» [1, 2]. В связи с этим большое число исследований в последние десятилетия было сконцентрировано на изучении соединений, обладающих антиоксидантной активностью, с целью разработки возможности их терапевтического применения для предотвращения развития окислительного стресса [3, 4]. Протекторное действие антиоксидантов продемонстрировано на экспериментальных моделях различных патологий. Однако, несмотря на имеющийся опыт применения антиоксидантов в клинической практике, многие вопросы, связанные с антиоксидантной терапией, остаются открытыми [5].
Одним из перспективных антиоксидантов является природный нейропептид карнозин
Он обладает не только свойствами прямого антиоксиданта - перехватчика радикалов, но является антигликирующим агентом, хелатором ионов металлов, молекулярным шапероном и индуктором антиоксидантных систем в условиях окислительного стресса [6].
В последние десятилетия в России интенсивно исследовались эффекты карнозина в опытах in vitro и in vivo. На различных экспериментальных моделях заболеваний ЦНС, характеризующихся окислительными повреждениями мозга - иммобилизационный и электроболевой стресс, острая гипобарическая гипоксия, ишемия головного мозга, гипергомоцистеинемия, МРТР-индуцированный паркинсонизм - было установлено антиоксидантное и нейропротекторное действие карнозина. Защитные эффекты карнозина проявлялись не только в поддержании эндогенного антиоксидантного статуса, но и в уменьшении объема очагов ишемического поражения, и в обеспечении сохранности двигательной активности животных и долговременной памяти, выявляемых в таких тестах как открытое поле, норковая камера, водный лабиринт Морриса [6, 7].
В пилотных исследованиях было показано, что карнозин повышает эффективность базисной терапии у пациентов с дисциркуляторной энцефалопатией [8] и болезнью Паркинсона [9]. Однако эффективность действия карнозина в организме ограничена низкой липофильностью, а также его гидролизом, осуществляемым специфическим ферментом - карнозиназой [10]. Эти особенности карнозина ставят задачу его модификации с целью улучшения биодоступности. Одним из путей решения является создание «гибридных» производных карнозина, повышающих его липофильность и устойчивость к гидролизу. Так, были получены биологически активные производные карнозина, связанного с тролоксом (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоксиловой кислотой) - достаточно липофильным водорастворимым аналогом витамина Е [11]
Липоевая кислота (ЛК) и ее восстановленная форма - дигидролипоевая кислота (ДГЛК) - являются эффективными антиоксидантами благодаря сочетанию таких свойств, как интенсивное тушение радикалов, способность хелатировать металлы, амфифильность и отсутствие опасных побочных эффектов при медицинском применении. Они могут взаимодействовать с другими антиоксидантами, регенерируя их.
ЛК представляет собой небольшую молекулу, содержащую две окисленные или восстановленные (в случае ДГЛК) тиоловые группы. ДГЛК - предпочтительная форма этой молекулы, однако и ДГЛК и ЛК способны перехватывать активные формы кислорода (АФК). ЛК может не только перехватывать свободные радикалы, но и восстанавливать эндогенные антиоксиданты - глутатион, витамины Е и С. Благодаря такому сочетанию свойств ЛК/ДГЛК рассматривают как перспективный терапевтический препарат [12]. Несмотря на то что в ряде исследований была показана эффективность применения ЛК при диабете, сердечно-сосудистых, нейродегенеративных, аутоиммунных, заболеваниях, раке и ВИЧ-инфекциях, дальнейшее применение ЛК нуждается в дополнительных клинических исследованиях [13].
Производители пищевых добавок предлагают композиции, включающие карнозин и липоевую кислоту. Так, разработан антивозрастной препарат, представляющий собой смесь альфа-липоевой кислоты, ацетил-L-карнитина, L-карнозина и экстракта виноградных косточек для антиоксидантной и антивозрастной защиты [14].
Описана пищевая добавка в форме таблеток для повышения чувствительности к инсулину, включающая в качестве основных компонентов альфа-липоевую кислоту, карнозин, тиамин, хром и ванадий, а также некоторые растительные экстракты [15].
Описан фармакологический препарат на основе смеси липоевой кислоты и карнозина, устраняющий синдром фантомных болей [16].
Имеются данные о совместном применении карнозина и липоевой кислоты в качестве пищевой добавки к корму крыс. Было показано, что карнозин и липоевая кислота по-разному изменяли антиоксидантный статус животных, в совокупности обеспечивая высокий уровень антиоксидантной защиты и контролируя липидный статус крови [17]. В этих экспериментах авторы добавляли липоевую кислоту и карнозин к корму животных, что не позволяет точно оценивать получаемую дозу этих добавок. Кроме того, липоевая кислота плохо усваивается организмом и имеет низкую биодоступность, если применяется не в форме водорастворимого производного. В свою очередь, карнозин при пероральном приеме быстро поступает в кровь, но легко разрушается под действием сывороточной и тканевой карнозиназ и не обнаруживается в крови уже через 2,5-3 час. Таким образом, использованный способ применения в форме подмешивания липоевой кислоты и карнозина в стандартный корм животных не обеспечивает продолжительное сохранение заданного соотношения липоевой кислоты и карнозина.
Описано соединение на основе карнозина, ацилированного липоевой кислотой по аминогруппе бета-аланина, полученное двухстадийным синтезом (при 73% выхода конечного продукта) [18].
В модельных экспериментах на крысах это соединение в дозе 30-120 мг/кг массы тела при пероральном приеме эффективно подавляло нейропатические болевые синдромы, индуцированные оксалиплатином, не вызывая побочных эффектов и не влияя на поведение животных. Полученное соединение проявляло в тесте с NВТ антиоксидантную активность меньшую, чем у липоевой кислоты. Оно было нетоксично на первичной культуре астроцитов и было способно подавлять индукцию супероксида при действии на клетки оксалиплатина. В то же время защитное действие этого соединения в условиях окислительного стресса, развивающегося в клеточной культуре и в организме животного, не описано [18].
Задачей настоящего изобретения является разработка антиоксиданта для подавления окислительного стресса у млекопитающих на основе α-липоевой кислоты и карнозина, отличающегося от липоевой кислоты хорошей водорастворимостью, а от карнозина устойчивостью к сывороточной карнозиназе, обладающего антиоксидантными, цитопротекторными и антигипоксическими свойствами, и его применение для защиты млекопитающих от окислительного стресса.
В соответствии с изобретением описывается антиоксидант для подавления окислительного стресса у млекопитающих, представляющий собой комплекс карнозина с α-липоевой кислотой, полученный путем смешивания α-липоевой кислоты с водным раствором карнозина в эквимолярном соотношении. Процесс можно проводить при обработке ультразвуком или нагревании при 30-40°C с последующей лиофилизацией. Описывается также применение полученного антиоксиданта для защиты млекопитающих от окислительного стресса.
Техническим результатом настоящего изобретения является получение водорастворимого стабильного при физиологических условиях комплекса карнозина и α-липоевой кислоты (комплекс К/ЛК), сохраняющего свои свойства при хранении в лиофилизированном виде, обладающего повышенной прямой антиоксидантной активностью, большей устойчивостью к гидролизу сывороточной карнозиназой, высокой нейропротекторной активностью, повышенной эффективностью защитного действия в условиях острой гипобарической гипоксии, значительным влиянием на успешность обучения животных при выработке условной реакции пассивного избегания и сохранение памятного следа в условиях воздействия на животных острой гипобарической гипоксии.
Изобретение иллюстрируется следующими примерами.
Пример 1. Способ получения комплекса карнозина с α-липоевой кислотой.
226 мг (1 моль) карнозина растворяют в 80 мл воды очищенной. Прибавляют 207 мг (1 ммоль) α-липоевой кислоты, перемешивают до растворения. Доводят объем водой до 100 мл. Для ускорения процесса проводят ультразвуковую обработку или подогрев раствора при перемешивании при 40°C до полного растворения. Полученный раствор разливают по 10 мл по флаконам и подвергают лиофилизации.
Сухой препарат во флаконе содержит 22,6 мг карнозина и 20,7 мг липоевой кислоты. Полученный сухой продукт расфасовывают в кислотоустойчивые капсулы для перорального применения или растворяют в 10 мл воды. При этом образуются наночастицы, имеющие размер около 25 нм. Концентрация по карнозину составляет 2,26 мг/мл.
Исследования показали, что полученные наночастицы представляют собой мицеллы, гидрофобное ядро которых организовано остатками α-липоевой кислоты, а гидрофильная область организована карнозином. Между карбоксильной группой α-липоевой кислоты и аминогруппой карнозина образуется ионная связь -COO H3N-. Полученный комплекс карнозина с липоевой кислотой устойчив при рН 5,5-8,5.
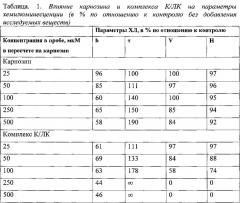
Пример 2. Оценка антиоксидантного действия комплекса карнозин/липоевая кислота (К/ЛК) на модели Fe2+-индуцированной хемилюминесценции (ХЛ) при перекисном окислении атерогенных липопротеинов (ЛП) сыворотки крови.
Состояние окислительного статуса (перекисного окисления липидов и активности антиоксидантной системы) определяли методом измерения железо-индуцированной хемилюминесценции, сопровождающей свободнорадикальные процессы при окислении липопротеинов низкой и очень низкой плотности (ЛП), выделенных из сыворотки доноров. Регистрируемые параметры хемилюминесценции - быстрая вспышка (h, mB) в ответ на добавление к реакционной смеси Fe2+; латентный период (τ, сек), свидетельствующий о резистентности ЛП к дальнейшему окислению; фаза медленного нарастания ХЛ (Н, mV) по окончании латентного периода, характеризуют, соответственно: уровень предобразованных продуктов перекисного окисления липидов (ПОЛ), (преимущественно гидроперекисей липидов), уровень в исследуемой пробе низкомолекулярных антиоксидантов (общую антиоксидантную активность), суммарную способность субстрата к окислению. Карнозин и комплекс К/ЛК вводили в реакционную пробу в виде аликвот стокового водного раствора с концентрацией 10 мМ (для К/ЛК в расчете по содержанию карнозина) до конечной концентрации 25-50-100-25-500 мкМ перед индукцией окисления добавкой Fe2+.
Результаты. Измерение ХЛ проводили на приборе Luminometer-1251 (LKB, Швеция) в 2 параллельных пробах для каждого образца, используя в анализе среднюю величину.
Результаты измерения параметров железо-индуцированной хемилюминесценции представлены в Таблице 1.
Полученные результаты указывают на высокую антиоксидантную активность комплекса К/ЛК по сравнению с карнозином в прямых in vitro экспериментах.
Пример 3. Определение устойчивости комплекса карнозин/липоевая кислота к сывороточной карнозиназе.
Для сравнения устойчивости к сывороточной карнозиназе карнозина и комплекса карнозин/липоевая кислота был использован метод, предложенный Lenny et al. (1982) в модификации Пеговой и соавт. (20). Через 60 и 180 мин гидролиза, обусловленного карнозиназой, отбирали пробы инкубационной смеси объемом 100 мкл и замораживали при -80°C. В качестве контроля были взяты пробы, которые инкубировали без добавления сыворотки. Определение гистидина, образовавшегося при гидролизе карнозина, проводили с помощью ВЭЖХ.
Результаты. По сравнению с пробами, содержащими карнозин (прирост гистидина в которых был принят за 100%), прирост гистидина в пробах, содержащих К/ЛК, был ниже и составил за 60 мин - 78%, за 180 мин - 85% от контроля. Полученные результаты указывают на 15%-22% защищенность карнозина от гидролиза в составе комплекса с липоевой кислотой.
Пример 4. Защитные эффекты комплекса карнозин/липоевая кислота в экспериментах на культуре клеток
6-гидроксидофамин (6-OHDA) - это катехоламинергический нейротоксин, который широко используется для моделирования паркинсонизма. Токсичность 6-OHDA проявляется сочетанным действием активных форм кислорода (АФК) и хинонов, поскольку 6-OHDA в аэробных щелочных условиях легко окисляется до перекиси водорода и парахинона.
Объект исследования - культура клеток нейробластомы человека SH-SY5Y, дифференцированная по дофаминергическому типу. Дифференцировка нейробластомы SH-SY5Y ведет к получению клеток с функционально зрелым нейрональным фенотипом. Для таких клеток характерен экстенсивный рост нейритов, морфологически схожих с нейритами живых нейронов головного мозга человека.
Получали дифференцированные по дофаминергическому типу клетки нейробластомы. Спустя 6 дней к дифференцированным клеткам экспериментальных групп добавляли 6-OHDA (50 μМ) и протекторы: карнозин, липоевую кислоту, смесь липоевой кислоты и карнозина или комплекс карнозина с липоевой кислотой (К/ЛК) в концентрации 0,25 mM. К контрольным клеткам исследуемые вещества не добавляли. Затем клетки инкубировали в течение 24 часов и определяли выживаемость клеток с помощью МТТ-теста.
Результаты. На рисунке 1 представлены результаты сравнения выживаемости дифференцированных клеток нейробластомы SH-SY5Y, культивируемых в различных условиях. Данные представлены в процентах от уровня сигнала в лунках с контрольными клетками (M±m).
Показано, что в присутствии 50 μM 6-OHDA выживаемость клеток снижалась до 59%. Добавление в культуральную среду 0,25 mM комплекса карнозин-липоевая кислота на фоне 6-OHDA приводило к увеличению выживаемости клеток до 113%, в то время как добавление липоевой кислоты, карнозина или смеси липоевой кислоты с карнозином не защищало клетки от гибели. Концентрация 0,25 мМ для комплекса карнозин-липоевая кислота представляет минимальную эффективную концентрацию в диапазоне от 0,1 до 1 mM.
Пример 5. Влияние комплекса карнозин/липоевая кислота (К/ЛК) на устойчивость крыс к острой гипобарической гипоксии.
Острую гипобарическую гипоксию (ОГГ) создавали в барокамере проточного типа для предотвращения развития эффекта гиперкапнии.
Опыты выполнены на нелинейных крысах-самцах, весом 130-150 г. Крыс разделили на три группы по 20-22 особи в каждой. Животным первой группы (контрольной) за 1 час до гипоксического воздействия вводили физиологический раствор (1 мл); крысы второй группы получали карнозин в дозе 100 мг/кг массы тела; крысы третьей группы получали препарат К/ЛК из расчета 100 мг содержащегося в нем карнозина на кг массы, при этом доза по липоевой кислоте составила 92, 5 мг/кг массы тела. Все животные получали препараты внутрибрюшинно.
Крыс по одной помещали в барокамеру и в течение 1 мин снижали давление до 0.14 атм. В ходе проведения экспериментов оценивали устойчивость крыс к гипоксии по следующим физиологическим характеристикам: время потери позы (ВПП, сек) - время от начала действия гипоксии (окончание «подъема на высоту») до полного расслабления скелетной мускулатуры; время жизни на "высоте" (ВЖ, сек) - время от момента окончания подъема до остановки дыхания; время реабилитации (BP, сек) - период времени от момента перемещения животного в условия нормального атмосферного давления до восстановления активной позы. Для объективизации этого параметра был введен коэффициент реабилитации (КР), который выражался как отношение продолжительности реабилитации к времени до остановки дыхания. Крысы находились в камере до момента остановки дыхания, после чего в течение 1 мин давление выравнивали с атмосферным.
Результаты. Было показано (рис. 2), что относительно контрольных животных, получавших физиологический раствор:
1. Карнозин и препарат К/ЛК в одинаковой степени увеличивали время до потери позы (р<0,05) в условиях ОГГ;
2. Карнозин увеличивал время до остановки дыхания животных на 73% (р<0,05), препарат К/ЛК - на 40%;
3. Препарат К/ЛК достоверно улучшал реабилитацию (КР=0,69, p<0,05) в отличие от карнозина (КР карнозина = 0,92) и КР физ. раствора (0,99), которые не оказывали существенного влияния на этот параметр.
Таким образом, установлено влияние комплекса К/ЛК на параметры, характеризующие устойчивость крыс к гипоксическому повреждению (время до потери позы и время до остановки дыхания), сопоставимое с действием карнозина. В то же время влияние на реабилитацию (время до восстановления активной позы) после воздействия гипоксии у комплекса К/ЛК оказалось более выраженным, чем у карнозина, что указывает на более быстрое восстановление животных после ОГГ.
Пример 6. Влияние комплекса К/ЛК на выработку условного рефлекса пассивного избегания
Нейротропные эффекты комплекса К/ЛК в сопоставлении с карнозином изучали тестированием животных в модифицированной методике условного рефлекса пассивного избегания. Экспериментальная установка представляет модификацию классической методики условного рефлекса пассивного избегания (УРПИ). Животное помещают в центральный ярко освещенный отсек трехкамерной установки, проходы в два боковых затемненных отсека находятся, соответственно, справа и слева. Регистрируются все действия животного в пределах экспериментальной среды, переходы между центральным и боковыми темными отсеками с их латентным периодом.
На стадии предварительного ознакомления со средой (5 мин) животное свободно может переходить между отсеками. На стадии обучения (5 мин) животное при заходе в любой темный отсек получает в нем в течение 10 с неизбегаемое электроболевое раздражение через решетчатый пол, после чего опыт заканчивается. Отсек, в котором животное получило ток, обозначается далее как «опасный». Противоположный отсек, соответственно, как «безопасный». Далее в последовательных тестах по предпочтению животным одного из отсеков и латентным периодам захода оценивают сохранность памятного следа.
В тесте 1 оценивали поведение крыс в течение 10 минут. Как только животное заходило в «опасный» отсек, оно получало электроболевое раздражение и опыт на этом заканчивался. Если животное в течение 10 минут не заходило в «опасный» отсек, его помещали туда принудительно. Таким образом, в тесте 1 происходило дополнительное предъявление ситуации и дообучение. Через сутки в тесте 2 оценивали поведение крыс в течение 10 минут. Регистрировали все переходы между отсеками, но удара тока животные не получали. В данном исследовании между тестом 1 и тестом 2 часть животных подвергалась воздействию ОГГ в соответствии с описанной выше методикой и, таким образом, в тесте 2 у них на эффект дополнительного обучение накладывался негативный эффект гипоксии мозга. Схема эксперимента представлена в таблице 2.
Крысы экспериментальных групп получали исследуемые вещества (карнозин и комплекс К/ЛК в дозе 100 мг/кг массы тела по карнозину и 92,5 мг по липоевой кислоте) внутрибрюшинно перед первым предъявлением задачи выработки УРПИ (влияние вещества на обучение) и перед экспозицией к гипоксии (протекторный эффект вещества). Контрольные крысы получали эквивалентный объем физиологического раствора.
Результаты. Анализ латентных периодов захода в опасный отсек камеры показал, что оба исследуемых вещества оказали физиологический эффект на животных (Рисунок 3). Различия между контрольной и экспериментальными группами были отчетливо выражены в Тесте 2, что может быть обусловлено двумя предшествующими сессиями обучения, против одной в тесте 1. Согласно принятому критерию увеличения латентного периода захода в «опасный» отсек эффект обучения больше проявился у животных под воздействием веществ. Данный параметр классически интерпретируется как показатель успешности обучения в УРПИ. Так, латентный период захода в «опасный» отсек увеличился на 51% у животных, получавших К/ЛК (уровень достоверности р<0.05 по критерию Манна-Уитни). Группа, получавшая карнозин, проявила большую гетерогенность, в связи с чем отличия от контрольных животных не достигают уровня достоверности. При этом если у контрольных животных воздействие острой гипобарической гипоксии практически полностью нивелировало эффект обучения, то оба исследованных соединения предотвращали негативное воздействие ОГГ на памятный след. Как в норме, так и в условиях воздействия гипоксии, К/ЛК показал большую физиологическую активность по сравнению с карнозином.
Комплекс К/ЛК показал сходный с карнозином эффект - прогрессивное увеличение латентного периода захода в «опасный» отсек, который оказался более выраженным в тесте 2. Данный параметр классически интерпретируется как показатель успешности обучения в УРПИ. При этом если у контрольных животных воздействие острой гипобарической гипоксии практически полностью нивелировало эффект обучения (отсутствует прирост от теста 1 к тесту 2), то оба исследованных соединения предотвращали негативное воздействие ОГГ на памятный след. Как в норме, так и в условиях воздействия гипоксии К/ЛК показал большую физиологическую активность по сравнению с карнозином.
Таким образом, на основании проведенных исследований можно сделать вывод, что описываемый антиоксидант, представляющий собой комплекс карнозина с липоевой кислотой, характеризуется:
- повышенной прямой антиоксидантной активностью, определяемой в хемилюминесцентном тесте железо-индуцированного перекисного окисления ЛП;
- большой устойчивостью к гидролизу сывороточной карнозиназой;
- высокой нейропротекторной активностью в условиях воздействия на дифференцированную нейрональную культуру нейротоксина;
- большой эффективностью защитного действия в условиях острой гипобарической гипоксии, выражающейся в существенном снижении времени реабилитации животных после их помещения в нормобарические условия;
- значительным влиянием на успешность обучения животных при выработке условной реакции пассивного избегания и сохранение памятного следа в условиях воздействия на животных острой гипобарической гипоксии.
Краткое описание рисунков.
На рисунке 1 представлены результаты сравнения влияния карнозина, липоевой кислоты, их смеси и комплекса карнозина с липоевой кислотой на выживаемость дифференцированных клеток нейробластомы SH-SY5Y, культивируемых в присутствии 6-OHDA. Данные представлены в процентах от уровня сигнала в лунках с контрольными клетками (M±m). (р<0,05 по отношению к контрольным клеткам).
На рисунке 2 изображено влияние карнозина и его комплекса с липоевой кислотой на устойчивость крыс к острой гипобарической гипоксии (р<0,05 по критерию Манна-Уитни по отношению к контрольным крысам, получавшим физиологический раствор).
На рисунке 3 показано влияние карнозина и его комплекса с липоевой кислотой (К/ЛК) на воспроизведение реакции пассивного избегания у животных без воздействия (А) и после воздействия острой гипобарической гипоксии (Б).
По оси абсцисс - последовательные тесты.
По оси ординат - латентный период захода в «опасный» отсек.
(р<0,05 по критерию Манна - Уитни по отношению к контрольным крысам, получавшим физиологический раствор).
ЛИТЕРАТУРА
1. Harman D. (1984) Age, 7, 11-31.
2. Harman D. (2009) Biogerontology, 10, 773-781.
3. Halliwell B. (2005) Am J Clin Nutr, 81, 268-276S.
4. Rizvi S.I., Jha R. (2011) Expert Opin Drug Discov, 6, 89-102.
5. Firuzi O., Miri R., Tavakkoli M. et al, (2011) Curr Med Chem, 18, 3871-3888.
6. Болдырев A.A. (2012) Биохимия, 77, 403-418.
7. Boldyrev A.A., Aldini G., Derave W. (2013) Physiol Rev, 93, 1803-1845.
8. Федорова T.H., Беляев M.C., Трунова O.A. и соавт. (2008) Биол. мембраны, 25, 479-483.
9. Boldyrev A., Fedorova Т., Stepanova М. et al., (2008) Rejuv Res, 11, 988-994.
10. Margolis F.L., Grillo M., Grannot-Reisfeld N., et al., (1983) Biochim Biophys Acta, 744, 237-248.
11. Stvolinsky S.L., Bulygina E.R., Fedorova T.N., et al. (2010) Cell Mol Neurobiol, 30, 395-404.
12. Goraca A. et al. (2011) Pharmacol. Rep., 63, 849-858.
13. Bilska A., Wlodek L. (2005) Pharmacol. Rep., 57, 570-577.
14. Anti-Aging Complex (ALA/ALC/Carnosine/GSE) // Ray & Terry's Longevity Products. (2011)© Copyright Ray and Terry's Health Products Inc. All Rights Reserved. info@rayandterry.com.
15. Патент US 20060269617 A1.
16. Патент US 20120129781 A1.
17. Kim MY, Kim EJ, Kim YN, et al. (2011) Nutr Res Pract, 5, 421-428.
18. Патент WO 2011080725 A1.
19. C. Nativi, R. Gualdani, E. et al. (2013) Sci. Reports, 3, Article №2005 doi:10.1038/srep 02005.
20 Pegova A., Abe H., Boldyrev A. (2000) Comp Biochem Physiol, 127, Part B, 443-446.
1. Антиоксидантный комплекс для подавления окислительного стресса у млекопитающих, представляющий собой комплекс карнозина с α-липоевой кислотой, полученный путем смешивания α-липоевой кислоты с водным раствором карнозина в эквимолярном соотношении.
2. Антиоксидантный комплекс по п. 1, где смешивание компонентов проводят при обработке ультразвуком или нагревании при 30-40°С.
3. Антиоксидантный комплекс по п. 1 или 2, где после смешивания компонентов полученный раствор подвергают лиофилизации.
4. Применение антиоксидантного комплекса по пп. 1, 2 для защиты млекопитающих от окислительного стресса.