Способ оценки пригодности эритроцитарной взвеси для проведения гемотрансфузии
Иллюстрации
Показать всеИзобретение относится к физико-химическим способам исследования биологического материала и может быть использовано в трансфузиологии для определения пригодности консервированной эритроцитарной взвеси (ЭВ) к переливанию. Способ оценки пригодности ЭВ для проведения гемотрансфузии включает измерения локального модуля Юнга мембран эритроцитов (МЭ) с помощью атомно-силовой спектроскопии и параметров наноповерхности мембран с помощью атомной силовой микроскопии: диаметра, высоты. При этом предварительно осуществляют моделирование процесса движения крови в кровеносном русле путем ротации порции 5 мл ЭВ в термостате при 36-37°C со скоростью вращения 6-8 об/мин в течение 25-30 мин, измеряют локальный модуль Юнга и параметры наноповерхности МЭ; если эти величины лежат в диапазоне контрольных значений: локальный модуль Юнга 40-70 кПа, диаметр наноструктур 30-150 нм, высота 1-10 нм, то делают вывод о пригодности данной ЭВ для гемотрансфузии; если значения локального модуля Юнга и параметров наноповерхности мембран выходят за диапазон контрольных значений, то продолжают ротацию ЭВ в течение 12 ч, повторно измеряют параметры, при восстановлении параметров до контрольных значений делают вывод о пригодности ЭВ, а в случае невосстановления до контрольных значений делают вывод о непригодности ЭВ для гемотрансфузии. Изобретение обеспечивает уточнение параметров годности консервированной ЭВ к трансфузии, особенно при необходимости массовой трансфузии. 3 пр., 6 ил.
Реферат
Изобретение относится к физико-химическим способам исследования биологического материала и может быть использовано в трансфузиологии для определения годности консервированной эритроцитарной взвеси (ЭВ) к переливанию.
Переливание компонентов крови является потенциально опасным способом коррекции и замещения их дефицита у реципиента. Осложнения от переливания компонентов крови могут развиваться как во время или в ближайшее время после трансфузии (непосредственные осложнения), так и спустя длительный период времени - несколько месяцев, а при повторных трансфузиях и спустя несколько лет после трансфузии (отдаленные осложнения). К посттрансфузионным осложнениям относят, в частности, острый гемолиз, а также отсроченный гемолиз. Особенно существенные патологические изменения могут возникнуть в результате массивной трансфузии, необходимой при массивных кровопотерях у больных тяжелой степени в критических состояниях.
Установлено, что ЭВ значительных сроков хранения содержит значительное количество функционально и морфологически неполноценных эритроцитов (I. Mustafa, Al.A. Marwani, Nasr. K. Mamdouh, Kano N. Abdulla, Т. Hadwan. Time Dependent Assessment of Morphological Changes: Leukodepleted Packed Red Blood Cells Stored in SAGM // BioMed research international. 2016; 2016: 4529434. doi: 10.1155/2016/4529434. Epub 2016 Jan 21).
Переливание такой трансфузионной среды приводит к агрегации эритроцитов и тромбированию микроциркуляторного русла и, в конечном счете, не к улучшению, а, наоборот, к ухудшению газотранспортной функции крови. Понимание причины как острого, так и отсроченного гемолиза важно для предотвращения тяжелых осложнений после переливания.
Все вышесказанное говорит об актуальности разработки способа определения годности ЭВ при планировании гемотрансфузии.
Уровень техники
Известен способ определения годности консервированной ЭВ, включающий контроль за показателями ЭВ, который заключается в том, что определяют концентрацию свободного гемоглобина в супернатанте ЭВ после центрифугирования. Повышение уровня свободного гемоглобина в ЭВ и степень гемолиза по международным стандартам не должен превышать 0,8%. Это позволяет выявить последствия влияния различных факторов на ЭВ: нарушение температурного режима или сроков хранения, неправильная подготовка к переливанию, смешивание с гипотоничным раствором и других. Такой анализ позволяет избежать неиммунные осложнения вследствие разрушения эритроцитов донора. (Постановление Правительства РФ от 26 января 2010 г. N 29 "Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии" (с изменениями от 12 октября 2010 г. ); S.O. Sowemimo-Coker. Red blood cell hemolysis during processing // Transfusion medicine reviews. 2002 Jan;16(1): 46-60; I.C. Vermeulen Windsant, N.C. de Wit, J.T. Sertorio, E.A. Beckers, J.E. Tanus-Santos, M.J. Jacobs., W.A. Buurman. Blood transfusions increase circulating plasma free hemoglobin levels and plasma nitric oxide consumption: a prospective observational pilot study // Critical care. 2012 May 25; 16(3): R95. doi: 10.1186/cc11359). Недостатком известного способа является то, что данное условие - уровень гемолиза менее 0,8% не исключает наличия в переливаемой ЭВ морфологически и функционально патологических форм эритроцитов.
Известен способ оценки состояния мембран эритроцитов (МЭ) с помощью атомной силовой микроскопии (АСМ). С помощью этого метода показано, что во время хранения донорской ЭВ существенно изменялись параметры наноструктуры МЭ. Наблюдалась возрастающая динамика развития топологических дефектов во время хранения крови. В результате существенно изменялась морфология клеток - образовывались эхиноциты, сфероэхиноциты и др. Отмечается, что измерение нанодефектов МЭ с помощью АСМ может быть положено в основу разработки метода оценки качества длительно хранящейся донорской крови (Kozlova Е., Chernysh A., Moroz V., Sergunova V., Gudkova О., Kuzovlev A. Nanodefects of membranes cause destruction of packed red blood cells during long-term storage // Experimental cell research. 2015 Oct 1; 337(2): 192-201. doi: 10.1016/j.yexcr.2015.07.009. Epub 2015 Jul 10). Однако размер наноструктуры МЭ является неполным (недостаточным) критерием годности вливаемой ЭВ, так как по мере хранения наряду с изменениями топологии мембраны изменяются и их локальные механические свойства, в частности локальная жесткость мембраны, что связано с существенными изменениями морфологии клеток - образованием эхиноцитов, сфероэхиноцитов и др.
Известно также несколько физико-химических способов определения механических параметров МЭ. При использовании одного из них оценивают хрупкость МЭ. Для этого в эритроцитах вызывают механические напряжения, а хрупкость мембран оценивают по гемолизу клеток (Method to characterize blood and red blood cells via erythrocyte membrane fragility quantification, US 8263408 B2). В другом известном способе деформируемость эритроцитов при механических напряжениях измеряют с помощью эктацитометра (Method to use ektacytometry to improve stored red blood cell or whole blood product utilization US 2011/0318773 A1). В обоих этих способах авторы предлагают использовать измеренные параметры для оценки качества клеток при хранении и при планировании трансфузии. Эти исследования достойны внимания при изучении свойств донорской крови. Однако авторы указанных патентов измеряют механические параметры мембран клеток только в исходном образце ЭВ или крови. При этом авторы не включают в алгоритм исследований изменения механических свойств эритроцитов и их мембран, возникающие после трансфузии по мере циркуляции крови в кровеносном русле и не делают количественных выводов о наличии или отсутствии указанных изменений.
Известен способ измерения упругоэластичных свойств мембраны нативных эритроцитов in vitro непосредственно в физиологической среде с помощью метода атомно-силовой спектроскопии (АСС). (Сергунова В.А., Гудкова О.Е., Козлов А.П., Черныш A.M. Измерение локальной жесткости мембран эритроцитов с помощью атомно-силовой спектроскопии // Общая реаниматология. 2013; 9(1): 14-17. doi: 10.15360/1813-9779-2013-1-14). Для оценки упругоэластичных свойств мембраны авторы используют зависимость F(h), где F - сила, h - глубина индентации зонда в мембрану. Для оценки локального модуля Юнга (Е) используют модель Герца, которая описывает деформацию мембраны при действии на нее сферического зонда: F=(4/3)ER0.5h3/2 (1), где F - сила; Е - модуль Юнга мембраны; R - радиус зонда; h - глубина индентации. Таким образом, по зависимости F(h) можно оценить величину Е для разных глубин погружения зонда. Преимуществом данного способа измерения упругоэластичных свойств мембраны является то обстоятельство, что АСС позволяет оценить локальный модуль Юнга в любой области мембраны.
Однако для решения задачи оценки пригодности ЭВ для проведения гемотрансфузии недостаточно одноразового определения параметров наноструктуры МЭ и измерения упругоэластичных свойств мембран, поскольку потенциальным источником дополнительного изменения наноструктуры и локальной жесткости мембран клеток вливаемой ЭВ является последующее движение эритроцитов в сосудах, и в частности, в микрососудах. В зависимости от исходного состояния эритроцитов при переливании, движение эритроцитов в сосудах может как улучшить, так и ухудшить нанопараметры мембран клеток и изменить локальный модуль Юнга. Поэтому для повышения точности оценки пригодности крови к трансфузии требуется дополнительный этап моделирования реальной ситуации движения крови в сосудах.
Заявляемое изобретение направлено на решение задачи уточнения параметров годности консервированной ЭВ к трансфузии, особенно при необходимости массивной трансфузии.
Использование в клинической практике заявляемого способа позволяет достичь следующих лечебных результатов:
- определение критериев возможности использования ЭВ для гемотрансфузии;
- повышение точности и расширение функциональных возможностей способа;
- уменьшение риска посттрансфузионных осложнений: гемолиза эритроцитов, образования тромбов, закупорки микрососудов, агрегации эритроцитов и вызванных этими процессами других патофизиологических проявлений за счет уточнения параметров годности ЭВ для переливания.
Указанные лечебные результаты при осуществлении изобретения достигаются за счет того, что так же, как в известном способе, определяют локальный модуль Юнга МЭ с помощью АСС и параметры наноповерхности МЭ с помощью АСМ.
Особенность заявляемого способа заключается в том, что предварительно осуществляют моделирование процесса движения крови путем ротации порции 5 мл ЭВ в термостате при 36-37°C со скоростью вращения 6-8 об/мин в течение 25-30 мин, осуществляют измерение величины локального модуля Юнга МЭ в количестве по крайней мере 150 значений и измерение параметров наноповерхности МЭ. Если полученные значения лежат в диапазоне контрольных значений: локальный модуль Юнга 40-70 кПа, диаметр топологических структур 30-150 нм, их высота 1-10 нм, то делают вывод о пригодности данной ЭВ для гемотрансфузии. Если измеренные параметры отличаются от контрольных значений, то продолжают ротацию ЭВ в течение 12 ч. Повторно измеряют параметры, при их восстановлении до контрольных значений делают вывод о пригодности крови, в случае невосстановления делают вывод о непригодности ЭВ для гемотрансфузии.
Раскрытие изобретения
С помощью АСМ показано, что во время хранения донорской ЭВ величина модуля Юнга и параметры наноповерхности мембран существенно изменялись. Наблюдалась динамика развития топологических дефектов во время хранения крови: в первые 7-10 дней появлялись нанодефекты диаметром 100-250 нм, затем к 14-20 дню они трансформировались до 300-600 нм и затем уже нанодефекты преобразовывались в микродефекты 900-1500 нм к 26-35 дням хранения ЭВ. Высота топологических дефектов изменялась по мере хранения ЭВ до 50 нм и более. В результате морфология клеток существенно изменялась - образовывались эхиноциты, сфероэхиноциты и др. (Kozlova Е., Chernysh A., Moroz V., Sergunova V., Gudkova О., Kuzovlev A. Nanodefects of membranes cause destruction of packed red blood cells during long-term storage // Experimental cell research. 2015 Oct 1; 337(2): 192-201. doi: 10.1016/j.yexcr.2015.07.009. Epub 2015 Jul 10).
Однако размеры наноструктуры МЭ является неполным (недостаточным) критерием годности вливаемой ЭВ, так как при изменении топологии мембраны изменяются по мере хранения и локальные механические свойства мембраны, в частности локальная жесткость мембраны. Исследования деформации биологической структуры позволяют сделать заключение о жесткости материала и его механических свойствах. Степень деформации биологической структуры может быть определена путем измерения локального модуля Юнга. Для измерения локального модуля Юнга в различных зонах мембран авторами был использован метод АСС.
Измерение локального модуля Юнга МЭ проводят после получения изображений клеток в жидкости в поле АСМ. На выбранные участки действуют зондом с заданной силой. По деформации биологической структуры делают заключение о локальной жесткости материала.
С помощью АСС и АСМ авторы проводили измерения локального модуля Юнга МЭ и топологических параметров наноструктуры на клетках одной пробы ЭВ. При этом в качестве контрольных значений были установлены: локальный модуль Юнга 40-70 кПа, параметры наноповерхности - диаметр 30-150 нм, высота 1-10 нм. Эти параметры получены авторами в условиях приготовления монослоев в более чем в сотне опытов на нативных клетках в жидкости. Эти же значения приводятся в научной литературе на эту тему.
В научной литературе существует мнение, что по мере циркуляции в кровеносном русле эритроциты могут как восстановить свои механические и структурно-функциональные свойства, так и ухудшить их. Однако получить результаты in vivo не представляется возможным. В научных работах также показано, что целостность эритроцитов и их мембран может быть обратимой или необратимой в зависимости от степени их повреждения. Исследовать это явление непосредственно в кровяном русле достоверно невозможно.
Авторами разработан способ оценки пригодности ЭВ для проведения гемотрансфузии, основанный на оценке способности клеток к восстановлению (или к невосстановлению) параметров мембран до исходных путем моделирования циркуляции крови.
Для проверки соответствия контрольным параметрам осуществляют ротацию образца ЭВ в термостате в течение сначала 25-30 мин (первичная ротация), а затем 12 ч (повторная ротация) при скорости вращения 6-8 об/мин, температурном режиме 36-37°C, осуществляют измерения локального модуля Юнга МЭ с помощью АСС и параметров наноповерхности с помощью АСМ. Сравнивают полученные показатели с контрольными (локальный модуль Юнга 40-70 кПа, диаметр топологических структур 30-150 нм, высота 1-10 нм).
Продолжительность ротации 12 ч определяется средним временем, за которое клетки теоретически могут восстановить свои свойства в кровеносном русле. После этого срока, если клетки не восстановились, то они остаются таковыми до их вывода из организма (Mock DM, Widness JA, Veng-Pedersen P, et al. Measurement of post-transfusion red cell survival with the biotin label. Transfusion Med Rev 2014; pii: S0887-7963(14)00022-4).
В случае если полученные показатели после первичной ротации совпадают с контрольными значениями, то данную ЭВ оценивают как годную к проведению гемотрансфузии. В случае если показатели локальной жесткости и/или параметры наноструктуры после первичной ротации не совпадают с контрольными значениями, то продолжают ротацию 12 ч. Необратимость значений локальной жесткости и/или параметров наноструктуры после ротации (то есть невосстановление до контрольных значений) свидетельствует о непригодности данной ЭВ для трансфузии.
Для оценки упругоэластичных свойств мембраны на выбранные участки измерения жесткости действуют зондом с заданной силой F. По величине деформации биологической структуры делают заключение о локальной жесткости материала. Для определения локального модуля Юнга (Е) используют модель Герца, которая описывает деформацию мембраны при действии на нее сферического зонда: F=(4/3)ER0.5h3/2, где F - сила; Е - локальный модуль Юнга мембраны; R - радиус зонда; h - глубина индентации. По зависимости F(h) оценивают величину Е для разных глубин погружения зонда.
Подтверждением правильности сделанных выводов и технической применимости заявляемого способа могут служить рабочие протоколы, содержащие исходные условия проводимых исследований и их результаты.
Протокол №1. Пакет с ЭВ П1
ЭВ хранили при температуре 4°C в течение 33 суток. Пробу ЭВ 5 мл в пробирке подвергали ротации 30 мин в термостате при 36,5°C, скорости вращения 8 об/мин.
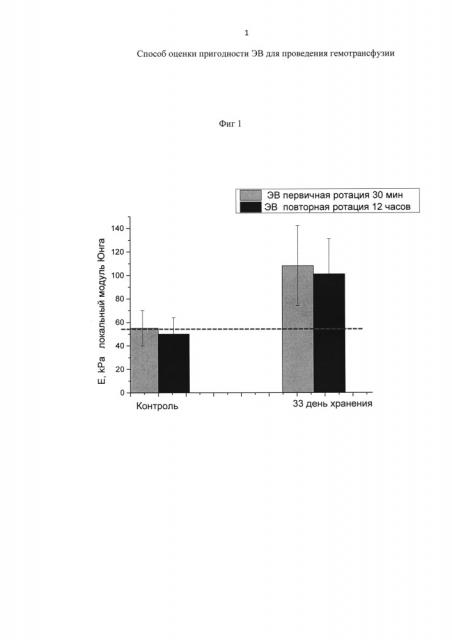
Затем провели измерение локального модуля Юнга МЭ и параметров наноструктуры (Фиг. 1) и (Фиг. 2).
Из Фиг. 1 и Фиг. 2 следует, что в пробе после 33 дней хранения и локальный модуль Юнга МЭ, и наноструктура мембран отличаются от контрольных значений. Был сделан вывод о непригодности ЭВ данного пакета для трансфузии.
Для проверки этого утверждения продолжили ротацию 12 ч в термостате. После ротации локальный модуль Юнга не восстановился до контрольных значений (остался выше красной линии) (Фиг. 1). Не восстановились до контрольных и параметры наноструктуры мембраны. Необратимость параметров мембран клеток ЭВ в опыте с ротацией подтвердила утверждение о непригодности данной ЭВ для трансфузии.
Протокол №2. Пакет с ЭВ П2
ЭВ хранили 12 суток. Пробу ЭВ 5 мл в пробирке подвергали ротации 30 мин в термостате при 36,5°C, 8 об/мин. Провели измерение параметров локального модуля Юнга и наноструктуры мембран клеток. Результаты представлены на Фиг. 3 и Фиг. 4. В данной ЭВ и параметры наноструктуры и локальная жесткость не превысили контрольные значения. Был сделан вывод о пригодности ЭВ данного пакета для трансфузии.
Для проверки этого утверждения продолжили ротацию. После ротации локальный модуль Юнга не превысил контрольных значений (остался около красной линии) (Фиг. 4). Остались соизмеримыми с контрольными и параметры наноструктуры мембраны. Опыт с ротацией в течение 12 ч подтвердил утверждение о пригодности данной ЭВ для трансфузии.
Протокол №3. Пакет с ЭВ П3
ЭВ хранили 16 суток. Пробу ЭВ 5 мл в пробирке подвергали ротации 30 мин в термостате при 36,5°C, 8 об/мин. Провели измерение локального модуля Юнга мембран клеток и параметров наноструктуры. Результаты представлены на Фиг. 5 и Фиг. 6. В данной ЭВ параметры наноструктуры почти не превысили контрольные значения, а локальная жесткость была выше контрольной.
Был сделано предположение о непригодности ЭВ данного пакета для трансфузии.
Для проверки этого утверждения продолжили ротацию пробы в термостате в течение 12 ч. После ротации локальный модуль Юнга не восстановился до контрольных значений (остался выше красной линии) (Фиг. 6). Параметры наноповерхности стали выше контрольных (Фиг. 5). Необратимость локальной жесткости после ротации и ухудшение параметров наноструктуры подтвердили утверждение о непригодности данной ЭВ для трансфузии.
Краткое описание чертежей
На Фиг. 1 изображены контрольные значения локального модуля Юнга МЭ и значения локального модуля Юнга МЭ после хранения в течение 33 дней, после ротации в течение 25-30 мин и после ротации в течение 12 ч.
На Фиг. 2А изображена наноструктура контрольных МЭ, на Фиг. 2В - наноструктура МЭ после хранения в течение 33 дней.
На Фиг. 3 изображены контрольные значения локального модуля Юнга МЭ и значения локального модуля Юнга МЭ после хранения в течение 12 дней (после ротации в течение 25-30 мин и после ротации в течение 12 ч).
На Фиг. 4 изображены контрольные значения параметров наноструктуры клеток в ЭВ и параметры наноструктуры клеток в ЭВ после хранения в течение 12 дней (после ротации в течение 25-30 мин и после ротации в течение 12 ч).
На Фиг. 5 изображены контрольные значения локального модуля Юнга МЭ и значения локального модуля Юнга МЭ после хранения в течение 16 дней (после ротации в течение 25-30 мин и после ротации в течение 12 ч).
На Фиг. 6 изображены контрольные значения параметров наноструктуры клеток в ЭВ и параметры наноструктуры клеток в ЭВ после хранения в течение 16 дней (после ротации в течение 25-30 мин и после ротации в течение 12 ч).
Способ осуществляют следующим образом.
Порцию ЭВ 5 мл переливают из пакета в пробирку, пробирку с кровью помещают в термостат при 36-37°C и непосредственно в термостате проводят ротацию со скоростью 6-8 об/мин. Через 30 мин после ротации из пробирки берут первую порцию ЭВ (50 мкл) - первичная ротация, затем продолжают ротацию в термостате и через 12 ч после ротации (повторная ротация) берут вторую порцию ЭВ (50 мкл). Раздельно осуществляют измерения локального модуля Юнга и параметров наноструктуры мембран клеток после первичной и повторной ротаций.
Для измерения локальной жесткости МЭ берут пробу ЭВ 50 мкл, разбавляют в 50 мл буфера (PBS, рН 7,4), суспензию наносят на стекло с полилизином, выдерживают 40 мин. Затем опускают стекло в раствор 1% глютарового альдегида на 20 с, промывают в буфере. Через 40 минут после формирования монослоя полученный образец помещают в жидкостную кювету с буфером. Кювету устанавливают и фиксируют на операционном столике атомного силового микроскопа. Измерение локального модуля Юнга МЭ проводят после получения изображений клеток в жидкости в поле АСМ, используют кантилеверы SD-R150-T3L450B-10 (радиус зонда 150 нм, к=0,15 Н/м). На участки мембран клеток действуют зондом с заданной силой F. По прогибу кантилевера измеряют деформацию мембраны h и по формуле Герца F(h) вычисляют модуль Юнга. Измерение локального модуля Юнга проводят по крайней мере в трех точках на клетке, и по крайней мере на 50 клетках. Проводят стандартную статистическую обработку полученных результатов.
Для измерения параметров наноповерхности МЭ той же пробы удаляют жидкость из кюветы, при этом кювета с образцом остается в том же фиксированном положении. Далее образец высушивают на воздухе в течение двух часов при комнатной температуре. Затем устанавливают кантилевер NSG01, радиус зонда 10 нм, к=5Н/м. Сканируют монослой клеток (не менее 100), поле сканирования 100*100 мкм, 30*30 мкм. Получают изображения в 2D и 3D форматах, строят профиль наноповерхности и измеряют параметры наноструктуры, используя программное обеспечение АСМ. Проводят стандартную статистическую обработку полученных результатов.
После первичной ротации сравнивают значения локального модуля Юнга и параметры наноструктуры с контрольными значениями. Если показатели лежат в диапазоне контрольных значений, то делают вывод о пригодности данной ЭВ для трансфузии. Если показатели выходят за диапазон контрольных значений, то проводят повторную ротацию, проверяют восстановление до контрольных значений и делают вывод о пригодности данной ЭВ для трансфузии.
Способ оценки пригодности эритроцитарной взвеси (ЭВ) для проведения гемотрансфузии, включающий измерения локального модуля Юнга мембран эритроцитов (МЭ) с помощью атомно-силовой спектроскопии и параметров наноповерхности мембран с помощью атомной силовой микроскопии: диаметра, высоты, отличающийся тем, что предварительно осуществляют моделирование процесса движения крови в кровеносном русле путем ротации порции 5 мл ЭВ в термостате при 36-37°C со скоростью вращения 6-8 об/мин в течение 25-30 мин, измеряют локальный модуль Юнга и параметры наноповерхности МЭ, если эти величины лежат в диапазоне контрольных значений: локальный модуль Юнга 40-70 кПа, диаметр наноструктур 30-150 нм, высота 1-10 нм, то делают вывод о пригодности данной ЭВ для гемотрансфузии, если значения локального модуля Юнга и параметров наноповерхности мембран выходят за диапазон контрольных значений, то продолжают ротацию ЭВ в течение 12 ч, повторно измеряют параметры, при восстановлении параметров до контрольных значений делают вывод о пригодности ЭВ, а в случае невосстановления до контрольных значений делают вывод о непригодности ЭВ для гемотрансфузии.