Способ получения нативного белка пролонгирующего действия в составе полимерных наносфер и резорбируемых микросфер для доставки
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к наномедицине, которая использует биодеградируемые наносферы и микросферы для включения в их состав биологически активных белков для стабилизации их структуры. Cпособ предусматривает предварительное включение гистона животного происхождения в состав матрикса наносфер диаметром не более 1000 нм, которые получают на основе декстрана, и последующее включение наносфер с гистоном в резорбируемые микросферы, которые получают на основе сополимера полилактид-гликолида, микросферы осаждают этиловым спиртом, осадок отфильтровывают и высушивают. Высвобождение гистона из резорбируемых микросфер происходит в течение не менее 50-ти суток. Изобретение обеспечивает сохранение нативной структуры белка за счет его включения в состав полимерных наносфер и повышает надежность, и упрощает способ получения нативного белка в составе полимерных наносфер и резорбируемых микросфер, которые предназначены для пролонгации физиологического действия нативного белка, применяемого в терапевтических целях. 3 пр., 2 ил., 1 табл.
Реферат
Изобретение относится к области медицины, в частности к наномедицине, которая использует нанотехнологии и наноструктурные системы в области нанодиагностики, нанотерапии и тканевой инженерии.
Наночастицы определяют как плотные коллоидные частицы, размеры которых лежат в диапазоне от 10 до 1000 нм. Наночастицы, в основном, могут быть построены из макромолекул или ансамблей макромолекул, таких как синтетические преформированные полимеры (например, сополимер полилактид-гликолид, полилактид-полиэтиленгликоль), или из природных макромолекул, таких как альгинат, хитозан, желатин, а также из полисахаридов (декстран). В наночастицах лекарственное средство или биологически активные высокомолекулярные соединения либо растворены, включены, инкапсулированы, либо адсорбированы, либо химически связаны с матриксом наночастиц [1]. В зависимости от способа изготовления наночастицы можно получить в виде наносфер или нанокапсул. Нанокапсулы - это система, в которой лекарственное средство заключено в полость капсулы, окруженной специфической полимерной мембраной. Наносферы - это матриксная система, в которой лекарственное средство физически и однородно диспергировано в матриксе полимера.
Биодеградируемые микро- и наночастицы используют для включения в их состав биологически активных макромолекул для повышения их стабильности, биодоступности и повышения терапевтического индекса при непрерывном и контролируемом высвобождении в течение длительного периода времени [2-4].
Рассматривают три возможных механизма высвобождения лекарственных средств или биомакромолекул, включенных в микро- и наночастицы:
- в результате диффузии через поры;
- в результате ферментативного расщепления или деградации полимера;
- при диссоциации лекарственного средства или биомакромолекул, связанных с полимером.
Высвобождение инкапсулированных макромолекул в результате деструкции полимера рассматривается как механизм контролируемого высвобождения макромолекул, который зависит от состава полимера (гомополимер или гетерополимер), молекулярной массы полимера и соотношения входящих в состав гетерополимера мономеров.
Способность направленной доставки лекарственных средств к мишени определяют такие факторы как размеры наночастиц, их поверхностный заряд, гидрофильность и характер модификации их поверхности [5-7].
Исходя из этого, в каждом конкретном случае для нового класса белковых молекул, предназначенных для инкапсулирования в наночастицы, требуется индивидуальное проектирование технологического процесса их приготовления, т.е. процесса формулирования с учетом особенностей их физико-химических свойств, выбора мишени их действия и путей введения в организм.
Процесс формулирования наносфер с преформированными полимерами включает удаление органического растворителя из системы формулирования [8]. В этом способе полимер растворяют в органическом растворителе. Лекарственное средство диспергируют в растворе преформированного полимера, затем смесь эмульгируют в водном растворе, чтобы получить эмульсию как масло (О, oil) в воде (W, water), то есть О/W эмульсию, используя эмульгирующий агент. После образования эмульсии органический растворитель удаляют либо при повышенной температуре, либо в вакууме, либо при продолжительном перемешивании, что приводит к образованию наночастиц. Способ спонтанной эмульгации (способ диффузии органического растворителя) рассматривают как модифицированную версию способа удаления органического растворителя. В этом способе водорастворимый органический растворитель, наряду с водонерастворимым органическим растворителем, используют как органическую фазу. За счет спонтанной диффузии водорастворимого органического растворителя на границе раздела между двумя фазами возникает турбуленция, что приводит к образованию частиц малого размера. Этот технологический прием получения наносфер, также известен как способ нанопреципитации.
Фактически, формулирование наночастиц основано на использовании наноэмульсионных систем, которые можно рассматривать как матрицы для получения наночастиц.
Микросферы на основе резорбируемого сополимера полилактид-гликолида часто используют при создании систем доставки биологически активных макромолекул. Однако имеется ряд проблем, связанных с использованием этих систем. Во-первых, для приготовления нагруженных белком микросфер используют органические растворители, которые оказывают неблагоприятное воздействие на стабильность белковых молекул.
Во-вторых, белки высвобождаются из микросфер либо через поры, либо при деградации полимерного матрикса микросфер. В-третьих, при деградации полимерного матрикса происходит генерация продуктов деградации, что, возможно, приводит к снижению значения рН в системе и химической деградации инкапсулированного белка. Наряду с этим, создание микросфер для пролонгированного высвобождения белка в течение продолжительного периода времени (до нескольких месяцев) требует разработки способа эффективного инкапсулирования белка в микросферы.
Оптимизация процессов получения микрочастиц на основе сополимера полилактид-гликолида, нагруженных белком для последующего пролонгированного их высвобождения, требует полного предохранения нативной структуры белка как в процессе его приготовления, так и его использования. Денатурация и агрегация молекул белка не только отменяет их терапевтическую активность, но и обуславливает побочные эффекты, такие как иммуногенность и токсичность.
Загрузка белкового лекарственного средства в наночастицы достигается двумя способами [9]. Первый способ основан на включении лекарственного средства в процессе получения наночастиц. Второй способ основан на адсорбции лекарственного средства на уже сформированных наночастицах в результате проведения процесса инкубации наночастиц в растворе лекарственного средства.
Помимо способа включения и адсорбции лекарственного средства известны способы химического конъюгирования лекарственных средств на поверхности наночастиц [4].
Во всех известных способах приготовления микрочастиц стартовой позицией является растворение сополимера полилактид-гликолида в органическом растворителе, обычно в хлористом метилене или этил ацетате (органическая фаза).
Рассматривают два различных подхода в процессе инкапсулирования препарата белка, которые различаются в зависимости от физического состояния белка. Для инкапсулирования используют либо растворы белка (растворимая форма), либо используют сублимационно высушенный препарат белка, или переводят белок в нерастворимую форму и получают «твердые» частицы белка («твердая» форма белка). Для получения «твердых» частиц, содержащих белковый препарат, используют стабилизаторы белка, такие как соли, сахара, детергенты, ионы металлов.
Однако многие стабилизаторы белков ограничивают продолжительность и непрерывность высвобождения белка после его инкапсулирования в систему непрерывного высвобождения.
Современные стратегии формулирования белковых препаратов можно отнести к двум категориям:
- формулированию белков в твердые частицы перед их инкапсулированием с целью увеличения их резистентности к органическим растворителям;
- наноинкапсулированию белков в полимерные материалы, которые растворимы в воде, что позволяет избежать контакта с органическими растворителями, которые используют для растворения биодеградируемых полимеров в системах непрерывного высвобождения [10].
Известны способы преобразования белков в твердые частицы перед микроинкапсулированием в полимерные структуры для их последующего непрерывного высвобождения из системы [11]. Белковые частицы образуются при фазовом разделении совместного раствора белок-полиэтиленгликоль (PEG) в процессе замораживания. Поскольку PEG растворим в органических растворителях, очищенные частицы белка получают сублимацией совместного раствора белка и PEG, с последующим удалением PEG фазы. Принцип этого способа основан на фазовом разделении водной смеси PEG-белок, индуцированном при использовании технологического приема «конденсация замораживанием». Белковые частицы образуются при фазовом разделении совместного раствора белок-PEG в процессе замораживания. В результате последующего процесса лиофилизации сферические микродомены белка, рассредоточенные в непрерывной «твердой фазе» PEG, могут образовываться при конкретных условиях. После растворения PEG в хлористом метилене получают суспензию микронизированных белковых частиц. Полученные белковые частицы добавляют к раствору сополимера полилактид-гликолида в органическом растворителе для формирования суспензии белок-в-растворе сополимера полилактид-гликолид и эмульгируют в водной непрерывной фазе, содержащей поливиниловый спирт в качестве эмульгатора, для образования сложных микросфер. Этот процесс известен как S/O/W (твердые частицы -в масле -в воде) микроинкапсулирование.
Однако белковые частицы при инкапсулировании окружены гидрофобным полимером матрикса микросфер (например, сополимер полилактид-гликолид). Поэтому к недостаткам этого способа относят как присутствие органических растворителей, так и гидрофобного полимерного матрикса.
Известно, что декстрановые микросферы получают при использовании приема эмульгирования в системе «вода-в-воде» [12]. Этот прием основан на неспособности к смешиванию водорастворимых полимеров в водных растворах. Полимеры остаются в растворе, но расслаиваются на две водные фазы при превышении концентрации выше определенного значения. Когда водные растворы PEG и декстрана смешивают, то получают двухфазную систему в зависимости от молекулярной массы и концентрации обоих полимеров. После приготовления эмульсии декстрановые частицы подвергают химической сшивке (предварительно в декстран вводят метакрилатные остатки). При этом микрочастицы приобретают свойства гидрогелей. Поперечно-сшитые декстрановые частицы отделяют при центрифугировании, при этом средний размер частиц лежит в диапазоне от 2,5 до 25 мкм. Высвобождение белка из таких микрочастиц осуществляют с помощью предварительно включенной в микросферы эндо-декстраназы. При этом высвобождение белка из микросфер линейно связано с количеством включенной декстраназы.
Таким образом, декстрановые микросферы, которые подвергаются ферментативной деградации, имеют некоторые недостатки. Во-первых, регулирование высвобождения белка определяется изменением количества сшивок с помощью метакрилата. Во-вторых, необходимо проводить введение целевого белка совместно с декстраназой.
Известен способ для загрузки белков в полисахаридные частицы в отсутствие гидрофобного-гидрофильного поверхностного натяжения. Этот способ основан на разделении двух водных фаз [13]. В этом способе для предотвращения слияния полисахарид-дисперсионных фаз и формирования блокирующей фазы в систему двойной водной фазы декстран-PEG вводят третий компонент, в качестве которого используют альгинат натрия [14]. Анионный полисахарид альгинат натрия формирует диффузионный заряженный слой вокруг диспергированных декстрановых капель, это удерживает их от слияния друг с другом. В результате, двухфазная система становится стабильной в эмульсии «жидкость-жидкость».
Таким образом, белки, которые предпочтительно отделяются в декстран-дисперсионную фазу при разделении двух водных фаз (см. 11), в данном случае предварительно переводят в фазу плотных стекловидных (glassy, некристаллических или стекловидных) наночастиц, которые устойчивы к органическим растворителям в процессе проведения лиофилизации. Такие декстрановые наночастицы, имеющие диаметр 200-500 нм, включают в микросферы на основе сополимера полилактид-гликолида, используя S/O/W процесс микроинкапсулирования.
«Упаковка» белков в декстрановые стекловидные наночастицы перед микроинкапсулированием предохраняет белки от деградации, снижения биологической активности и адсорбции на сополимере полилактид-гликолида как в процессе формулирования в микросферы, так и при непрерывном их высвобождении из полимерной системы в течение длительного периода времени.
Однако эта система имеет некоторые недостатки. Например, необходимость использования относительно концентрированных водных растворов двух гидрофильных полимеров (полисахарида и PEG раствора) и использование третьего водорастворимого полимера полиэлектролита, несущего отрицательный заряд как для формирования эмульсии «вода-вода», так и для стабилизации дисперсионной полисахаридной фазы от слияния. Кроме того, некоторые белки могут интенсивно взаимодействовать с полиэлектролитами за счет ионных взаимодействий.
Известен способ приготовления полисахаридных стекловидных микрочастиц, которые имеют диаметр менее 10 мкм, а также наночастиц, которые имеют диаметр 500 нм и содержат в своем составе подвергающиеся деградации агенты, такие как белки, пептиды, продуценты генной инженерии, вакцины, антитела, вирусы, липосомы. В основу способа положен принцип эмульгации в системе «вода-вода» при низкой температуре и индуцированного замораживанием фазового разделения [15, 16].
Этот способ обеспечивает приготовление полисахаридных частиц, содержащих структурно-нестабильные агенты, такие как белки без использования полиэлектролитов. Однако, без образования диффузионного заряженного слоя вокруг дисперсионной фазы (см. 13-14), дисперсионные капли сливаются, и образование двух фаз блокируется сразу после прекращения механических воздействий (например, перемешивания). Чтобы избежать эффекта, приводящего к блокированию образования фаз, используют технологические приемы, которые стабилизируют водные капли в водной непрерывной фазе без использования полиэлектролитов. Используют два приема для стабилизации диспергированных водных капель от агрегации и слияния двух фаз, которые основаны на проведении процессов при низкой температуре: низкая температура при приготовлении водной эмульсии и замораживание, индуцирующее двухфазное водное разделение. К недостаткам этого способа относят способность белков, растворенных в растворе PEG образовывать частицы при замораживании - высушивании. Другими словами, фазовое разделение, индуцированное замораживанием, также может иметь место для растворов белок-PEG (см. 11). Следовательно, белки, которые формируют собственные частицы наряду с декстрановыми частицами, будут совместно осаждаться из PEG раствора в продолжении замораживания.
Известен способ приготовления полимерных микросфер, которые получают на основе кристаллизованного декстрана при эмульгировании водного раствора декстранов с молекулярной массой 500 kDa и 10 kDa в органической эмульсионной среде, в качестве которой используют растительное масло [17]. Такую эмульсию двух несмешивающихся жидкостей подвергают ультразвуковой обработке. Затем полученную суспензию вносят в ацетон для осуществления кристаллизации полисахарида в эмульсионной среде. Образованные микросферы отделяют от суспензии при центрифугировании. Окончательно осадок микросфер высушивают при комнатной температуре. Образцы микросфер из кристаллизованного декстрана по данным электронной микроскопии имеют диаметр не более 1000 нм. Известный способ предусматривает ковалентное связывание положительно заряженных белков, в качестве которых используют гистоны, с поверхностью декстрановых микросфер. Ковалентное связывание обусловлено реакцией между -аминогруппами лизиновых остатков в молекуле гистона и активными группами в цепях полисахаридов. Количество ковалентно связанного гистона с поверхностью микросфер составляет от 60 до 200 мкг белка на 1,0 г наносфер.
Недостатком известного способа является модификация поверхности декстрановых микросфер положительно заряженными гистонами, что препятствует созданию микрочастиц для продолжительной циркуляции после их введения in vivo [17, 18].
Известно, что адсорбция определенных белков плазмы крови, таких как IgG, альбумин, компоненты комплемента (общее название этих белков - «опсонины»), а также гистонов [19, 20], на поверхности микрочастиц и фагоцитоз микрочастиц являются взаимосвязанными процессами. Опсонины действуют как «мостик» между микрочастицами и фагоцитами. Когда микрочастицы вводят внутривенно, они легко узнаются иммунной системой организма и затем выводятся из циркуляции (иммунный клиренс).
Следовательно, исследование процесса опсонизации наноносителей, наряду с установлением их распределения в различных органах после введения in vivo, как и последующее выведение (клиренс) из организма, одинаково важно для развития наномедицинских технологий.
Известен способ приготовления состава для контролируемого высвобождения рекомбинантного инсулина человека при пероральном применении, который является наиболее близким по технической сущности предполагаемому изобретению и выбран в качестве прототипа [21]. Известный состав включает микрочастицы, которые предварительно получают на основе кристаллизованного декстрана и рекомбинантный инсулин человека, который добавляют к водной суспензии микрочастиц, причем инсулин адсорбируется на поверхности микрочастиц, которые получают на основе водного раствора декстрана 55-65%-ной концентрации с молекулярной массой от 20 до 75 kDa, затем раствор выдерживают в течение 3-х часов при температуре 60°C, и после кристаллизации декстрана в результате упаривания воды формируются микрочастицы, которые осаждают из раствора при центрифугировании и высушивают при комантной температуре, причем микрочастицы имеют диаметр более 500 нм и не более 5000 нм, затем приготавливают водную суспензию микрочастиц и в полученную суспензию вносят равный объем инсулина, который растворяют до 15-30%-ной концентрации в дистиллированной воде, затем суспензию повторно центрифугируют и получают плотные микрочастицы, содержащие в составе инсулин, причем инсулин адсорбируется на поверхности и/или в порах дестранового матрикса.
Недостатком известного способа приготовления состава для контролируемого высвобождения инсулина, в котором инсулин адсорбирован на поверхности декстранового матрикса, является доступность белка к действию протеолитических ферментов, в частности, в процессе его высвобождении из состава при пероральном введении животным. Поэтому время действия инсулина ограничено одними сутками, как показано в эксперименте.
Кроме того, микрочастицы, полученные на основе кристаллизованию декстрана, представляют гетерогенную по размерам популяцию микрочастиц, диаметр которых лежит в пределах более 500 нм и не более 5000 нм.
Необходимо отметить, что в настоящее время микрочастицы с диаметром от 10 до 1000 нм определяют как плотные коллоидные наночастицы или наносферы [1]. Поэтому, можно предположить, что в данной гетерогенной по размеру популяции микрочастиц присутствуют как наночастицы или наносферы, так и микрочастицы или микросферы.
Предлагаемое изобретение лишено указанных недостатков благодаря предварительному включению биологически активного белка, в качестве которого используют гистон животного происхождения, в структуру матрикса декстрановых наносфер в процессе их получения. Такие наносферы, содержащие гистон, предназначены для последующего их включения в резорбируемые микросферы на основе сополимера полилактид-гликолида для пролонгированного высвобождения нативного гистона.
В научно-технической литературе профили высвобождения белков из различных микрочастиц классифицируют на четыре категории: А, В, С, D. Разделение основано на величине начального бурст-высвобождения, длительности высвобождения белка и кинетике устойчивого состояния высвобождения после бурст-высвобождения соответственно в каждой категории [22]. Бурст-высвобождение рассматривается как исходное высвобождение в течение первых 24 ч. В категории А вслед за исходным бурст-высвобождением (с выходом более 30%) следует незначительное добавочное высвобождение. В категории В вслед за низким исходным бурст-высвобождением (менее 30%) следует незначительное добавочное высвобождение. Если формулированный белок при его высвобождении имеет исходное бурст-высвобождение менее 30%, но общее высвобождение белка составляет более 60%, тогда такой тип высвобождения относят к категории С .Категорию D рассматривают как идеальный профиль высвобождения белка с низким бурст-высвобождением, за которым следует устойчивое состояние высвобождения всего загруженного в систему белка.
Неполное высвобождение биоактивного белка из микросфер, полученных на основе резорбируемого сополимера полилактид-гликолида, связывают с одним из следующих явлений: ковалентная или нековалентная агрегация, гидролиз или неспецифическая адсорбция на матриксе полимера. Нестабильность белка в процессе высвобождения может быть следствием локального снижения рН внутри микрочастиц за счет задержки кислотных продуктов деградации полимера.
Для пояснения свойств белков, в частности гистонов, используемых в заявляемом изобретении, заявитель считает целесообразным дать их характеристику в приложении к данному описанию (см. Приложение).
Техническим результатом заявленного изобретения является сохранение нативной структуры белка, предварительно включенного в структуру матрикса наносфер диаметром не более 1000 нм, приготовленных на основе декстрана, повышение надежности и упрощение способа включения белка и удешевления способа получения наносфер, предназначенных для последующего включения в резорбируемые полимерные микросферы, которые получают на основе сополимера полилактид-гликолида, что обеспечивает пролонгированное высвобождение гистона в результате резорбции микросфер в течение не менее 50-ти суток и имеет ряд преимуществ, которые обусловлены, в основном тем, что:
1) физическое включение белка в наносферы менее сложный процесс, чем химическое присоединение к поверхности наносфер;
2) получение наносфер с включенными в их состав белками дешевле и может иметь промышленный масштаб по сравнению с химическим присоединением белка к поверхности наносфер;
3) инкапсулирование наносфер с включенными в их состав белками в микросферы с пролонгированным высвобождением белков из их состава обеспечивает их эффективность и специфичность действия за счет:
- предохранения белков от действия протеолитических ферментов и гидролитической деградации при взаимодействии с биологическими компонентами in vivo;
- устранения потенциально возможных токсических эффектов белков при прямом их введении в организм различными путями;
- повышения биологического периода полураспада белка в системе циркуляции и возможности снижения терапевтических доз белка;
- повышение терапевтического индекса (соотношение между LD 50 и ED 50, где LD 50, полу-летальная доза и ED, 50% эффективная доза), за счет непрерывного высвобождения белкового лекарственного средства в течение длительного периода времени;
- преимущества использовании непрерывной доставки белковых препаратов в терапевтических целях, которые заключаются в поддержании его концентрации в сыворотке в пределах «терапевтического окна» (терапевтическое окно, временной период в пределах которого концентрация лекарственного средства ниже токсической величины и выше терапевтической величины).
Технический результат достигается тем, что в известном способе приготовления и использования состава для перорального введения, содержащего рекомбинантный инсулин человека, который включает известные и общие с заявленным новым способом признаки, где состав содержит водную суспензию микрочастиц с диаметром более 500 нм и не более 5000 нм, которые получают на основе кристаллизованного декстрана и водный раствор инсулина, который вносят в предварительно полученную водную суспензию микрочастиц, где инсулин адсорбируется на поверхности декстранового матрикса, в предлагаемом способе используют белок животного происхождения, и в качестве белка используют сублимационно высушенный гистон, который растворяют до 1,0%-ной концентрации в дистиллированной воде, затем водный раствор гистона добавляют в равном объеме к водному раствору декстрана 6%-ной концентрации с молекулярной массой от 50 до 70 kDa, затем раствор, содержащий декстран и гистон, выдерживают в течение 30±5 мин при температуре 6±2°С, затем этот раствор добавляют в органическую жидкость, в качестве которой используют растительное масло, в количестве 3,5 объема от объема исходного раствора, и получают смесь двух несмешивающихся жидкостей, которую перемешивают и повторно выдерживают в течение 30±5 мин при температуре 6±2°C и получают суспензию, затем суспензию подвергают ультразвуковой обработке в течение 45±5 с при мощности излучения 100 Вт, затем полученную суспензию центрифугируют, а центрифугирование проводят в течение 5±1 мин при 2000g, затем осадок высушивают при комнатной температуре и получают наносферы диаметром не более 1000 нм, содержащие гистон, после чего приготавливают первичную суспензию наносфер в предварительно приготовленном растворе полимера, в качестве которого используют резорбируемый сополимер полилактид-гликолид с молекулярной массой от 50 до 80 kDa при молярном соотношении мономеров, равном 75:25, который растворяют до 10%-ной концентрации в гидрофобном органическом растворителе, в качестве которого используют хлористый метилен, перемешивают в течение 60±5 мин при температуре 6±2°C, причем в раствор полимера добавляют наносферы с гистоном при весовом соотношении наносфер и полимера, равном 1:50, затем к раствору добавляют этиловый спирт в количестве 10 объемов по отношению к объему исходного раствора, затем смесь перемешивают и получают вторичную суспензию, которую подвергают диспергированию при перемешивании в течение 10 мин. при комнатной температуре для равномерного распределения полимера в органическом растворителе и формирования микросфер, затем микросферы осаждают из суспензии при добавлении охлажденного этилового спирта, который добавляют в 100-кратном объеме по отношению к объему суспензии, затем осадок микросфер помещают на мелкопористый стеклянный фильтр и отфильтровывают, затем осадок собирают и высушивают при комнатной температуре в течение 8±2 ч, и полученные резорбируемые микросферы, содержащие в своем составе наносферы с гистоном с содержанием белка на 1,0 мг сухого веса микросфер от 2,0 до 4,0 мкг вносят в модельную среду инкубации, в качестве которой используют фосфатно-солевой буферный раствор, рН 7,2 и подвергают инкубации при +21°C в течение 2-х месяцев, отслеживая при этом через каждые сутки в течение не менее 50-ти суток концентрацию белка в инкубационной среде, после чего полученные нативные белки в составе резорбируемых микросфер используют в качестве основы пролонгации физиологического действия белков.
Таким образом, предварительное включение белка в матрикс наносфер и последующее включение наносфер в состав резорбируемых микросфер обеспечивает сохранение нативной структуры белка за счет устойчивости белка к действию протеолитических ферментов, так же, как и к органическим растворителям, и кислотному окружению в составе микросфер при пролонгированном высвобождении белка.
Заявленный способ был апробирован в лабораторных условиях на лабораторной базе Санкт-Петербургского государственного университета. Результаты проведенных исследований поясняются следующими примерами и чертежами.
На Фиг. 1 представлены результаты электронной микроскопии наносфер, полученных на основе декстрана (×1000). Адсорбция на поверхности стекла. Показано, что наносферы имеют средний диаметр не более 1000 нм и формируют однородный слой на поверхности стекла. Слой наносфер на поверхности стекла устойчив к действию инкубационной среды при длительном хранении.
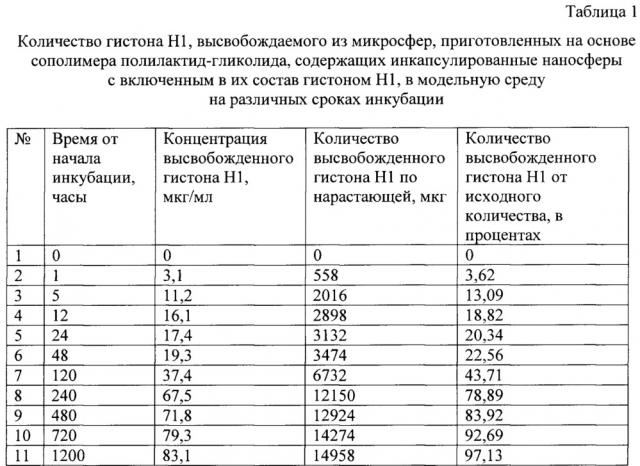
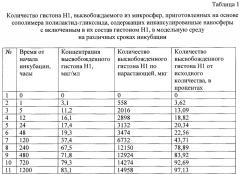
На Фиг. 2 представлен график высвобождения гистона H1 из резорбируемых микросфер, приготовленных на основе сополимера полилактид-гликолида, содержащих декстрановые наносферы с включенным в их состав гистоном H1, в модельную среду инкубации в зависимости от времени от начала инкубации в фосфатно-солевом буферном растворе в течение 50-ти суток. По оси абсцисс - время инкубации в часах.
По оси ординат - количество высвобожденного белка в процентах от исходного количества белка в микросферах.
На представленном графике видно, что в течение первых 2-х суток количество высвобождаемого гистона H1 составляет 20-22% от количества исходного белка. После 120 ч выход белка составлял 43%, после 240 ч - 79%, после 480 ч - 84% и после 720 ч - 92%. Полное высвобождение гистона H1 наступает в течение 50-ти суток (1200 ч) и составляет 97% от начала инкубации.
Пример 1. В этой серии экспериментов осуществления предлагаемого изобретения способ получения биологически активного белка в составе полимерных наносфер предусматривает использование стабильной полимерной суспензии двух несмешивающихся жидкостей (водный раствор - органическая жидкость), в качестве которых используют водный раствор декстрана, содержащий белковый препарат (дисперсионная фаза) и органическую жидкость, в качестве которой используют растительное масло (непрерывная фаза).
В частном конкретном случае способ осуществляют следующим образом. В качестве модельного белка используют гистон H1. Получение гистона H1 осуществляют следующим образом. Предварительно получают препарат суммарного гистона сернокислого из ткани тимуса телят известным способом [23]. Затем из водного раствора суммарного гистона отделяют гистон H1 от других классов гистонов известным способом [24].
Приготавливают водный раствор декстрана и водный раствор белка, причем используют сублимационно высушенный гистон, который растворяют до 1,0%-ной концентрации в дистиллированной воде, затем водный раствор гистона добавляют в равном объеме к водному раствору декстрана 6%-ной концентрации с молекулярной массой от 50 до 70 kDa, затем раствор, содержащий декстран и гистон, выдерживают в течение 30±5 мин при температуре 6±2°C, затем этот раствор добавляют в органическую жидкость, в качестве которой используют растительное масло, в количестве 3,5 объема от объема исходного раствора, и получают смесь двух несмешивающихся жидкостей, которую перемешивают и повторно выдерживают в течение 30±5 мин при температуре 6±2°С и получают суспензию, затем суспензию подвергают ультразвуковой обработке в течение 45±5 с при мощности излучения 100 Вт, затем полученную суспензию центрифугируют, а центрифугирование проводят в течение 5±1 мин при 2000g, затем осадок высушивают при комнатной температуре и получают наносферы диаметром не более 1000 нм, содержащие гистон H1 в составе декстранового матрикса.
Определение количества белка, включенного в наносферы, осуществляют с помощью аминокислотного анализа. Декстрановые наносферы, содержащие включенный в матрикс гистон H1, высушивают до постоянного веса при 50°С. В качестве стандарта используют препарат гистона H1. Образцы гидролизуют 6 н. хлористо-водородной кислотой в герметичных пробирках в течение 24 ч при 110°С.
После высушивания образцов до постоянного веса проводят аминокислотный анализ и рассчитывают количество белка.
Количество белка оценивают на основании данных по содержанию в гидролизатах устойчивых к дегидратации аминокислот, таких как аспарагиновая кислота, глицин, глутаминовая кислота.
Образцы наносфер, которые получают на основе декстрана анализируют с использованием электронной микроскопии при их нанесении на поверхность стекла. Для этого стандартные образцы стекла обрабатывают смесью этанол-эфир (в равных объемах) в течение 1 ч и выдерживают при 500°С в течение 1 ч. Поверхность стекла покрывают водной суспензией наносфер и высушивают при комнатной температуре.
Результаты сканирующей электронной микроскопии наносфер, которые получают на основе декстрана представлены на Фиг. 1. Показано, что наносферы имеют диаметр не более 1000 нм.
Пример 2. В этой серии экспериментов осуществления заявленного изобретения, использован способ включения наносфер, содержащих белки, в матрикс резорбируемых микросфер на основе сополимера полилактид-гликолида, где наносферы с белком представляют «твердую» форму белка.
В частном конкретном случае способ осуществляют следующим образом. Наносферы с гистоном H1 в их составе получают, как это описано в примере 1. Приготавливают первичную суспензию наносфер в предварительно приготовленном растворе полимера, в качестве которого используют резорбируемый сополимер полилактид-гликолид с молекулярной массой от 50 до 80 kDa при молярном соотношении мономеров, равном 75:25, который растворяют до 10%-ной концентрации в гидрофобном органическом растворителе, в качестве которого используют хлористый метилен, перемешивают в течение 60±5 мин при температуре 6±2°C, причем в раствор полимера добавляют наносферы с гистоном при весовом соотношении наносфер и полимера, равном 1:50, затем к раствору добавляют этиловый спирт в количестве 10 объемов по отношению к объему исходного раствора, затем смесь перемешивают и получают вторичную суспензию, которую подвергают диспергированию при перемешивании в течение 10 мин при комнатной температуре для равномерного распределения полимера в органическом растворителе и формирования микросфер, затем микросферы осаждают из суспензии при добавлении охлажденного этилового спирта, который добавляют в 100-кратном объеме по отношению к объему суспензии, затем осадок микросфер помещают на мелкопористый стеклянный фильтр и отфильтровывают, затем осадок собирают и высушивают при комнатной температуре в течение 8±2 ч, и полученные резорбируемые микросферы, содержащие в своем составе наносферы с гистоном с содержанием белка на 1,0 мг сухого веса микросфер от 2,0 до 4,0 мкг, причем высвобождение гистона из микросфер в результате их резорбции происходит в течение не менне 50-ти суток, как описано ниже в примере 3.
Пример 3. В этой серии экспериментов оценивают скорость высвобождения белка из резорбируемых микросфер по количеству белка в инкубационной среде в зависимости от времени инкубации.
В модельных экспериментах проводят оценку скорости высвобождения белка из микросфер, приготовленных на основе резорбируемого сополимера полилактид-гликолида, содержащих в своем составе наносферы с гистоном H1, в зависимости от времени инкубации in vitro.
В первой серии экспериментов: проводят оценку скорости высвобождения белка из наносфер, приготовленных на основе декстрана. Скорость высвобождения белка из наносфер оценивают по количеству белка в модельной среде при инкубации наносфер в фосфатно-солевом буферном растворе, рН 7,2 и температуре +21°С, при этом концентрацию белка определяют в инкубационной среде в течение первых 5 ч и вплоть до 120 ч.
В частном конкретном случае используют образцы наносфер с диаметром не более 1000 нм, содержащих в составе от 110 до 130 нг белка на 1,0 мкг сухого веса наносфер. Образец наносфер в количестве 0,98 г помещают в среду инкубации объемом 65 мл и инкубируют при +21°C при перемешивании.
Для анализа количества высвобождаемого гистона H1 из модельной среды инкубации последовательно отбирают аликвоты среды в период первых 5 ч (через каждый час), в период от 10 до 24 ч (через каждые 5 ч) и вплоть до 120 ч от начала инкубации и проводят определение концентрации белка в аликвотах инкубационной среды.
Результаты экспериментов показывают, что основное количество гистона H1 высвобождается в первые 10 ч инкубации и составляет 40%, затем через 24 ч высвобождение гистона H1 из системы достигает 70%. Оставшиеся 30% белка высвобождается постепенно в течение последующих 4 суток, т.е. полное высвобождение достигается через 120 ч.
На основании полученных данных можно сделать заключение, что биодеградация наносфер, приготовленных на основе декстрана, в основном, протекает в течение первых суток от начала инкубации.
Во второй серии экспериментов оценивают скорость резорбции микросфер, приготовленных на основе резорбируемого сополимера полилактид-гликолида с инкапсулированными в их матрикс наносферами, содержащих в своем составе гистон H1.
Скорость резорбции микросфер оценивают по высвобожден