Экспрессия химерного белка ksac и способ получения растворимых белков с помощью высокого давления
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков и может быть использовано для получения растворимого белка, экспрессированного в Е. coli. Способ включает стадии (i) приготовления телец включения в буфере, содержащем от 0 М до около 7 М мочевины для образования суспензии телец включения; (ii) воздействие на суспензию телец включения поэтапным увеличением давления в течение некоторого периода времени и (iii) поддержание высокого давления, примененного к тельцам включения, в течение некоторого периода времени. Изобретение позволяет увеличить выход растворимых, дезагрегированных, подвергнутых рефолдингу активных белков из телец включения. 6 з.п. ф-лы, 22 ил., 13 табл., 3 пр.
Реферат
Перекрестные ссылки на связанные заявки
Данной заявкой заявлен приоритет предварительной заявки США No. 61/694,968 от 30 августа 2012 года и предварительной заявки США No. 61/830,425 от 3 июня 2013 года.
Область техники, к которой относится изобретение
Настоящее изобретение относится к составам для борьбы с инфекциями Leishmania у животных или людей. В частности, в настоящем изобретении предлагаются фармацевтические композиции, содержащие химерный антиген Leishmania и способ вакцинации против Leishmania. Настоящее изобретение также относится к способам получения растворимых или дезагрегированных белков с помощью высокого давления.
Предшествующий уровень техники
Лейшманиоз является основным и тяжелым паразитическим заболеванием, которое поражает людей, собак и, в меньшей степени, кошек.
Подроды Leishmania и Viannia сгруппированы в комплексы видов и подвидов на основании молекулярной, биохимической и иммунологической схожести. Существует несколько форм заболевания, названных по их клиническому проявлению, включая кожный, слизисто-кожный или висцеральный лейшманиоз. Каждая из этих форм заболевания обуславливается различными видами песчаных мух, обнаруженных в различных регионах мира. Кожный лейшманиоз людей ассоциирован с представителями комплексов L. aethiopica, L. major, и L. tropica в Старом Свете и комплексов L. mexicana и L. braziliensis в Новом Свете. Висцеральный лейшманиоз вызывается L. donovani и L. infantum в регионах Старого Света, тогда как L. chagasi в основном отвечает за висцеральное заболевание в Новом Свете. Из-за того, что L. infantum является основным агентом, связанным с собачьим лейшманиозом, заражения у собак часто рассматриваются, как висцеральное заболевание, даже если они не имеют тенденцию к висцеральному и кожному заболеванию.
Агент висцерального лейшманиоза является паразитом-простейшим и принадлежит к комплексу leishmania donovani. Этот паразит широко распространен в умеренных и субтропических странах Южной Европы, Африки, Азии, Южной Америки и Центральной Америки (Desjeux P. et al., 1984, Nucl. Acids Res., 12:387-395). Leishmania donovani infantum (L. infantum) ответственны за заболевание кошек и собак в Южной Европе, Африке и Азии. В Южной Америке и Центральной Америке агентом является Leishmania donovani chagasi (L. chagasi), который близко связан с L. infantum. У людей агентом является Leishmania donovani donovani (L. donovani), который также связан с L. infantum и L. chagasi.
Лейшманиоз является медленно прогрессирующим заболеванием, которое до клинически очевидного может развиваться до 7 лет (McConkey SE et al, 2002, Canine Vet J 43:607-609). Даже в таком случае, признаки являются зачастую неспецифичными и диагноз Leishmania рассматривается редко. Собаки наиболее часто инфицируются L. infantum (комплекс L. donovani), которая ответственна за висцеротропное заболевание у людей. Однако вплоть до 90% инфицированных собак демонстрируют как висцеральные, так и кожные поражения (Slappendel RJ et al, 1998, In: Greene CE: Infectious Diseases of the Dog and Cat, pp. 450-458). С другой стороны, множество собак оказалось естественным образом устойчивыми к этому паразиту и могут оставаться бессимптомными, несмотря на известную инфекцию (Grosjean NL et al, 2002, Vet Rec 150:241-244). Считается, что только у 10% собак, проживающих в эндемичных районах, действительно развивается клиническое заболевание (Lindsay DS et al, 2002, Compend Cont Educ Pract Vet 24:304-312). Такая низкая встречаемость клинического заболевания объясняется генетической предрасположенностью определенных собак к защитному ответу клеточного иммунитета, а не гуморального ответа (Lindsay DS et al, McConkey SE et al, Slappendel RJ, et al). Более того, сообщалось, что вплоть до 20% инфицированных собак могут иметь адекватный иммунный ответ и спонтанно восстанавливаться после клинической болезни (McConkey SE et al). У животных, которые имеют гуморальный ответ, IgGl по-видимому коррелируют с клиническим заболеванием, тогда как бессимптомные собаки имеют более высокие уровни антитела IgG2 (Lindsay et al).
Некоторые из наиболее часто сообщаемых клинических признаков лейшманиоза включают вялость, усталость и непереносимость физических нагрузок в сочетании с анорексией и потерей массы, что в конечном итоге завершается изнуряющей болезнью (McConkey SE et al). Признаки могут сопровождаться или не сопровождаться лихорадкой или общей лимфоаденопатией (90%) и/или гепатоспленомегалией (Grosjean NL et al, 2003, J Am Vet Med Assoc 222:603-606; Lindsay DS et al, McConkey SE et al; Martínez-Subiela S et al, 2002, Vet Rec 150:241-244). Поражение суставов также довольно частое и может проявляться в виде хромоты с распухшими суставами или просто как напряженная походка. Менее частые признаки включают поражения глаз (<5%), хроническую диарею (30%) и длинные деформированные хрупкие ногти (20%), называемые онихогрифозом (Lindsay DS et al, Slappendel RJ et al). Кожные поражения имеются у вплоть до 89% инфицированных собак, с явными признаками висцерального вовлечения или без них. Поражения кожным лейшманиозом могут произойти в любом месте на организме, но наиболее частыми участками являются те, которые экспонированы окружающей среде и следовательно являются более восприимчивыми к укусам песчаных мух. Изначальная папула быстро развивается в язву. Висцеральный лейшманиоз является неизменно фатальным, если его своевременно не лечить. Висцеральный лейшманиоз влияет на внутренние органы, в частности на селезенку и печень.
Собаки рассматриваются как основной резервуар лейшманиоза. Заболевание характеризуется постоянной эволюцией висцеро-кожных признаков, происходящих не менее чем у 50% инфицированных животных (Lanotte G. et al, 1979, Ann. Parasitol. Hum. Comp. 54:277-95). Как бессимптомные, так и симптоматические собаки с детектируемыми антителами могут быть инфекционными (Molina R. et al., 1994, Trans. R. Soc. Med. Hyg. 88:491-3; Courtenay O. et al, 2002, J. Infect. Dis., 186:1314-20). Кошки также могут быть носителями паразитов-простейших и, таким образом, рассматриваются как второстепенные потенциальные резервуары.
Из-за некоторых факторов, условия лечения лейшманиоза у собак и ответ на терапию в лучшем случае ограничены. По некоторой неопределенной причине, висцеральный лейшманиоз более труден для лечения у собак, чем у людей. Вариант без лечения является 100% эффективным при устранении паразитарной инфекции и клиническое заболевание повторно появляется при прекращении терапии (Lindsay DS et al). В эндемичных районах, наиболее частой схемой лечения являлась комбинация аллопуринола с пентавалентной сурьмой, таким как меглумина антимонат или стибоглюконат натрия (Lindsay DS et al, Slappendel RJ et al). Однако в последние годы этот протокол оказался неэффективным из-за повышения устойчивости паразита к лекарственному средству, а также побочному эффекту, связанному с этими соединениями (Lindsay DS et al). Для дополнительного ограничения параметров лечения, PENTOSTAM® (стибоглюконат натрия) является единственным соединением сурьмы в Соединенных Штатах и его распределение регулируется Центром по Контролю и Профилактике Заболеваний (CDC) в Атланте, Джорджия (Lindsay DS et al). Другие исследования были направлены на идентификацию способов профилактики и лечения лейшманиоза, путем, например, введения антигенных химерных полипептидов (см. US 2009/0291099, который включен в данный документ ссылкой в полном объеме).
Были опробованы различные протоколы, но они оказались не более эффективными при устранении паразитарной инфекции или при предотвращении клинического рецидива. Кроме того, каждый протокол связан с потенциальными побочными эффектами. Амфотерицин В связывает стеролы и нарушает проницаемость клеточных мембран, но является нефротоксичным (Lindsay DS et al). При введении парентерально, паромомицин действует синергично с препаратами сурьмы, позволяя использовать более высокие уровни препарата сурьмы в течение более длительных периодов времени, но также является нефротоксичным и в настоящее время не рекомендуется для клинического применения (Lindsay DS et al). Пентамидин изетионат эффективен против лейшманиоза, но требует, по меньшей мере, 15 внутримышечных инъекций и является достаточно болезненным (Lindsay DS et al). Кетаконазол, миконазол, флуконазол и итраконазол являются пероральными лекарственными средствами, которые могут быть полезны при сдерживании заболевания, но являются непомерно дорогими и несут риск развития устойчивости при симптоматическом лечении пациентов. В общем, были исследованы различные режимы лечения лейшманиоза у собак, но они не являются на 100% эффективными; рецидивы являются скорее правилом, чем исключением. В конечном счете, ветеринарный врач сталкивается с дилеммой обработки симптоматических вспышек лейшманиоза у собак при риске развития в Соединенных Штатах штаммов этого паразита с лекарственной устойчивостью.
Было показано, что массовое обнаружение сероположительных собак с последующей выбраковкой и/или медикаментозным лечением, или массовое применение ошейников с импрегнированным делтаметрином, оказывает влияние на уменьшение распространенности лейшманиоза собак и человека в эндемичных районах Южной Европы, Африки и Азии (Maroli M. et al, 2001, Med. Vet. Entomol. 15:358-63; Mazloumi Gavgani A.S. et al, 2002, Lancet 360:374-9), хотя эффективность уничтожения сероположительных собак была спорной (Dietze R. et al, 1997, Clin. Infect. Dis. 25:1240-2; Moreira Jr. E.D. et al, 2004, Vet. Parasitol. 122:245-52). Эти меры контроля считаются либо неприемлемым, либо дорогими, либо неэффективными (Gradoni L. et al, 2005, Vaccine 23:5245-51).
Математические модели, используемые для сравнения эффективности различных инструментов для контроля лейшманиоза, подтвердили, что собачья вакцина может быть наиболее практичным и эффективным способом (Dye С, 1996, Am. J. Trop. Med. Hyg. 55:125-30). Следовательно, разработка вакцин, способных защитить собак от лейшманиоза и/или предотвратить прогрессию заболевания в инфицированных животных, является весьма желательным для имплементации программ контроля лейшманиоза, а также для ветеринарного сообщества (Gradoni L. et al).
Haynes et al. (Biotechnol. Prog., 2010, Vol. 26, No. 3, 743-749) обсуждают применение высокого гидростатического давления для достижения высокой растворимости и высокого выхода рефолдинга гормона роста (GH), полученного в тельцах включения E.coli. US 6,489,450, US 7,064,192, US 7,767,795 и US 7,615,617 описывают обратимую агрегацию и повышение рефолдинга денатурированных белков при применении высокого давления.
Сохраняется потребность в эффективных и действенных способах продуцирования субъединичной (белковой) вакцины для лечения лейшмании. Вакцинный состав и способ получения такой вакцины по настоящему изобретению восполняет эту давно ощущаемую потребность в данной области.
Сущность изобретения
Настоящее изобретение впервые демонстрирует, что химерный белок KSAC, экспрессированный в тельца включения Е. coli, фактически был солюбилизирован и повторно свернут (подвергнут рефолдингу) после обработки высоким давлением.
Настоящее изобретение демонстрирует удивительный результат, который заключается в том, что применение поэтапного увеличения давления в сочетании с продолжительной обработкой телец включения при высоком давлении дают высокий выход растворимых, дезагрегированных, подвергнутых рефолдингу и активных белков.
Предложены композиции и вакцины, содержащие химерный белок KSAC. Такие вакцины или композиции могут быть использованы для вакцинации животного и обеспечения защиты от лейшманиоза. Белок KSAC может быть экспрессирован в тельца включения Е. coli, а затем солюбилизирован при обработке высоким давлением. Белок KSAC обладает иммуногенными и защитными свойствами.
Способы изобретения включают способы изготовления и получения, растворимых, дезагрегированных, подвергнутых рефолдингу и активных белков из телец включения под действием высокого давления в течение длительного периода времени. Способы также включают способы применения, включая введение животному эффективного количества антигенного белка KSAC для того, чтобы вызвать защитный иммуногенный ответ.
Краткое описание чертежей
Следующее подробное описание, приведенное в качестве примера, но не предназначенное для ограничения изобретения конкретными описанными воплощениями, может быть воспринято в сочетании со следующими чертежами, включенными в настоящий документ ссылкой, в которых:
фиг. 1 является таблицей, демонстрирующей SEQ ID NO, назначенные для каждой последовательности ДНК и белка;
фиг. 2А-2С демонстрируют последовательности ДНК и белка;
фиг. 3 является графическим отображением давления и времени обработки телец включения с KSAC;
фиг. 4 является графическим отображением сравнения между обработкой высоким давлением и классическим хроматографическим рефолдингом;
фиг. 5 является графической отображением процесса рефолдинга KSAC;
фиг. 6 изображает ДСН-ПААГ KSAC, рефолдинг которого осуществлен эксклюзионной хроматографией;
фиг. 7 изображает график ВЭЖХ KSAC после рефолдинга с помощью эксклюзионной хроматографии;
фиг. 8А и 8В отображает динамическое рассеяние света (DLS) белка KSAC после рефолдинга с помощью эксклюзионной хроматографии;
на фиг. 9 изображен Q-дот-блот образцов KSAC, обработанных при 3000 бар;
на фиг. 10 изображен ДСН-ПААГ образцов KSAC, обработанных при 3000 бар;
на фиг. 11 изображен ВЭЖХ контрольных образцов и солюбилизированный KSAC после обработки 3000 бар;
на фиг. 12 изображены наложенные ВЭЖХ-хроматограммы супернатанта образцов KSAC, обработанных при давлении 3000 бар, и белка KSAC, полученного с помощью классического способа рефолдинга;
на фиг. 13 изображено наложение данных DLS, полученных с белком, обработанным при давлении 3000 бар, в буфере без мочевины и белком, полученным с помощью классического способа рефолдинга;
на фиг. 14 изображено влияние давления и буфера на размеры белков;
на фиг. 15 изображена хроматограмма ВЭЖХ образцов, обработанных при 4000 бар;
на фиг. 16 показано распределение по числу образцов, обработанных 5000 бар без мочевины;
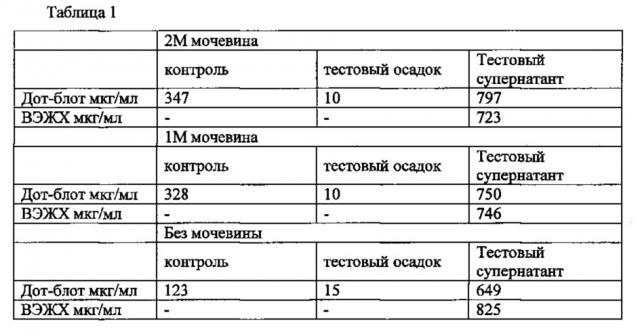
на фиг. 17 показано сравнение содержания растворимого белка KSAC определенное ВЭЖХ и Q-дот-блотом;
на фиг. 18А и 18В изображен анализ ДСН-ПААГ образцов KSAC после обработок высоким давлением;
на фиг. 19A-19D изображен анализ Q-дот-блот образцов KSAC после обработок высоким давлением;
на фиг. 20 изображен анализ ВЭЖХ образцов KSAC после обработки способом А;
на фиг. 21 изображен анализ ВЭЖХ образцов KSAC после обработки способом В;
на фиг. 22 изображен анализ ВЭЖХ образцов KSAC после обработки способом А, способом В и классическим способом.
Подробное описание изобретения
Следует отметить, что в данном описании и особенно в формуле изобретения термины, такие как «содержать», «содержит», «содержащий» и т.п. могут иметь значение, которое придается термину в патентном законе США; например, они могут означать «включать», «включает», «включающий» и т.п.; и что термины, такие как «состоящий в основном» и «состоять в основном» имеют значение, приписанное им в патентном законе США, например, они позволяют не явным образом упоминать элементы, но исключать элементы, которые обнаружены в предшествующем уровне техники или которые влияют на основную или новую характеристику изобретения.
Если не указано иное, технические термины используются в соответствии с обычным применением. Определения общих терминов в молекулярной биологии может быть обнаружено в Benjamin Lewin, Genes V. published by Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Термины в единственном числе с артиклями «a,» «an,» и «the» в варианте на английском языке включают множественные обозначаемые, если контекстом ясно не указано иное. Аналогичным образом, слово «или» предназначен для включения «и» если контекст с очевидностью не указывает на иное. Слово «или» означает один из членов конкретного списка, а также включает в себя любое сочетание членов этого списка.
Термин «животное» используется в данном документе для включения млекопитающих, птиц и рыб. Животное может быть выбрано из группы, состоящей из лошадиных (например, лошадь), псовых (например, собак, волков, лис, койотов, шакалов), кошачьих (например, львов, тигров, домашних кошек, диких кошек, других больших кошек, и других животных семейства кошачьих, включающих гепардов и рысей), овец (например, овец), крупного рогатого скота (например, коров), свиней (например, свиней), птиц (например, кур, уток, гусей, индейки, перепелов, фазанов, попугаев, певчих птиц, ястребов, ворон, страусов, эму и казуаров), приматов (например, древесного примата, долгопята, обезьяны, гиббона, гориллы), и рыб. Термин «животное» также включает индивидуальное животное во всех стадиях развития, включая стадии эмбриона и плода.
Термин «полипептид» и «белок» применяются взаимозаменяемо в данном документе для обозначения полимера последовательных аминокислотных остатков.
Термин «нуклеиновая кислота», «нуклеотид» и «полинуклеотид» используются взаимозаменяемо и относятся к РНК, ДНК, кДНК или кРНК и их производным, таким как те, что содержат модифицированные каркасы. Следует отметить, что изобретение обеспечивает полинуклеотиды, содержащие последовательности, комплементарные тем, что описаны в данном документе. «Полинуклеотид», предусмотренный в настоящем изобретении включает как прямую цепь (5'-3'), так и обратную комплементарную цепь (3'-5'). Полинуклеотиды по изобретению могут быть приготовлены различными способами (например, химическим синтезом, клонированием генов и т.п.) и могут быть взяты в различных формах (например, линейной или расщепленной, одно- или двухцепочечной, или ее гибрид, праймеры, зонды и т.п.).
Термин «геномная ДНК» или «геном» используются взаимозаменяемо и относятся к наследуемой генетической информации организма хозяина. Геномная ДНК включает ДНК ядра (также называемой хромосомной ДНК), но также и ДНК пластид (например, хлоропластов) и других клеточных органелл (например, митохондрий). Геномная ДНК или геном, предусмотренные в настоящем изобретении, также относятся к РНК вируса. РНК может быть положительной цепью или отрицательной цепью РНК. Термин «геномная ДНК», предусмотренный в настоящем изобретении, включает геномную ДНК, содержащую последовательности, комплементарные описанным в данном документе. Термин «геномная ДНК» также относится матричной (информационной) РНК (мРНК), комплементарной ДНК (кДНК) и комплементарной РНК (кРНК).
Термин «ген» используется широко для обозначения какого-либо сегмента полинуклеотида, ассоциированного с биологической функцией. Таким образом, гены или полинуклеотиды включают интроны и экзоны, как, например, в геномной последовательности, или только кодирующие последовательности как в кДНК, такие как открытая рамка считывания (ORF), начиная от стартового кодона (метионинового кодона), и заканчивая сигналом терминации (стоп-кодоном). Гены и полинуклеотиды могут также включать области, которые регулируют их экспрессию, такие как области инициации транскрипции, трансляции и терминации транскрипции. Таким образом, также включены промоторы и участки связывания с рибосомами (в общем, эти регуляторные элементы находятся примерно между 60 и 250 нуклеотидами выше стартового кодона кодирующей последовательности или гена; Doree S M et al; Pandher К et al; Chung J Y et al), терминаторы транскрипции (как правило, терминатор расположен в пределах примерно 50 нуклеотидов ниже стоп-кодона кодирующей последовательности или гена; Ward С К et al). Ген, или полинуклеотид, также относится к фрагменту нуклеиновой кислоты, которая экспрессирует мРНК или функциональную РНК, или кодирует конкретный белок, и которая включает регуляторные последовательности.
Термин «гетерологичная ДНК» при использовании в данном документе, относится к ДНК, полученной из отличающегося организма, такого как другой тип клеток или вид, отличающийся от реципиента. Термин также относится к ДНК или ее фрагменту в том же геноме ДНК хозяина, где гетерологичная ДНК вставлена в участок генома, который отличается от ее изначального расположения.
При использовании в данном документе, термин «антиген» или «иммуноген» обозначает вещество, которое индуцирует специфический иммунный ответ у животного-хозяина. Антиген может включать цельный организм, убитый, ослабленный или живой; субъединицу или часть организма; рекомбинантный вектор, содержащий вставку с иммуногенными свойствами; часть или фрагмент ДНК, способной индуцировать иммунный ответ при презентировании животному-хозяину; полипептид, эпитоп, гаптен или любую их комбинацию. В ином случае, иммуноген или антиген могут содержать токсин или антитоксин.
Термин «иммуногенный белок или пептид» при использовании в данном документе включают полипептид, который иммунологически активен в том смысле, что будучи единожды введенным хозяину, он способен вызвать иммунный ответ гуморального и/или клеточного типа, направленный против данного белка. Предпочтительно, если фрагмент белка такой, что он имеет фактически такую же иммунологическую активность что и целый белок. Таким образом, белковый фрагмент по изобретению включает или фактически состоит из или состоит из, по меньшей мере, одного эпитопа или антигенной детерминанты. «Иммуногенный» белок или полипептид, при использовании в данном документе, включает полноразмерную последовательность белка, его аналогов или его иммуногенных фрагментов. Под «иммуногенным фрагментом» понимается фрагмент белка, который включает один или несколько эпитопов и таким образом вызывает иммунологический ответ, описанный выше. Такие фрагменты могут быть идентифицированы с помощью любого из методов картирования эпитопов, хорошо известных в данной области.
Термин «иммуногенный белок или пептид» дополнительно предусматривает делеции, добавления и замены в последовательности, при условии, что полипептид вызывает иммунологический ответ, как определено в настоящем документе. Термин «консервативная вариация» обозначает замену аминокислотного остатка другим похожим остатком, или замену нуклеотида в последовательности нуклеиновой кислоты, так чтобы кодируемый аминокислотный остаток не изменялся или был бы другим биологически похожим остатком. В этом отношении, в особенности предпочтительными заменами будут, как правило, консервативные по своей природе замены, т.е. замены, которые имеют место в пределах семейства аминокислот. Например, аминокислоты в общем разделяют на четыре семейства: (1) кислые = аспартат, глутамат; (2) основные = лизин, аргинин, гистидин; (3) неполярные = аланин, валин, лейцин, изолейцин, пролин, фенил аланин, метионин, триптофан; и (4) незаряженные полярные = глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Примеры консервативных вариаций включает замену одного гидрофобного остатка, такого как изолейцин, валин, лейцин или метионин, на другой гидрофобный остаток, или замену одного полярного остатка на другой полярный остаток, например, замена аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту, или глутамина на аспарагин, и т.п.; или похожая консервативная замена аминокислоты на структурно родственную аминокислоту, которая не оказывает основное воздействие на биологическую активность. Белки, имеющие фактически такую же аминокислотную последовательность, как и эталонная молекула, но обладающая незначительными аминокислотными заменами, которые фактически не влияют на иммуногенность белка, подпадают, следовательно, под определение эталонного полипептида. Все полипептиды, полученные этими модификациями, включены в данный документ. Термин «консервативная вариация» также включает применение замещенной аминокислоты вместо незамещенной родительской аминокислоты, при условии, что антитело, полученное против замещенного полипептида, также иммунореагирует с незамещенным полипептидом.
Термин «эпитоп» обозначает сайт на антигене или гаптене, на который отвечают В- и/или Т-клетки. Термин также используется взаимозаменяемо с «антигенной детерминантой» или «участком антигенной детерминанты». Антитела, которые распознают похожий эпитоп, могут быть идентифицированы в простом иммуноанализе, демонстрирующем способность одного антитела блокировать связывание другого антитела с целевым антигеном.
«Иммунологический ответ» к композиции или вакцине является развитием в хозяине клеточного и/или антитело-опосредованного иммунного ответа к представляющей интерес композиции или вакцине. Обычно «иммунологический ответ» включает, без ограничения перечисленным, один или несколько эффектов: выработку антител, В-клетки, хэлперные Т-клетки, и/или цитотоксичные Т-клетки, нацеленные специфически на антиген или антигены, включенные в представляющую интерес композицию или вакцину. Предпочтительно, если хозяин демонстрирует либо терапевтический, либо защитный иммунологический ответ, так что устойчивость к новой инфекции будет усиленной и/или клиническая тяжесть заболевания снизится. Такая защита будет продемонстрирована либо снижением, либо утратой симптомов, обычно демонстрируемых инфицируемым хозяином, более быстрым временем восстановления и/или сниженным вирусным титром в инфицированном хозяине.
Термины «рекомбинант» и «генетически модифицированный» используются взаимозаменяемо и относятся к любой модификации, изменению или конструированию полинуклеотида или белка в его нативной форме или структуре, или любой модификации, изменению или конструированию полинуклеотида или белка в его естественной среде или окружении. Модификация, изменение или конструирование полинуклеотида или белка может включать, без ограничения перечисленным, делецию одного или нескольких нуклеотидов или аминокислот, делецию целого гена, кодоновую оптимизацию гена, консервативную замену аминокислот, вставку одного или нескольких гетерологичных полинуклеотидов.
Термин «тельца включения» при использовании в данном документе относятся к неактивным агрегатам гетерологичных белков, экспрессированных в прокариотах или эукариотах. Термины «фактически растворимый», «фактически солюбилизированный», «фактически дезагрегированный» или «фактически подвергнутый рефолдингу» используются в данном документе взаимозаменяемо по отношению к агрегированным белкам в тельцах включения, которые, по меньшей мере, на 50%, по меньшей мере, на 60%, по меньшей мере, на 70%, по меньшей мере, на 80%, по меньшей мере, на 90%, по меньшей мере, на 95%, или, по меньшей мере, на 98% растворимы в водном растворе, или дезагрегированы, или подвергнуты рефолдингу в активную форму после обработок. Рефолдинг означает, что полностью или частично денатурированный белок принимает вторичную, третичную или четвертичную структуру как у нативной молекулы.
В одном воплощении изобретения предлагается композиция или вакцина, включающая белок, полученный из Е. coli. Белок может быть химерным белком, содержащим две или несколько иммуногенных частей белков лейшмании, выбранных из кинетопластидного мембранного белка 11 (КМР11), стеролметилтрансферазы (SMT), А2 и цистеин протеиназы (CP). Белок может быть химерным белком, включающим КМР11, SMT, А2 и CP лейшмании, обозначенный как химерный белок KSAC. В одном аспекте воплощения, белок KSAC солюбилизирован из телец включения E.coli посредством высокого давления. В другом аспекте, белок KSAC фактически растворим в водном растворе или фактически подвергнут рефолдингу.
Более того, предполагается, что гомологи вышеупомянутых белков или полинуклеотидов находятся в рамках настоящего изобретения. При использовании в данном документе термин «гомолог» включает ортологи, аналоги и паралоги. Термин «аналог» относится к двум полинуклеотидам или полипептидам, которые имеют одну и ту же или похожую функцию, но развивались отдельно в неродственных организмах. Термин «ортологи» относится к двум полинуклеотидам или полипептидам из различных видов, которые развились из общего гена-предшественника в ходе видообразования. Как правило, ортологи кодируют полипептиды, имеющие одни и те же или похожие функции. Термин «паралог» относится к двум полинуклеотидам или полипептидам, которые являются родственными по причине публикации в геноме. Паралоги, как правило, обладают различными функциями, но эти функции могут быть родственными. Аналоги, ортологи и паралоги полипептида дикого типа могут отличаться от полипептида дикого типа посттрансляционными модификациями, различиями в аминокислотной последовательности, или и тем и другим. В частности, гомологи изобретения будут, в общем, демонстрировать, по меньшей мере, 80-85%, 85-90%, 90-95%, иди 95%, 96%, 97%, 98%, 99% идентичность последовательности, со всем или частью полипептидных или полинуклеотидных последовательностей, описанных выше, и будут демонстрировать похожие функции.
В одном воплощении химерный белок KSAC идентичен, по меньшей мере, на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности полипептида, имеющего последовательность, указанную в SEQ ID NO: 2. В другом воплощении, полинуклеотид, кодирующий химерный белок KSAC идентичен, по меньшей мере, на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности полипептида, имеющего последовательность, указанную в SEQ ID NO: 2. В еще одном воплощении полинуклеотид, кодирующий KSAC, идентичен, по меньшей мере, на 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% последовательности полинуклеотида, имеющего последовательность, указанную в SEQ ID NO: 1.
Термин «идентичность» в отношении последовательностей может относиться к числу позиций с идентичными нуклеотидами или аминокислотами разделенному на число нуклеотидов или аминокислот в более короткой из двух последовательностей, где выравнивание двух последовательностей может быть определено в соответствии с алгоритмом Вилбура и Липмана (Wilbur and Lipman). Идентичность последовательности или сходство последовательности двух аминокислотных последовательностей, или идентичность последовательности двух нуклеотидных последовательностей может быть определена с помощью пакета программного обеспечения «Vector NTI» (Invitrogen, 1600 Faraday Ave., Карлсбад, Калифорния). Когда последовательности РНК называются похожими, или обладают степенью идентичности последовательности или гомологии с последовательностью ДНК, тимидин (Т) в последовательности ДНК рассматривается как равный урацилу (U) в последовательности РНК. Таким образом, последовательности РНК находятся в пределах объема изобретения и могут быть получены из последовательностей ДНК, если тимидин (Т) в последовательностях ДНК рассматриваются как равные урацилу (U) в последовательностях РНК.
Полинуклеотиды раскрытия включают последовательности, которые являются вырожденными из-за генетического кода, например, оптимизированная частота применения кодонов для конкретного хозяина. При использовании в данном документе «оптимизированный» относится к полинуклеотиду, который изготовлен генно-инженерно для повышения его экспрессии в данных видах. Для обеспечения оптимизированных полинуклеотидов, кодирующих полипептиды KSAC, ДНК-последовательность гена белка KSAC может быть модифицирована для 1) включения кодонов, предпочитаемых высоко экспрессирующимися генами в конкретных видах; 2) для включения содержания А+Т или G+C в составе нуклеотидных оснований, по существу обнаруженного в указанных видах; 3) образования инициирующей последовательности указанных видов; или 4) для исключения последовательностей, которые вызывают дестабилизацию, некорректное полиаденилирование, деградацию и терминацию РНК, или таких, которые образуют вторичную структуру шпилек или сайты сплайсинга РНК. Повышенная экспрессия белка KSAC в указанных видах может быть достигнута использованием частоты распределения использования кодонов в эукариотах и прокариотах, или в определенных видах. Термин «частота предпочтительного использования кодонов» относится к предпочтению, демонстрируемому конкретной клеткой-хозяином в применении нуклеотидных кодонов для определения данной аминокислоты. Существуют 20 аминокислот, большая часть которых определена более чем одним кодоном. Следовательно, все вырожденные нуклеотидные последовательности включены в раскрытие при условии, что аминокислотная последовательность полипептида, кодируемая нуклеотидной последовательностью, является функционально неизмененной.
В другом воплощении, в настоящем изобретении предлагается способ получения растворимого белка, экспрессированного в прокариотах или эукариотах, включающий стадии (i) приготовления телец включения в буфере, не содержащем или содержащем низкую концентрацию мочевины для образования суспензии телец включения; (ii) воздействие на суспензию телец включения давлением в течение некоторого периода времени.
В другом воплощении, в настоящем изобретении предлагается способ получения растворимого белка, экспрессированного в прокариотах или эукариотах, включающий стадии (i) приготовления телец включения в буфере, не содержащем или содержащем низкую концентрацию мочевины для образования суспензии телец включения; (ii) воздействие на суспензию телец включения постепенным увеличением давления в течение некоторого периода времени; и (ш) поддержка высокого давления, примененного к тельцам включения в течение некоторого периода времени.
В одном аспекте воплощения, буфер может содержать дитиотреитол (DTT). В другом аспекте, концентрация DTT может находиться в диапазоне от около 1 мМ до около 100 мМ, от около 1 мМ до около 90 мМ, от около 1 мМ до около 70 мМ, от около 1 мМ до около 60 мМ, от около 1 мМ до около 50 мМ, или около 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 35 мМ, 40 мМ, 45 мМ, 50 мМ, 55 мМ, 60 мМ, 65 мМ, 70 мМ, 75 мМ, 80 мМ, 85 мМ, 90 мМ, 95 мМ, 100 мМ.
В одном аспекте мочевина может отсутствовать в буфере. В другом аспекте мочевина может присутствовать в буфере в концентрации около 1 М, около 2 М, около 3 М, около 4 М, около 5 М, около 6 М, около 7 М, около 8 М, около 9 М, и около ЮМ.
В другом аспекте воплощения, высокое давление может быть в диапазоне от около 1000 бар до около 5000 бар, от около 2000 бар до около 4000 бар. Высокое давление может быть любым давлением в диапазоне от около 2000 бар до около 4000 бар, например, без ограничения перечисленным, до 2000 бар, 2100 бар, 2200 бар, 2300 бар, 2400 бар, 2500 бар, 2600 бар, 2700 бар, 2800 бар, 2900 бар, 3000 бар, 3100 бар, 3200 бар, 3300 бар, 3400 бар, 3500 бар, 3600 бар, 3700 бар, 3800 бар, 3900 бар, и 4000 бар.
В другом аспекте воплощения, постепенное увеличение давления может быть осуществлено непрерывно или поэтапно. В одном аспекте постепенное повышение давление применяется к суспензии телец включения с помощью непрерывно увеличивающегося давления при постоянной скорости в течение периода времени для достижения конечного высокого давления. Например, давление повышается со скоростью около 200 бар/мин - около 1000 бар/мин непрерывно в течение около 2 мин - около 10 мин до достижения 2000 бар, со скоростью около 200 бар/мин - около 1000 бар/мин непрерывно в течение около 3 мин - около 15 мин до достижения 3000 бар, со скоростью около 200 бар/мин - около 1000 бар/мин непрерывно в течение около 4 мин - около 20 мин до достижения 4000 бар, со скоростью около 200 бар/мин - около 1000 бар/мин непрерывно в течение около 5 мин - около 25 мин до достижения 5000 бар. В другом аспекте, постепенное увеличение давления применяется поэтапно. Например, давление повышается при около 1000 бар/мин в течение около одной минуты до достижения 1000 бар, затем давление 1000 бар поддерживается в течение около одного часа для расслабления белка, после периода релаксации давление повышается опять со скоростью около 1000 бар/мин в течение около одной минуты до достижения конечного искомого высокого давления 2000 бар. Давление также может быть повышено со скоростью около 1000 бар/мин в течение около тридцати секунд для достижения 500 бра, давление 500 бар может поддерживаться в течение около одного часа для расслабления белка, затем давление может быть повышено опять со скоростью 1000 бар/мин в течение около тридцати секунд до достижения 1000 бар, давление 1000 бар может поддерживаться в течение около одного часа для расслабления белка, давление может быть повышено опять со скоростью 1000 бар/мин в течение около тридцати секунд до достижения 1500 бар, давление 1500 бар может поддерживаться в течение около одного часа для расслабления белка, давление может быть повышено опять со скоростью 1000 бар/мин в течение около тридцати секунд до достижения конечного искомого давления 2000 бар. Для достижения конечного искомого давления 3000 бар, 4000 бар и 5000 бар, может быть использовано такое же поэтапное увеличение давления со скоростью около 1000 бар/мин в течение около одной минуты или около 30 секунд с пром