Генетическая конструкция для экспрессии функционально-активного человеческого стресс-белка (бтш70) с мутированными сайтами гликозилирования для наработки в эукариотических экспрессионных системах
Иллюстрации
Показать всеИзобретение относится к биотехнологии, конкретно к рекомбинантному получению белка теплового шока человека 70 (БТШ70), и может быть использовано для получения БТШ70 в молоке трансгенных животных. Получен человеческий БТШ70 с SEQ ID NO:1, характеризующийся мутациями в сайтах гликозилирования, которые не влияют на шаперонные свойства белка и позволяют предотвратить не характерную для внутриклеточных форм БТШ70 посттрансляционную модификацию, возникающую обычно в процессе получения рекомбинантного БТШ70 в молоке трансгенных животных. Изобретение позволяет получить БТШ70 человека, обладающий шаперонными свойствами нативного человеческого БТШ70, в молоке трансгенных животных. 2 н.п. ф-лы, 8 ил., 1 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, биоинженерии, молекулярной биофармакологии и может быть использовано для получения биологически активного белка теплового шока с молекулярной массой 70 килодальтон (БТШ70), который может быть экспрессирован и выделен из различных эукариотических систем, включая и биореакторы (трансгенные животные и др.) для дальнейшего использования в медицине.
БТШ70 играют важнейшую роль в развитии организма млекопитающих и в перспективе могут быть использованы в качестве терапевтического средства для лечения заболеваний человека, связанных с протеинопатией, таких как Болезнь Альцгеймера или Паркинсонизм. В настоящее время человеческий стресс-белок (БТШ70), нарабатываемый в бактериях, проходит доклинические испытания, как лекарство, применяемое для лечения некоторых злокачественных опухолей. С другой стороны, при наработке в бактериях белки человека не проходят свойственных им посттрансляционных модификаций и исследователям приходится тщательно очищать препараты от бактериальных токсинов. Поэтому наработка БТШ70 в эукариотических системах экспрессии в препаративных количествах является важной задачей с точки зрения биофармакологии.
Белки теплового шока и особенно БТШ70 играют важную роль при нормальном функционировании организма на всех стадиях его развития. Особенно важна роль БТШ70 при различных стрессорных воздействиях, обеспечивая выживание клеток при действии токсинов, радиации, сублетальной температуры, гипоксии или гипероксии, при энергетическом истощении клетки, а также при многих вирусных и микробных инфекциях. Рекомбинантный БТШ70 востребован в таких ситуациях, когда синтез эндогенного БТШ70 снижен или заблокирован, что наблюдается при старении и многих нейродегенеративных заболеваниях.
Уровень техники
В результате интенсивных исследований, проводимых во многих лабораториях, за последнее десятилетие подробно изучены основные функции внутриклеточных БТШ70 и его ко-шаперонов, связанные с нормальным функционированием этого комплекса белков, как при нормальном функционировании клетки, так и при различных стрессовых воздействиях. Эти белки осуществляют так называемые «шаперонные» функции и обеспечивают правильную укладку и транспорт вновь синтезированных пептидов в клетке (ссылки). Хотя БТШ70 цитоплазматический белок, в последнее десятилетие оказалось, что он может при определенных условиях выходить из клетки и вести себя как цитокин. Свободный БТШ70 был обнаружен во внеклеточном пространстве в норме и при некоторых патологиях ((Hait1 et al. 2011). Более того БТШ70 был обнаружен на поверхности клеток у ряда линий опухолевых клеток и у вирус-инфицированных лимфоцитов. Продемонстрированы также иммуноадъювантные свойства человеческого БТШ70 и на этой основе ведутся исследования по разработке вакцин для иммунотерапии некоторых злокачественных опухолей ((Srivastava 2002). Интересно, что антитела на БТШ70 обнаружены в крови людей при различных заболеваниях, а также в крови людей, часто подвергающихся действию высокой температуры (например, у рабочих сталелитейной промышленности).
Структурно-функциональный анализ молекул БТШ70 разного происхождения показал, что аминоконцевая часть молекулы БТШ70 у всех организмов, включая человека и мышь, содержит консервативный АТФазный домен (44 кДа), в то время как в карбокситерминальной части молекулы находится субстрат-связывающий домен, занимающий обычно около 25 кДа. Этот домен обеспечивает взаимодействие шаперона с различными полипептидами. В отличие от большинства других стрессовых белков БТШ70 функционируют в виде мономеров. У человека имеется целое семейство генов (более 17 членов), отвечающих за синтез различных вариантов БТШ70 с различным уровнем гомологии и выполняющих разные функции в клетке.
Синтез индуцибельного БТШ70 повышает устойчивость клетки к различным повреждающим факторам, таким как высокая температура, токсины, соли тяжелых металлов и пр. Кроме этого БТШ70 принимают участие в ренатурации и поддержании нормальной структуры клеточных белков. БТШ70 в комплексе с другими шаперонами участвует в норме и особенно после стрессирующих воздействий в выявлении протеолиза белков с нарушенной структурой, а также препятствует необратимой агрегации денатурированных клеточных белков и принимает участие в диссоциации уже образовавшихся агрегатов (Hartl et al., 2011).
В последние годы полезные, протективные свойства рекомбинантного БТШ70 были продемонстрированы на многих клеточных и животных моделях (Guzhova et al. 2001; Kakimura et al. 2002; Robinson et al. 2005; Kustanova et al. 2006; Rozhkova et al. 2010; Vinokurov et al. 2012) и поэтому необходимость в наработке этого белка в препаративных количествах стоит весьма остро.
Отметим, что получение препарата белка БТШ70 из органов и тканей человека крайне не эффективно и опасно с точки зрения риска контаминации, в т.ч. вирусами и поэтому не применяется.
Генно-инженерные методы позволяют нарабатывать препаративные количества БТШ70, необходимые для исследования различных функций белка и производства лекарственных препаратов. Рядом исследователей были разработаны продуценты для наработки рекомбинантных аналогов белков теплового шока БТШ70 [пат. США №№6,524,825; 5,919,620; 05.08.1997, 06.07.1999].
Помимо этого, поскольку рекомбинантный БТШ70 способен образовывать комплексы с белковыми антигенами in vitro, это позволило создавать на их основе противоопухолевые и противовирусные вакцины. Так известны работы в области создания противоопухолевых препаратов на основе гибридных, слитых и других белков с участием рекомбинантного БТШ70. Например, в опубликованной заявке на изобретение РФ №2003101965/14 (опубл. 07.2004 г.) описан способ лечения заболеваний, связанных с вирусом папилломы человека (бородавки, рак шейки матки и прямой кишки и т.д.) с помощью гибридного белка, состоящего из белка теплового шока (БТШ70 65 или БТШ70 из Mycobacterium bovis) и белка вируса папилломы. Лечение может осуществляться либо путем введения субъекту рекомбинантного гибридного белка, либо путем введения нуклеиновой кислоты, кодирующей гибридный белок, которая содержится в вирусном векторе.
Препаративное получение целевых белков в различных системах.
Так рекомбинантные белки с полезными свойствами для использования в качестве лекарственных препаратов или биодобавок (БАДы) нарабатываются посредством экспрессии: а) в дрожжевых и бактериальных системах, б) в культуре клеток животных, например, в культуре клеток шелкопряда, в) с использованием в качестве биореактора трансгенных животных (млекопитающих). По экономической эффективности и качеству препарата для биофармакологии производство на основе трансгенных животных превосходит другие методы.
В настоящее время многие человеческие рекомбинантные белки нарабатываются в молоке коз или коров. Для этого используют конструкции, в которых экспрессия в молоке обеспечивается промотором генов казеина, лактоферрина или генов других молочных белков. Обычно целевой белок несет на своем С-конце слитый пептид, обеспечивающий его синтез в молоко. Надо сказать, что экскретируемые в молоко или кровь рекомбинантные белки, в принципе, легче очистить, и они обладают и другими преимуществами с точки зрения биотехнологии. Отметим, что экскретируемые белки и в том числе белки, выходящие в молоко, обычно гликозилированы. Это не влияет на свойства секретируемых в норме «молочных» белков, таких как лизоцим или лактоферрин, но может влиять на свойства белков, которые в норме не гликозилируются.
Проведенный нами биоинформационный анализ последовательности человеческого рекомбинантного БТШ70 показал, что он имеет потенциальные сайты гликозилирования и его экспрессия в молоке модельных животных может привести к нежелательной посттрансляционной модификации (гликозилированию), которая может нарушить его шаперонные и другие протективные функции.
Изобретательской задачей изобретения является получение биологически активного модифицированного белка человека БТШ70 в препаративных количествах в различных экспрессионных системах для использования в медицине и биотехнологии.
Для решения этой задачи была получена генетическая конструкция на базе человеческого индуцибельного гена БТШ70, в котором были мутированы все (пять) потенциальных сайтов гликозилирования.
На следующем этапе (Пример №1) экспрессировали полученную конструкцию в клетках бактерий (E. coli) и исследовали свойства мутантного БТШ70, а также наработали «дикий» и мутантный БТШ70 в молоке (пример №2), полученных нами для этой цели двух линий трансгенных мышей. Введенные мутации не должны были повлиять на шаперонные свойства белка, но могли предотвратить нехарактерную для внутриклеточных форм БТШ70 посттрансляционную модификацию, возникающую обычно в процессе получения БТШ70 и других рекомбинантных белков в молоке трансгенных животных.
Технический результат
Анализ потенциальных сайтов гликозилирования и проведение in vitro мутагенеза гена БТШ70 человека.
Гликозилирование белков эукариот происходит по следующей схеме: гликозидные остатки присоединяются к азоту амидогруппы боковых цепей аминокислотных остатков Аспарагина или Глицина в специфических последовательностях [Asn OR Gln]X[Ser OR Thr] (где X = любая аминокислота кроме Пролина).
Соответствующие последовательности в белке БТШ70 были выявлены нами при помощи "fuzzpro" EMBOSS программного обеспечения ("The European Molecular Biology Open Software Suite"). Предполагаемые сайты 0-гликозилирования были проанализированы с помощью программы NetOGlyc 4.0 Server (www.expasy.org) и не были обнаружены.
Были выявлены потенциальные сайты гликозилирования БТШ70: DQGnRTTPS, AYFnDSQR, GRDLnKSI, IKRnSTIPT и GILnVTAT. Была проведена оценка влияния гликозилирования по этим сайтам на свойства белка БТШ70. Для этого аналогичные места гликозилирования были выявлены, используя уже установленную 3D структуру гомологичных белков (2QWL.pdb, 1CKR.pdb, 3CQX.pdb) и структуру фрагментов БТШ70 (2E8A.pdb, 2E88.pdb) (http://www.ncbi.nlm.nih.gov). Большинство сайтов возможного гликозилирования оказались важными для энзиматической функции БТШ70. Например, гликозилирование DQGnRTTPS может экранировать АТФ-связывающий центр БТШ70.
Основным техническим результатом является получение функционально активного человеческого БТШ70 с мутациями в основных сайтах гликозилирования для наработки в молоке животных.
Мутагенез потенциальных сайтов гликозилирования БТШ70
Общие принципы мутагенеза описаны в статье (Lei Young, Qihan Dong. Nucleic Acids Research, 2003, Vol. 31, No. 3 e11). Мы использовали два фланкирующих мутагенных праймера: 5ʹ-CCTCGAGCATATGGCGAAGGCAGCCGCTATCGGCATCGACCT-3ʹ (Р1), вносящих сайт Nde на N-конце, и мутацию гликозилирования. 5ʹ-GAGGGTCTGGTTCTGGTCCTACAATTGAGGAGGT-3ʹ (Р2), вносящих мутацию последовательности без изменения кодируемой ей аминокислоты на С-конце. Для элиминации сайтов гликозилирования были использованы следующие мутагенные праймеры:
{5ʹ-ACGACCAGGGTAACCGCGCCACCCCTAGCTACGTGGC-3ʹ M11
5ʹ-ACGACCAGGGTGACCGCACCACCCCTAGCTACGTGGC-3ʹ M12
5ʹ-TCACCGTGCCTGCCTACTTCAACGACGCGCAGCGCCA-3ʹ M2
5ʹ-CCTGAACAAGGCCATCAATCCGGACGAGGCTGT-3ʹ M3
5ʹ-CTGCCCTGATTAAGAGGAATTCCGCCATCCCCAC-3ʹ M4
5ʹ-GATGCCAACGGAATTCTGAACGTCGCGGCCACGGA-3ʹ M5}
Олигонуклеотиды были синтезированы на фирме SYNTOL. 1 nmol олигонуклеотида был фосфорилирован 2 ug Т4 полинуклеотидкиназы при 37о в буфере (12mM MgCl2, 20mM tric-Ac рН8, 1mM АТР). Матрицей для мутагенеза был БТШ человека, клонированный в плазмиду Bluescript. В реакцию мутагенеза брали 1ug/ml денатурированной матрицы, 0.4 uM праймера Р1, 0.4 uM фосфорилированного праймера Р2, 0.1 uM фосфорилированных М-праймеров (только одного праймера для единичной мутации или вместе с М11 (или 12) +М2+М3+М4+М5) в x1 буфере для Pfu (Sibenzyme), 0.1mM NADH, 0.1mM каждого dNTP. В смесь добавляли 10u of Pfu ДНК полимеразы (Sibenzyme) и 1ug Taq ДНК лигазы и проводили РЦР реакцию {94° 20ʹʹ; (93° 10ʹʹ, 65° 20ʹ) х10 циклов}.
Так для переклонирования последовательности дикого типа без замены аминокислоты использовали только праймеры Р1 и Р2; для создания мутации М5 были использованы праймеры P1, Р2 и М5. Для создания варианта M125 были использованы праймеры Р1+Р2+М12+М2+М3+М4+М5.
Смесь для мутагенеза разводили в пропорции 1:100 смесью для ПЦР: {x1 Pfu буфер, 5u/100ul Pfu (Sibenzyme), 0.25mM каждого dNTP+1ug/100ul фермента KlenTaq. ПЦР реакцию вели при: {94° 20ʹʹ; (93° 10ʹʹ, 72° 5ʹ) х15 циклов} с праймерами РА1 5ʹ-CCTCGAGCATATGGCGAAGGCAGCCGCTA-3 и РА2 5ʹ-GGGGATCCTATTAATCTACCTCCTCAATAGTAGGAC-3ʹ
Праймеры P1, Р2, РА1 и РА2 были подобраны так, что РА1,2 амплифицировали только последовательности, мутированные праймерами Р1, Р2. Смесь Pfu и Taq позволяла провести удлинение цепи до следующего праймера. При температуре 65°С Pfu имеет очень низкую активность по замене цепи. Преимуществом данного метода мутагенеза является одновременное включение в матрицу всех мутаций с выходом около 80%.
Продукты ПЦР реакции были проанализированы в агарозном геле, реакционная смесь была разведена в 100 раз смесью для ПЦР реакции {x1 Pfu буфер, 5u/100ul Pfu (Sibenzyme), 0.25mM каждого dNTP+1ug/100ul фермента KlenTaq}. ПЦР реакцию вели при: (94° 20ʹʹ; 93° 10ʹʹ, 72° 5ʹ) x25 циклов} с праймерами РА1 5ʹ-CCTCGAGCATATGGCGAAGGCAGCCGCTA-3 и PS2 5ʹ-CCTTGTCGACCTCGACCTAATCTACCTCCTCAATGGTGGGGCCTGACCCAGACC-3ʹ.
Продукты ПЦР реакции были проанализированы в агарозе, экстрагированы фенолом, осаждены и промыты этанолом. Далее была проведена рестрикция по сайтам Nde+Sal, клонирование мутированного фрагмента и его секвенирование.
На Фиг. 1 представлена последовательность аминокислот человеческого БТШ70 и указаны сайты гликозилирования, которые были мутированы.
Изобретение поясняется двумя примерами:
Пример 1. Экспрессия в бактериях (E. coli) и характеристика протективных свойств «дикого» и мутантного человеческого БТШ70
Формы рекомбинантных человеческих БТШ70, включая модифицированные варианты, при экспрессии в бактериях содержат полигистидиновый «хвост» (6xHis), что позволяет выделять эти белки из биомассы с использованием никелевых колонок, как описано (Hoffmann, Roeder 1991). Специальные исследования показали, что 6xHis не влияет на функциональные свойства форм БТШ70. БТШ70 «дикого» типа, не содержащий 6xHis, выделяли на DEAE-Sepharose (GE Healthcare Life Sciences, Cleveland, OH, USA) с последующей очисткой на АТФ-агарозе (Sigma, St Louis, MO, USA) (Welch and Feramisco, 1985).
Электрофорез выделенных БТШ70 проводили согласно общепринятым методикам (Magi and Liberatori, 2004). Для визуализации БТШ70 использовали коммерческие моноклональные антитела SPA822 (EnzoLab) или поликлональные антитела, получены из ФГБУН «Институт биологии гена» Российской академии наук (ИБГ РАН).
Различные in vitro тесты, использованные для характеристики рекомбинантных форм БТШ70, наработанных в бактериях.
Все эксперименты по анализу протективных свойств рекомбинантных форм БТШ70 проводили с препаратами высокой степени очистки (97-98%), выделенными из бактерий. В некоторых случаях в качестве контроля использовали человеческий БТШ70, экспрессированный в эукариотической экспрессионной системе (культура клеток Spodoptera), характеризующийся полным отсутствием бактериальных эндотоксинов.
а. Способность связываться с субстратом
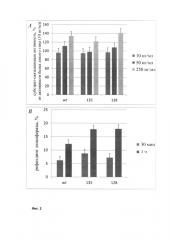
Шаперонную активность рекомбинантных форм БТШ70 анализировали модифицированным иммуноэнзиматическим методом (Cheetham et al 1994; Lazarev 2011). Суть метода заключается в том, что необратимо денатурированный белок (лактальбумин) наносится в 96-луночную плашку. После отмывки не связавшегося белка препараты БТШ70 в разных концентрациях наносятся в лунки, а после этого наносятся поликлональные антитела к БТШ70 (RSIII, Институт Цитологии (Lazarev et al., 2016). Антитела RSIII узнают БТШ70, связавшийся с денатурированным белком, и это позволяет количественно измерять уровень связывания (то есть шаперонные свойства БТШ70). В качестве вторых антител для визуализации комплексов использовали антикроличьи антитела, конъюгированные с пероксидазой (Jackson Immunochemicals, USA). Проведенные эксперименты показали, что по данному показателю модифицированная форма БТШ70, названная нами «вариант 128», не уступает «дикому типу» («вариант 135»). См. Фиг. 2 (А).
б. Способность восстанавливать укладку (рефолдинг) поврежденных белков
Для оценки способности препаратов БТШ70 восстанавливать нормальную укладку белков использовали методику, описанную Касселом с некоторыми модификациям (Cassel et al., 2012). Согласно этому протоколу люциферазу светлячка (Sigma-Aldrich, USA), инактивированную с помощью 8М мочевины, смешивали с экстрактом прогретых клеток эритробластомы K-562. После 100-кратного разведения в раствор добавляли БТШ70, креатин фосфат, креатин фосфокиназу, а также Glo-Bright раствор, представляющий собой субстрат для люциферазы (Promega, USA), и измеряли интенсивность люминесценции с помощью Charity multifunctional reader (Probanauchpribor, Russia). Проведенные опыты показали, что мутантный белок БТШ70 (вариант 128) по способности восстанавливать укладку не уступает белку «дикого типа». См. Фиг. 2 (Б).
в. Способность вытеснять эндогенный БТШ70 из клетки
В ряде лабораторий было показано, что при введении рекомбинантного БТШ70 в клетки, происходит вытеснение эндогенного БТШ70 на поверхность клетки (Mikhaylova et al., 2016). Для проверки способности полученных препаратов БТШ70 вытеснять эндогенный БТШ70 клетки крысиной глиобластомы инкубировали с препаратами БТШ70 в 96-луночной плашке и после инкубации добавляли антитела cmHsp70.1, которые селективно узнают TKD-пептид во внутриклеточном БТШ70, который вытесняется на поверхность клетки (Stangl et al., 2011; Shevtsov et al., 2014b). Интенсивность окраски (абсорбция), измеряемая с помощью ридера, пропорциональна количеству вытесненного эндогенного БТШ70. Опыты показали, что модифицированный БТШ70 не уступает исходному препарату БТШ70 по этому параметру (Фиг. 3А).
Способность экзогенного БТШ70 вытеснять из клеток эндогенный аналог изучали также с использованием конфокального микроскопа. Для этого рекомбинантный БТШ70 метили флуорохромом Alexa Fluor 555 (красный, Invitrogen, USA) и добавляли к клеткам человеческой эритробластомы K-562 cells (50μg/мл). Через 18 часов инкубации локализация меченого и суммарного БТШ70 была выявлена с помощью поликлональных антител RSIII, с использованием конфокальной микроскопии согласно известной методике (Shevtsov et al., 2014b). Эндогенный окрашенный БТШ70 виден на клеточной поверхности в виде зеленых точек (Фиг. 3Б). Опыты показали, что модифицированный рекомбинантный БТШ70 не уступает исходному препарату БТШ70 по этому параметру и эффективно вытесняет эндогенный аналог из клеток. См. Фиг. 3Б.
г. Способность понижать уровень АФК, индуцированный эндотоксинами бактерий.
Ранее мы показали, что добавление рекомбинантного БТШ70 до введения бактериальных токсинов (ЛПС) достоверно снижает уровень активных форм кислорода (АФК) в клетках (Kustanova et al., 2006; Rozhkova et al., 2010). Мы провели сравнительный анализ действия различных препаратов рекомбинантного БТШ70, включая модифицированный БТШ70 с мутированными сайтами гликозилирования, на уровень АФК в клетках, индуцированный добавлением эндотоксина на модели человеческих нейтрофилов по описанной ранее методике (Rozhkova et al., 2010). Полученные результаты свидетельствуют в пользу того, что модифицированный БТШ70 («128») превосходит все остальные протестированные препараты БТШ70 по этому важнейшему параметру (Фиг. 4).
Пример 2. Получение и анализ нативного и мутантного белка БТШ70 при экспрессии в молочной железе трансгенных мышей
Клонирование гена БТШ70 в плазмидный вектор для инъекций в животных.
Плазмида БТШ70 была создана на основе коммерческого вектора pBC1 (Invitrogen) и геномной последовательности гена БТШ70 человека, причем в работе использовали, как БТШ70 «дикого типа», так и модифицированный вариант с мутированными сайтами гликозилирования (Фиг. 5). Клонирование гена мутантного БТШ70 в плазмидный вектор для инъекций в животных осуществлялось как и для интактного БТШ70, за исключением того, что в позициях 55, 172, 380, 437 и 507 были изменены аминокислотные остатки на аланин для мутирования соответствующих сайтов гликозилирования (Фиг. 1). Измерение наличия трансгена в животных проводили методом ПЦР.
Молекулярно-биологические свойства используемой в работе плазмиды, содержащей ген человеческого БТШ70 - размер конструкции: 16912 п.н., размер векторной части - 5877 п.н., маркерный признак - устойчивость к ампициллину. Структурные элементы: тандемный повтор инсуляторов из бета-глобинового гена кур, бета-казеиновый промотор из генома коз, 5ʹ-нетранслируемая область содержит два первых экзона бета-казеинового гена, кодирующая область содержит геномную последовательность сигнального пептида лактоферрина и кодирующую область гена БТШ70 человека («дикий тип» или мутант), ген устойчивости к ампициллину, bla-промотор, ориджин репликации из плазмиды pBR322; сайт клонирования: NotI-SalI; размер кодируемого белка: 659 а.о. Устойчивость рекомбинантной плазмиды. Стандартные условия выращивания in vitro, условия культивирования - линия Е. coli XL-2, среда 2xYT, ампициллин 50 мкг/мл, 37°С, 18-20 часов. Хранение в течение 2 лет (срок наблюдения) в виде плазмидной ДНК при температуре минус 20°С.
Аликвоту плазмидной ДНК извлекают из холодильника (температура хранения - минус 20,0±2,0°С) и проводят трансформацию культуры Е. coli методом электропорации. Проводят культивирование трансформированной культуры на среде 2xYT с добавлением 50 мкг/мл ампициллина. Продолжительность культивирования составляет от 18 до 20 часов при температуре +37,0±0,5°С.
Плазмидная ДНК выделяется методом щелочного лизиса.
Центрифугируют при ЦФ 4°С в течение 10-15ʹ, сливают среду; далее центрифугируют 4krpm в течение 1ʹ, удаляют остатки жидкости. Ресуспензируют в 10(5)ml раствора "I" (Глюкоза 50mM, Tris-HCl, рН 8.0 25mM, EDTA 10mM); + 1ml свежеприготовленного раствора лизоцима (10mg/ml в р-ре "I"). Далее выдерживают при нормальной температуре в течение 15ʹ, добавляют 20ml раствора "II" (NaOH 0.2N, SDS 1%), резко выливают, смешивают при 0°С в течение 5ʹ; добавляют 10ml холодного 10М AcONH4 (добавляют 5 ml пипеткой по каплям), смешивают. Выдерживают при 0°С в течение 5ʹ.
Центрифугируют 5krpm, при 4°С в течение 10ʹ; супернатант снимают, делят на 2 пробирки, добавляют к каждой по 12.5 мл изопропанола. Делают это на весах, чтобы пробирки имели равный вес; выдерживают при комнатной температуре в течение 10ʹ, далее центрифугируют 5krpm при 4°С в течение 10ʹ, сбросить супернатант. Центрифугируют при комнатной температуре в течение 3ʹ, отсасывают остатки жидкости.
Суспендируют осадок в 800μl 2 М AcONH4, объединяют в одной 2ml пробирке; выдерживают при комнатной температуре в течение 5ʹ и центрифугируют при комнатной температуре в течение 10ʹ. Супернатант переносят в пробирку с 800μl изопропанола; выдерживают при комнатной температуре в течение 5ʹ; центрифугируют при комнатной температуре в течение 5ʹ; далее споласкивают 70% EtOH; растворяют в 0.2-1ml Н2O.
Выделенные и очищенные препараты плазмидной ДНК оценивают электрофоретически в 0,8% агарозном геле. Концентрацию измеряли на спектрофотометре и флуорометре. Проводили рестриктное картирование отдельно по EcoRI, HindIII, NotI-SalI. Рестриктные фрагменты разделяют электрофоретически на 0,8% агарозном геле и сравнивают с эталонными картами, представленными на фиг. 2-4.
Полученный препарат представляет собой очищенный препарат ДНК рекомбинантной плазмиды для экспрессии природного БТШ70, который может быть использован для подготовки фрагмента для микроинъекций.
Создание и анализ трансгенных мышей.
Создание трансгенных животных, получение потомства и анализ наличия трансгена проводили согласно ранее описанной методике (Goldman at al., 2008). Первичные трансгены были получены методом микроинъекций раствора ДНК в ТЕ-буфере (концентрация ДНК 5 нг/мкл) в мужской пронуклеус оплодотворенных яйцеклеток мышей гибридной линии (CBAxC57BL/6)F1 с последующей пересадкой выживших микроинъецированных зигот псевдобеременным реципиентам.
Яйцеклетки получали после индукции суперовуляции. Для этого неполовозрелым самкам (CBAxC57BL/6) F1 весом 12-13 г вводили внутрибрюшинно 8 ед. ГСЖК (гонадотропин сыворотки жеребых кобыл, фирма "МОСАГРОГЕН"), а затем, через 46 ч, внутрибрюшинно вводили 8 ед. Хгч (хорионический гонадотропин человека. Московский эндокринный завод). После такой обработки самок подсаживали к самцам-производителям гибридной линии (CBAxC57BL/6)F1. Факт спаривания констатировали на следующее утро по наличию копулятивной пробки. Схема получения суперовуляции: 13.00 ч - ГСЖК, через 46 ч в 11.00 ч - Хгч. В 17.00 ч этого же дня - подсадка к самцам-производителям. Отбор доноров производили на следующий день в 9.30 ч. Виварий освещали с 7.00 до 19.00 ч.
Самок с копулятивными пробками умерщвляли путем цервикальной дислокации и извлекали яйцеводы. Яйцеклетки вымывали из яйцеводов средой HEPES_KSOM с добавлением гиалуронидазы ("Sigma") под бинокуляром "Zeiss Stemi DV4" при увеличении 32х. Для вымывания использовали стеклянные капилляры с внутренним диаметром около 100 мкм, изготовленные на пуллере "Narishige РС-10" и микрокузнице "Narishige MF-900". Яйцеклетки культивировали в течение 2 ч (37°С, 5% CO2) в капле среды HEPES-KSOM или KSOM под минеральным маслом, затем помещали в микроинъекционную камеру. Микроинъекции проводили в среде HEPES-KSOM под микроскопом "Zeiss Axiovert 200M" при увеличении 400х-600х, используя микроманипуляторы "Narishige". Для изготовления игл для микроинъекций использовали пуллер "Sutter instrument Со Р-97". После окончания микроинъекций выжившие клетки переносили в каплю среды KSOM или HEPES-KSOM под минеральное масло и культивировали в течение 1 ч для выявления жизнеспособных клеток. Реципиентов получали следующим образом. Половозрелых самок (CBAxC57BL/6) F1 весом не менее 24 г подсаживали к вазэктомированным самцам той же линии. Псевдобеременных реципиентов отбирали на следующее утро по наличию копулятивных пробок.
Выжившие после микроинъекции зиготы трансплантировали в левый яйцевод псевдобеременной самки. В зависимости от числа клеток, выживших после микроинъекции, одной псевдобеременной самке пересаживали от 10 до 20 зигот. Для обездвиживания животных во время операции использовали авертин, который представляет собой 2.5% раствор в воде раствора 1 г 2,2,2 трибромэтанола в 1 мл 2_метил_2_бутанола. Авертин вводили внутрибрюшинно из расчета 15 мкл на 1 г веса животного.
Получение потомства и анализ наличия трансгена
При отсутствии естественных родов на 21-й день после пересадки микроинъецированных яйцеклеток реципиента умерщвляли путем цервикальной дислокации и проводили кесарево сечение, после чего выживших детенышей помещали к заранее подготовленной кормилице. Через 14-21 сут после рождения у мышат, рожденных после микроинъекций, отрезали кусочек хвоста, выделяли из них ДНК и анализировали наличие трансгена методом ПЦР.
ДНК выделяли по стандартному протоколу ("Molecular Cloning", USA). Фрагменты ДНК амплифицировали с помощью Taq-полимеразы ("GIBCO/BRL", USA) в буфере (с 2.5 мМ MgCl2), прилагаемом фирмой-производителем, в присутствии 0.2 мМ dNTP и 0.3 мкМ каждого праймера.
Для амплификации гена использовали следующие праймеры:
1 - 5ʹcgcaactccaccatccccaccaag
2 - 5ʹgccctctcgccctcgtacacctg
С помощью ПЦР в режиме реального времени было оценено наличие трансгенов в молочной железе трансгенных мышей. Таким образом, нами были получены две линии трансгенных мышей, которые экспрессировали в молочной железе нативный (линия 1) и модифицированный (линия 2) человеческий БТШ70.
Очистка препарата БТШ 70 из молока трансгенных мышей
Пробы молока у трансгенных мышей получали на 2-20 день после родов не чаще 2 раз за лактацию. Взятие молока проводится у наркотизированной внутрибрюшинной инъекцией раствора Avertin (0,25%) мыши из расчета 10 мкл/г, для увеличения молокоотдачи мыши внутрибрюшинно вводится окситоцин (10 ед./мл) из расчета 10 мкл/г. Молоко отбирается с помощью доильного аппарата, представляющего собой перистальтический насос, создающий разреженную атмосферу в пробирке для образцов.
Анализ свойств нативного и модифицированного БТШ70, полученного в молочной железе трансгенных мышей.
Далее было измерено примерное содержание БТШ70 (г/л) в молоке трансгенных мышей.). Молоко разбавляли 5 раз буфером состава 20 мМ NaH2PO4/300 мМ NaCl рН 8.0, после чего разделяли методом диск-электрофореза в 10% полиакриламидном геле. После разделения белки переносили на мембрану Hybond ECL и обрабатывали моноклональными антителами к БТШ70 человека. Белок узнавался антителами, но его электрофоретическая подвижность была меньше, чем у контрольного образца, что говорит о его посттрансляционной модификации (Фиг. 6).
Несмотря на высокий уровень продукции и иммунологическую идентичность полученного препарата природному аналогу, биологических функций он не выполнял (не связывался с АТФ-колонкой, что, вероятно, объясняется его гликозилированием). Для проверки этого предположения мы выделили молоко из обеих линий мышей и исследовали его с помощью иммуноблотинга. На Фиг. 6 видно, что в молоке обеих линий мышей присутствует человеческий БТШ70, но в линии, где экспрессируется в молоке БТШ70 «дикого типа», молекулярная масса этого белка достоверно выше, чем в линии, экспрессирующей модифицированный БТШ70.
Более того, было показано, что модифицированный БТШ70 успешно выделяется на АТФ-агарозе, в отличие от БТШ70 «дикого типа». В этих опытах молоко разбавляли высокосолевым буфером Tris-HCl pH8.0/300mM NaCl в соотношении 1:10 (10 частей буфера на 1 часть молока), после чего центрифугировали 10 мин при ускорении не меньше 8000 g и отбрасывали жировую фракцию. К обезжиренному молоку добавляли АТФ-агарозу производства Sigma (соотношение молоко/смола зависит от теоретической емкости смолы) и инкубировали при температуре 4°С в течение 1 ч при постоянном перемешивании. Затем молоко вместе со смолой наносили на 2-мл колонку производства Bio-Rad, пропускали жидкую фракцию, а оставшуюся на колонке смолу трижды промывали буфером Tris-HCl pH8.0/300mM NaCl (объем каждой промывки не менее трех объемов смолы). После промывки белок элюировали со смолы раствором 10 mM АТФ/10 mM MgCl2, приготовленном на буфере Tris-HCl pH8.0/300mM NaCl. Далее для очистки белка от АТФ к элюату добавляли ЭДТА до концентрации 20 mM и диализовали сначала против PBS/10 mM ЭДТА, затем дважды против PBS. В результате БТШ70 связывается с АТФ, иммобилизованным на колонке, после чего выделяется с чистотой не менее 90% (Фиг. 7).
Анализ биологической активности препарата БТШ70, выделенного из молока трансгенных мышей
Для оценки шаперонных свойств модифицированного БТШ70, нарабатываемого в молоке трансгенных мышей, белок выделяли по описанной выше методике (АТФ-колонки) и исследовали по тем же in vitro тестам, что и препараты БТШ70, выделяемые из бактерий (см. Пример 1). Так мы изучали субстрат-связывание с помощью шаперонного теста, который представляет собой систему, с помощью которой определяется способность активной части молекул шаперона, в данном случае БТШ70, узнавать и связывать субстрат, денатурированный белок. Тест подробно описан в работе Лазарев и др., 2011. При сравнении с эталонным белком БТШ70 (r-Hu-Hsp70, HSPA1A, выделенным из биомассы Е. coli), хорошо видно, что аналог, выделенный из молока, не уступает эталонному белку по этому показателю (Фиг. 8А).
Другим информативным тестом для оценки протективных свойств рекомбинантного модифицированного БТШ70, нарабатываемого в молоке, был ЦТЛ тест. ЦТЛ (CTL) классический тест цитотоксических лимфоцитов, в котором последние должны узнавать и убивать опухолевые клетки. Тест является одним из ключевых в иммунологии при определении активности клеток врожденного и приобретенного иммунитета. В нашем случае в качестве ЦТЛ служили неактивированные спленоциты, выделенные из мышей С3Н в соответствии со стандартным протоколом; по данным проточной цитометрии 2-7% от результирующей популяции составляют натуральные киллеры. Мишенью для них служат клетки эритробластомы человека К-562, обработанные в течение 18 час Hsp70 (50 мкг/мл). После совместной инкубации в соотношении эффекторы : опухолевые клетки 50:1 и 100:1 клетки помещаются в лунки 96-луночной платы, где после введения необходимых составляющих определяется активность ЛДГ, вышедшего в среду из погибающих клеток с помощью тест-системы CytoTox-96 (Promega). Тест подробно описан в работах Shevtsov et al., 2014, Oncotarget, Int J Cancer. Анализ результатов данного теста показал, что БТШ70, нарабатываемый в молоке, не только не уступает по данному показателю аналогичному белку, экспрессированному и выделенному из бактерий, но даже превосходит его (Фиг. 8Б).
Подписи под чертежами
Фиг. 1
Сравнение последовательностей БТШ70-135 (последовательность дикого типа с добавлением полигистидиновой метки), БТШ70-128 (с 5-ю заменами в составе сайтов гликозилирования) и БТШ70, экспрессируемого в молоке (с 5-ю заменами в составе сайтов гликозилирования и добавлением лидерной последовательности, обеспечивающей секрецию белка).
Фиг. 2
Шаперонная активность различных препаратов БТШ70. А - субстрат-связывающая активность БТШ70 в различных концентрациях. В - способность восстанавливать нативную конформацию фермента люциферазы. "Wt": рекомбинантный БТШ70 дикого типа (не содержащий модификаций аминокислотной последовательности); "135": БТШ70, меченный шестью остатками гистидина; "128": БТШ70 с модифицированной аминокислотной последовательностью (мутированными сайтами гликозилирования).
Фиг. 3
Вытеснение эндогенного БТШ70. А - результаты по инкубации клеток глиобластомы с различными пробами БТШ70 и антителами, узнающими внутриклеточный БТШ70, вытесняемый на поверхность клеток. Использовались две концентрации проб экзогенного БТШ70 (50 и 125 мкг/мл). В - результаты конфокальной микроскопии клеток эритробластомы, инкубированных с пробами БТШ70, конъюгированного с Alexa-555 и поликлональными антителами, узнающими БТШ70 (зеленое окрашивание) (Shevtsov et al. 2014).
Все пробы БТШ70 (но не БСА) вытесняют внутриклеточный БТШ70 на поверхность клеток (зеленое окрашивание). Wt - БТШ70 дикого типа; 128 - модифицированный БТШ70 с мутированными сайтами гликозилирования; 135 - БТШ70 дикого типа, меченый шестью остатками гистидина.
Фиг. 4
Влияние препаратов БТШ70 на продукцию активных форм кислорода нейтрофилами под действием ЛПС. К - контроль (без добавления БТШ70); 128 - модифицированный БТШ70; 135 - БТШ70, меченный гистидином; BTШ70S - белок, свободный от ЛПС, выделенный из клеток Spodoptera.
Фиг. 5
Карта экспрессионной конструкции для получения БТШ70 в молоке. Карта конструкции (рБТШ70), содержащей ген нативного БТШ70 (Hsp70), для инъекции в животных. Структурные элементы конструкции: бета-казеиновый промотор из генома козы, сигнальная последовательность лактоферрина, тандемный повтор инсуляторов из бета-глобинового гена кур, ТАТА-бокс, ген устойчивости к ампициллину, ориджин репликации из плазмиды pBR322, кДНК копия человеческого гена БТШ70 (получена от Проф. Моримото GenBank Accession No M11717), аминокислотная последовательность соответствующего белка SwissProt Р08107.
Фиг. 6
БТШ70, выделенный из молока трансгенных мышей. 1 - БТШ70 дикого типа, экспрессируемый в клетках Е. coli; 2, 3 - БТШ70 дикого типа, выделенный из молока трансгенных мышей; 4 - молоко нетрансгенной мыши (отрицательный контроль); 5, 6 - модифицированный БТШ70 (128), экспрессируемый в молоке мышей.
Фиг. 7
Очистка мутантного БТШ70 из молока с помощью АТФ-колонки. А. 1 - молоко; 2 - фракция «проскока»; 3 - смола после элюции БТШ70; 4 - элюированный БТШ70 (1-4 - молоко трансгенных мышей). 5 - молоко; 6 - фракция «проскока»; 7 - смола после элюции БТШ70; 8 - элюат (5-8 - молоко нетрансгенных мышей) В. Вестерн-гибридизация геля, представленного на рис. А, с антителами к БТШ70.
Фиг. 8
Активность проб БТШ70, выделенного из клеток Е. coli в сравнении с БТШ70, выделенным из молока трансгенных мышей. А - субстрат-связывающая активность; В - цитотоксичность.
Список литературы
1. Hartl FU, Bracher A, Hayer-Hartl M. 2011. Molecular chaperones in protein folding and proteostasis. Nature. 475: 324 – 32.
2. Srivastava P. 2002. Interaction of heat shock proteins with peptides and antigen presenting cells: chaperoning of the innate and adaptive immune responses. Annu Rev Immunol. 20: 395-425.
3. Guzhova I, Kislyakova K, Moskaliova O, Fridlanskaya I, Tytell M, Cheetham M, Margulis B. 2001. In vitro studies show that Hsp70 can be released by glia and that exogenous Hsp70 can enhance neuronal stresstolerance. Brain Res. 914: 66-73.
4. Kakimura J, Kitamura Y, Takata K, Umeki M, Suzuki S, Shibagaki K, Taniguchi T, Nomura Y, Gebicke-Haerter PJ, Smith MA, Perry G, Shimohama S. 2002. Microglial activation and amyloid-beta clearance induced by exogenous heat-shock proteins. FASEB J. 16: 601 – 3.
5. Robinson MB, Tidwell JL, Gould T, Taylor AR, Newbern JM, Graves J, Tytell M, Milligan CE. 2005. Extracellular heat shock protein 70: critical component for motoneuron survival. J. Neurosci. 25: 9735-45.
6. Kustanova G, Murashev A, Karpov V, Margulis B, Guzhova IV, Prokhorenko IR, Grachev SV, MB. 2006. Exogenous heat shock protein 70 mediates sepsis manifestations and decreases the mortality rate in rats. Cell Stress Chaperones. 11: 276 – 86.
7. Rozhkova E., M. Yurinskaya, O. Zatsepina, D. Garbuz, Arkady Murashev, Vladimir Ostrov, Boris Margulis, M. Evgenev, M. Vinokurov. 2010. Exogenous mammalian extracellular HSP70 reduces endotoxin manifestations at the cellular and organism levels. Annals of the New-York Academy of Sciences. 1197: 94 – 107.
8. Vinokurov M, Ostrov V, Yurinskaya M, Garbuz D, Murashev A, Antonova O, M. 2012. Recombinant human Hsp70 protects against lipoteichoic acid-induced inflammation manifestations at the cellular and organismal levels. Cell Stress Chaperones. 17: 89 – 101.
9. Welch WJ, Feramisco JR. 1985. Rapid purification of mammalian 70,000-dalton stress proteins: affinity of the prot