Способ профилактики лимфореи после радикальной простатэктомии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкоурологии, и может использоваться для профилактики лимфореи, возникающей после радикальной простатэктомии. Радикальная простатэктомия включает удаление опухоли и подвздошно-запирательно-тазовую лимфаденэктомию. В конце операции осуществляют обработку раневой поверхности фибриновым клеем, который наносят на гемостатическую губку. Производят аппликацию губки на сухую раневую поверхность по границам лимфаденэктомии. Через 2-3 минуты губку удаляют и послойно ушивают рану. Способ позволяет уменьшить число послеоперационных осложнений, уменьшить образование лимфоцеле (серомы) и сократить сроки лимфореи, при этом сокращаются сроки послеоперационной реабилитации, что способствует ранней активации пациента. 2 ил., 1 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к онкоурологии, и может использоваться для профилактики лимфореи, возникающей после радикальной позадилонной простатэктомии.
В настоящее время тазовая лимфаденэктомия является обязательным компонентом радикальной простатэктомии, которая имеет не только лечебное, но и диагностическое значение и несет важную информацию о стадии онкологического процесса. Однако тазовая лимфаденэктомия (стандартная или расширенная) сопровождается удалением значительной массы тканей с пересечением и ранением большого количества мелких лимфатических и кровеносных сосудов, которые зачастую не перевязываются, так как не визуализируются во время операции. Эти обстоятельства приводят к скоплению серозной и геморрагической жидкости и способствуют формированию лимфоцеле (серомы). Образование лимфоцеле (кист в забрюшинном пространстве, заполненных лимфой) в раннем послеоперационном периоде после тазовой лимфаденэктомии и радикальной простатэктомии, составляет 25-50%. Механизм их развития связан с рассечением при тазовой лимфаденэктомии эфферентных лимфатических сосудов с последующей аккумуляцией лимфы в забрюшинном пространстве. Предрасполагающими факторами являются предшествующая лучевая терапия, пролонгированное лечение кортикостероидами, диуретиками, наличие метастатической опухоли в лимфатических узлах, гематома в полости таза, инфекция. Лимфоцеле могут быть одно- или двусторонними. Клинически тазовые лимфоцеле протекают бессимптомно или проявляются симптомами сдавления органов, к которым они прилежат (мочеточники, мочевой пузырь, прямокишечно-сигмовидный сегмент, подвздошные сосуды). Наиболее часто - это симптомы сдавления мочеточников, раздражение мочевого пузыря, задержка стула, отек половых органов, боли в нижней половине живота, отеки голеней. Диагноз устанавливается на основании данных экскреторной урографии, цистографии, КТ и эхографии таза. Для профилактики лимфоцеле при лимфаденэктомии необходимо тщательно лигировать края резецированных лимфатических сосудов. Лечение лимфоцеле заключается в аспирации содержимого кисты с ее последующим дренированием. В некоторых случаях приходится прибегать к иссечению кисты с пришиванием краев ее стенки к брюшной стенке для выполнения полости лимфоцеле грануляциями. Дополнительно используют антибиотики, антикаугулянты.
Длительное и большое скопление лимфоцеле в образованном замкнутом пространстве могут провоцировать сдавление близлежащих органов и структур малого таза (стеноз мочеточника, сдавление подвздошных сосудов, развитие кишечной непроходимости). Возможно появление отечности нижних конечностей, мягких тканей лона, мошонки, а присоединение бактериальной инфекции приводит к воспалительным явлениям (абсцессы, флегмоны), которые нередко являются причиной повторных оперативных вмешательств. Кроме того, длительная лимфорея приводит к потерю свободных аминокислот и обуславливает гипоальбуминемию.
Учитывая вышеуказанные данные, разработка новых методов профилактики образования лимфоцеле после радикальной простатэктомии у пациентов раком предстательной железы является крайне актуальной задачей.
В медицине имеются многочисленные методы профилактики лимфореи после лимфодисекции. Известны различные физические методы профилактики лимфоцеле при хирургическом лечении пациентов раком различной локолизации. В частности применение низкоинтенсивного магнитно-лазерного излучения аппаратом (МИЛТА) после радикальной простатэктомии (Карелин М.И., Школьник М.И., Харитонов М.В. «Применение аппарата Милта в профилактике осложнений после радикальной простатэктомии», Лазерная медицина 2008, 2008. - N 3. - С. 31-35. Библ. 14 назв.). Также известен метод, позволяющий уменьшить лимфо-, и кровопотерю используя плазменные потоки в онкохирургии (Кабисов Р.К., Чиссов В.И., Соколов В.В., Пекшев А.В. «Плазменные потоки в онкохирургии», МНИОИ им. П.А. Герцена. Методические рекомендации. М., 1996). В вышеперечисленных способах подробно описываются методики проведения плазменных потоков и морфологические особенности изменения на воздействующие ткани с целью хирургического гемостаза. Однако на ранних сроках послеоперационного периода рекомендуемые методы воздействия плазменных потоков с целью гемостаза не могут быть применены для достижения лимфостаза раневой поверхности.
Известен способ профилактики лимфореи после пахово-бедренной лимфаденэктомии по поводу меланомы кожи. Для этого раневую полость после ее стандартной обработки инсуфлируют стерильным порошком «Полисорб МП» до прекращения лимфореи. Способ обеспечивает прекращение лимфореи за счет формирования комплексов оксида кремния с белками тканевой жидкости, которые создают окклюзию просвета лимфотических сосудов (патент РФ №2532898 С1, 10.11.2014). Однако при этом способе профилактике лимфореи не учитывается суточная доза препарата Полисорб МП и неконтролируемое ведение объема суспензии может привести к передозировке и нежелательным побочным воздействиям (атония кишечника, кровотечение из желудочно-кишечного тракта), кроме этого Полисорб МП противопоказан больным с язвенной болезнью желудка и двенадцатиперстной кишки.
Некоторые авторы предлагают при формировании лимфоцеле пункционное удаление лимфы под контролем УЗИ, при этом возникает высокий риск ятрогенного повреждения ближе лежащих органов и анатомических структур (Хирургия предстательной железы. Под ред. проф. С.Б. Петрова Санкт Петербург 2004).
Известен метод склеротерапии для профилактики лимфореи после простатэктомии, который заключается в том, что через установленный дренаж вводят 10% раствор Повидона на 30 мин, после чего дренаж удаляется (Gilliant J. Det. et al., 1997). Этот способ склеротеропии не дает желаемый эффект уменьшения лимфореи, так как раствор Повидона неравномерно распределяется по раневой поверхности за брюшинного пространства.
Известен способ уменьшения длительной лифореи после подключично-подмышечно-подлопаточной лимфоаденэктомии. Для этого в конце радикальной мастэктомии, включающий подключично-подмышечно-подлопаточной лимфоаденэктомию с пересечением и отсепаровкой малой грудной мышцы у места прикрепления к 3-5 ребрам, наносят латексный тканевой клей слоем 0,1 мм, ротируя мышечный лоскут при помощи пинцетов в течение 5-7 минут; дополнительно фиксируя лоскут тремя узловыми швами рассасывающейся нитью 3,0 к окружающим тканям; далее фиксируют, отсепарованной мышцы спины к передней зубчатой и малой грудной мышцам отдельными швами (патент РФ №2527836 С2, 28.03.2013). Однако установлено, что латексный клей имеет свои недостатки, такие как: 1) длительное образование полимеризационной пленки на раневой поверхности, что препятствует надежному гемостазу; 2) обладает менее адгезивным свойством по сравнению с фибриновым клеем (Пландовский, А.В. Видеоторакоскопическая клеевая герметизация аппаратного легочного шва в хирургическом лечении спонтанного пневмоторакса / А.В. Пландовский, А.А.Татур // Военная медицина. 2010. №4. С. 100-103).
Наиболее надежным способом в профилактике лимфореи является обработка подмышечной зоны аутологичиским фибрином (Moore M.M., et al., 1993) после удаления регионарной клетчатки, который обладает адгезивным и гомеостатическими свойствами. Такая процедура, по полученным данным, приводит к уменьшению объема аспирируемой жидкости с 467 до 198 мл и способствует более быстрому удалению дренажа (при контроле без обработки фибрином - на 7-й день, после применения фибрина - на 4-й).
Недостатками данного способа является: 1) необходимость специального оборудования в клинике; 2) высокой риск инфицирования послеоперационной раны.
Задачей заявляемого изобретения является уменьшение послеоперационных осложнений и сокращение сроков лечения лимфореи.
Этот абзац необходимо дополнить и дать в этом разделе.
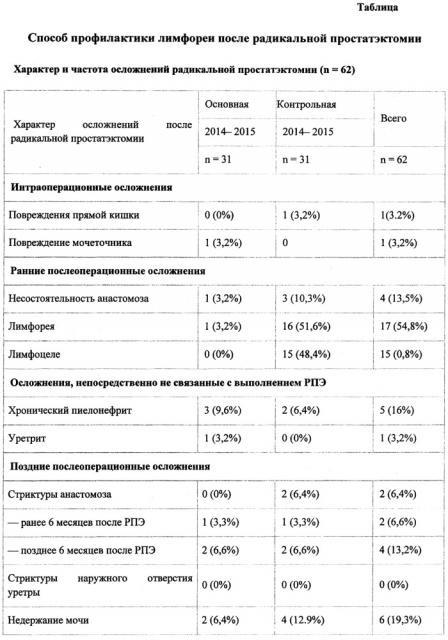
Для подтверждения описания способа и клинических примеров приводятся таблица и фото 1 и 2.
В таблице представлены результаты исследований осложнений после РПЭ основной и контрольной групп.
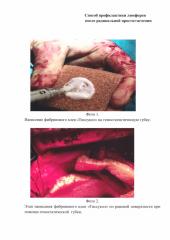
На фото 1 показано нанесение фибринового клея «Тиссукол» на гемостатистическую губку.
На фото 2 показано нанесение фибринового клея «Тиссукол» на раневую поверхность при помощи гемостатической губки.
Технический результат заявляемого решения заключается в предупреждении образования лимфоцеле в забрюшинном пространстве после радикальной простатэктомии с сокращением сроков лечения. Указанный технический результат достигается таким образом: после обработки кожи и ограничения операционного поля стандартным методам в положении Трендельбурга производится нижнесрединный разрез на 2 см ниже пупка по белой линии живота, обеспечивая доступ к предпузырному пространству. Брюшина отводится кверху и отделяется до бифуркации общих подвздошных сосудов. Затем производится поэтапная подвздошно-запирательная лимфоаденэктомия, которая начинается с рассечения лимфатической ткани над наружными подвздошными венами. Далее выделяется область огибающей подвздошной вены и узла Клоквета. Лимфатическая ткань, расположенная в запирательной ямке, мобилизуется от стенки таза к направлению бифуркации подвздошных сосудов, и пакет лимфатических узлов удаляется единым блоком. Затем рассекается тазовая фасция с боков от предстательной железы до пубопростатической связки, которые пересекаются острым путем. Дорзальный венозный комплекс лигируется «максоном» нитью 2-0, выделяется дистальная часть простаты и уретры. Уретра пересекается сразу ниже апикальной части простаты. В мочевой пузырь вводится катетер Фолея, рассекается задняя часть рабдосфинктера и фасция Денонвилье, мобилизуется задняя поверхность простаты путем тракции за катетер. Острым и тупым путем простата отделяется от прямой кишки до шейки мочевого пузыря вместе с семенными пузырьками и фасцией Денонвилье, простата отсекается от мочевого пузыря с сохранением шейки, препарат удаляется, производиться тщательный гемостаз. После эвогинации шейки формируется анастомоз уретры с мочевым пузырем на катетере Фолея. После основного этапа радикальной простатэктомии с расширенной лимфодиссекции производится аппликация фибринового клея по границам лимфоаденэктомии путем наложения гемостатической губки с нанесенном на нее фибринового клея в зонах предполагаемой лимфореи.
Способ осуществляется следующим образом: соблюдая правила асептики, на гемостатическую губку наносят фибриновый клей (например«Тиссукол» (Фото 1), затем производят аппликацию на сухую раневую поверхность по границам лимфоаденэктомии, после 2-3 минутной экспозиции гемостатическую губку удаляют (Фото 2).
При таком способе нанесения фибринового клея на раневой поверхности образуется белая тонкая эластическая масса, плотно прилипающая к тканям, имитируя основной этап свертывания крови.
Таким образом, за счет облитерации мелких кровеносных и лимфатических сосудов уменьшается образования лимфоцелле (серомы) и достигается надежный гемостаз. После нанесения фибринового клея предпузырное пространство дренируется двумя 2-просветными дренажными трубками. Рана послойно ушивается. Клинический пример.
Пациент А.Т., 61 лет, госпитализирован с диагнозом, С61 Са простаты Т2с N1 М0. Биопсия предстательной железы: 22.01.2014. Гистологическое заключение 1354/2014: В столбике 7 (очаг менее 1 мм), столбиках 10, 11 (по очагу менее 1 мм), в столбиках 8, 9, 12 - умеренно дифференцированная ацинарная аденокарцинома 7 баллов по Глисону (4+3) с периневральным ростом.
24.01.2014 больному выполнена радикальная позадилонная простатэктомия с расширенной подвздошно-запирательной лимфоаденэктомией. Под общим обезболиванием произведена нижнесрединная, внебрюшинная лапаротомия. Аппаратная коррекция доступа. При ревизии пальпируется опухоль в левой доле простаты. Тазовые лимфоузлы не увеличены. Решено произвести радикальную простатэктомию. Первым этапом произведена подвздошно-запирательная лифоаденэктомия с обеих сторон, затем проведена тазоподвздошная лимфоаденэктомия. Лимфоузлы не вызывают подозрение на метастатическое поражение. Далее рассечена тазовая фасция с боков от предстательной железы до пубопростатических связок. Визуализированы пубопростатические связки. Связки пересечены острым путем. Лигирован полисорбовой нитью 2-0 и пересечен дорзальный венозный комплекс. Выделена дистальная часть простаты и уретра. Уретра пересечена сразу ниже апикальной части простаты. В мочевой пузырь введен катетер Фолея. Рассечена задняя часть рабдосфинктера и фасция Денонвилье. Начата мобилизация задней поверхности простаты путем тракции за катетер. Острым путем простата отделена от прямой кишки до шейки мочевого пузыря вместе с семенными пузырьками и фасцией Денонвилье, отсечена от мочевого пузыря с сохранением шейки. Препарат удален. Произведена аппликация препарата (Тиссукол 2 ml) по границам лимфоаденэктомии (в зонах предполагаемой лимфореи) с помощью гомеостатической губки, через 2 минуты губку удалили, провели тщательный гемостаз. После эвагинации слизистой шейки сформирован анастомоз уретры с мочевым пузырем на катетере Фолея. Дренирование предпузырного пространства двумя 2-просветными дренажами. Ушивание раны.
Макропрепарат: предстательная железа с семенными пузырьками в виде плотного узла 6×8 см. На разрезе дольчатая, многоузловая белесоватая.
26.01.2014. УЗИ органов брюшной полости и забрюшинного пространства. В брюшной полости и малом тазу свободной и осумкованной жидкости не выявлено.
В послеоперационном периоде пациент получал комплексную патогенетическую терапию. Послеоперационный период протекал без осложнений. Дренажные трубки удалены на 2 сутки.
Послеоперационная рана зажила первичным натяжением. В удовлетворительном состоянии пациент выписан (на 8 сутки) под наблюдение онколога по месту жительства.
01.02.2014 Гистологическое заключение. Низкодифференцированная ацинарная аденокарцинома левой доли предстательной железы с инвазией в сосуды и капсулу по Глисону 8 бал. Прорастание в основание и верхушку органа. В одном подвздошно-запирательном лимфоузле - слева метастаз рака. В других лимфоузлах ракового роста нет.
Также для подтверждения эффективности предлагаемого способа проведен сравнительный анализ.
В исследовании были проанализированы результаты хирургического лечения 62 пациента с раком предстательной железы, оперированных в плановом порядке за период с 2014 по 2016 год на базе ГАУЗ РКОД МЗ РТ. Больные, в зависимости от способа профилактики интраоперационных осложнений были разделены на две группы. В группе сравнения (первой) применяли традиционные для клиники методы профилактики. В основной группе (второй) был апробирован разработанный нами метод аппликации фибринового клея (Тиссукол) с помощью гемостатической губки по границам лимфоаденэктомии.
Возраст больных варьировал от 59 до 75 лет (в среднем 67±2,5 года).
Все пациенты, включенные в исследования, имели сопутствующую соматическую патологию в стадии компенсации или субкомпенсации; при этом проводилась корригирующая терапия по назначениям соответствующих специалистов. Наиболее частой патологией были заболевания сердечно-сосудистой системы (54%), в структуре которых превалировали гипертоническая болезнь и различные формы стенокардии. 1/3 пациентов имела проблему лишнего веса. Среди исследуемых отмечено 9 (14%) случаев сахарного диабета, 15 (24%) эпизодов заболеваний органов пищеварения.
Все 62 больных были госпитализированы в РКОД МЗ РТ в отделение №6 (урологическое) с диагнозом: Са простаты, стадий заболеваний от Т1-Т3. Предоперацинная диагностика составлялась с учетом локализации, обьема простаты, размеров, отдаленных метастаз (М), метастаз в лимфатические узлы (N). До операции всем больным произведены специальные методы диагностики: пальцевое исследование предстательной железы, ПСА крови своб/общий, ТРУЗИ простаты, MPT ОМТ, мультифокальная биопсия простаты (МФБ), остеосцинтиграфия (ОСГ).
Всем больным была проведена радикальная простатэктомия с подвздошно-запирательной-тазовой лимфоаденэктомией.
В основной группе состояли 31 (50%) пациентов, которым с целью профилактики интра- и послеоперационных осложнений проводилась аппликация фибриновым клеем (Тиссукол) с помощью гемостатической губки по границам лимфоаденэктомии, в зонах предполагаемой лимфореи, по предложенному нами способу.
Группу сравнения составили 31 (50%) пациент, которым профилактика интра- и послеоперационных осложнений проводилась перевязкой лимфатических протоков по границам лимфоаденэктомии. Результаты исследования отражены в таблице, где представлены осложнения РПЭ, разделенные на несколько групп: интраоперационные, ранние и поздние послеоперационные, а также осложнения, непосредственно не связанные с выполнением РПЭ.
Необходимо отметить, что летальных исходов во время оперативного вмешательства, а также в раннем послеоперационном периоде не было. К ранним послеоперационным осложнениям были отнесены лимфорея, потребовавшие длительного (более 14 дней) дренирования предпузырного пространства (cavum Retzii), также лимфоцеле и несостоятельность пузырно-уретрального анастомоза. Отдельно выделены осложнения, непосредственно не связанные с хирургическим вмешательством, - обострение хронического пиелонефрита и уретрит.
Результаты статистического анализа выявили достоверную корреляционную связь между развитием лимфореии и лимфоцеле и возрастом больного, объемом кровопотери, длительностью операции, назначением неоадьювантной терапии, предшествовавшей трансуретальной резекции предстательной железы, сохранением сосудисто-нервных пучков и стадией рака предстательной железы.
Критерием эффективности проводимой профилактики с проведением аппликации фибринового клея «Тиссукол» интра- и послеоперационных осложнений после радикальной простатэктомии явилось: отсутствие у 87% (27) оперированных больных лимфореи, лимфоцеле, отсутствие у этих больных стеноза мочеточника, сдавления подвздошных сосудов, что приводит к отечности нижних конечностей, мягких тканей лона, мошонки. У 30 (96,8%) пациентов отсутствие интра- ранних послеоперационных кровотечений и тромбоэмболических осложнений, т к. с использованием современных методов лигирования и коагуляции кровеносных и лимфатических сосудов позволяют более детально визиализировать операционное поле, что приводит к значительному сокращению продолжительности операции и величины интраоперационной кровопотери. У 27 (87%) больных послеоперационный период сократился на 3-5 дней, что приводит к быстрой реабилитации, активации больного и сокращению койко-дня в реанимационном отделении и уменьшает экономические затраты.
Таким образом, предлагаемый способ профилактики лимфареи после радикальной простатэктомии позволяет уменьшить количество послеоперационных осложнений, способствует уменьшению образования лимфоцеле (серомы), сократить сроки лимфореи от 1- до 3 суток, сократить сроки послеоперационной реабилитации, а также способствует ранней активации пациента.
Преимущества данного метода: простота исполнения, доступность препарата «Туссукол», хороший медицинский результат, экономическая составляющая.
Способ профилактики лимфореи после радикальной простатэктомии, включающий удаление опухоли и подвздошно-запирательно-тазовую лимфаденэктомию, отличающийся тем, что после основного этапа операции производят обработку раневой поверхности фибриновым клеем, который наносят на гемостатическую губку, производят аппликацию губки на сухую раневую поверхность по границам лимфаденэктомии, через 2-3 минуты губку удаляют и послойно ушивают рану.