Способ получения рекомбинантного орексина а человека, плазмидная днк, штамм-продуцент
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков человека, и может быть использовано для получения орексина А человека в клетках Escherichia coli. Способ получения заключается в культивировании клеток штамма-продуцента Escherichia coli BL21(DE3)pET151/D-TOPO, полученного трансформацией плазмидной ДНК pET151/D-TOPO, содержащей кодонно оптимизированный ген орексина А человека, клеток Escherichia coli BL21(DE3) с использованием индуктора экспрессии таргетного белка. Затем лизируют клетки, отмывают тельца включения 0.2 М дезоксихолятом натрия, растворяют тельца включения в 8 М растворе мочевины, проводят рефолдинг орексина А в буфере 0.1M Tris рН 8.0, 0.2 mM ЭДТА с 0.5 М L-аргинином и проводят хроматографическую очистку полученного раствора белка на S-Sepharose колонке и S-100 колонке. Изобретение позволяет получить высокоочищенный физиологически активный рекомбинантный орексин А человека. 3 н.п. ф-лы, 3 ил., 2 табл., 5 пр.
Реферат
Предложена группа изобретений, относящихся к биотехнологии, фармации и медицине. Изобретения могут быть применены для получения орексина А человека.
Орексины, или гипокретины, - это нейропептиды, открытые в 1998 году независимо двумя группами исследователей (Sakurai Т. et al., 1998, de Lecea L. et al., 1998). Орексины А и В транслируются с одной мРНК в виде пептида-предшественника препроорексина, состоящего из 130 аминокислотных остатков (Peyron С., et al., 1998). Человеческий ген, кодирующий белок препроорексин, расположен в 17 хромосоме и имеет 2 экзона, которые целиком транслируются в конечные пептиды. Препроорексин имеет N-терминальную сигнальную последовательность из 33 аминокислот. После удаления этой последовательности образуется проорексин, из которого прогормонконвертаза вырезает две аминокислотные последовательности с образованием орексинов А и В (Sakurai Т. et al., 1999).
Орексин А млекопитающих представляет собой олигопептид, состоящий из 33 аминокислот, его приблизительная масса составляет 3,5 кДа. Молекула орексина А имеет петлеобразную пространственную структуру, амидированную по С-концу; ее N-конец содержит пироглютамиловый остаток и две внутримолекулярные дисульфидные связи: Cys6-Cys12 и Cys7-Cys14 (Sakurai Т. et al., 1998).
Орексины синтезируются небольшой популяцией гипоталамических нейронов (около 1100-3400 у крысы, 50000-80000 у человека) (Harrison, Т.A., et al., 1999; Peyron С., et al., 1998; Thannickal Т.С.et al., 2000), наиболее многочисленной в перифорникальной зоне латеральной гипоталамической области (De Lecea L. et al., 1998; Sakurai T. et al., 1998). Отростки орексин-содержащих клеток проецируются в различные области головного и спинного мозга, например в таламус, компоненты лимбической системы (гиппокамп, амигдалла), эпифиз, кору больших полушарий, спинной мозг (I и X пластинки) (Date Y., et al., 2000; Date Y., et al 2000; Peyron C. et al., 1998).
Рецепторы к орексину и отростки орексин-содержащих нейронов обнаруживаются во многих ядрах на различных уровнях ЦНС, вовлеченных в регуляцию цикла сон/бодрствование (голубое пятно, мост, ретикулярная формация, ядра шва, маммилярные ядра, латеральная преоптическая область гипоталамуса) (Kukkonen J.P. et al., 2002). Активность орексин-содержащих нейронов подвержена суточным колебаниям, она повышается в период активности и снижается в период покоя (Estabrooke I.V. et al., 2001; Yoshida Y et al., 2001). В норме количество орексина утром повышается, что ведет к пробуждению (Taheri, 2001).
Основное действие орексина заключается в инициации пробуждения и поддержании активного состояния, главным образом за счет активации центров бодрствования. Инъекции орексина А в структуры, вовлеченные в регуляцию цикла сон/бодрствование, провоцируют состояние бодрствования у крыс и кошек, а также угнетают обе фазы сна (Bourgin P. et al., 2000; Espana R.A. et al., 2001; Hagan J.J. et al., 1999; Huang Z.L. et al., 2001; Methippara M.M. et al., 2000; Piper D.C. et al., 2000).
Орексин-содержащие нейроны вовлекаются в регуляцию пищевого поведения, выступая в роли триггера, запускающего поисковое пищевое поведение. Внутрижелудочковое введение орексина А инициирует прием пищи у крыс (Sakurai Т. et al., 1998). Введение антагониста рецептора орексина первого типа, SB-334867, подавляет базовый уровень пищевого поведения, нормальный набор веса, а также аппетитстимулирующий эффект, вызванный микроинъекциями орексина А в гипоталамус (Haynes А.С. et al., 2000).
За пределами центральной нервной системы орексин-содержащие нейроны обнаружены в 12-перстной кишке, желудке, поджелудочной железе, надпочечниках, сердце, яичках, а также в мезентеральных симпатических ганглиях (Arihara, Z., et al., 2000; Johren, О., et al 2001; Karteris, E, et al., 2001 Kirchgessner, A.L., et al 1999; Naslund, E., et al., 2002; Randeva H.S. et al., 2001).
Орексины оказывают влияние на функции эндокринной системы и через регуляцию синтеза и секреции различных гормонов воздействуют на вегетативные функции организма. Анализ современной литературы свидетельствует об участии орексин-содержащих нейронов в терморегуляции, которое заключается в поддержании циркадных изменений температуры тела, а также их модулировании при различных формах патологии (Mochizuki Takatoshi, Elizabeth В. Klerman, Takeshi Sakurai, Thomas E. Scammell. Elevated body temperature during sleep in orexin knockout mice. Am. J. Physiol. Regul. Integrative Comp.Physiol. 291: 533-540. 2006, Szekely M., Petervari E., Balasko M., Hernadi I., Uzsoki B. Effects of orexins on energy balance and thermoregulation. Regul. Pept. 104(1-3): 47-53. 2002, Tanaka M., Tonouchi M., Hosono Т., Nagashima K., Yanase-Fujiwara M., Kanosue K. Hypothalamic region facilitating shivering in rats. Jpn. J. Physiol. 51: 625-629. 2001).
Комплекс полученных данных дает основание предполагать участие системы орексин-содержащих нейронов в формировании системного ответа, в частности, компонентов продромального синдрома, на введение антигена и в механизмах центральной регуляции функций иммунной системы.
Повышение секреции основных стрессорных нейромедиаторов и гормонов, вызываемое действием орексина, позволяет говорить о возможном участии орексин-содержащих нейронов в механизмах регуляции стресс-индуцированных реакций организма. Эти данные согласуются с работами, в которых описаны поведенческие реакции животных на внутрижелудочковое введение орексина А. Например, грумминг и оборонительное поведение, вызванные данным воздействием, являются типичными для генерализованной стресс-реакции (Duxon М.S. et al., 2001; Espana R.A. et al., 2001; Ida T. et al., 1999; Ida T. et al., 2000).
В настоящее время активно изучается вопрос о роли орексина в патогенезе таких заболеваний, как хорея Хантингтона (Petersen A. et al., 2005), болезнь Паркинсона (Yasuia K. et al., 2006), синдром обструктивного сонного апноэ (Sakurai S. et al., 2005), диабет II типа (Goncz Е. et al., 2007, Cai J. et al., 2006). При некоторых формах тяжелой черепно-мозговой травмы обнаруживается снижение концентраций орексина и атрофия орексин-содержащих нейронов у больных (Baumann С.R. et al., 2005).
Орексины улучшают когнитивные функции, такие как внимание и память. Показано, что интраназальное или внутривенное введение орексина А после вынужденного бодрствования в течение 30-36 часов значительно улучшает показатели теста на кратковременную память у макак-резусов (Deadwyler S.A. et al., 2007).
Особое значение имеют данные о положительном эффекте орексина А у пациентов с нарколепсией (Baier P. Ch. et al., 2008).
Находящиеся в разработке препараты, влияющие на активность орексин-содержащих нейронов, в основном, являются антагонистами рецепторов орексинов. Известны некоторые низкомолекулярные соединения, возможно являющиеся антагонистами, специфически связывающимися с рецепторами OXR1 или OXR2 или одновременно с обоими рецепторами. В некоторых заявках на изобретение, например фирмы SmithKline Beecham, описаны фенилмочевиновые, фенилтиомочевиновые и цианамидные производные как селективные антагонисты OXR1 (WO 99/09024, WO 00/47576 и WO 00/47580). Недавно в своих заявках на изобретение фирма SmithKline Beecham предложила производные 2-аминометилпиперидина (WO 01/96302), 3-производные аминометилморфолина (WO 02/44172) и N-ароил-циклические амины (WO 02/090355, WO 03/002559 и WO 03/002561) в качестве антагонистов рецепторов орексинов. В WO 01/85693 фирма Banyu Pharmaceuticals описала в формуле изобретения производные N-ацилтетрагидроизохинолина. Другие антагонисты рецепторов орексинов, такие как новые производные бензазепина, раскрыты в WO 02/051838. Фирма Actelion Pharmaceuticals Ltd. описала в формуле изобретения производные 1,2,3,4-тетрагидроизохинолина и их применение в качестве неселективных антагонистов рецепторов OXR1 и OXR2 (WO 01/68609).
Однако антагонисты рецепторов к орексину А имеют иной механизм действия, обуславливающий отличные от действия орексина А эффекты.
Активно ведутся работы по созданию небелковых агонистов к рецептору орексина А, но пока не удалось получить ни одного разрешенного небелкового препарата.
В настоящее время орексин А синтезируется и производится компаниями Sigma-Aldrich и Tocris Bioscience только для лабораторного использования.
Однако использование химически синтезированных молекул, в том числе и белковых, может приводить к непредсказуемым результатам в организме при применении, поскольку в результате химического синтеза часть молекул может быть представлена энантиомерами. Понятие энантиомерии играет важную роль в фармацевтике, поскольку разные энантиомеры лекарственных веществ, как правило, имеют различную биологическую активность.
Таким образом, в настоящее время актуальной задачей является разработка способа получения безопасного препарата орексина А человека, обуславливающего реакции, аналогичные действию эндогенного орексина А. Это позволило бы контролируемо, например, корректировать дисфункцию орексин-содержащей системы, пищевое поведение, поддерживать состояние бодрствования.
Авторами настоящего изобретения предложено решение данной задачи - группа изобретений. Орексин А человека получают с использованием созданного авторами штамма-продуцента (п.2 формулы), полученного на основе клеток Escherichia coli BL21(DE3), содержащего созданную авторами плазмидную ДНК (п. 1 формулы), представленную вектором pET151/D-TOPO, содержащим вставку гена, кодирующего белок орексин А человека, охарактеризованный аминокислотной последовательностью SEQ ID NO: 1, кодонно оптимизированного для экспрессии в клетках Escherichia coli, причем белок синтезируется с нативным N-концом. Авторами разработан и способ получения высокоочищенного нативного рекомбинантного орексина А человека (п. 3 формулы), заключающийся в том, что культивируют клетки полученного штамма-продуцента, с использованием индуктора экспрессии таргетного белка, лизируют клетки, отмывают тельца включения 0.2 М дезоксихолятом натрия, растворяют тельца включения в 8 М растворе мочевины, проводят рефолдинг орексина А в буфере для рефолдинга (0.1М Tris рН 8.0, 0.2 mM ЭДТА) с 0.5 М L-аргинином, проводят хроматографическую очистку полученного раствора белка на S-Sepharose колонке и S-100 колонке. Изобретения, заявленные для получения рекомбинантного орексина А человека, обеспечивают его безопасность и простоту при производстве и применении.
Использование препарата такого белка позволит, например, человеку сохранять состояние бодрствования, что особенно важно при выполнении специальных задач и в экстремальных условиях, при использовании безопасного препарата. Фармакологический потенциал такого препарата очень велик, поскольку и в повседневных условиях, и в ситуации повышенных нагрузок применение такого лекарственного средства крайне необходимо и актуально.
Изобретение проиллюстрировано следующими графическими материалами:
Фиг. 1. Хроматограмма орексина А человека на колонке P20RPC HR 16/10.
Фиг. 2. Средний процент периодов сна у крыс в дневное время суток (с 11-00 по 14-00) после интраназального введения физиологического раствора (серые столбики) и орексина А (в дозе 10 мкг/кг веса животного) (черные столбики). **-Р<0,05 в сравнении с показателями длительности сна у животных контрольной группы.
Фиг. 3. Средний процент периодов бодрствования у крыс в дневное время суток (с 11-00 по 14-00) после интраназального введения физиологического раствора (серые столбики) и орексина А (в дозе 10 мкг/кг веса животного) (черные столбики). *-Р<0,05 в сравнении с показателями длительности периодов бодрствования у животных контрольной группы.
Таблица 1. Результаты высокоэффективной жидкостной хроматографии (ВЖХ)
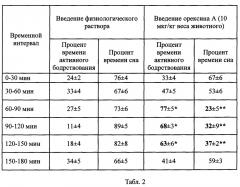
Таблица 2. Степень активности крыс в дневное время суток (с 11-00 по 14-00) после введения орексина А и физиологического раствора интраназально.
Осуществление настоящего изобретения.
Пример 1. Создание плазмидной ДНК, кодирующей орексин А человека
Перевели аминокислотную последовательность орексина А человека, SEQ ID NO: 1, в нуклеотидную, с одновременной кодонной оптимизацией для экспрессии в клетках Escherichia coli с использованием специализированной программы, представленной на сайте http://www.encorbio.com/protocols/Codon.htm.
Синтез гена, кодирующего рекомбинантный орексин А, осуществляли путем удлинения взаимоперекрывающихся олигонуклеотидов согласно описанным методам (Majumder, 1992).
Подбор оптимальных праймеров осуществляли путем сдвига праймера по отношению к матрице или изменения длины праймера на 3-6 нуклеотидов. Рассчитанные нуклеотидные последовательности праймеров синтезировали химическим методом с помощью синтезатора ДНК ASM-800 (БИОССЕТ, Россия). Далее осуществляли синтез фрагменов гена с использованием полимеразной цепной реакции (ПЦР) и полученных праймеров. Синтезированные фрагменты выделяли с помощью гель-электрофореза и клонировали в плазмидный вектор pGEM-T Easy по инструкции к вектору. Клонирование осуществляли с использованием рестрикционных сайтов Kpnl, SacII, EcoRV, BamHI или посредством «тупых» концов. После секвенирования фрагменты вырезали из вектора с помощью соответствующих рестрикционных ферментов или амплифицировали. После заключительного этапа синтеза полученный ген orexA клонировали в вектор pGEM-T Easy по рестрикционным сайтам KpnI и SacI по инструкции к вектору. С использованием секвенирования по Сэнджеру убедились в том, что получен таргетный ген.
Клонировали полученный ген в плазмиде pET151/D-TOPO (Invitrogen™) по инструкции к вектору для получения белка без довеска на N-конце.
Пример 2. Создание штамма-продуцента орексина А человека на основе клеток Escherichia coli BL21(DE3)
Для создания штамма-продуцента использовали клетки E.coli штамма BL21 с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3), имеющего lon- и ompT-мутации по генам протеаз, позволяющего получать непротеолизированные рекомбинантные белки в больших количествах.
Подготавливали клетки Е. coli штамма BL21(DE3) для трансформации полученной плазмидной ДНК - получали компетентные клетки - следующим образом. Инкубировали клетки при +37°С в течение ночи в 5 мл L-бульона, содержащего 1% триптон, 1% дрожжевой экстракт и 1% натрий хлористый. Разводили культуру свежим L-бульоном в 50-100 раз и выращивали на качалке при +37°С до оптической плотности 0,2-0,3 при длине волны 590 нм. При достижении оптической плотности более 0,3 культуру разводили свежим L-бульоном до оптической плотности 0,1 и растили 30 мин. Переносили 100 мл культуры в стерильную центрифужную пробирку и осаждали клетки при +4°С на 5000 g в течение 10 мин. Супернатант сливали, клетки ресуспендировали в 50 мл 0,1 М CaCl2, охлажденного на льду. Инкубировали клетки 20 мин на льду. Осаждали клетки в течение 10 мин при 5000 об/мин, +4°С. Супернатант сливали, клетки ресуспендировали в 3 мл 0,1 М CaCl2, охлажденного на льду.
Переносили 3 мл компетентных клеток в холодную пробирку и добавляли 5 мкг плазмидной ДНК. Инкубировали на льду 1 ч. Переносили пробирку на +42°С и выдерживали 5 мин. Переносили клетки в колбу с подогретым до +37°С L-бульоном без антибиотика и инкубировали при +37°С в течение 1-1,5 ч. Затем клетки высевали на чашки Петри с антибиотиком, ампициллином, для селекции клонов, содержащих плазмидную ДНК. Выросшие клоны проверяли на наличие таргетной плазмидной ДНК с использованием рестрикционного анализа и ПЦР, а также проводили анализ экспрессии гена 0,2% лактозой и ИПТГ. В итоге выбрали клон клеток Escherichia coli, который далее использовали для получения орексина А человека (штамм-продуцент). Штамм помещали в банк клеток.
Индукцию экспрессии получали и с использованием ИПТГ, и 0,2% лактозы. Однако во втором случае достигали большего выхода таргетного белка при меньших затратах, в связи с чем для дальнейшей работы использовали индуктор 0,2% лактозу.
Пример 3. Получение высокоочищенного нативного рекомбинантного орексина А человека
Клетки штамма-продуцента рекомбинантного орексина А человека рассевали микробиологической петлей из криофлакона на поверхность чашки Петри, содержащей LB-агар с добавлением 100 мкг/мл ампициллина. После инкубации в термостате в течение 18 ч при 37°С выросшие колонии использовали в качестве посевного материала.
В среду PYP-5052 (1% пептон (Gibco, США), 0.5% дрожжевой экстракт (Gibco, США), 50 мМ Na2HPO4, 50 мМ K2HPO4, 25 мМ (NH4)2SO4, 2 мМ MgSO4, 0.5% глицерол, 0.05% глюкоза и 0.2% лактоза), содержащую ампициллин в концентрации 100 мкг/мл, инокулировали единичную колонию штамма-продуцента. После ферментировали при +37°С в термостатированном шейкере роторного типа при 250 об/мин в течение 20 часов до отсутствия существенного изменения оптической плотности при длине волны 600 нм за 1 ч. Далее отбирали аликвоту клеток на анализ методом электрофореза, а оставшуюся биомассу осаждали центрифугированием при 9000 g.
Осажденные клетки лизировали с помощью 3 циклов соникации по 30 с с перерывом в 2 мин на льду. Затем трехкратно отмывали тельца включения 0.2 М дезоксихолятом натрия, что позволяло получить препарат без примесей бактериальных эндотоксинов.
Растворяли тельца включения в 8 М растворе мочевины, затем осуществляли рефолдинг белка орексин А в буфере для рефолдинга (0.1М Tris рН 8.0, 0.2 mM ЭДТА) с 0.5 М L-аргинином.
Проводили хроматографическую очистку полученного раствора белка. Около 1200 мл обессоленного супернатанта помещали на 20 мл S-Sepharose колонку, уравновешенную 20 мМ Tris-HCl рН 8.0. Колонку отмывали 200 мл 50 мМ Tris рН 8.0, белок элюировали 160 мл линейного градиента 50 мМ Tris рН 8.0⋅1M⋅NaCl. Фракция очищенного на S-Sepharose человеческого орексина А была помещена на S-100 колонку (2.5⋅80 см), предварительно уравновешенную фосфатным буфером. Собирали фракции по 1 мл, анализировали электрофоретически в 20% ПААГ-ДДс-Na, фракции с целевым белком объединяли, концентрацию белка в них определяли по методу Бредфорд. Колонку откалибровывали с использованием 10 мг бычьего сывороточного альбумина, овальбумина и соевого трипсинового ингибитора.
Пример 4. Анализ полученного орексина А
Однородность полученного с использованием описанных выше способа, штамма и плазмидной ДНК орексина А проверяли с помощью метода ВЭЖХ (Высокоэффективная жидкостная хроматография).
Хроматографическую однородность полученного препарата орексина А проверяли методом обращенно-фазовой хроматографии (ОФХ) на колонке Р20 RPC HR 16/10 ("Фармация", Швеция) в режиме HPLC. Нагрузка на колонку составляла 1,0 мг. Элюцию проводили градиентом концентрации ацетонитрила в трифторуксусной кислоте (ТФУ) при комнатной температуре (раствор А=0,1%-ная ТФУ, раствор В - ацетонитрил в 0,1%-ной ТФУ). Регистрацию белка в элюате проводили по поглощению при 280 нм.
Результат хроматографии рекомбинантного белка на колонке P20RPC HR 16/10 представлен на фиг. 1 и в таблице 1. Хроматография показала, что полученный препарат орексина А человека однороден, поскольку белок выходит при ОФХ одним пиком, концентрация белка достигает 95.02%.
Пример 5. Изучение эффективности полученного орексина А
Проводили анализ степени активности животных в течение 3 ч после введения полученного рекомбинантного орексина А в дозе 10 мкг/кг веса животного, который позволил установить, что полученное соединение изменяет цикл сон-бодрствование (фиг. 2, 3). Введение рекомбинатного пептида орексина А приводит к повышению активности, снижению длительности периода сна (фиг. 2) и увеличению времени бодрствования крыс (фиг. 3) в дневное время суток (таблица 2).
Полученные данные подтверждают эффективность орексина А, полученного с использованием разработанных авторами способа, штамма-продуцента и плазмидной ДНК. Это косвенно подтверждает наличие специфической активности орексина А у белка, получаемого с использованием указанных выше изобретений.
Табл. 1.
Способ получения рекомбинантного орексина А человека, плазмидная ДНК, штамм-продуцент
Способ получения рекомбинантного орексина А человека, плазмидная ДНК, штамм-продуцент
Перечень последовательностей
<110>ООО «Орексал»
<120>Способ получения рекомбинантного орексина А человека, плазмидная ДНК, штамм-продуцент
<150>RU 2016116370
<151>2016-04-26
<160>1
<210>SEQ ID NO: 1
<211>33
<212>ПРТ
<213>Homo sapiens
<220>
<223>орексин А
<400>1
1. Плазмидная ДНК для синтеза орексина А человека с нативным N-концом в клетках Escherichia coli, представленная вектором pET151/D-TOPO, содержащим вставку гена, кодирующего белок орексин А человека, охарактеризованный аминокислотной последовательностью SEQ ID NO: 1, кодонно оптимизированного для экспрессии в клетках Escherichia coli.
2. Штамм Escherichia coli BL21(DE3)pET151/D-TOPO - продуцент орексина А человека, охарактеризованного аминокислотной последовательностью SEQ ID NO: 1, полученный на основе клеток Escherichia coli BL21(DE3), трансформированных плазмидной ДНК по п. 1.
3. Способ получения высокоочищенного нативного рекомбинантного орексина А человека, охарактеризованного аминокислотной последовательностью SEQ ID NO: 1, заключающийся в том, что культивируют клетки штамма-продуцента по п. 2 с использованием индуктора экспрессии таргетного белка лизируют клетки, отмывают тельца включения 0.2 М дезоксихолятом натрия, растворяют тельца включения в 8 М растворе мочевины, проводят рефолдинг орексина А в буфере 0.1M Tris рН 8.0, 0.2 mM ЭДТА с 0.5 М L-аргинином, проводят хроматографическую очистку полученного раствора белка на S-Sepharose колонке и S-100 колонке.