Флуоресцентный способ прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом
Иллюстрации
Показать всеИзобретение относится к области биофизики, а именно к медицинской физики, и описывает способ прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом (ОЛЛ), в частности прогнозирования рисков возникновения лекарственной резистентности при проведении химиотерапии у пациентов с ОЛЛ с помощью исследования свойств биологических жидкостей физическими методами. Флуоресцентный способ прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом, включающий забор крови до и после химиотерапии, выделение флуоресцентного макро-биомаркера эффективности химиотерапии, отличается тем, что макро-биомаркером является концентрация аденозин-трифосфата (АТФ), которую определяют автоматизировано, с помощью лазерного конфокального микроскопа, путем подсчета интенсивности флуоресценции макро-биомаркера, и при концентрации АТФ 1,04±0,14 мг/мл не наблюдается риск развития гепатотоксических эффектов в данный момент времени, при концентрации АТФ 0,8±0,112 мг/мл наступает апоптоз клеток, при концентрации АТФ 0,312±0,042 мг/мл наступает некроз клеток. 1 табл.
Реферат
Изобретение относится к области биофизики, а именно к медицинской физики, и описывает способ прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом (ОЛЛ), в частности прогнозирования рисков возникновения лекарственной резистентности при проведении химиотерапии у пациентов с ОЛЛ с помощью исследования свойств биологических жидкостей физическими методами. Способ включает в себя определение и оценку количественных уровней концентрации аденозинтрифосфата (АТФ), в клетках крови, методом лазерной конфокальной микроскопии, после получения курса химиотерапии пациентом. Изобретение может быть использовано в онкологии, в клинической лабораторной практике для индивидуального прогнозирования эффективности химиотерапии при лечении острых лимфобластных лейкозов у детей.
Известно изобретение «Способ прогнозирования эффективности химиотерапии у больных со злокачественными новообразованиями эпителиальных тканей» (патент РФ №2542505, 2013 г., G01N 33/49), содержащее сходный с используемым в заявленном способе принцип выбора молекулярных маркеров химиочувствительности новообразований.
Недостатком этого способа является то, что с его помощью не представляется возможным производить работу с флуоресцентными маркерами, а именно обеспечивать их использование для определения концентраций АТФ в клетках крови, и, как следствие, производить оценку степени гепатотоксических эффектов и степени лекарственной резистентности, необходимых для индивидуализации химиотерапии (и ее эффективности) у пациентов.
За прототип изобретения выбран способ прогнозирования эффективности химиотерапии у больных со злокачественными опухолями эпителиальных тканей, включающий в себя исследование крови до и после лечения с количественным определением содержания CD50+ антигена (Алясова А.В. Клинико-неврологические и клинико-иммунологические характеристики рака молочной железы: Автореферат диссертации д.м.н., Иваново, 2004, 43 с.).
Иммунофенотипирование мононуклеарных клеток периферической крови проводят с помощью метода непрямой иммунофлуоресценции. Для выделения мононуклеарных клеток периферической крови гепаринизированную кровь, разведенную на 1/3 средой 199, наслаивают на градиент фиколл-верографина (9 объемов крови на 3 объема градиента) и центрифугируют при 1700 об/мин в течение 40 минут при 20°C. Мононуклеарные клетки собирают из интерфазы, а затем трижды отмывают средой 199. При этом центрифугируют в течение 20 минут при 1200 об/мин.
На обезжиренное предметное стекло, предварительно покрытое парафилмом фирмы American Can Company, имеющим круглые перфорации диаметром 7 мм, наносят по 20-50 мкл поли-L-лизина Serva в концентрации 50 мкг/мл. Предметное стекло помещают на 30 минут в термостат при температуре 37°C. Затем его отмывают физиологическим раствором, забуференным 0,01 молярным фосфатным буфером pH 7,4. Суспензию клеток в концентрации 2-106 кл/мл наносят по 40 мкл в лунки на предметное стекло. Предметное стекло выдерживают 30 минут при 37°C во влажной камере. Затем не прикрепившиеся к стеклу клетки отсасывают пипеткой и наносят в лунки раствор моноклональных антител (МКА) объемом 40 мкл. В контрольных образцах клетки обрабатывают физиологическим раствором взамен МКА.
Вновь инкубируют стекла при 37°C во влажной камере в течение 30 минут, после чего отмывают их в пяти порциях физиологического раствора с фосфатным буфером pH 7,4. На отмытые клетки наслаивают по 40 мкл ФИТЦ-меченных фрагментов козьих антител против мышиных иммуноглобулинов производства НПК Препарат и стекла инкубируют на льду во влажной камере в течение 30 минут. Затем стекла промывают в пяти порциях физиологического раствора с фосфатным буфером pH 7,4, заливают 50%-ным глицерином в физиологическом растворе и препарат закрывают предметными стеклами. Просмотр препаратов проводят с помощью люминесцентного микроскопа ЛЮМАМ-И2. Учитывают свечение при увеличении объектива × 40-100, окуляра × 2,5-10. Люминесценцию клеточной поверхности регистрируют визуально. В препарате просчитывали 200-300 клеток. Учитывают общее количество клеток и антиген-положительных клеток. Затем подсчитывают относительное содержание антиген-положительных клеток.
В результате проведенных исследований было показано, что изменение содержания CD50+ клеток является устойчивым признаком, позволяющим прогнозировать исход заболевания. Снижение уровня этой популяции по окончании лечения не менее чем в 1,2-1,6 раза, по сравнению с ее содержанием перед 1 курсом ПХТ, особенно на фоне угнетения иммунологической реактивности, свидетельствует о неэффективности проводимой терапии, возможности развития рецидива заболевания в ближайшие 4-5 месяцев или прогрессирования процесса на фоне введения цитостатиков. Напротив, в случаях повышения в процессе лечения исходно сниженного количества CD50+ клеток отмечалось развитие стойкой ремиссии болезни.
Несовершенство этого способа заключается в недостаточной его автоматизации, а именно ручной подсчет клеток и антиген-положительных клеток, что может приводить к ошибкам. Другим недостатком способа является невозможность непосредственного мониторинга рисков возникновения гепатотоксичности и лекарственной резистентности у пациентов.
Задачей предлагаемого изобретения является создание флуоресцентного способа для прогнозирования эффективности химиотерапии у больных с острыми лимфобластными лейкозами, обладающего высокой степенью автоматизации ключевых этапов эксперимента, а также обеспечение возможности непосредственного мониторинга рисков возникновения гепатотоксичности и лекарственной резистентности у пациентов.
Поставленная задача решается тем, что во флуоресцентном способе для прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом, при котором производится забор крови до и после химиотерапии, выделяется флуоресцентный макро-биомаркер эффективности химиотерапии, согласно изобретению, макро-биомаркером является концентрация аденозинтрифосфата, определяемая автоматизировано, с помощью лазерного конфокального микроскопа, путем подсчета интенсивности флуоресценции макро-биомаркера для непосредственного мониторинга рисков возникновения гепатотоксичности и лекарственной резистентности у пациентов.
Заявленный способ основан на использовании определения концентрации АТФ методом лазерной конфокальной микроскопии, который начинается с обработки образца после формирования кровяного сгустка (не ранее чем через 30 минут и не более 3 часов после забора). Далее осуществляется центрифугирование на скоростях 1500 об/мин в течение 10 минут, 2000 об/мин в течение 10 минут и 3000 об/мин в течение 7,5 минут. Максимальное разделение сыворотки и клеточного осадка наблюдают при режиме центрифугирования 2000 об/мин в течение 10 минут при комнатной температуре.
Далее сыворотка отбирается по 1 мл в криовиалы объемом (1,8-2,0) мл. Пробы хранят в штативах с крышками, при -20°C, -40°C, -60°C, -80°C до выполнения анализа. При температуре -80°C количество жизнеспособных мононуклеарных клеток превышало должно быть не меньше 25 млн. Для длительного хранения и коллекционирования образцов выбирается температурный режим -80°C. Для реализации способа проводят выделение мононуклеарных клеток и их подготовку для конфокальной микроскопии.
Обработку предварительно подготовленных образцов начинают после их размораживания в течение 30 минут при комнатной температуре. В ламинарном шкафу, при помощи 0,5 мл и 1 мл механических пипеток переносят образцы периферической крови в маркированные пробирки типа Фалькон объемом 10 мл. Пробу разводят стерильным 0,2 молярным фосфатно-солевым буфером (ФСБ) из расчета 5:1. Значение pH буфера составляло 7,8 ед. Далее центрифугируют образцы на скорости 4000 оборотов в минуту в течение 10 минут при температуре 4°C. Аккуратно удаляют жидкую фазу механической пипеткой и добавляли 5 мл ФСБ к осадку. Также используют механическую пипетку объемом 1 мл, разводят осадок в ФСБ и доливают ФСБ до 5 мл, далее перемешивают. Затем повторяют процедуру отмывки (центрифугирования образца, удаления жидкой фазы, добавления буфера) при указанных выше параметрах еще 2 раза.
После проводят лизирование образцов в течение двух часов при температуре -80°C. Далее пробу размораживают при комнатной температуре, добавляют до 5 мл ФСБ и центрифугируют на скорости 4000 об/мин в течение 4 минут при комнатной температуре 4°C. Жидкую фазу удаляют пипеткой. Для наблюдения внутриклеточного АТФ используют ATP Bioluminescent Assay Kit (BAK), используемый для количественного определения АТФ в клетках.
После подготовительных процедур используется 96-луночный плоскодонный культуральный планшет ТРР. Механической пипеткой подготовленные образцы помещаются в лунки планшета в объеме 0,1 мл, и делается отметка соответствия об их размещении в лабораторном журнале. Согласно инструкции BAK готовится люминесцентный реагент, который в объеме 0,1 мл смешивается с образцом в лунке. Для каждой серии эксперимента подготавливается контрольный образец (смесь стандарта АТФ из BAK и ATPAssayMix из BAK в пропорции 1:1 объемом 0,1 мкл), а также образцы для построения калибровочной кривой, согласно инструкции BAK. Далее значение интенсивности люминесценции регистрируется с помощью детектора конфокального микроскопа. Детекция проводится в спектре свечения люцеферина желтого (в видимом диапазоне ~500-700 нм) с ожидаемым максимумом около 536 нм. Для анализа каждой лунки данные снимаются в нескольких точках. Для построения калибровочной кривой используются стандарты в разной степени разведения и без него. После построения калибровочных кривых берутся пробы пациентов с тяжелыми клиническими проявлениями НПР, где проводятся измерения степени интенсивности люминесценции АТФ с помощью лазерного конфокального микроскопа. На основании полученных спектральных данных о пиковой средней величине интенсивности, рассчитывалась концентрация АТФ (мг/мл) по формуле
Где Inexp - интенсивность свечения образца, Inst - интенсивность свечения стандарта,
[АТФ]st - концентрация АТФ в стандарте, бралась равной 0.1 мг/мл.
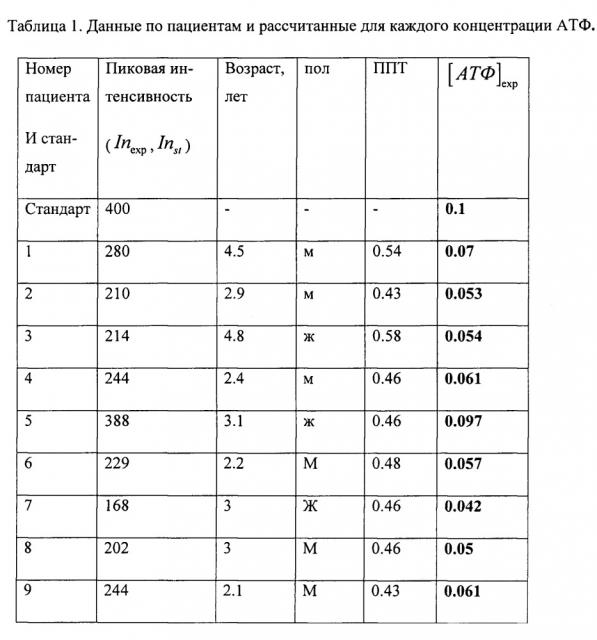
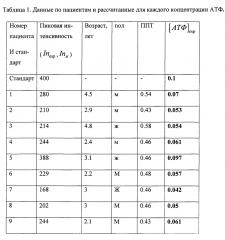
Расчетные данные концентрациям АТФ в клетках крови сводятся в таблицу. В таблицу также добавляются данные по возрасту, полу, площади поверхности тела пациента, количественное значение аланинаминотрансфераза (АЛТ), количественное значение аспартатаминотрансфераза (ACT). Номера каждого спектра нумеруются по номеру пациента.
В таблице 1 показаны данные по пациентам и рассчитанные для каждого концентрации АТФ, где АЛТ - аланинамилотрансфераза, АСТ - аспартатаминотрансфераза, ППТ - рассчитанная площадь поверхность тела.
По результатам подсчитанной концентрации АТФ делается прогностический вывод об эффективности проводимой химиотерапии посредством взятия нормы концентрации АТФ для здоровой функционирующей клетки (1,04±0.14 мг/мл), при которой осуществляется лекарственный транспорт и не наблюдается риска развития гепатотоксических эффектов в данный момент терапии. Концентрация АТФ в клетке более (0,8±0,112 мг/мл) сигнализируют о наступлении апоптоза клетки. Потери АТФ в клетке более 70% (0,312±0,042) сигнализирует о некрозе клеток.
Таким образом, в заявляемом способе, включающем исследование крови до и после лечения, определяют и используют значение концентрации макро-биологического маркера - АТФ в клетках крови пациентов, что позволяет произвести прогноз риска возникновения гепатотоксичности и лекарственной резистентности пациентов, оценив, эффективность проводимой химиотерапии в нужный момент времени.
Флуоресцентный способ прогнозирования эффективности химиотерапии у детей, больных острым лимфобластным лейкозом, при котором производят забор крови до и после химиотерапии, выделяют флуоресцентный макро-биомаркер эффективности химиотерапии, отличающийся тем, что макро-биомаркером является концентрация аденозин-трифосфата (АТФ), которую определяют автоматизировано, с помощью лазерного конфокального микроскопа, путем подсчета интенсивности флуоресценции макро-биомаркера, и при концентрации АТФ 1,04±0,14 мг/мл не наблюдается риск развития гепатотоксических эффектов в данный момент времени, при концентрации АТФ 0,8±0,112 мг/мл наступает апоптоз клеток, при концентрации АТФ 0,312±0,042 мг/мл наступает некроз клеток.