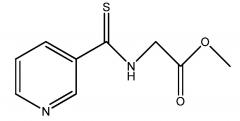
Способы получения некоторых 2-(пиридин-3-ил)тиазолов
Иллюстрации
Показать всеИзобретение относится к способу получения 2-(пиридин-3-ил)тиазолов формулы (IV), где (A) каждый R1 представляет собой H; (B) R2 представляет собой (C1-C6)алкил; (C) R3 представляет собой H и (D) R4 представляет собой (C1-C6)алкил. Способ осуществляют путем (i) взаимодействия соединения (I) с соединением (IIa) с образованием соединения (IIb), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном протонном растворителе; (ii) взаимодействия соединения (IIb) с соединением (IIc) с образованием соединения (III), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном растворителе; и (iii) циклизации соединения (III) с использованием дегидратирующего реагента с образованием соединения (IV), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном апротонном растворителе. Указанный полярный протонный растворитель стадии a1 представляет собой муравьиную кислоту, н-бутанол, изопропанол, н-пропанол, этанол, метанол, уксусную кислоту, воду или их смесь. На стадии b соединение (III) циклизуют с использованием дегидратирующего реагента, выбранного из POCl3, H2SO4, SOCl2, P2O5, полифосфорной кислоты, п-толуолсульфоновой кислоты, трифторуксусного ангидрида или их смеси. Способ дополнительно включает галогенирование указанного R3 до F, Cl, Br или I. Технический результат – способ получения 2-(пиридин-3-ил)тиазолов в качестве промежуточных продуктов для синтеза пестицидных тиазоламидов. 10 з.п. ф-лы, 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашиваются приоритет и преимущества по предварительной заявке U.S. № 61/655089, поданной 4 июня 2012 г. Все содержание этой предварительной заявки включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение, раскрытое в настоящем документе, относится к области способов получения некоторых 2-(пиридин-3-ил)тиазолов в качестве промежуточных продуктов для синтеза пестицидных тиазоламидов.
УРОВЕНЬ ТЕХНИКИ
Борьба с популяциями вредителей важна для современного сельского хозяйства, хранения пищевых продуктов и гигиены. Имеется более десяти тысяч видов вредителей, которые приводят к потерям в сельском хозяйстве. Ежегодные потери в сельском хозяйстве во всем мире составляют триллионы долларов США. Также известно, что вредители, такие как термиты, повреждают все виды частных и общественных строений, что приводит к ежегодным потерям во всем мире, составляющим триллионы долларов США. Вредители также поедают и ухудшают качество хранящихся пищевых продуктов, что приводит к ежегодным потерям, составляющим триллионы долларов США, а также к потере пищевых продуктов, необходимых людям.
Некоторых вредители обладают устойчивостью по отношению к использующимся в настоящее время пестицидам или приобретают. Сотни видов вредителей обладают устойчивостью по отношению к одному или большему количеству пестицидов. Поэтому постоянно необходимы новые пестициды и способы получения таких пестицидов.
В WO 2010/129497 (полное раскрытие которой включено в настоящее изобретение в качестве ссылки) раскрыты некоторые пестициды. Однако способы получения таких пестицидов могут быть и дорогостоящими, и неэффективными. Поэтому необходимы эффективные способы получения таких пестицидов.
ОПРЕДЕЛЕНИЯ
Примеры, приведенные в определениях, обычно не являются исчерпывающими и их не следует рассматривать в качестве ограничивающих изобретение, раскрытое в настоящем документе. Следует понимать, что заместитель должен соответствовать правилам образования химических связей и ограничениям по стерической совместимости для конкретной молекулы, к которой он присоединен.
"Алкенил" означает ациклический ненасыщенный (содержащий по меньшей мере одну двойную связь углерод-углерод), разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
"Алкенилоксигруппа" означает алкенил, дополнительно содержащий ординарную связь углерод-кислород, например аллилоксигруппу, бутенилоксигруппу, пентенилоксигруппу, гексенилоксигруппу, гептенилоксигруппу, октенилоксигруппу, ноненилоксигруппу и деценилоксигруппу.
"Алкоксигруппа" означает алкил, дополнительно содержащий ординарную связь углерод-кислород, например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, 1-бутоксигруппу, 2-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу, 2-метилбутоксигруппу, 1,1-диметилпропоксигруппу, гексоксигруппу, гептоксигруппу, октоксигруппу, ноноксигруппу и децоксигруппу.
"Алкил" означает ациклический, насыщенный разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
"Алкинил" означает ациклический ненасыщенный (содержащий по меньшей мере одну тройную связь углерод-углерод), разветвленный или неразветвленный заместитель, состоящий из атомов углерода и водорода, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
"Алкинилоксигруппа" означает алкинил, дополнительно содержащий ординарную связь углерод-кислород, например пентинилоксигруппу, гексинилоксигруппу, гептинилоксигруппу, октинилоксигруппу, нонинилоксигруппу и децинилоксигруппу.
"Арил" означает циклический ароматический заместитель, состоящий из атомов водорода и углерода, например фенил, нафтил и бифенил.
"Циклоалкенил" означает моноциклический или полициклический ненасыщенный (содержащий по меньшей мере одну двойную связь углерод-углерод) заместитель, состоящий из атомов углерода и водорода, например циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
"Циклоалкенилоксигруппа" означает циклоалкенил, дополнительно содержащий ординарную связь углерод-кислород, например циклобутенилоксигруппу, циклопентенилоксигруппу, циклогексенилоксигруппу, циклогептенилоксигруппу, циклооктенилоксигруппу, циклодеценилоксигруппу, норборненилоксигруппу и бицикло[2.2.2]октенилоксигруппу.
"Циклоалкил" означает моноциклический или полициклический насыщенный заместитель, состоящий из атомов углерода и водорода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
"Циклоалкоксигруппа" означает циклоалкил, дополнительно содержащий ординарную связь углерод-кислород, например циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, циклогептилоксигруппу, циклооктилоксигруппу, циклодецилоксигруппу, норборнилоксигруппу и бицикло[2.2.2]октилоксигруппу.
"Циклогалогеналкил" означает моноциклический или полициклический насыщенный заместитель, состоящий из атомов углерода, галогена и водорода, например 1-хлорциклопропил, 1-хлорциклобутил и 1-дихлорциклопентил.
"Галоген" означает фтор, хлор, бром и йод.
"Галогеналкил" означает алкил, дополнительно содержащий от одного до максимально возможного количества одинаковых или разных галогенов, например фторметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
"Гетероциклил" означает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным, или полностью ненасыщенным, где циклическая структура содержит по меньшей мере один атом углерода и по меньшей мере один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород, например бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
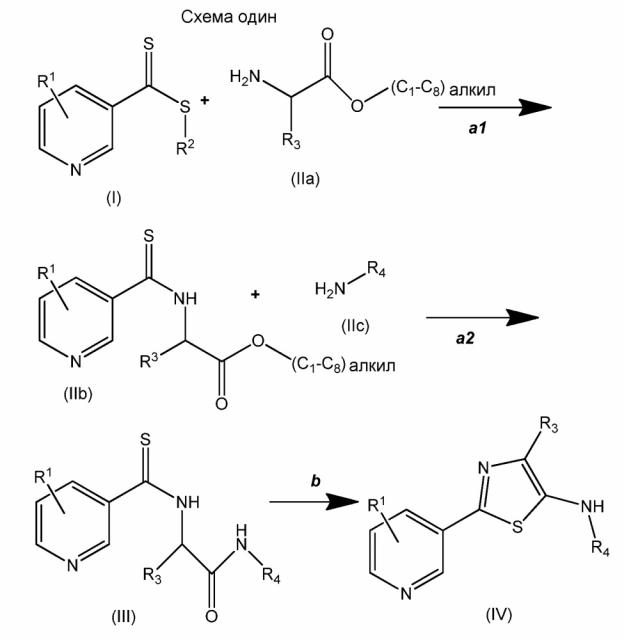
Вариант осуществления настоящего изобретения проиллюстрирован на схеме 1.
на которой
(A) каждый R1 независимо выбран из группы, включающей H, F, Cl, Br, I, CN, NO2 и замещенный или незамещенный (C1-C6)алкил, где каждый замещенный R1 содержит один или большее количество заместителей, независимо выбранных из группы, включающей F, Cl, Br, I, CN, NO2, (C1-C6)алкил и (C1-C6)галогеналкил;
(B) R2 выбран из группы, включающей замещенный или незамещенный (C1-C6)алкил, замещенный или незамещенный (C2-C6)алкенил, замещенную или незамещенную (C1-C6)алкоксигруппу, замещенную или незамещенную (C2-C6)алкенилоксигруппу, замещенный или незамещенный (C3-C10)циклоалкил, замещенный или незамещенный (C3-C10)циклоалкенил, замещенный или незамещенный (C6-C20)арил, замещенный или незамещенный (C1-C6)алкил)(C6-C20)арил и замещенный или незамещенный (C1-C20)гетероциклил, где каждый замещенный R2 содержит один или большее количество заместителей, независимо выбранных из группы, включающей F, Cl, Br, I, CN, NO2, (C1-C6)алкил, (C2-C6)алкенил, (C1-C6)галогеналкил, (C2-C6)галогеналкенил, (C1-C6)галогеналкилоксигруппу, (C2-C6)галогеналкенилоксигруппу, (C3-C10)циклоалкил, (C3-C10)циклоалкенил, (C3-C10)галогенциклоалкил, (C3-C10)галогенциклоалкенил, (C6-C20)арил и (C1-C20)гетероциклил;
(C) R3 выбран из группы, включающей H, замещенный или незамещенный (C1-C6)алкил, замещенный или незамещенный (C3-C10)циклоалкил, замещенный или незамещенный (C1-C6)алкил(C3-C10)циклоалкил, замещенный или незамещенный (C6-C20)арил и замещенный или незамещенный (C1-C6)алкил(C6-C20)арил, где каждый замещенный R3 содержит один или большее количество заместителей, независимо выбранных из группы, включающей F, Cl, Br и I; и
(D) R4 выбран из группы, включающей H, замещенный или незамещенный (C1-C6)алкил, замещенный или незамещенный (C3-C10)циклоалкил, замещенный или незамещенный (C1-C6)алкил(C3-C10)циклоалкил, замещенный или незамещенный (C6-C20)арил, замещенный или незамещенный (C1-C6)алкил(C6-C20)арил, замещенный или незамещенный (C1-C6)алкил(C2-C6)алкенил и замещенный или незамещенный (C1-C6)алкил(C2-C6)алкинил, где каждый указанный R4, который является замещенным, содержит один или большее количество заместителей, выбранных из группы, включающей F, Cl, Br, I, CN, NO2, (C1-C6)алкил, (C1-C6)галогеналкил, (C1-C6)алкилоксигруппу, (C1-C6)галогеналкилоксигруппу, (C3-C10)циклоалкил, (C3-C10)галогенциклоалкил, (C6-C20)арил и (C1-C20)гетероциклил.
В другом варианте осуществления настоящего изобретения каждый R1 независимо выбран из группы, включающей H, F и Cl.
В другом варианте осуществления настоящего изобретения R1 означает H.
В другом варианте осуществления настоящего изобретения R3 выбран из группы, включающей H, (C1-C6)алкил, (C1-C6)галогеналкил и (C6-C20)арил.
В другом варианте осуществления настоящего изобретения R3 выбран из группы, включающей H, CF3, CH2F, CHF2, CH3, CH2CH3, CH(CH3)2 и фенил.
В другом варианте осуществления настоящего изобретения R3 выбран из группы, включающей H и CH3.
В другом варианте осуществления настоящего изобретения R4 означает (C1-C6)алкил(C3-C10)циклогалогеналкил.
В другом варианте осуществления настоящего изобретения R4 выбран из группы, включающей H, (C1-C6)алкил, (C1-C6)алкил(C6-C20)арил, (C1-C6)галогеналкил, (C1-C6)алкил(C3-C10)циклоалкил, (C3-C10)циклоалкил-O-(C1-C6)алкил и (C3-C10)циклогалогеналкил.
В другом варианте осуществления настоящего изобретения R4 выбран из группы, включающей H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, циклопропил, (C6-C20)арил, CH2-фенил, CH2-фенил-OCH3, CH2OCH2-фенил, CH2CH2CH3, CH2CH2F, CH2CH2OCH3, CH2-циклопропил и циклопропил-O-CH2CH3.
В другом варианте осуществления настоящего изобретения R4 выбран из группы, включающей H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH2CH2CH3, циклопропил, CH2-циклопропил и CH2CH=CH2, CH2C≡CH.
В другом варианте осуществления настоящего изобретения молекулы, обладающие структурой, соответствующей соединению (III), раскрыты в качестве промежуточных продуктов, применимых для синтеза пестицидных тиазоламидов.
Обычно S-R2 обозначает отщепляющуюся группу, в которой R2 является частью отщепляющейся группы, которая в основном не оказывает влияния и не оказывает неблагоприятного влияния на проводимую реакцию. Желательно, чтобы R2 являлась группой, которая благоприятно влияет на летучесть содержащего тиогруппу побочного продукта реакции.
На стадии a1 соединения (I) и (IIa) взаимодействуют с образованием соединения (IIb). Реакцию можно провести при температуре окружающей среды и при давлении окружающей среды, но при необходимости можно использовать более высокие и менее высокие температуры и давления. Соединения (IIa) и (IIb) могут находиться в форме соли или свободного основания. Реакцию проводят в присутствии основания, такого как триэтиламин, если соединение (IIa) является солью. Реакцию проводят в полярном протонном растворителе. Примеры таких растворителей включают, но не ограничиваются только ими, муравьиную кислоту, н-бутанол, изопропанол, н-пропанол, этанол, метанол, уксусную кислоту и воду или их смесь. В настоящем изобретении предпочтительным является метанол.
На стадии a2 соединения (IIb) и (IIc) взаимодействуют с образованием соединения (III). Реакцию можно провести при температуре окружающей среды и при давлении окружающей среды, но при необходимости можно использовать более высокие и менее высокие температуры и давления, такие как температуры, равные от примерно 50°C до примерно 70°C. Реакцию проводят в полярном растворителе, таком как эфир или спирт. Примеры таких растворителей включают, но не ограничиваются только ими, дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид, н-бутанол, изопропанол, н-пропанол, этанол и метанол. В настоящем изобретении предпочтительным является метанол. Также целесообразно использовать молярный избыток соединений (IIc) - (IIb), такой как составляющий примерно 25:1 (IIc):(IIb), однако можно использовать молярные отношения, составляющие от примерно 3:1 до примерно 20:1, и предпочтительно используют молярные отношения, составляющие от 10:1 до 15:1.
На стадии b соединение (III) циклизуют с использованием дегидратирующего реагента. Примеры таких дегидратирующих реагентов включают, но не ограничиваются только ими, POCl3, H2SO4, SOCl2, P2O5, полифосфорную кислоту, п-толуолсульфоновую кислоту и трифторуксусный ангидрид или их смесь. Реакцию можно провести при температуре окружающей среды и при давлении окружающей среды, но при необходимости можно использовать более высокие и менее высокие температуры и давления. В настоящем изобретении предпочтительно использовать температуру, которая выше температуры окружающей среды, предпочтительно, вплоть до и включая температуру кипения раствора, например, можно использовать температуру, равную от примерно 60°C до примерно 120°C. Реакцию проводят в полярном апротонном растворителе. В настоящем изобретении предпочтительным является ацетонитрил.
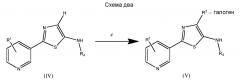
Преимуществом этих способов является то, что соединение (IV) - если R3 означает H, можно галогенировать. Поэтому в данном случае R3 дополнительно включает F, Cl, Br и I (см. схему 2).
На стадии c можно использовать любой галогенирующий реагент, например, 1-хлорпирролидин-2,5-дион, N-бромсукцинимид и 1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октан бис(тетрафторборат). Можно использовать полярные растворители, такие как дихлорметан, тетрагидрофуран, этилацетат, ацетон, диметилформамид, ацетонитрил и диметилсульфоксид. В настоящем изобретении предпочтительным является дихлорметан. Реакцию можно провести при температуре и давлении окружающей среды, но при необходимости можно использовать более высокие и менее высокие температуры и давления. В настоящем изобретении предпочтительными являются температуры, равные от примерно 0°C примерно до температуры окружающей среды.
В другом варианте осуществления настоящего изобретения R3 предпочтительно означает Cl.
Соединение (IV) или соединение (V) можно ввести в последующие реакции и получить некоторые пестициды, раскрытые в WO 2010/129497 (полное раскрытие которой включено в настоящее изобретение в качестве ссылки).
ПРИМЕРЫ
Примеры приведены для иллюстрации и их не следует рассматривать в качестве ограничивающих изобретение, раскрытое в настоящем документе, только вариантами осуществления, раскрытыми в этих примерах.
Исходные вещества, реагенты и растворители, которые получали из коммерческих источников, использовали без дополнительной очистки. Безводные растворители приобретали в виде Sure/Seal™ у фирмы Aldrich и использовали в том виде, в котором они были получены. Температуры плавления измеряли с помощью капиллярного аппарата для определения температуры плавления Thomas Hoover Unimelt или с помощью автоматический системы для определения температуры плавления OptiMelt, выпускающейся фирмой Stanford Research Systems, и они являются не скорректированными. Молекулы представлены своими известными названиями, полученными с помощью программ, включенных в программы ISIS Draw, ChemDraw или ACD Name Pro. Если такие программы не могли выработать название молекулы, то название молекулы получали в соответствии с обычными правилами номенклатуры. Все данные спектров ЯМР приведены в ч/млн (δ) и регистрировали при 300, 400 или 600 МГц, если не указано иное.
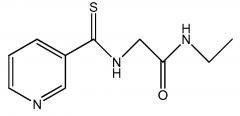
Пример 1: Получение N -этил-2-(пиридин-3-карботиоамидо)ацетамида:
Стадия 1: Получение метил-2-пиридин-3-карботиоамидоацетат:
В сухую круглодонную колбу объемом 50 мл, снабженную магнитной мешалкой, патрубком для подачи азота, поглотителем газа, термометром и капельной воронкой, помещали метилпиридин-3-карбодитиоат (2,0 г, 11,82 ммоль), метил-2-аминоацетатгидрохлорид (1,48 г; 11,82 ммоль) и 20 мл метанола. По каплям добавляли триэтиламин (1,20 г, 11,82 ммоль) в метаноле (5 мл). Смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь выливали в 200 мл воды и водную смесь экстрагировали с помощью 3×50 мл этилацетата. Объединенные органические экстракты промывали водой, сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении в роторном испарителе. Затем неочищенный продукт растворяли в дихлорметане и хроматографировали на силикагеле (картридж ISCO массой 80 г) в градиентном режиме от 100% гексанов до 100% этилацетата за 20 мин. Чистые фракции объединяли и затем растворитель выпаривали в вакууме и получали искомое соединение в виде вязкого желтого масла (1,6 г, 64%): 1H ЯМР (400 МГц, CDCl3) δ 8,96 (дд, J = 2,4, 0,8 Гц, 1H), 8,68 (дд, J = 4,8, 1,7 Гц, 1H), 8,47 (ушир.с, 1H), 8,16 (ддд, J = 8,0, 2,4, 1,7 Гц, 1H), 7,35 (ддд, J = 8,0, 4,8, 0,9 Гц, 1H), 4,59 (d, J = 4,7 Гц, 2H), 3,86 (с, 3H); ESIMS (масс-спектроскопия с ионизацией электрораспылением) m/z 209,17 ([M-H]-).
Стадия 2: Получение N -этил-2-(пиридин-3-карботиоамидо)ацетамида:
К охлажденному (-40°C) раствору метил-2-(пиридин-3-карботиоамидо)ацетата (2,5 г, 11,89 ммоль) в 20 мл метанола в реакторе Парра объемом 45 мл добавляли этиламин (6,6 г, 146,00 ммоль). Реактор Парра герметизировали и нагревали при 60°C в течение 5 ч. К этому раствору добавляли 5 г силикагеля и смесь выпаривали досуха. Образец хроматографировали с помощью ISCO в градиентном режиме от смеси этилацетата и дихлорметана, затем 100% этилацетат. Растворитель удаляли в вакууме и получали искомое соединение в виде желтого твердого вещества (1,8 г; 68%); Температура плавления 136-138°C; 1H ЯМР (400 МГц, d6-ДМСО (диметилсульфоксид)) δ 10,62 (с, 1H), 8,94 (дд, J = 2,4, 0,7 Гц, 1H), 8,68 (ддд, J = 13,4, 4,8, 1,7 Гц, 1H), 8,15-7,94 (м, 2H), 7,49 (тдд, J = 8,0, 4,8, 0,8 Гц, 1H), 4,34 (с, 2H), 3,21-3,03 (м, 2H), 1,03 (т, J = 7,2 Гц, 3H); 13C ЯМР (101 МГц, ДМСО-d6) δ 195,74 (с), 166,34 (с), 151,87 (с), 151,29 (с), 148,66 (с), 147,70 (с), 136,20 (с), 135,02 (д, J = 18,7 Гц), 123,37 (с), 123,00 (с), 48,79 (с), 40,13 (с), 39,93 (с), 39,72 (с), 39,51 (с), 39,30 (с), 39,09 (с), 38,88 (с), 33,51 (с), 14,71 (с).
Пример 2: Получение N -(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)-N,2-диметил-3-(метилтио)пропанамида:
Стадия 1: Получение N -метил-2-(пиридин-3-ил)тиазол-5-амина:
В сухую круглодонную колбу объемом 2 л, снабженную механической мешалкой, капельной воронкой и обратным холодильником, помещали N-метил-2-(пиридин-3-карботиоамидо)ацетамид (100 г, 478 ммоль) и ацетонитрил (1 л). К этой смеси порциями в течение 10 мин добавляли оксихлорид фосфора (256 г, 1672 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 10 мин и за это время происходило небольшое разогревание от 22°C до 34°C. Реакционную смесь нагревали при 85°C (медленное кипение с обратным холодильником). Через 3 ч все твердые вещества растворялись с образованием темно-коричневого раствора. Проведенный через 4 ч анализ аликвоты с помощью ТСХ (тонкослойная хроматография) (70% этилацетат : 30% гексаны) показывал, что реакция в основном завершалась. Реакционной смеси давали охладиться до 25°C и растворитель удаляли путем выпаривания в роторном испарителе. Остаток растворяли в воде и при непрерывном перемешивании обрабатывали твердым бикарбонатом натрия до установления слабощелочной реакции (pH~8). Через несколько минут начинал образовываться коричневый осадок. Смесь продолжали перемешивать при 25°C в течение 16 ч. Коричневый осадок собирали с помощью вакуумного фильтрования и промывали водой. Это давало желтовато-коричневый осадок на фильтре (91 г), который затем сушили в вакууме при 40°C до постоянной массы. Это давало N-метил-2-(пиридин-3-ил)тиазол-5-амин в виде твердого вещества песчаного цвета (68,5 г, выход 75%); Температура плавления 140-141°C; 1H ЯМР (400 МГц, CDCl3) δ 8,98 (дд, J = 2,3, 0,7 Гц, 1H), 8,53 (дд, J = 4,8, 1,6 Гц, 1H), 8,07 (ддд, J = 8,0, 2,2, 1,7 Гц, 1H), 7,40 - 7,21 (м, 1H), 6,96 (с, 1H), 4,18 (с, 1H), 2,96 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 153,23, 149,15, 146,54, 132,23, 130,47, 123,65, 121,20, 34,48; Результаты анализа. Рассчитано для C9H9N3S: C, 56,52; H, 4,74; N, 21,97; S, 16,77. Найдено: C, 56,31: H, 4,74; N, 21,81; S, 16,96.
Стадия 2: Получение 4-хлор-N-метил-2-(пиридин-3-ил)тиазол-5-амина:
В сухую круглодонную колбу объемом 100 мл, снабженную магнитной мешалкой, термометром и патрубком для подачи азота, помещали N-метил-2-(пиридин-3-ил)тиазол-5-амин (0,528 г, 2,76 ммоль) и дихлорметан (50 мл). Полученный раствор охлаждали до 5°C, затем порциями добавляли твердый N-хлорсукцинимид (0,312 г, 2,76 ммоль). После добавления всего хлорирующего реагента образовывался темно-коричневый раствор. Раствор перемешивали при 5°C в течение 20 мин, затем аликвоту анализировали с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) (колонка YMC AQ, от 5% АЦН (ацетонитрил) 95% вода - 0,05% ТФК (трифторуксусная кислота) до 95% АЦН 5% вода с добавлением 0,05% ТФК за 20 мин при скорости, равной 1,0 мл/мин). Анализ с помощью ВЭЖХ указывал на отсутствие исходного вещества и наличие только основного продукта. Реакционную смесь выливали в делительную воронку, содержащую дихлорметан (50 мл), и промывали водой (2×10 мл) затем насыщенным водным раствором хлорида натрия (10 мл). Органическую фазу сушили над безводным сульфатом магния, фильтровали и выпаривали в роторном испарителе и получали порошкообразное коричневое твердое вещество (0,51 г). Твердое вещество очищали с помощью ISCO Combiflash Rf (картридж, содержащий 80 г силикагеля, подвижная фаза A = гексан, B = этилацетат, градиентный режим от 0% B до 100% B за 20 мин). Содержимое пробирок, содержащих искомое вещество, объединяли и выпаривали в роторном испарителе и получали 4-хлор-N-метил-2-(пиридин-3-ил)тиазол-5-амин в виде канареечно-желтого твердого вещества (0,32 г, выход 51%); 1H ЯМР (400 МГц, CDCl3) δ 8,97 (дд, J = 2,3, 0,7 Гц, 1H), 8,54 (дд, J = 4,8, 1,6 Гц, 1H), 8,07 (ддд, J = 8,0, 2,3, 1,6 Гц, 1H), 7,45-7,14 (м, 1H), 4,07 (дд, J = 40,5, 38,0 Гц, 1H), 3,03 (д, J = 5,3 Гц, 3H); 13C ЯМР (101 МГц, CDCl3) δ 149,55, 146,03, 145,60, 145,28, 131,73, 129,71, 123,64, 117,37, 35,75; Результаты анализа. Рассчитано для C9H8ClN3S: C, 49,89; H, 3,57; N, 18,62; S, 14,21. Найдено: C, 48,03: H, 3,64; N, 18,42; S, 14,23.
Стадия 3: Получение N-(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)- N ,2-диметил-3-(метилтио)пропанамида:
В сухую круглодонную колбу объемом 500 мл, снабженную магнитной мешалкой, термометром и патрубком для подачи азота, добавляли 4-хлор-N-метил-2-(пиридин-3-ил)тиазол-5-амин (22 г, 97 ммоль) и дихлорметан (250 мл). Суспензию перемешивали при температуре окружающей среды при добавлении пиридина (8,48 г, 107 ммоль) и ДМАП (диметиламинопиридин) (1,20 г, 9,75 ммоль). К этой суспензии в течение 5 мин добавляли 2-метил-3-(метилтио)пропаноилхлорид (17,8 г, 117 ммоль). Во время добавления все твердые вещества переходили в раствор и температура реакционной смеси повышалась от 20°C до 30°C. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Смесь исследовали с помощью ВЭЖХ (колонка YMC AQ, от 5% АЦН 95% вода - 0,05% ТФК до 95% АЦН 5% вода с добавлением 0,05% ТФК за 20 Мин при скорости, равной 1,0 мл/мин), которая указывала на полное превращение всего исходного вещества. Реакционную смесь разбавляли дихлорметаном и затем добавляли воду. Смесь выливали в делительную воронку, содержащую дихлорметан, и промывали водой и слои разделяли. Органическую фазу промывали рассолом, сушили над безводным сульфатом магния, фильтровали и выпаривали в роторном испарителе и получали 33,6 г темного масла. Масло очищали с помощью ISCO Combiflash Rf (картридж, содержащий 330 г силикагеля, подвижная фаза A = гексан, B = этилацетат, градиентный режим от 0% B до 100% B за 20 мин). Фракции собирали в пробирки объемом 25 мл. Содержимое пробирок, содержащих искомый продукт, объединяли и растворитель удаляли путем выпаривания в роторном испарителе. Это давало 22,8 г вязкой желтой жидкости с выходом 68,4%. Весь образец кристаллизовали и добавляли гексан (200 мл) с получением взвеси. Взвесь фильтровали с помощью вакуума и твердому веществу давали высохнуть на воздухе. Это давало N-(4-хлор-2-(пиридин-3-ил)тиазол-5-ил)-N,2-диметил-3-(метилтио)пропанамид в виде почти белого твердого вещества; Температура плавления 75-80°C; 1H ЯМР (400 МГц, CDCl3) δ 9,12 (д, J = 1,4 Гц, 1H), 8,73 (д, J = 3,8 Гц, 1H), 8,34-8,09 (м, 1H), 7,43 (дд, J = 7,9, 4,9 Гц, 1H), 3,30 (с, 3H), 3,06-2,70 (м, 2H), 2,49 (д, J = 7,4 Гц, 1H), 2,04 (с, 3H), 1,21 (д, J = 6,4 Гц, 3H); 13C ЯМР (101 МГц, ДМСО-d6) δ 175,22, 162,37, 151,91, 146,53, 136,46, 134,64, 133,35, 127,98, 124,27, 37,47, 36,71, 36,47, 17,56, 15,44; Результаты анализа. Рассчитано для C14H16ClN3OS2: C, 49,18; H, 4,72; N, 12,29; S, 18,76. Найдено: C, 49,04: H, 4,68; N, 12,29; S, 18,68.
1. Способ, включающий
(i) взаимодействие соединения (I) с соединением (IIa) с образованием соединения (IIb), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном протонном растворителе; затем
(ii) взаимодействие соединения (IIb) с соединением (IIc) с образованием соединения (III), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном растворителе; затем
(iii) циклизацию соединения (III) с использованием дегидратирующего реагента с образованием соединения (IV), где указанное взаимодействие проводят при температуре окружающей среды и при давлении окружающей среды в полярном апротонном растворителе;
в котором
(A) каждый R1 представляет собой H;
(B) R2 представляет собой (C1-C6)алкил;
(C) R3 представляет собой H и
(D) R4 представляет собой (C1-C6)алкил.
2. Способ по п.1, в котором указанный полярный протонный растворитель стадии a1 представляет собой муравьиную кислоту, н-бутанол, изопропанол, н-пропанол, этанол, метанол, уксусную кислоту, воду или их смесь.
3. Способ по п.1, в котором указанный полярный протонный растворитель стадии a1 представляет собой метанол.
4. Способ по п.1, в котором на стадии b соединение (III) циклизуют с использованием дегидратирующего реагента, выбранного из POCl3, H2SO4, SOCl2, P2O5, полифосфорной кислоты, п-толуолсульфоновой кислоты, трифторуксусного ангидрида или их смеси.
5. Способ по п.1, в котором стадию b проводят при температуре от 60 до 120°C.
6. Способ по п.1, в котором указанный апротонный полярный растворитель стадии b представляет собой ацетонитрил.
7. Способ по п.1, в котором указанный способ дополнительно включает галогенирование указанного R3 до F, Cl, Br или I.
8. Способ по п.7, в котором указанное галогенирование проводят в растворителе, выбранном из дихлорметана, тетрагидрофурана, этилацетата, ацетона, диметилформамида, ацетонитрила и диметилсульфоксида.
9. Способ по п.8, в котором указанный растворитель представляет собой дихлорметан.
10. Способ по любому из пп.7, 8 и 9, в котором указанное галогенирование проводят при температуре от 0°C до температуры окружающей среды.
11. Способ по любому из пп.7, 8 и 9, в котором R3 представляет собой Cl.