Новый сульфатированный фукоолигосахарид и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложены новый сульфатированный фукоолигосахарид формулы II, представленной на фиг.3, и способ его получения. Осуществляют обработку фукоидана из Sargassum horneri рекомбинантной фукоиданазой FFA1 в Tris-HCl буфере с рН 7,2 при 37°С в течение 72-75 ч. Затем нагревают до 100°C в течение 5-10 мин. Далее высокомолекулярные продукты гидролиза осаждают 75% водным раствором этанола или ацетона. Затем образовавшийся осадок отделяют с помощью центрифугирования при 9000-10000 g в течение 20-30 мин. Супернатант наносят на колонку с анионообменным сорбентом, уравновешенную водой, и элюируют фукоолигосахариды линейным градиентом гидрокарбоната аммония со скоростью 1 мл/мин. Сначала элюируют сульфатированный фукоолигосахарид формулы II, затем сульфатированный фукоолигосахарид формулы I. Полученные фракции целевых продуктов лиофильно высушивают. Изобретение расширяет арсенал сульфатированных фукоолигосахаридов, полученных из бурой водоросли Sargassum horneri. 2 н.п. ф-лы, 3 ил., 2 табл., 2 пр.
Реферат
Изобретение относится к биотехнологии и касается получения новых сульфатированных фукоолигосахаридов из фукоиданов. Эти соединения могут быть использованы в научных исследованиях, а также в медицине, косметологии, сельском хозяйстве.
Фукоиданы - сульфатированные гетерополисахариды бурых водорослей обладают широким спектром биологической активности [Fitton, J.H., Stringer, D.N., and Karpiniec, S.S. (2015). Therapies from Fucoidan: An Update. Marin Drugs 13, 5920-5946]. Однако использование полимерных молекул в медицине практически невозможно из-за гетерогенности препаратов полисахаридов и невозможности их стандартизации. Поэтому стоит проблема получения из фукоидана олигосахаридов, имеющих постоянные структуры и стандартные характеристики. Применение ферментов для деполимеризации биологически активных фукоиданов и получение олигосахаридов открывает новые возможности использования этих соединений в фармацевтике и косметологии [Kusaykin, M.I., Silchenko, A.S., Zakharenko, A.M., and Zvyagintseva, T.N. (2016). Fucoidanases. Glycobiology 26, 3-12].
Описано использование фукозилированных олигосахаридов в составе композиции, используемой для предупреждения и/или лечения атопического дерматита и экземы [RU 2586776 С2, 10.06.2016], желудочно-кишечной инфекции [WO2016139333 А1, 09.09.2016]. Предложены новые N-сульфатированные олигосахариды, стимулирующие образование сосудов [RU 2559629 С2, 10.08.2015], а также новые сульфатированные производные олигосахаридов, эффективные в качестве ингибиторов гепаринсульфат-связывающих белков [RU 2483074 С2, 27.05.2013]. Известны фукоолигосахариды, которые могут быть использованы для защиты растений от патогенов [US 6984630 В1, 10.01.2006].
По сравнению с получением сульфатированных олигосахаридов многостадийным методом органического синтеза, ферментативное получение подобных олигосахаридов из фукоиданов отличается меньшей трудоёмкостью, существенно меньшим числом стадий получения и высоким выходом продуктов реакции.
Описано получение фукоолигосахаридов из фуканов деполимеризацией с помощью бактериальных эндофуканаз [US 6984630 В1, 10.01.2006].
Описано получение фукоолигосахаридов, используемых в области гликотехнологии, с помощью ферментов из фукоидана, полученного из бурых водорослей порядка Laminarinales. [US 6927289 В2, 09.08.2005].
Раннее нами были получены фукоолигосахариды ферментативным гидролизом фукоидана из бурой водоросли Fucus evanescens. Для этого фукоидан смешивали с нативной фукоиданазой FFA из морской бактерии Formosa algae в 0,015 М Na-фосфатном буфере, рН 7,2 и инкубировали в течение 72 ч при 25ºС. Высокомолекулярные продукты гидролиза осаждали 75% водным раствором этанола. Выпавший осадок центрифугировали при 10000 g в течение 30 мин. Супернатант упаривали на роторном испарителе, растворяли в дистиллированной воде и наносили на термостатируемую колонку с биогелем Р-6, уравновешенную водой. Фукоолигосахариды элюировали со скоростью 0,7 мл/мин. Присутствие сахаров в исследуемых фракциях проверяли фенол-сернокислотным методом. Низкомолекулярные фракции олигосахаридов объединяли, концентрировали на роторном испарителе и рехроматографировали. В результате получали дисахариды [Сильченко А.С. Фукоиданазы и альгинат-лиазы морской бактерии Formosa algae KMM 3553T и морского моллюска Lambis sp: диссертация на соискание ученой степени канд. хим. наук. ТИБОХ ДВО РАН, Владивосток, 2014, стр. 69].
На фиг. 1 (А, Б) представлены структуры дисахаридов.
Задача изобретения – расширение арсенала сульфатированных фукоолигосахаридов. Задача решена разработкой способа их получения из фукоидана, выделенного из бурой водоросли Sargassum horneri.
Технический результат, обеспечиваемый изобретением, заключается в получении новых сульфатированных фукоолигосахаридов постоянной структуры из фукоидана из Sargassum horneri.
В доступной патентной и другой научно-технической литературе заявляемые сульфатированные фукоолигосахариды не обнаружены.
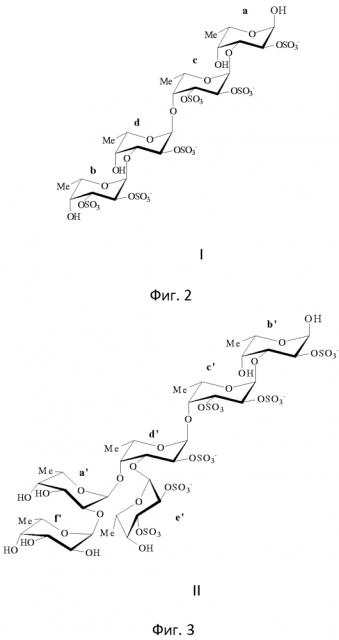
Заявляемый сульфатированный фукоолигосахарид формулы I состоит из остатков фукозы (n=4), связанных чередующимися 1→3;1→4 гликозидными связями, сульфатные группы расположены при С2 в 1→3-связанных остатках фукозы, и при С2 и С3 в 1→4-связанных остатках фукозы.
На фиг. 2 представлена структура сульфатированного фукоолигосахарида формулы I.
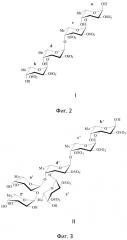
Заявляемый сульфатированный фукоолигосахарид формулы II состоит из остатков фукозы (n=6), связанных чередующимися 1→3;1→4 гликозидными связями, сульфатные группы расположены при С2 в 1→3-связанных остатках фукозы, и при С2 и С3 в 1→4-связанных остатках фукозы, к третьему моносахаридному остатку, которого присоединена боковая цепь с 1→4 гликозидной связью, состоящая из 2 остатков несульфатированной фукозы, связанных между собой 1→2 гликозидной связью.
На фиг. 3 представлена структура сульфатированного фукоолигосахарида формулы II.
Заявляемый способ получения сульфатированных фукоолигосахаридов формул I и II заключается в том, что рекомбинантную фукоиданазу FFA1 в Tris-HCl буфере рН 7,2 смешивают с 5-10% раствором фукоидана из Sargassum horneri, смесь инкубируют при 37°С в течение 72-75 часов, затем нагревают до 100°С в течение 5-10 мин, далее высокомолекулярные продукты гидролиза осаждают 75% водным раствором этанола или ацетона, затем образовавшийся осадок отделяют с помощью центрифугирования при 9000-10000 g в течение 20-30 мин, а супернатант наносят на колонку с анионообменным сорбентом, уравновешенную водой, и элюируют фукоолигосахариды линейным градиентом гидрокарбоната аммония со скоростью 1 мл/мин, сначала сульфатированный фукоолигосахарид формулы II, затем сульфатированный фукоолигосахарид формулы I, далее полученные фракции целевых продуктов лиофильно высушивают.
Рекомбинантную фукоиданазу FFA1 получают известным способом [Сильченко А.С. Фукоиданазы и альгинат-лиазы морской бактерии Formosa algae KMM 3553T и морского моллюска Lambis sp: диссертация на соискание ученой степени канд. хим. наук. ТИБОХ ДВО РАН, Владивосток, 2014, стр. 110].
Фукоидан получают из бурой водоросли Sargassum horneri по известной методике [Zvyagintseva, T. N., Shevchenko, N. M., et.al. (1999). A new procedure for the separation of water-soluble polysaccharides from brown seaweeds. Carbohydr. Res. 322, 32-39].
Изобретение иллюстрируется примерами конкретного выполнения.
ПРИМЕР 1
Рекомбинантную фукоиданазу FFA1 (1 мг) в Tris-HCl буфере, рН 7,2 смешивают с 5% раствором фукоидана из Sargassum horneri. Смесь инкубируют при 37°С в течение 72 ч, затем нагревают до 100°С в течение 5 мин. Образовавшийся осадок отделяют с помощью центрифугирования и отбрасывают. В супернатант добавляют этанол до достижения его концентрации 75%. Выпавший осадок (высокомолекулярная фракция) центрифугируют при 9000 g в течение 20 мин. Супернатант (низкомолекулярная фракция) наносят на колонку с сорбентом Q-Sepharose, уравновешенную водой. Олигосахариды элюируют линейным градиентом гидрокарбоната аммония со скоростью 1 мл/мин, сначала сульфатированный фукоолигосахарид формулы II, затем сульфатированный фукоолигосахарид формулы I. Полученные фракции олигосахаридов лиофильно высушивают. Выход целевых продуктов составляет 5-15% от веса низкомолекулярной фракции.
ПРИМЕР 2
Рекомбинантную фукоиданазу FFA1 (1 мг) в Tris-HCl буфере, рН 7,2 смешивают с 10% раствором фукоидана из Sargassum horneri. Смесь инкубируют при 37°С в течение 75 ч, затем нагревают до 100°С в течение 10 мин. Образовавшийся осадок отделяют с помощью центрифугирования и отбрасывают. В супернатант добавляют ацетон до достижения его концентрации 75%. Выпавший осадок (высокомолекулярная фракция) центрифугируют при 10000 g в течение 30 мин. Супернатант (низкомолекулярная фракция) наносят на колонку с сорбентом Mono-Q, уравновешенную водой. Олигосахариды элюируют линейным градиентом гидрокарбоната аммония со скоростью 1 мл/мин, сначала сульфатированный фукоолигосахарид формулы II, затем сульфатированный фукоолигосахарид формулы I. Полученные фракции олигосахаридов лиофильно высушивают. Выход целевых продуктов составляет 7-20% от веса низкомолекулярной фракции.
Структура полученных олигосахаридов была установлена с помощью ЯМР спектроскопии.
На 1H-спектре олигосахарида формулы I были обнаружены химические сдвиги, принадлежащие четырём разным остаткам α-метил-L-фукопиранозида, обозначенным буквами a-d, представленные в таблице 1. С помощью спектров 1DTOXY и COSY были определены хим. сдвиги, принадлежащие каждому остатку, и их последовательность. Из HSQC-спектра было установлено соотношение между хим. сдвигами 1H и 13C. Спектр ROESY показал корреляцию между H1 остатка d и H4 остатка c, H1 остатка c и H3 остатка a, H1 остатка b и H3 и H4 остатка d. В спектре HMBC наблюдалась связь между С1 остатка d и H4 остатка c, С1 остатка c и H3 остатка a, С1 остатка b и H3 и остатка d. Аналогично протоны d1, c1 и b1 коррелировали с атомами углерода c4, a3 и d3 соответственно. На основании этого был сделан вывод, что олигосахарид формулы I имеет углеродный скелет α-L-Fucp-1→3-α-L-Fucp-1→4-α-L-Fucp-1→3-α-L-Fucp.
Спектр 1H снят при 700 MHz, 308 К, хим. сдвиги измерены относительно хим. сдвига ацетона 2,225. Спектр 13С снят при 700 MHz, 308 К, хим. сдвиги измерены относительно хим. сдвига ацетона 31,45.
Аналогичным образом была установлена структура олигосахарида формулы II. 1H-спектр показал наличие шести разных моносахаридных остатков. Спектры 1DTOXY, COSY и HSQC позволили установить протонные и углеродные хим. сдвиги каждого из них, представленные в таблице 2.
На спектре ROESY наблюдается корреляция между H1 остатка a’ и H4 остатка d’, H1 остатка e’ и H3 остатка d’, H1 остатка d’ и H4 остатка c’, H1 остатка c’ и H3 остатка b’, H1 остатка f’ и H2 остатка a’. В спектре HMBC атомы углерода a’1, d’1, e’1, f’1, c’1 коррелируют с протонами d’4, c’4, d’3, a’2 и b’3 соответственно, а протоны a’1, e’1, f’1, d’1 – с атомами углерода d’4, d’3, a’2, c’4 соответственно. Кроме того, в спектре HMBC наблюдается связь атома углерода b’3 с протоном c’1 или d’1.
Спектр 1H снят при 700 MHz, 308 К, хим. сдвиги измерены относительно хим. сдвига ацетона 2,225. Спектр 13С снят при 700 MHz, 308 К, хим. сдвиги измерены относительно хим. сдвига ацетона 31,45.
На основании вышесказанного был сделан вывод, что олигосахарид формулы II имеет разветвлённую структуру вида
α-L-Fucp-1→2-α-L-Fucp-1↓4
α-L-Fucp-1→3-α-L-Fucp-1→4-α-L-Fucp-1→3-α-L-Fucp.
Положение сульфатов в моносахаридных остатках было установлено путём сравнения сдвигов их протонов с фукозой (H1 = 5,19, H2 = 3,76, H3 = 3,85, H4 = 3,80, H5 = 4,19, H6 = 1,20) и сдвигов их углеродных атомов с α-метил-L-фукопиранозидом (C1 = 100,5, C2 = 69,0, С3 = 70,6, С4 = 72,9, С5 = 67,5, С6 = 16,5). Сульфатирование в положении 2 было вычислено из смещения H2 в слабое поле на 0,8-0,9 ppm относительно фукозы и C2 – на 4-6 ppm относительно α-метил-L-фукопиранозида. По сдвигу H3 в слабое поле на 0,9-1,0 ppm и C3 – на 4-6 ppm было установлено наличие сульфатов в положении 3.
Заявляемые сульфатированные фукоолигосахариды используют в научных исследованиях в качестве субстратов фукоиданаз, фукозидаз и сульфатаз.
1. Способ получения сульфатированных фукоолигосахаридов формулы I, представленной на фиг. 2, и формулы II, представленной на фиг. 3, заключающийся в том, что рекомбинантную фукоиданазу FFA1 в Tris-HCl буфере, рН 7,2 смешивают с 5-10% раствором фукоидана из Sargassum horneri, смесь инкубируют при 37°C в течение 72-75 ч, затем нагревают до 100°C в течение 5-10 мин, далее высокомолекулярные продукты гидролиза осаждают 75% водным раствором этанола или ацетона, затем образовавшийся осадок отделяют с помощью центрифугирования при 9000-10000 g в течение 20-30 мин, а супернатант наносят на колонку с анионообменным сорбентом, уравновешенную водой, и элюируют фукоолигосахариды линейным градиентом гидрокарбоната аммония со скоростью 1 мл/мин, сначала сульфатированный фукоолигосахарид формулы II, затем сульфатированный фукоолигосахарид формулы I, далее полученные фракции целевых продуктов лиофильно высушивают.
2. Сульфатированный фукоолигосахарид формулы II, представленной на фиг. 3.