Композиции, содержащие гетерогенные популяции рекомбинантных белков человеческого фактора свертывания крови ха
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к композициям, содержащим рекомбинантные варианты человеческого фактора свертывания крови Ха, что может быть использовано в медицине. Рекомбинантным путем получают широкое разнообразие изоформ и посттрансляционных модификаций FXa. Изобретение позволяет осуществлять эффективную терапию гемостаза у нуждающихся в этом субъектов. 4 н. и 33 з.п. ф-лы, 7 ил., 4 табл., 7 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ НА ИЗОБРЕТЕНИЕ
В данной заявке на изобретение заявлено преимущество предварительной заявки на патент США №61/881834, поданной 24 сентября 2013 г., включенной в данное описание путем ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, поданный одновременно с данной заявкой на изобретение в соответствии с 37 CFR §1.821 в машиночитаемой форме (CRF) через EFS-Web в виде файла с названием PC72049_SEQLIST_ST25.txt, включен в данное описание путем ссылки. Электронная копия перечня последовательностей создана 10 сентября 2014 г., где размер файла составляет 31 килобайт.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Эффективные способы терапии необходимы для того, чтобы контролировать чрезмерные кровотечения в ряде клинических состояний, при которых кровотечение нельзя адекватно контролировать путем медицинского или хирургического вмешательства. Данная неудовлетворенная потребность особенно критична для пациентов, страдающих от гемофилии, в особенности тех, у которых заместительная терапия в отношении фактора свертывания крови оказывается менее эффективной вследствие продукции ингибиторных антител.
Активированный фактор свертывания крови X (FXa) занимает центральную позицию в каскаде свертывания крови на схождении внутренних и внешних путей свертывания крови. Связанный с мембраной FXa в присутствии своего кофактора фактора Va (FVa) превращает протромбин в тромбин, который активирует тромбоциты и превращает фибриноген в фибрин с образованием тромба. В принципе, заместительная терапия путем прямого введения FXa может корректировать кровотечение. Тем не менее, терапевтический потенциал FXa ограничен вследствие его очень короткого периода полувыведения из плазмы крови и возможности вызывать чрезмерное свертывание крови вследствие активации других факторов свертывания крови.
В более ранней работе идентифицировали вариант FXa (вариант I16L), в котором лейцин заменял изолейцин по N-концу тяжелой цепи FXa дикого типа (позиция 16 в схеме нумерации химотрипсина). Эта замена приводила к варианту FXa, обладающему зимогеноподобными свойствами. Toso R. et al., The conformational switch from the factor X zymogen to protease state mediates exosite expression and prothrombinase assembly. J. Biol. Chem. 283, 18627-18635 (2008); Ivanciu L. et al., A zymogen-like factor Xa variant corrects the coagulation defect in hemophilia. Nat. Biotechnol. 29:1028-33 (2011).
Будучи не включенным в протромбиназный комплекс со своим кофактором, а именно фактором Va (FVa), вариант FXa I16L не обладал значимой каталитической активностью и был лучше защищен от инактивации ингибиторами сывороточной протеазы по сравнению FXa дикого типа. В результате этот вариант обладал более длительным периодом полувыведения из сыворотки крови по сравнению с FXa дикого типа. Тем не менее, связывание с FVa в протромбиназе приводило к переходу варианта от зимогеноподобного состояния к активной конформации, таким образом, восстанавливая способность этого варианта катализировать превращение протромбина в тромбин и, таким образом, его прокоагулянтную активность. В мышиных моделях гемофилии А и гемофилии В введение варианта FXa I16L до повреждения уменьшало кровопотерю после отсечения хвоста в зависимости от дозы. Результаты этих экспериментов свидетельствуют о том, что вариант FXa I16L может быть полезен для лечения неконтролируемого кровотечения у людей, страдающих от гемофилии.
Тем не менее, вариант FXa I16L, используемый в более ранних исследованиях, получали в небольших количествах из стабильно трансфицируемых клеток НЕК 293 с последующей активацией белка FX с использованием протеазы яда гадюки Рассела RWX. Toso R., Zhu H. & Camire R.M. The conformational switch from the factor X zymogen to protease state mediates exosite expression and prothrombinase assembly. J. Biol. Chem. 283, 18627-18635 (2008). Несмотря на пользу данного подхода для мелкомасштабных исследований, он не подходит для продукции больших количеств очищенного варианта белка FXa, необходимых для клинических исследований и конечной поставки пациентам. Соответственно, в области техники существует потребность в препаратах варианта белка FXa I16L, приготавливаемых в таком количестве и с такой чистотой, что они могут быть тестированы в клинических исследованиях, и после одобрения предложены субъектам, нуждающимся в гемостазе.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Описание настоящего изобретения относится к неудовлетворенной потребности в области техники, описанной выше, путем того, что предложены композиции вариантов белка FXa, получаемые с достаточной чистотой и в достаточном количестве, таким образом, что они могут доставляться субъектам нуждающимся в гемостазе. В различных воплощениях эти композиции содержат разные изоформы и посттрансляционные модификации вариантов белка FXa.
В одном из воплощений композиции содержат бета форму варианта белка FXa, в которой последовательности легкой и тяжелой цепей белка соответственно состоят из аминокислот с 1 по 139 и со 146 по 386, аминокислот с 1 по 140 и со 146 по 384, аминокислот с 1 по 140 и со 146 по 386, аминокислот с 1 по 141 и со 146 по 384, аминокислот с 1 по 141 и со 146 по 386, аминокислот с 1 по 142 и со 146 по 384, аминокислот с 1 по 142 и со 146 по 386, аминокислот с 1 по 143 и со 146 по 384, и аминокислот с 1 по 143 и со 146 по 386, все из которых имеют аминокислотную последовательность в соответствии с SEQ ID NO: 1.
В еще одном воплощении композиции содержат альфа форму варианта белка FXa, в которой последовательности легкой и тяжелой цепей белка соответственно состоят из аминокислот с 1 по 139 и со 146 по 398, аминокислот с 1 по 140 и со 146 по 398, аминокислот с 1 по 140 и со 146 по 399, аминокислот с 1 по 141 и со 146 по 398, аминокислот с 1 по 141 и со 146 по 399, аминокислот с 1 по 142 и со 146 по 398, и аминокислот с 1 по 142 и со 146 по 399, все из которых имеют аминокислотную последовательность в соответствии с SEQ ID NO: 1.
В любом одном или более чем одном из воплощений бета и альфа изоформы вариантов белков FXa, описанных выше, легкие цепи белков могут быть модифицированы таким образом, что включают β-гидрокси Asp63, О-связанную гексозу и 9, 10 или 11 остатков Gla. В некоторых воплощениях присутствует 9 остатков Gla. В других воплощениях присутствует 10 остатков Gla. И в других воплощениях присутствует 11 остатков Gla.
В любом одном или более чем одном воплощении бета изоформы вариантов белка FXa, описанных выше, тяжелые цепи могут быть модифицированы таким образом, что включают один или два О-связанных гликана ядра-1. В некоторых воплощениях только первый, только второй или оба О-связанных гликана ядра-1 могут быть не сиалилированы, моносиалилированы или дисиалилированы. В соответствии с некоторыми воплощениями отсутствуют какие-либо группы сиаловой кислоты. В других воплощениях присутствует одна группа сиаловой кислоты. В других воплощениях присутствует две группы сиаловой кислоты. В дополнительных воплощениях присутствует три группы сиаловой кислоты. И в других дополнительных воплощениях в общей сложности присутствует четыре группы сиаловой кислоты.
В соответствии с некоторыми воплощениями композиции варианта белка FXa включают по меньшей мере один вид варианта белка FXa, представленный в таблице 2 описания изобретения. В других воплощениях композиции в соответствии с описанием изобретения содержат по меньшей мере 5, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30, по меньшей мере 35, по меньшей мере 40, по меньшей мере 45, по меньшей мере 50, по меньшей мере 55 или по меньшей мере 60 видов варианта белка FXa, перечисленных в таблице 2.
В соответствии с другими воплощениями композиции варианта белка FXa включают по меньшей мере один вариант белка FXa, в котором легкая цепь представляет собой виды, перечисленные в таблице 3 описания изобретения. И в других воплощениях композиции варианта белка FXa включают по меньшей мере один вариант белка FXa, в котором тяжелая цепь представляет собой виды, перечисленные в таблице 4 описания изобретения.
В некоторых воплощениях любой один или более чем один вариант белка FXa в соответствии с описанием изобретения может быть представлен в композиции со средней частотой, которая варьирует относительно других видов, которые могут быть представлены. Например, конкретный вид может быть представлен с основной, минорной или следовой частотой по сравнению с другими представленными видами. Альтернативно, конкретный вид может быть представлен с высокой частотой, средней частотой, низкой частотой или очень низкой частотой по сравнению с другими представленными видами.
В описании настоящего изобретения также предложены нуклеиновые кислоты, векторы, клетки-хозяева и способы получения и очистки вариантов белка FXa.
Например представлены последовательности нуклеиновых кислот, кодирующие вариант белка FX, включающий замену нативной последовательности активационного пептида (АР) на сайт процессинга РАСЕ (фермент, расщепляющий белок в месте спаренных основных аминокислот), таким образом, давая возможность для внутриклеточной активации фактора свертывания крови. В некоторых воплощениях последовательность АР удаляют полностью и заменяют на аминокислотную последовательность Arg-Lys-Arg. В соответствии с некоторыми воплощениями в качестве последовательности кДНК (комплементарная ДНК), кодирующей вариант белка FX, предложена последовательность нуклеиновой кислоты SEQ ID NO: 4, и в качестве кодируемой ею аминокислотной последовательности предложена аминокислотная последовательность SEQ ID NO: 1. Родственные способы предложены для получения варианта белка FXa путем выращивания клеток-хозяев, коэкспрессирующих РАСЕ (или сходную протеазу) и вариант белка FX, и затем очистки варианта белка FXa, продуцируемого, процессируемого и секретируемого клетками-хозяевами. Также раскрыты варианты белка FXa, продуцируемые в соответствии с этими способами. В некоторых воплощениях этих способов клетки-хозяева представляют собой клетки СНО (яичника китайского хомячка).
Очистка вариантов белка FXa может быть осуществлена путем хроматографии, включающей пропускание раствора, содержащего белки, через колонку для хроматографии в смешанном режиме (ММС) (например, с использованием сред Capto ММС), с последующим промыванием и элюированием, затем пропусканием белков через первую колонку для ионообменной хроматографии (например, с использованием сред Q-Sepharose Fast Flow), с последующим промыванием и элюированием, и затем пропусканием белков через вторую отличающуюся от первой колонку для ионообменной хроматографии (например, с использованием сред Fractogel SO3-). с последующим промыванием и элюированием. Также возможны другие способы очистки вариантов белка FXa.
Способы очистки могут возможно включать стадию вирусной инактивации, а также стадии ультрафильтрования и диафильтрования. После очистки вариантов белка FXa, и в некоторых случаях их концентрирования, они могут быть разведены в фармацевтически приемлемом разбавителе, возможно содержащем другие ингредиенты, такие как буферы или эксципиенты.
В описании также предложены способы лечения субъектов, нуждающихся в гемостазе, путем введения гемостатически эффективного количества композиции, содержащей один или более чем один вариант белка FXa в соответствии с описанием изобретения. В других воплощениях субъектам вводят гемостатически эффективное количество композиции, содержащей один или более чем один вариант белка FXa в соответствии с описанием изобретения, до возникновения кровотечения для профилактического предупреждения неконтролируемого кровотечения у восприимчивого субъекта. В некоторых воплощениях субъекта лечат от гемофилии А. В других воплощениях субъекта лечат от гемофилии В. И в других воплощениях субъекта лечат от травмы или других типов неконтролируемого кровотечения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1А представлена аминокислотная последовательность (SEQ ID NO: 1) зрелого варианта белка FX, в котором изолейциновый остаток дикого типа в положении 146 заменен на лейцин, показанный жирным шрифтом. Положение 146 соответствует положению 16 в системе нумерации химотрипсина. Потенциальные остатки γ-карбоксиглутаминовой кислоты (Gla) подчеркнуты и выделены курсивом. Предсказанные внутрицепочечные и межцепочечные дисульфидные связи проиллюстрированы при помощи линий, проведенных между связанными цистеинами. Предсказанный сайт β-гидроксилирования заключен в рамку из сплошных линий. Сайт распознавания и расщепления РАСЕ, сконструированный для замены активационного пептида, заключен в рамку из пунктирных линий. Лизин, составляющий С-концевую аминокислоту бета формы тяжелой цепи (Lys386) заключен в овал из сплошной линии. На Фиг. 1В представлена предсказанная аминокислотная последовательность (SEQ ID NO: 2) легкой цепи зрелого варианта белка FX. На Фиг. 1С представлена предсказанная аминокислотная последовательность (SEQ ID NO: 3) тяжелой цепи варианта белка FXa. На Фиг. 1D представлена нуклеотидная последовательность (SEQ ID NO: 4) кДНК, кодирующей вариант белка FX, включающий сигнальную последовательность и пропептид.
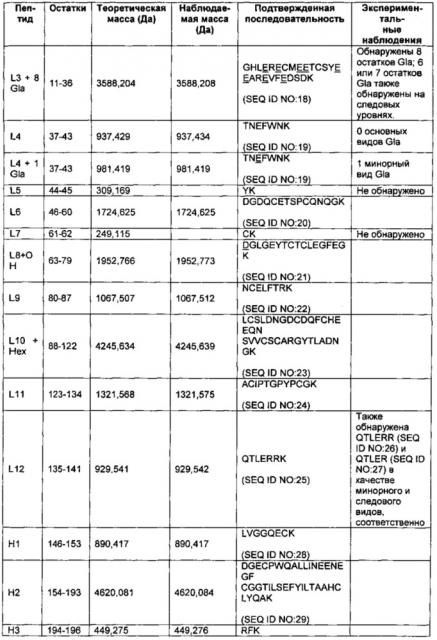
На Фиг. 2 представлен масс-спектр пептидов, полученных в результате восстановления, алкилирования и протеолитического расщепления при помощи Lys-C очищенного препарата интактного варианта белка FXa. Обозначение пиков, основанное на масс-спектре после анализа пептидов при помощи RP-HPLC (высокоэффективная жидкостная хроматография на обращенной фазе)/ESI-QТОF MS (времяпролетная квадрупольная масс-спектрометрия с ионизацией электрораспылением), использовали для подтверждения аминокислотной последовательности белка и для идентификации некоторых посттрансляционных модификаций, описанных в таблице 1 и в настоящем описании. Маркировка пиков является следующей. "L" с последующим номером относится к конкретному пептиду, происходящему из легкой цепи. "Н" с последующим номером относится к конкретному пептиду, происходящему из тяжелой цепи. "Н201": С-концевая альфа-форма H цепи, оканчивающаяся Lys399, содержащая два дисиалилированых О-гликана ядра-1. "Н202": С-концевая альфа-форма H цепи, оканчивающаяся Lys399, содержащая один дисиалилированый О-гликан ядра-1. "Н203": С-концевая альфа-форма H цепи, оканичивающаяся Leu398, содержащая один дисиалилированый О-гликан ядра-1. “L41Gla”: пептид L цепи #4, содержащий 1 остаток γ-карбоксиглутаминовой кислоты. "L10glc": пептид L цепи #10, содержащий потенциально О-связанную глюкозу (гексозу). "L1Gla": пептид L цепи #1 с 2 остатками γ-карбоксиглутаминовой кислоты. "L36-8Gla": пептид L цепи #3 с 6, 7 или 8 остатками γ-карбоксиглутаминовой кислоты. "L8b-OH": пептид L цепи #8, содержащий β-гидрокси Asp. "d": деамидирование. "R": пик реагента, т.е. продукты буфера, соответствующие реагентному контролю. "*": сверхалкилирование.
На Фиг. 3 представлена хроматограмма HPLC очищенного препарата интактного варианта белка FXa и продемонстрировано присутствие в препарате различных изоформ варианта белка FXa.
На Фиг. 4 представлена хроматограмма HPLC очищенного препарата интактного варианта белка FXa и продемонстрировано присутствие в препарате различных изоформ варианта белка FXa. Препарат также анализировали при помощи масс-спектрометрии.
На Фиг. 5 представлен масс-спектр интактного варианта белка FXa из очищенного препарата. Масс-спектр подтверждает присутствие двух основных изоформ альфа и бета, а также обширную гетерогенность по массам, присущую вариабельному расщеплению по сайту расщепления РАСЕ, и присутствие различных типов посттрансляционной модификации. Основные пики идентифицированы на фигуре по их обнаруженной массе в дальтонах. Обозначение пиков, основанное на масс-спектре после анализа RP-HPLC/ESI-QTOF MS, использовали для подтверждения аминокислотной последовательности белковых изоформ и для идентификации некоторых посттрансляционных модификаций, описанных в таблице 2 и описании изобретения. Пики, обозначенные "*", указывают на присутствие 11 остатков Gla в домене Gla легкой цепи.
На Фиг. 6 представлена хроматограмма HPLC очищенного препарата варианта белка FXa после восстановления и алкилирования для разделения легкой и тяжелой цепей путем устранения межцепочечных и внутрицепочечных дисульфидных связей. Хроматограмма демонстрирует присутствие различных изоформ варианта белка FXa. Препарат также анализировали при помощи масс-спектрометрии.
На Фиг. 7А представлен масс-спектр легкой цепи варианта белка FXa после восстановления и алкилирования очищенного препарата белка. Масс-спектр демонстрирует обширную гетерогеннность по массам, присущую вариабельному расщеплению по сайту расщепления РАСЕ, и присутствие различных типов посттрансляционных модификаций. Основные пики идентифицированы на фигуре по их обнаруженной массе в дальтонах. Обозначение пиков, основанное на масс-спектре после анализа RP-HPLC/ESI-QTOF MS, использовали для подтверждения аминокислотной последовательности белковых изоформ и для идентификации некоторых посттрансляционных модификаций, описанных в таблице 3 и описании изобретения.
На Фиг. 7В представлен масс-спектр тяжелой цепи варианта белка FXa после восстановления и алкилирования очищенного препарата белка. Масс-спектр демонстрирует обширную гетерогеннность по массам, присущую присутствию различных типов посттрансляционных модификаций. Основные пики идентифицированы на фигуре по их обнаруженной массе в дальтонах. Обозначение пиков, основанное на масс-спектре после анализа RP-HPLC/ESI-QTOF MS, использовали для подтверждения аминокислотной последовательности белковых изоформ и для идентификации некоторых посттрансляционных модификаций, описанных в таблице 4 и в описании изобретения. Пики, обозначенные "*", указывают на сверхалкилирование тяжелой цепи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Здесь описаны композиции, содержащие вариант белка FXa, полученный с достаточной чистотой и в достаточном количестве, тестируемые в клинических исследованиях, и предложенные для субъектов, нуждающихся в гемостазе. Также описаны способы получения и очистки варианта белка FXa.
В некоторых воплощениях фраза "вариант белка FX", "вариант белка FXa" и похожие термины относятся (если из контекста не ясно иное) к человеческому фактору X (FX) или активированному фактору X (FXa), соответственно, в котором изолейцин (IIе или I) непосредственно за последовательностью активационного пептида в тяжелой цепи заменен на лейцин (Leu или L). На основе выравнивания последовательностей тяжелой цепи FXa и каталитического домена химотрипсина эту замену также называют мутацией путем замены I16L с использованием схемы нумерации химотрипсина. Эта позиция соответствует аминокислоте 146 в SEQ ID NO: 1 и аминокислоте 1 в SEQ ID NO: 3. Как обсуждалось выше, FXa, включающий эту мутацию, обладает зимогенными свойствами, которые дают ему возможность циркулировать в крови в течение более длительных периодов времени по сравнению с FXa дикого типа, а также способен расщеплять протромбин с высокой скоростью при включении в протромбиназный комплекс.
В соответствии с другими воплощениями вариант белка FX и вариант белка FXa относятся к FX или FXa, соответственно, в котором аминокислота, соответствующая положению 146 в SEQ ID NO: 1 (положение 16 в схеме нумерации химотрипсина) заменена на Phe (F), Asp (D) или Gly (G). В соответствии с другими воплощениями вариант белка FX и вариант белка FXa относятся к человеческому FX или FXa, соответственно, в котором валин (Val или V), соответствующий положению 147 в SEQ ID NO: 1 (положение 17 в схеме нумерации химотрипсина), заменен на Leu (L), Ala (А) или Gly (G). В других воплощениях вариант белка FX и вариант белка FXa относятся к человеческому FX или FXa, соответственно, в котором аминокислота, соответствующая положению 329 в SEQ ID NO: 1 (положение 194 в схеме нумерации химотрипсина), заменена на Asn (Ν) или Glu (Ε).
Фактор X дикого типа обычно циркулирует в крови в виде неактивных двух цепей зимогена, удерживаемых вместе при помощи дисульфидной связи. Двухцепочечный зимоген образуется из зрелого FX (т.е. лишенного сигнального пептида и пропептида) после протеолитического удаления пептида Arg-Lys-Arg, представленного в зрелом белке аминокислотами 140-142. Тем не менее, для активации требуется удаление активационного пептида (АР) фактором IXa или фактором VIIa до образования сгустка, или при помощи других протеаз, таких как RWX. АР соответствует аминокислотам 143-194 в зрелом одноцепочечном FX. В двухцепочечном зимогене он представлен по N-концу тяжелой цепи. М. Hertzberg, Biochemistry of factor X, Blood Rev. 8(1):56-62 (1994).
В примере воплощения последовательность варианта белка фактора X модифицирована путем удаления активационного пептида и его замены на аминокислотную последовательность Arg-Lys-Arg (RKR в однобуквенном коде) для создания сайта распознавания и расщепления для фермента, расщепляющего спаренные основные аминокислоты (РАСЕ; также называемого фурин). Вместо того, чтобы активировать FXa на отдельной стадии, замена АР дает возможность для внутриклеточной активации варианта белка FX, когда РАСЕ коэкспрессируется в клетках-хозяевах. Это позволяет избежать потребности в исходной очистке варианта FX, продуцируемого клетками, отдельной активации белка с использованием протеазы (такой как RWX) и затем очистки варианта FXa. Путем того, что избегают этих дополнительных стадий, вариант FXa может быть получен в более чистой форме и в больших количествах.
Аминокислотная последовательность зрелого варианта фактора X изображена на Фиг. 1А (SEQ ID NO: 1), в которой лейциновая замена I16L располагается по аминокислотному положению 146 (показана жирным шрифтом), последовательность RKR, заменяющая активационный пептид, располагается в положениях 143-145 и сайт процессинга РАСЕ располагается в положениях 140-145 (показан рамкой с пунктирной линией). На Фиг. 1В и Фиг. 1С изображена предсказанная аминокислотная последовательность легкой цепи (SEQ ID NO: 2) и тяжелой цепи (SEQ ID NO: 3) варианта FXa, соответственно, после расщепления по сайту РАСЕ.
Анализ множества препаратов варианта белка FXa, продуцируемых в соответствии со способами в соответствии с описанием изобретения, продемонстрировал неожиданную степень гетерогенности в отношении белковой последовательности и посттрансляционной модификации по сравнению с предсказанной структурой. Тем не менее, такие композиции, содержащие структурно гетерогенные популяции вариантов белка FXa способны действовать в качестве сильных прокоагулянтов в анализе in vitro. Как дополнительно описано ниже, гетерогенность присуща вариациям в аминокислотной последовательности легкой цепи и тяжелой цепи и посттрансляционным модификациям, представленным в одной, другой или обеих цепях.
Не желая быть связанными какой-либо конкретной теорией действия, полагают, что один источник структурной гетерогенности присущ вариабельному расщеплению по сайту распознавания и расщепления протеазой РАСЕ/фурин, сконструированному для замены активационного пептида. В не ограничивающем объем изобретения воплощении аминокислотная последовательность сайта РАСЕ представляет собой RKRRKR (в однобуквенном коде) (SEQ ID NO: 5), сконструированную в варианте белка FX путем замены нативной аминокислотной последовательности АР на остатки RKR, которые вместе с последними тремя остатками легкой цепи, образуют сайт протеолитического распознавания RKRRKR (SEQ ID NO: 5). Также могут быть использованы другие сайты распознавания РАСЕ (например, только RKR), а также сайты распознавания и расщепления протеазами, отличающимися от РАСЕ/фурина.
В некоторых воплощениях сайт РАСЕ протеолитически отщеплен для полного его удаления из легкой цепи, не оставляя остатки позади (ANS…TLER139/RKRRKR/) (SEQ ID NO: 6 и SEQ ID NO: 5, соответственно, легкая цепь и пептидный фрагмент). В предшествующем и следующих воплощениях, описанных в этом абзаце, косая черта ("I") указывает на возможные сайты расщепления между соседними аминокислотами, и надстрочный номер указывает на позицию С-концевой аминокислоты легкой цепи после расщепления (на основе Фиг. 1А; SEQ ID NO: 1). В других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя свой первый остаток по С-концу легкой цепи (ANS…TLERR140/KRRKR/) (SEQ ID NO: 7 и SEQ ID NO: 8, соответственно, легкая цепь и пептидный фрагмент). В других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя свои первые два остатка по С-концу легкой цепи (ANS…TLERRK141/RRKR/) (SEQ ID NO: 9 и SEQ ID NO: 10, соответственно, легкая цепь и пептидный фрагмент). В других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя свои первые три остатка по С-концу легкой цепи (ANS…TLERRKR142/RKR/) (SEQ ID NO: 11). В других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя свои первые четыре остатка по С-концу легкой цепи (ANS…TLERRKRR143/KR/) (SEQ ID NO: 12). В других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя свои первые пять остатков по С-концу легкой цепи (ANS…TLERRKRRK144/R/) (SEQ ID NO: 13). И в других воплощениях сайт РАСЕ протеолитически расщеплен, оставляя всю свою последовательность по С-концу легкой цепи (ANS…TLERRKRRKR145/) (SEQ ID NO: 2).
В других воплощениях структурная гетерогенность в легкой цепи может также включать присутствие варьирующего количества остатков Gla в домене Gla, присущего вариациям степени γ-карбоксилирования некоторых остатков глутаминовой кислоты. В некоторых воплощениях количество остатков Gla составляет 9, 10 или 11. Потенциальные сайты γ-карбоксилирования глутаминовой кислоты в домене Gla идентифицированы на Фиг. 1А. В соответствии с другими воплощениями дополнительные потенциальные источники структурной гетерогенности легкой цепи включают присутствие или отсутствие β-гидроксилированного остатка аспарагиновой кислоты по Asp63 (Фиг. 1А; SEQ ID NO: 1) и присутствие или отсутствие О-связанной гексозы. В некоторых воплощениях О-связанная гексоза представляет собой глюкозу, но в других воплощениях она может представлять собой другую альдогексозу, или циклический полуацеталь, кетогексозу или другую О-связанную гексозу.
Тяжелая цепь также может демонстрировать структурную гетерогенность. В соответствии с некоторыми воплощениями вариация может возникать по длине тяжелой цепи. Например некоторые тяжелые цепи представляют собой более длинную альфа изоформу, оканчивающуюся по К399 (SEQ ID NO: 3) (надстрочный индекс указывает на положение С-концевой аминокислоты тяжелой цепи на основе Фиг. 1А; SEQ ID NO: 1), а в других случаях концевой лизин отсутствует, таким образом, что белок оканчивается по L398 (SEQ ID NO: 14). В других воплощениях тяжелая цепь представляет собой более короткую бета форму, оканчивающуюся по К386 или К384 (SEQ ID NO: 46 и SEQ ID NO: 45, соответственно).
Еще один источник гетерогенности в тяжелых цепях представляет собой степень О-связанного гликозилирования. Таким образом, в некоторых воплощениях тяжелые цепи не гликозилированы. В других воплощениях тяжелые цепи включают один или два О-гликана ядра-1. О-гликан ядра-1 представляет собой О-гликан, где N-ацетилгалактозамин (GalNAc) присоединен по серину или треонину, и галактоза (Gal) присоединена по GalNAc. В некоторых воплощениях изобретения представлен сахар GalNAc, но отсутствует сахар Gal. В соответствии с другими воплощениями каждый из двух О-связанных гликанов ядра-1 по отдельности может быть не сиалилирован, моносиалилирован или дисиалилирован, таким образом, что тяжелые цепи могут нести в общей сложности 0-4 группы сиаловой кислоты. Когда группы сиаловой кислоты присутствуют, тогда они могут быть присоединены по GalNAc или по Gal, или по обоим сахарам.
В соответствии с другими воплощениями возможны различные варианты образования пар легких цепей и тяжелых цепей, таким образом, давая возможность для получения большого комбинаторного набора двухцепочечных зимогенов с различными длинами цепи и посттрансляционными модификациями.
В других воплощениях различные виды вариантов белка FXa могут варьировать по своей относительной частоте. В одном из воплощений частота различных видов может быть определена путем сравнения высот пиков в масс-спектрах интактных вариантов белка FXa. Альтернативно, частота легкой и тяжелой цепей могут быть по отдельности проанализированы при помощи масс-спектрометрии после восстановления интактного белка и его алкилирования для устранения межцепочечных и внутрицепочечных дисульфидных связей. Как описано в приведенных ниже примерах, частота различных видов вариантов FXa может быть оценена как основная, минорная или следовая путем сравнения с самым высоким пиком в масс-спектрах.
Тем не менее, сравнение высоты пиков масс-спектров представляет собой не единственный способ измерения частоты. Другие способы измерения абсолютной или относительной частоты структурных видов находятся в пределах знаний специалистов в данной области техники. В не ограничивающем объем изобретения примере другого способа классификации относительной частоты виды рассматривают как имеющие высокую частоту в том случае, если высота их пиков в масс-спектре составляет по меньшей мере приблизительно 50% от наиболее частых видов (т.е. самый высокий пик в масс-спектре). Вид имеет среднюю частоту в том случае, если его пик составляет приблизительно 10-50% от наиболее частых видов. Виды обладают низкой частотой в том случае, если их пик составляет приблизительно 2-10% от наиболее частых видов, и обладают очень низкой частотой в том случае, если их пик составляет меньше чем приблизительно 2% от наиболее частых видов. Также возможны другие соглашения для сравнения относительной частоты видов.
Специфические не ограничивающие объем изобретения воплощения структурной гетерогенности в легких цепях, тяжелых цепях варианта белка FXa, и их комбинаций описаны ниже.
Воплощения изобретения включают варианты белка FXa, в которых С-концы легкой цепи оканчиваются по различным аминокислотам вследствие вариабельного расщепления по сайту РАСЕ. Родственные воплощения включают присутствие варьирующего числа остатков Gla и посттрансляционные модификации, такие как β-гидроксилирование остатка аспарагиновой кислоты и О-связанную гексозу. Некоторые из этих воплощений описаны ниже.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором легкая цепь состоит из аминокислот с 1 по 139 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях легкая цепь дополнительно содержит 9 остатков Gla, 10 остатков Gla или 11 остатков Gla. В каждом из этих воплощений легкая цепь может дополнительно содержать β-гидрокси Asp63, О-связанную гексозу или обе эти посттрансляционные модификации. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми из других вариантов белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором легкая цепь состоит из аминокислот с 1 по 140 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях легкая цепь дополнительно содержит 9 остатков Gla, 10 остатков Gla или 11 остатков Gla. В каждом из этих воплощений легкая цепь может дополнительно содержать β-гидрокси Asp63, О-связанную гексозу или обе эти посттрансляционные модификации. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором легкая цепь состоит из аминокислот с 1 по 141 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях легкая цепь дополнительно содержит 9 остатков Gla, 10 остатков Gla или 11 остатков Gla. В каждом из этих воплощений легкая цепь может дополнительно содержать β-гидрокси Asp63, О-связанную гексозу или обе эти посттрансляционные модификации. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором легкая цепь состоит из аминокислот с 1 по 142 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях легкая цепь дополнительно содержит 9 остатков Gla, 10 остатков Gla или 11 остатков Gla. В каждом из этих воплощений легкая цепь может дополнительно содержать β-гидрокси Asp63, О-связанную гексозу или обе эти посттрансляционные модификации. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором легкая цепь состоит из аминокислот с 1 по 143 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях легкая цепь дополнительно содержит 9 остатков Gla, 10 остатков Gla или 11 остатков Gla. В каждом из этих воплощений легкая цепь может дополнительно содержать β-гидрокси Asp63, О-связанную гексозу или обе эти посттрансляционные модификации. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
Воплощения в соответствии с описанием изобретения включают варианты белка FXa, в котором С-конец тяжелой цепи оканчивается по различным аминокислотам. Родственные воплощения включают варьирующие количества О-связанных гликанов, включающие варьирующие степени сиалилирования. Некоторые из этих воплощений описаны ниже.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором тяжелая цепь состоит из аминокислот с 146 по 384 аминокислотной последовательности SEQ ID NO: 1. Композиции в соответствии с описанием изобретения могут дополнительно содержать любой из других вариантов белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором тяжелая цепь состоит из аминокислот с 146 по 386 аминокислотной последовательности SEQ ID NO: 1. Композиции в соответствии с описанием изобретения могут дополнительно содержать любой из других вариантов белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором тяжелая цепь состоит из аминокислот с 146 по 398 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях тяжелая цепь дополнительно содержит один гликан ядра-1, который может быть не сиалилирован, моносиалилирован или дисиалилирован, или два гликана ядра-1, каждый из которых может быть независимо не сиалилирован, моносиалилирован или дисиалилирован. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
В некоторых воплощениях композиции в соответствии с описанием изобретения содержат вариант белка FXa, в котором тяжелая цепь состоит из аминокислот с 146 по 399 аминокислотной последовательности SEQ ID NO: 1. В родственных воплощениях тяжелая цепь дополнительно содержит один гликан ядра-1, который может быть не сиалилирован, моносиалилирован или дисиалилирован, или два гликана ядра-1, каждый из которых может быть независимо не сиалилирован, моносиалилирован или дисиалилирован. Композиции в соответствии с описанием изобретения могут содержать любые варианты белка FXa, описанные в этом абзаце, сами по себе или в комбинации с другими описанными, а также с любыми другими вариантами белка FXa в соответствии с описанием изобретения.
Воплощения в соответствии с описанием изобретения включают варианты белка FXa, в которых С-конец легкой цепи оканчивается по различным аминокислотам вследствие вариабельного расщепления по сайту РАСЕ и в которых С-конец тяжелой цепи также оканчивается по различным аминокислотам. Родственн