Укороченные варианты cd95-f-c
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к слитым белкам домена CD95, и может быть использовано для ингибирования сигнального пути CD95. Получен химерный белок, содержащий функциональный фрагмент укороченного по N-концу внеклеточного домена CD95, непосредственно сшитого с Fc-доменом, где функциональный фрагмент укороченного по N-концу внеклеточного домена CD95 расположен на N-конце Fc-домена или его функционального фрагмента, и где химерный белок лишен дополнительной N-концевой последовательности. Изобретение позволяет получить химерный белок CD95 в стабильной форме и эффективно ингибировать сигнальный путь CD95. 6 н. и 7 з.п. ф-лы, 8 ил., 4 табл., 2 пр.
Реферат
Настоящее изобретение относится к выделенному химерному белку, содержащему внеклеточный домен CD95 или его функциональный фрагмент и Fc-домен или его функциональный фрагмент, к композициям, обеспечивающим такой химерный белок в стабильной форме, а также к способу получения такого химерного белка.
Химерные белки, содержащие внеклеточный домен рецептора смерти CD95 (Аро-1; Fas), сшитый с иммуноглобулиновым Fc-доменом, описаны в РСТ/ЕР04/03239. Однако оказалось, что трудно обеспечить такие химерные белки в достаточном количестве с достаточной стабильностью.
С помощью настоящего изобретения в первый раз стало возможно обеспечение таких композиций и способов.
Согласно первому аспекту изобретение относится к композиции, содержащей смесь изоформ химерного белка, причем каждый химерный белок содержит по меньшей меревнеклеточный домен CD95 (АРО-1; Fas) или его функциональный фрагмент и по меньшей меревторой домен, представляющий собой Fc-домен или его функциональный фрагмент, распределенные в интервале pI от около 4 до около 8,5. Соответственно, внеклеточный домен CD95 при использовании в данном документе может также называться «первый домен», в то время как Fc-домен может называться «второй домен».
Первый белковый домен представляет собой внеклеточный домен CD95, предпочтительно внеклеточный домен млекопитающих, конкретно человеческий белок, т.е. человеческий внеклеточный домен CD95. Первый домен, т.е., внеклеточный домен CD95, химерного белка предпочтительно содержит аминокислотную последовательность до аминокислот 170, 171, 172 или 173 человеческого CD95 (SEQ ID NO. 1). Сигнальный пептид (например, положение 1-25 SEQ ID NO: 1) может или присутствовать или отсутствовать.
Конкретно для терапевтических целей использование человеческого белка является предпочтительным.
Химерный белок может включать один или несколько первых доменов, которые могут быть одинаковыми или отличными. Однако один первый домен, содержащий один внеклеточный домен CD95, является предпочтительным.
Согласно предпочтительному воплощению Fc-домен или его функциональный фрагмент, т.е. второй домен химерного белка согласно изобретению содержит СН2- и/или СН3-домен и необязательно по меньшей мере часть шарнирного участка, домен или модифицированный иммуноглоулиновый домен, выделенный из него.
Иммуноглобулиновый домен может представлять собой домен иммуноглобулина IgG, IgM, IgD или IgE или модифицированный иммуноглобулиновый домен, выделенный из них. Предпочтительно, если второй домен содержит по меньшей меречасть константного домена иммуноглобулина IgG. Домен иммуноглобулина IgG может быть выбран из доменов IgG1, IgG2, IgG3 или IgG4 или из их модифицированных доменов. Предпочтительно, второй домен представляет собой человеческий Fc-домен, такой как IgG Fc-домен, например, человеческий IgGl Fc-домен.
Химерный белок может включать один или несколько вторых доменов, которые могут быть одинаковыми или отличными. Однако один второй домен является предпочтительным, т.е. химерный белок, содержащий один Fc-домен.
Кроме того, предпочтительно, если первый и второй домены будут из одного вида.
Первый домен, т.е. внеклеточный домен CD95 или его функциональный фрагмент может быть локализован на N- или С-конце. Второй домен, т.е. Fc-домен или функциональный фрагмент также может быть локализован на С- или N-конце химерного белка. Однако внеклеточный домен CD95 на N-конце химерного белка является предпочтительным.
Согласно следующему предпочтительному воплощению химерный белок представляет собой APG101 (CD95-Fc, положение 26-400 в SEQ ID NO: 1). Как определено SEQ ID NO: 1 APG101 может быть химерным белком, содержащим человеческий внеклеточный домен CD95 (аминокислоты 26-172) и человеческий IgG1 Fc-домен (аминокислоты 172-400), необязательно дополнительно содержащим N-концевую сигнальную последовательность (например, аминокислоты 1-25 SEQ ID NO: 1). Присутствие сигнального пептида указывает на незрелую форму APG101. В процессе созревания сигнальный пептид отщепляется. Согласно особенно предпочтительному воплощению сигнальная последовательность отщепляется. APG101 с сигнальной последовательностью также охвачен термином «немодифицированный APG101». В следующем воплощении химерный белок представляет собой полипептид, имеющий по меньшей мере70% идентичности, более предпочтительно, 75% идентичности, 80% идентичности, 85% идентичности, 90% идентичности, 95% идентичности, 96% идентичности, 97% идентичности, 98% идентичности, 99% идентичности с APG101. Согласно настоящему применению термин «идентичность» относится к степени, при которой две аминокислотные последовательности являются инвариантными, другими словами, имеют одинаковые аминокислоты в одном и том же положении.
Термин «APG101» описывает химерный белок положения 26-400 SEQ ID NO: 1, содержащий или нет сигнальный пептид. Термин «APG101» также включает химерные белки, содержащие укороченные по N-концу формы внеклеточного домена CD95.
В другом предпочтительном воплощении химерный белок согласно изобретению представляет собой функциональный фрагмент APG101. При использовании в данном документе, термин «фрагмент», как правило, обозначает «функциональный фрагмент», т.е. фрагмент или часть белка дикого типа или полноразмерного белка, который имеет по существу такую же биологическую активность и/или свойства как у соответствующего белка дикого типа или полноразмерного белка.
Специалистам в данной области известны способы конструирования и получения химерных белков согласно настоящему изобретению. Смесь изоформ химерных белков, конкретно изоформ APG101, однако, получают способом, описанным в данном документе ниже. Такие способы описаны, например, в PCT/EP04/03239. Согласно предпочтительному воплощению конструкция химерного белка по настоящему изобретению включает селекцию концевой аминокислоты (аминокислот) первого домена и второго домена с целью создания по меньшей мере одного аминокислотного перекрывания между двумя доменами. Перекрывание между первым и вторым доменом или между двумя первыми доменами имеет длину предпочтительно 1, 2 или 3 аминокислоты. Более предпочтительно, перекрывание имеет длину в одну аминокислоту. Примеры перекрывающихся аминокислот представляют собой S, Е, К, Н, Т, Р и D.
Композиция согласно изобретению содержит смесь белковых изоформ. Термин «изоформа» при использовании в данном документе обозначает различные формы одного и того же белка, такие как различные формы APG101, конкретно APG101 без сигнальной последовательности. Такие изоформы могут отличаться, например, по длине белка, по аминокислотам, т.е. по замене или делеции и/или по посттрансляционной модификации при сравнении с соответствующим немодифицированным белком, т.е. с белком, который транслируется и экспрессируется из данной кодирующей последовательности без какой-либо модификации. Различные изоформы могут быть различены, например, с помощью электрофореза, такого как SDS-электрофорез, и/или изоэлектрическое фокусирование, которое предпочтительно согласно настоящему изобретению.
Изоформы, отличающиеся по длине белка, могут быть, например, удлиненными с N-конца и/или С-конца и/или укорочены по сравнению с соответствующим немодифицированным белком. Например, смесь изоформ APG101 согласно изобретению может включать APG101 в немодифицированной форме, а также его варианты, удлиненные и/или укороченные с N-конца и/или С-конца.
Таким образом, согласно предпочтительному воплощению смесь по изобретению содержит варианты APG101, укороченные с N-конца и/или с С-конца.
Таким образом, согласно предпочтительному воплощению смесь по изобретению содержит варианты APG101, укороченные с N-конца и/или с С-конца.
В частности предпочтительна смесь изоформ химерных белков, содержащая химерные белки, укороченные с N-конца.
Укороченные химерные белки могут включать последовательность SEQ ID NO: 1, укороченную с N-конца на 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45 и/или 50 аминокислот. Предпочтительные укороченные химерные белки имею последовательность SEQ ID NO: 1, укороченную с N-конца на 16,20 или 25 аминокислот.
Такие химерные белки, укороченные с N-конца, также могут быть обозначены в рамках настоящего изобретения и включают укороченные с N-конца варианты немодифицированного APG101, -1, -2, -3, -4, -5, -6, -7, -8, -9, -10, -11, -12, -13, -14, -15, -16, -17, -18, -19, -20, -21, -22, -23, -24, -25, -26, -27, -28, -29, -30, -35, -40, -45 и/или -50. Конкретно предпочтительными являются укороченные с N-конца варианты -17, -21 и/или -26. Нумерация относится к белку APG101, содержащему сигнальную последовательность согласно SEQ ID NO: 1, где номер относится к первой аминокислоте в APG101, укорачиваемом с N-конца.
Это означает, что укороченный химерный белок, имеющий последовательность SEQ ID NO: 1, укороченную с N-конца на 16 аминокислот, соответствует варианту APG101, обозначенному -17, который приводит к получению белка, содержащего аминокислоты 17-400 SEQ ID NO: 1, укороченный с N-конца на 20 аминокислот (аминокислоты 21-400 SEQ ID NO: 1) соответствует -21 и укороченный с N-конца на 25 аминокислот соответствует -26 (аминокислоты 26-400 SEQ ID NO: 1).
Пример для С-концевого укорачивания изоформ APG101 представляет собой С-концевое Lys-обрезание.
Согласно предпочтительному воплощению настоящего изобретения смесь химерных белков композиции согласно настоящему изобретению предпочтительно содержит 50 моль % немодифицированного APG101 по отношению к модифицированным изоформам, более предпочтительно 40 мол. % немодифицированного APG101, более предпочтительно 30 мол. % немодифицированного APG101, более предпочтительно 20 мол. % немодифицированного APG101, более предпочтительно 10 мол. % немодифицированного APG101, более предпочтительно 5 мол. % немодифицированного APG101 и еще более предпочтительно 3 мол. % немодифицированного APG101 и наиболее более предпочтительно 1 мол. % и/или менее немодифицированного APG101. Наиболее предпочтительно воплощение, представляющее собой смесь химерных белков, которые не включают немодифицированный APG101.
Как указано выше, изоформы также могут отличаться аминокислотной заменой, аминокислотной делецией и/или вставкой аминокислот. Такая замена и/или деления может включать одну или несколько аминокислот.Однако замена единственной аминокислоты предпочтительна согласно данному воплощению.
Изоформы согласно изобретению также могут отличаться по части посттрансляционной модификации. Посттрансляционная модификация согласно настоящему изобретению может включать, в частности, добавление гидрофобных групп, конкретно для мембранной локализации, как, например, с использованием миристилирования, пальмитилирования, изопренилирования или глипирования (glypiation), добавление кофакторов для повышенной ферментной активности, как, например, с использованием лиопоилирования, добавление более мелких химических групп, например, с помощью ацилирования, формилирования, алкилирования, метилирования, амидирования по С-концу, добавления аминокислоты, γ-карбоксилирования, гликозилирования, гидроксилирования, окисления, глицилирования, биотинилирования и/или ПЭГилирования.
Согласно настоящему изобретению добавление сиаловых кислот, гликозилирование на основе Fc, конкретно N-концевое гликозилирование на основе Fc, и/или Пиро-Глу-модификация представляют собой предпочтительные воплощения посттрансляционной модификации.
Согласно предпочтительному воплощению химерные белки, содержащиеся в композиции по изобретению, включают высокие количества сиаловых кислот. Согласно настоящему изобретению содержание сиаловой кислоты составляет предпочтительно от около 4 до 7 моль NeuAc/моль APG101, более предпочтительно от 4,5 до 6 моль NeuAc/моль APG101 и наиболее предпочтительно около 5 моль NeuAc/моль APG101. При использовании в данном документе сиаловые кислоты относятся к N- или О-замещенным производным нейраминовой кислоты. Предпочтительная сиаловая кислота представляет собой N-ацетилейраминовую кислоту (NeuAc). Аминогруппа, как правило, несет или ацетильную, или гликолильную группу, но другие модификации также описаны. Гидроксильные заместители могут варьировать в значительной степени. Предпочтительные гидроксильные заместители представляют собой ацетильную группу, лактильную, метильную, сульфатную и/или фосфатную группу. Добавление сиаловой кислоты, как правило, приводит к получению более анионных белков. Результирующий отрицательный заряд придает данной модификации способность изменять поверхностный заряд и способность связывания. Большие количества сиаловой кислоты приводят к лучшей стабильности в сыворотке и, таким образом, к улучшенной фармакокинетике и к более низкой иммуногенности. Высокая степень сиалирования изоформ APG101 по настоящему изобретению может объясняться большим количеством двухантенальных структур. Следует рассматривать как очень удивительный факт тот, что изоформы APG101 в композиции изобретения, полученные с помощью способа по изобретению, демонстрируют такую высокую степень добавления сиаловой кислоты.
Согласно настоящему изобретению гликозилирование означает реакцию, в которой углевод присоединяется к функциональной группе химерного белка, его функциональному фрагменту, как определено в данном документе. Конкретно, это относится к добавлению углевода к APG101 или к его изоформе. Углевод может быть добавлен, например, с помощью N-связывания или О-связывания. N-связанные углеводы присоединяются к азоту боковых цепей аспарагина или аргинина. О-связанные углеводы присоединяются к кислороду гидроксильной группы серина, треонина, тирозина, боковых цепей гидроксилизина или гидроксипролина. Согласно настоящему изобретению N-связывание, конкретно, основанное на Fc N-концевое гликозилирование является предпочтительным. Особенно предпочтительные N-связанные сайты гликозилирования локализованы в положениях N118, N136 и/или N250 APG101 (SEQ ID NO: 1).
Фукозилирование согласно настоящему изобретению относится к добавлению фукозных сахарных единиц к молекуле. Что касается настоящего изобретения, то такое добавление фукозной сахарной единицы к химерному белку и конкретно к APG101 представляет собой особенно предпочтительный тип гликозилирования. Высокая доля фукозилированных форм приводит к пониженной антителозависимой клеточной цитотоксичности (ADCC). Таким образом, смесь изоформ химерных белков характеризуется пониженной ADCC, что полезно для фармацевтических и диагностических применений.
Несмотря на то, что первый и второй домен определены в данном документе, химерные белки согласно изобретению могут включать дополнительные домены, такие как дополнительные домены для нацеливания, например, одноцепочечные антитела или их фрагменты и/или сигнальные домены. Согласно следующему воплощению химерный белок, применяемый согласно изобретению, может включать N-концевую сигнальную последовательность, которая определяет возможность секреции из клетки-хозяина после рекомбинантной экспрессии. Сигнальная последовательность может представлять собой сигнальную последовательность, которая гомологична первому домену химерного белка. В ином случае сигнальная последовательность также может быть гетерологичной сигнальной последовательностью. В другом воплощении химерный белок не содержит добавленную N-концевую последовательность, такую как сигнальный пептид.
Композиция согласно настоящему изобретению может включать блокированные по N-концу химерные белки, которые обеспечивают более высокую стабильность в отношении N-концевой деградации протеазами, а также химерные белки, содержащие свободный N-конец, который обеспечивает более высокую стабильность в отношении N-концевой деградации протеазами.
Модификации, блокирующие N-конец белка, известны специалистам в данной области. Однако предпочтительная посттрансляционная модификация согласно настоящему изобретению, блокирующая N-конец, представляет собой Пиро-Глу-модификацию. Пиро-Глу также называют пирролидон карбоновой кислотной. Пиро-Глу-модификация согласно настоящему изобретению относится к модификации N-концевого глутамина путем циклизации глутамина посредством конденсации α-аминогруппы с карбоксильной группой боковой цепи. Модифицированные белки демонстрируют увеличенный период полужизни. Такая модификация также может осуществляться в остатке глутамата. Особенно предпочтительной модификацией является Пиро-Глу-модификация, т.е. пирролидон карбоновая кислота в отношении укороченного белка -26 с N-конца.
В предпочтительном воплощении настоящего применения композиция согласно настоящему изобретению содержит 80-99 мол. % блокированных по N-концу химерных белков и/или 1-20 мол. % химерных белков, содержащих свободный N-конец.
Согласно следующему предпочтительному воплощению композиция содержит 0-5 мол. %, более предпочтительно 0-3 мол. % и еще более предпочтительно 0-1 мол. %, высокомолекулярных форм химерного белка, таких как агрегаты. В предпочтительном воплощении композиция согласно настоящему изобретению не содержит никаких агрегатов изоформ химерного белка, конкретно никаких димеров или агрегатов APG101. Димеры или агрегаты, как правило, нежелательны, так как они оказывают негативное влияние на растворимость.
Функциональная форма APG101 включает два химерных белка, как описано в данном документе, связанных дисульфидными мостиками в шарнирном участке в положениях 179 и/или 182 относительно SEQ ID NO: 1 двух молекул (см. Фигура 7). Дисульфидный мостик также может быть образован в двух молекулах в положении 173 относительно SEQ ID NO: 1, что приводит к повышенной стабильности. Если дисульфидный мостик в положении 173 относительно SEQ ID NO: 1 не требуется, остаток Cys в данном положении может быть замещен другой аминокислотой или может быть удален.
В предпочтительном воплощении смесь согласно изобретению обеспечивается с помощью способа согласно настоящему изобретению, описанному в данном документе.
Согласно изобретению смесь изоформ химерных белков распределена в интервале от около 4 до около 8,5. В следующем воплощении интервал pI смеси изоформ химерных белков, включенных в композицию согласно изобретению, составляет от около 4,5 до около 7,8, более предпочтительно от около 5 до около 7,5.
Изоэлектрическая точка (pi) определяется значением рН, при котором конкретная молекула или поверхность не несет электрического заряда. В зависимости от интервала рН окружающей среды аминокислоты белка могут нести различные положительные или отрицательные заряды. Сумма всех зарядов белка равна нулю в определенном интервале рН, в его изоэлектрической точке, т.е. в его значении pI. Если белковая молекула в электрическом поле достигает точки среды, имеющей данное рН, то его электрофоретическая подвижность ослабевает и она остается в данном месте. Специалисту в данной области знакомы способы определения значения pI данного белка, такие как изоэлектрическое фокусирование. Метод имеет исключительно высокое разрешение. Белки, отличающиеся на один заряд, могут быть разделены и/или фракционированы.
Композиция согласно настоящему изобретению, описанная в данном документе, может использоваться для фармацевтических, диагностических и/или исследовательских применений. Она может применяться в области медицины людей, а также в ветеринарной медицине.
Другой аспект настоящего изобретения относится к составу, содержащему композицию согласно изобретению.
Согласно предпочтительному воплощению состав содержит
(a) фосфат, предпочтительно от около 20 мМ до около 100 мМ фосфата, более предпочтительно от около 30 мМ до около 70 мМ фосфата, еще более предпочтительно от около 40 мМ до около 60 мМ фосфата, наиболее предпочтительно от около 50 мМ фосфата,
(b) агент, усиливающий вязкость, предпочтительно около 0,1-10 масс. % агента, усиливающего вязкость, более предпочтительно 1-8 масс. % агента, усиливающего вязкость, более предпочтительно от около 3 масс. % до около 7 масс. % агента, усиливающего вязкость, еще более предпочтительно от около 6 масс. % до около 7 масс. % агента, усиливающего вязкость, и наиболее предпочтительно около 5 масс. % агента, усиливающего вязкость, и
(c) имеет значение рН в интервале 4-8.
Агенты, усиливающие вязкость, хорошо известны специалисту в данной области и включают альгиновую кислоту, карбоксиметилцеллюлозу, декстрин, желатин, гуаровую камедь, гидроксиэтилцеллюлозу, алюмосиликат магния, поливиниловый спирт, полиэтиленоксид, диоксид кремния, крахмал, ксантановую камедь и т.д. Однако агент, усиливающий вязкость, который особенно предпочтителен согласно настоящему изобретению, является сорбитом.
Неожиданно оказалось, что композиция по изобретению, предлагаемая в данном типе состава, является очень стабильной и не имеет тенденции к образованию агрегатов. Кроме того, возможно обеспечить высокую концентрацию белка, например, около 20 мг/мл в стабильной форме.
Композиция и состав согласно изобретению может вводиться нуждающемуся в этом объекту, конкретно, пациенту-человеку в дозе, достаточной для лечения определенных патологических состояний с помощью подходящих средств. Например, композиция и/или состав согласно изобретению может быть составлена в виде фармацевтической композиции вместе с фармацевтически приемлемыми носителями, разбавителями и/или адъювантами. Терапевтическая эффективность и токсичность может определяться согласно стандартным протоколам. Фармацевтическая композиция может вводиться системно, например, внутрибрюшинно, внутримышечно или внутривенно, или локально, как например, внутриназально, подкожно или внутриболочечно. Доза композиции и/или состава, которая будет вводиться, конечно будет зависеть от объекта, подвергаемого лечению и от патологического состояния объекта, таких как вес объекта, возраст объекта и тип и тяжесть заболевания или нарушения, подвергаемого лечению, способа введения и предписания врача. Например, суточная доза 0,001-100 мг/кг является подходящей.
Другой аспект настоящего изобретения относится к фармацевтической композиции или составу, содержащему композицию или состав согласно изобретению, которые содержат по меньшей мере один активный дополнительный агент. Этот дополнительный активный агент используется в зависимости от симптома, подвергаемого лечению. Например, цитотоксические агенты, такие как доксорубицин, цисплатин или карбоплатин, цитокины или другие антинеопластические агенты, могут использоваться в лечении злокачественного новообразования.
Состав и/или композиция согласно изобретению могут дополнительно включать фармацевтически приемлемые носители, разбавители и/или адъюванты. Термин «носитель» при использовании в данном документе, включает носители, вспомогательные вещества и/или стабилизаторы, которые не токсичны по отношению к клетке или к млекопитающему, экспонированному их воздействию при применяемых дозировках и концентрациях. Часто физиологически приемлемые носители представлены в водных растворах, содержащих буфер с определенным рН или в липосомах. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и органические кислоты (однако по отношению к составу по настоящему изобретению фосфатный буфер является предпочтительным); антиоксиданты, содержащие аскорбиновую кислоту, низкомолекулярные (менее чем 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, содержащие глюкозу, маннозу или декстрины, желирующие агенты, такие как EDTA, сахар, спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно активные вещества, такие как TWEEN, полиэтилен или полиэтиленгликоль.
Согласно предпочтительному воплощению композиция и/или состав согласно изобретению может использоваться для ингибирования сигнального пути CD95, конкретно, внешнего апоптотического пути, запускаемого CD95L, т.е. лигандом рецептора CD95. Конкретно, композиция может использоваться в профилактике и/или в лечении расстройств, выбранных из аутоиммунных расстройств, ВИЧ, сердечных расстройств, например инфаркта миокарда, расстройств трансплантат-против-хозяина, отторжения трансплантата, нарушений мозга, например инсульта, поражений спинного мозга, сепсиса, гепатита, расстройств, ассоциированных с воспалением, ишемического реперфузионного повреждения и почечных расстройств. Конечно, композиция и/или состав, описанный в данном документе, может использоваться для лечения злокачественных новообразований, предпочтительно солидных злокачественных опухолей, например, злокачественных новообразований мозга, например, глиобластомы. В ином случае, злокачественное новообразование, подвергаемое лечению, может представлять собой злокачественное новообразование, имеющее лимфоидное или миелоидное происхождение.
Другой аспект настоящего изобретения относится к способу получения композиции согласно изобретению. Согласно предпочтительному воплощению способ включает стадии:
(a) продуцирования композиции, предлагаемой настоящим изобретением, с помощью периодического процесса с добавлением субстрата, обеспечивающего получение культуры клеток, и
(b) выделения композиции по настоящему изобретению из культуры клеток.
Другое преимущество способа по настоящему изобретению по сравнению со способами, известными в данной области, представляет собой его высокий выход.
Стадия (а), т.е. «способ получения композиции согласно настоящему изобретению с помощью периодического процесса с добавлением субстрата, обеспечивающего получение культуры клеток» также будет обозначаться далее как «начальный процесс (USP)». Способ согласно стадии (а) настоящего изобретения также обозначается как «USP по изобретению». На Фигуре 1 представлена композиция начального процесса согласно данным, известным в данной области, и предпочтительное воплощение начального процесса настоящего изобретения.
Стадия (b), т.е. «выделение композиции по настоящему изобретению из культуры клеток» также будет обозначаться далее как «процесс последующей обработки (DSP)».
Предпочтительно, если стадия (а) включает серии стадий культивирования данного базового клеточного бульона до тех пор, пока не будут достигнуты соответствующие параметры культуры, с последующей седиментацией клеток и фильтрацией надосадочной жидкости, содержащей химерный белок. В предпочтительном воплощении настоящего изобретения стадии способа начального процесса могут суммироваться как серии, включающие следующие стадии.
Оттаивание,
субкультивирование,
50 л биореактор,
200 л биореактор,
1000 л биореактор,
осаждение,
глубинная фильтрация и
0,2 μм фильтрация.
Конечно, проведение стадий культивирования от субкультивирования до 1000 л биореактора представляет собой только один из путей осуществления изобретения. Например, стадии культивирования могут также проводиться в биореакторах с варьирующимися размерами. Конечно, во время серий стадий субкультивирования специалист в данной области может определить подходящие параметры типа температуры, времени роста, среды и т.д. Критическим фактором является достижение соответствующих параметров клеточной культуры, которые могут представлять собой титр, клеточную плотность, причем титр предпочтительно находится в интервале 0,5 г/л -5 г/л, более предпочтительно 1 г/л - 3 г/л, более предпочтительно 1,5 г/л - 5 г/л и наиболее предпочтительно 1,8 г/л - 2 г/л. Примеры предпочтительных значений клеточной плотности оставляют от около 1×106 до 1×108 клеток/мл, предпочтительно около 1×107 клеток/мл. В особенно предпочтительном воплощении настоящего изобретения титр составляет от около 1,8 г/л до около 2 г/л, и клеточная плотность составляет около 1×107 клеток/мл.
Способ согласно настоящему изобретению предпочтительно проводят в пептон-содержащей базальной среде и в среде с определенным химическим составом.
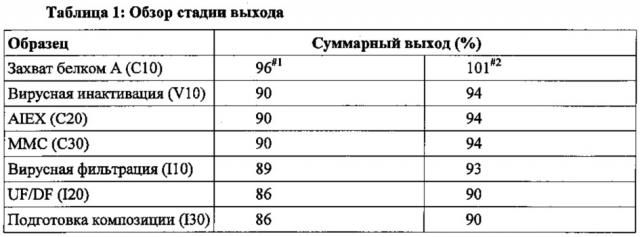
Стадия (b) может включать захватывающую хроматографию, вирусную инактивацию, серии анионной и/или катионной хроматографии, вирусную фильтрацию и/или доведение до конечной искомой концентрации белка.
Процесс последующей обработки предусматривает очистку композиции, содержащей изоформы APG101, полученные с помощью стадии (а) согласно стадии (b), определенной выше, и включает стадии хроматографии, стадию вирусной инактивации, стадию ультрафильтрации, стадию диафильтрации и стадию вирусной фильтрации. Согласно предпочтительному воплощению данный процесс последующей обработки включает три различные хроматографические стадии. Первую хроматографическую стадию проводят со смолой для захвата белка-мишени и/или для удаления ассоциированных с процессом примесей (например, НСР, ДНК) и/или для уменьшения объема фракции, содержащей продукт. Соответствующая смола может быть выбрана специалистом в данной области. Примером смолы является «Mab Select SuRE», которая также представляет собой предпочтительное воплощение согласно изобретению.
После данной первой хроматографической стадии следует стадия вирусной инактивации. Предпочтительно данную стадию вирусной инактивации осуществляют в кислых условиях (например, рН 3,5±0,2) с последующей обработкой пула инактивации или при менее кислых значениях рН 5. Буферный матрикс для вирусной инактивации и последующее доведение до рН 5 может быть основано исключительно на 20 нМ Na-цитратном буфере.
После данной стадии вирусной инактивации проводят стадию ионообменной хроматографии с целью уменьшения ассоциированных с процессом загрязнений, таких как ДНК. Согласно настоящему изобретению осуществляют стадию анионообменной хроматографии (AIEX), в частности проточным способом. Белок-мишень пропускается через колонку AIEX, при этом ДНК связывается со смолой. Предпочтительно, если проточный пул AIEX затем обрабатывается без обработки с использованием дополнительной колоночной стадии. Эта необязательная дополнительная стадия способствует общему снижению вирусной контаминации и остаточных НСР, ДНК и обесцвеченного лиганда белка-А. Согласно предпочтительному воплощению используется колонка, набитая смолой смешанного типа capto-MMC, в режиме связывания/элюирования.
Элюат пропускается через вирусный фильтр (VF) и затем применяется в стадии ультрафильтрации (UF/DF). Согласно изобретению в стадии вирусной фильтрации может быть получена конкретная волюметрическая нагрузка ≤100 л/м2. Предпочтительно используется мембрана с порогом около 30 кДа. Конечно, единственная стадия очистки, описанная выше, может быть заменена на стадии, известные специалистам в данной области, с достижением такого же или сравнимого эффекта.
Наконец, получают ультраконцентрат UF/DF, и концентрацию композиции APG101 согласно настоящему изобретению доводят до желаемой концентрации белка, такой как 20±2 мг/мл.
На Фигуре 2 представлена блок-схема предпочтительного воплощения процесса последующей обработки согласно настоящему изобретению. Как можно понять из Фигуры 3, процесс последующей обработки по изобретению характеризуется рядом преимуществ по отношению к процессам последующей обработки, известным в данной области. Например, после вирусной инактивации не требуется стадия выдержки при нейтральном значении рН. Что касается стадии вирусной фильтрации, то возможна волюметрическая нагрузка ≤100 л/м2 по сравнению с нагрузкой 37 г/м2, известной в данной области. Кроме того, использование буферного состава по настоящему изобретению позволяет достичь высокие белковые концентрации, такие как 20 мг/мл, по сравнению с 10 мг/мл в PBS.
Способ получения композиции согласно настоящему изобретению, который описан в данном документе, приводит к получению изоформ APG101 в интервале pI 4-8,5. Предлагаемая таким образом композиция содержит только очень маленькие количества нежелательных высокомолекулярных форм, таких как димеры или агрегаты. Полученные таким образом изоформы APG101 характеризуются большими количествами сиаловых кислот, а также N-концевым гликозилированием Fc, содержащим высокие количества фукозилированных форм.
Другой аспект настоящего изобретения представляет собой химерный белок, содержащий по меньшей меревнеклеточный домен CD95 или его функциональный фрагмент, и по меньшей мереFc-домен или его функциональный фрагмент.
Внеклеточный домен CD95 может представлять собой человеческий внеклеточный домен CD95. Внеклеточный домен CD95 может включать SEQ ID NO: 7 и последовательности, имеющие по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 97% идентичности с SEQ ID NO: 7.
В химерном белке согласно настоящему изобретению дисульфидные мостики могут присутствовать в домене CD95 или в его функциональном фрагменте, связывая положения 34 и 48, 38-57, 60 и 76, 79 и 94, 82 и 102, 104 и 118, 110 и 115,121 и 132, и/или 124 и 140 относительно SEQ ID NO: 7. Предпочтительный химерный белок содержит дисульфидный мостик в положении ПО -115 относительно SEQ ID NO: 7. Дисульфидный мостик также может присутствовать в Fc-домене или в его функциональном фрагменте, связывая положение 43 и 103 и/или положение 149 и 207 относительно SEQ ID NO: 8.
Предполагается, что ссылка на конкретное положение в SEQ ID NO: 7 или SEQ ID NO: 8 включает ссылку на соответствующие положения в SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, или SEQ ID NO: 19, если это применимо. Например, дисульфидный мостик в положении 104 и 118 относительно SEQ ID NO: 7 соответствует дисульфидному мостику в положении 129- 143 относительно SEQ ID NO: 1.
В настоящем изобретении неожиданно обнаружили, что в химерном белке при N-концевом укорачивании внеклеточного домена CD95, содержащего до 33 аминокислот в SEQ ID NO: 7, стабильность не уменьшается по сравнению с полноразмерным APG101. Например, химерные белки SEQ ID NO: 3, SEQ ID NO: 4,SEQ ID NO: 5, и SEQ ID NO: 6 обеспечивают стабильность, которая по меньшей мересоответствует стабильности полноразмерного белка APG101 (Пример 2). Таким образом, другой аспект настоящего изобретения представляет собой химерный белок, содержащий функциональный фрагмент внеклеточного домена CD95 из SEQ ID NO: 7, укороченного до положения 33. В химерном белке функциональный фрагмент внеклеточного домена CD95 может включать SEQ ГО NO: 7, укороченную вплоть до 33 аминокислот, расположенных на N-конце. В химерном белке настоящего изобретения функциональный фрагмент внеклеточного домена CD95 может включать аминокислотную последовательность, где 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, или 33 N-концевые аминокислоты удалены в SEQ ID NO: 7.
В предпочтительном аспекте во внеклеточном домене CD95 удалены 13 N-концевых аминокислот (SEQ ID NO: 3).
В другом предпочтительном аспекте во внеклеточном домене CD95 удалены 14 N-концевых аминокислот (SEQ ID NO: 4).
Еще в одном предпочтительном аспекте во внеклеточном домене CD95 удалены 29 N-концевых аминокислот (SEQ ID NO: 5).
Еще в одном предпочтительном аспекте во внеклеточном домене CD95 удалены 31 N-концевая аминокислота (SEQ ID NO: 6).
В следующем аспекте химерный белок по настоящему изобретению может включать функциональный фрагмент, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, и последовательностей, имеющих по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 97% идентичности с SEQ ID NO: 9, SEQ ID NO: 10, SEQ ГО NO: 11 или SEQ ID NO: 12. Конкретно, химерный белок может включать функциональный фрагмент внеклеточного домена CD95, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12.
В химерном белке согласно настоящему изобретению по меньшей мереFc-домен может представлять собой человеческий Fc-домен. Подходящие Fc-домены и Fc-фрагменты описаны в данном документе. В частности, по меньшей мере Fc-домен может включать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и последовательностей, имеющих по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 97% идентичности с SEQ ID NO: 8.
Химерный белок согласно настоящему изобретению может быть свободен от сигнального пептида, поскольку сигнальный пептид, присутствующий в незрелом продукте экспрессии, будет отщепляться в процессе созревания.