Способ подготовки шахтных вод для выделения днк
Иллюстрации
Показать всеИзобретение относится к микробиологии. Способ подготовки шахтных вод для выделения ДНК предусматривает фильтрацию проб кислой шахтной воды через нитрозоцеллюлозный фильтр, трехкратную промывку осадка оксалатом аммония и осаждение отмытых клеток центрифугированием в течение 20 мин. Изобретение позволяет подготовить образцы биомассы для последующего выделения с помощью стандартных наборов реагентов образцов ДНК необходимого качества для проведения молекулярно-биологического анализа. 2 табл., 1 пр.
Реферат
Изобретение относится к микробиологии и представляет собой способ подготовки воды и осадков кислых шахтных дренажей для выделения ДНК для последующего молекулярно-биологического анализа. Высокую эффективность выделения ДНК предлагается достичь путем сбора клеток микроорганизмов с помощью фильтрации и промывки оксалатом аммония. Данный способ может быть использован для получения образцов ДНК с целью проведения молекулярно-биологического анализа микробных сообществ кислых сточных вод и осадков для выявления штаммов, перспективных для использования в различных биотехнологических процессах.
Кислые шахтные дренажные воды содержат высокие концентрации тяжелых металлов, характеризуются низкими значениями рН и относительно невысокой численностью микроорганизмов. Все это в совокупности затрудняет выделение ДНК в достаточном количестве для проведения молекулярно-биологических исследований, так как делает невозможным получение препаратов ДНК надлежащего качества. При этом молекулярно-биологические анализы микробных сообществ кислых дренажей являются необходимым этапом исследований, направленных на выделение перспективных для использования в биотехнологиях излечения металлов из сульфидного сырья и очистки кислых сточных вод от сульфатов и тяжелых металлов штаммов микроорганизмов.
Известен способ подготовки проб осадков кислых дренажей угольных шахт для последующего выделения ДНК для молекулярно-биологических исследований (CN 101648985). Для подготовки проб предлагается добавление к пробе осадка раствора ПАВ (Tween 40 или 80) в фосфатном буфере, обработку ультразвуком, чтобы перевести клетки в супернатант, и последующее его фильтрование для сбора клеток из жидкой фазы. Осажденную на мембранном фильтре предлагается использовать для выделения ДНК. Недостатком способа является необходимость использования специального оборудования для обработки ультразвуком.
В статье (Zeng et al., 2008) предложен способ подготовки проб биомассы ацидофильных микроорганизмов для последующего выделения ДНК, т.к. применение стандартных коммерческих наборов для выделения ДНК из проб кислых сточных вод не давало удовлетворительных результатов: клетки ацидофильных микроорганизмов, осажденных центрифугированием, промывали три раза PBS с высоким содержанием хлорида натрия (PBS; 300 mM NaCl, 2.7 mM KСl, 10 mM Na2HPO4, 1.7 mM NaH2PO4), затем ресуспендировали в буфере для лизиса клеток (EDTA: рН 8.0, 0.5М, 50 ml; NaCl: 5М, 5 ml; SDS: 20%, 25 ml; Cetyltrimethylammoniumbromide (СТАВ): 1 %) и инкубировали в кипящей воде 6 мин и по 30 мин при 60°С и 72°С, затем выделяли ДНК фенол-хлороформным методом. Недостатком способа является необходимость длительной инкубации биомассы при высоких температурах.
В статье (Zammit et al., 2011) был предложен способ для выделения ДНК ацидофильных микроорганизмов, выращенных на средах с двухвалентным железом и нерастворимыми субстратами (элементарной серой и пиритом). Клетки с поверхности пирита удаляли с помощью обработки 1% Tween 20, затем пирит осаждали центрифугированием при 3000 g в течение 3 с. Аналогично удаляли из среды элементарную серу и осадки гидроксида железа, затем клетки собирали из супернатанта центрифугированием при 20000 g. Клетки разрушали комбинацией ферментативного лизиса и механического разрушения, ДНК извлекали с помощью раствора полиэтиленгликоля (30 % PEG 8000/1.6 М NaCl) в течение 16 часов. Недостатками способа являются сложная процедура разрушения клеток, требующая комбинации различных методов, и большая продолжительность.
Наиболее близким по сущности и достигаемому результату к заявленному изобретению является способ выделения ДНК ацидофильных микроорганизмов из пульпы реактора биовыщелачивания с рН 1.8-2.0 (CN 1990864), который для достижения высокой эффективности выделения ДНК предполагает проведение следующих операций:
(1) осаждения клеток центрифугированием;
(2) двукратная промывка 0.02 М серной кислотой;
(3) ресуспендирование в нейтральном STE буфере (сахароза 10%, Tris ⋅ НСl 50 mM, EDTA 10 mM, NaCl 100 mM, pH 8.0), чтобы избежать разрушения ДНК при лизисе клеток;
(4) лизис клеток путем добавления к суспензии лизоцима, SDS и протеиназы К, экстракцию ДНК с помощью хлороформа.
Недостатком способа является промывка 0.02 М серной кислотой, что может не позволить полностью удалить осадки соединений железа из биомассы, так как они стабильны в разбавленных сернокислых растворах и могут ингибировать реагенты, предназначенные для лизиса клеток и выделения нуклеиновых кислот.
Задачей настоящего изобретения является разработка способа подготовки воды и осадков кислых шахтных дренажей для молекулярно-биологического анализа с целью повышения качества и количества выделенной ДНК, что должно обеспечить высокую достоверность и точность результатов последующего молекулярно-биологического анализа.
Техническим результатом при осуществлении заявленного способа является получение достаточного количества и качества образцов ДНК из кислых шахтных дренажей для молекулярно-биологического анализа.
Поставленная задача решается тем, что способ подготовки воды и осадков кислых шахтных дренажей для молекулярно-биологического анализа включает следующую последовательность манипуляций:
(1) фильтрование проб кислой шахтной воды через нитроцеллюлозный фильтр для сбора клеток;
(2) промывку оксалатом аммония (рН 5.0), который способствует переводу железа из твердой фазы в жидкую, что благоприятствует отделению клеток от микрочастиц породы с клетками с фильтра, оксалат аммония благодаря способности образовывать растворимые комплексы эффективно растворяет осадки соединений железа при относительно небольшой концентрации;
(3) осаждение при помощи центрифугирования.
Полученный осадок используется для выделения ДНК с помощью стандартных реагентов и последующего молекулярно-биологического анализа.
Предложенный способ можно применять для выделения ДНК из кислых шахтных дренажных вод, а также других жидких отходов горно-рудной промышленности с последующим молекулярно-биологическим анализом.
Пример осуществления изобретения приведен ниже.
Пример 1.
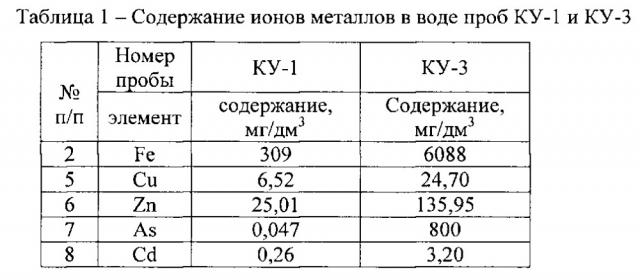
Для анализа были взяты пробы кислой шахтной воды из отходов добычи золота месторождений «Центральный» (проба КУ1, рН 2,85) и «Комсомольский» (проба КУ3, рН 2,29) Кемеровской области, содержащие высокие концентрации металлов (Таблица 1).
Предварительно проводили фильтрование проб кислой шахтной воды с помощью системы Sartorius (Германия) через нитроцеллюлозный фильтр для сбора клеток. Далее фильтр промывали оксалатом аммония (рН 5.0) 3 раза по 30 минут при температуре 30°С и осаждали отмытые клетки с помощью центрифугирования (20 минут, 4000 об/мин, 4°С). Полученный осадок с клетками использовали для выделения ДНК.
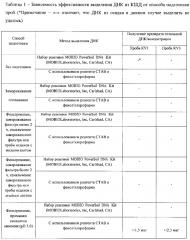
Кроме того, были использованы другие стандартные методы подготовки осадков для выделения ДНК (Таблица 2).
Далее из проб, подготовленных описанными в Таблице 2 способами, проводили выделение ДНК с помощью двух разных методов. В качестве первого метода использовали набор реактивов MOBIO PowerSoil DNA Kit (MOBIOLaboratories, Inc, Carlsbad, CA) в строгом соответствии с инструкцией производителя (https://mobio.com/media/wysiwyg/pdfs/protocols/12888.pdf). Второй метод выделения ДНК заключался в использовании реагента СТАВ (ЦТАБ-цетилтриметиламмонийбромид) и фенол/хлороформа. Для этого ресуспендировали клетки на фильтре в ТЕ-буфере (10 мМ Tris; 1 мМ EDTA, рН 8,0) и лизировали с помощью лизоцима, SDS и протеиназы К. Далее ДНК очищали с помощью 5М NaCl и CTAB/NaCl, промывки в смеси фенол : хлороформ : изоамиловый спирт и осаждали с этанолом. Концентрацию ДНК в полученных препаратах измеряли спектрофотометрически.
Как видно из представленных данных, ДНК удалось выделить только при использовании способа, предлагаемого в качестве изобретения.
Предлагаемый способ подготовки проб позволил выделить с помощью реагента СТАВ и фенол/хлороформа 1,5 мкг и 2,3 мкг ДНК из пробы КУ-1 и КУ-3 соответственно. Другие способы подготовки осадков не позволили выделить ДНК ни одним из использованных методов.
СПИСОК ЛИТЕРАТУРЫ
1. Patent CN 101648985, С07Н 21/04, 2010.
2. Patent CN 1990864, C12N 15/10, C22B 3/18, 2007.
3. Zammit С.М., Mutch L.A., Watling H.R., Watkin E.L.J. The recovery of nucleic acid from biomining and acid mine drainage microorganisms. Hydrometallurgy. 2011. Volume 108, Issues 1-2, P. 87-92.
4. Zeng L., Huang J., Zhang Y., Qiu G., Tong J., Chen D., Zhou J., Luo X. An effective method of DNA extraction for bioleaching bacteria from acid mine drainage. Applied Microbiology and Biotechnology. 2008. V. 79. P. 881.
Способ подготовки биомассы микроорганизмов из осадков шахтных вод для выделения ДНК, включающий фильтрование проб кислой шахтной воды через нитроцеллюлозный фильтр для сбора осадков, содержащих клетки микроорганизмов, трехкратную промывку собранного осадка раствором оксалата аммония, рН 5,0, и осаждение отмытых клеток с помощью центрифугирования при 4000 об/мин и 4°С в течение 20 минут.