Способ получения антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка her2/neu, в растении, антитело, полученное этим способом, и его применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к рекомбинантным экспрессионным неамплифицирующимся векторам, рекомбинантным вирусным амплифицирующимся векторам на основе Х-вируса картофеля и рекомбинантным вирусным амплифицирующимся векторам на основе вируса табачной мозаики крестоцветных, предназначенных для получения в клетках растения легкой и тяжелой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu. Изобретение также предусматривает способ получения антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, в растении, антитело, специфически связывающее домен димеризации экзоклеточной части онкобелка HER2/neu, полученное предложенным способом, и его применение в качестве терапевтического агента для лечения HER2/neu-позитивного рака молочной железы. Заявленное изобретение позволяет получить антитело, специфически связывающее домен димеризации экзоклеточной части онкобелка HER2/neu, в растении наиболее эффективно. 8 н. и 20 з.п. ф-лы, 9 ил., 3 табл., 8 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии, генной инженерии и медицине и может быть использовано для создания растений - суперпродуцентов антител, в частности против HER2/neu-позитивных раковых клеток. Настоящее изобретение может быть использовано для диагностики и лечения рака молочной железы.
Предшествующий уровень техники
Каждый год рак молочной железы (РМЖ) убивает больше чем 500000 женщин во всем мире (WHO Position Paper on Mammography Screening, 2014). Примерно у 30% больных РМЖ, так называемых HER2-позитивных и наиболее опасных форм рака, наблюдается суперпродукция онкобелка HER2 (от Human Epidermal growth factor Receptor 2), представляющего собой трансмембранную тирозиновую протеинкиназу ErbB2 с мол. массой 185 кДа. Аномальная активность HER2 вызывает ускоренное метастазирование и устойчивость к терапевтическому воздействию (Ahmed et al., 2015). Успех в лечении РМЖ связан с тем, что несколько лет назад в медицинскую практику был введен трастузумаб, созданный фирмой Дженентек (Genentech, США) и производимый фирмой Хоффман-Ля Рош (Hoffman La Roche, Швейцария). Это лекарство создано на основе гуманизированных моноклональных антител (MA) (huMab4D5-8 или rhuMabHer2), производимых мышиной гибридомой АТСС CRL-10463 из коллекции штаммов микроорганизмов и клеточных культур США (Hudziak et al., 1989) (Harries and Smith, 2002). Антитело, введенное в кровоток пациента, взаимодействует с внеклеточный частью HER2/neu и угнетает деление раковых клеток, редко сопровождающееся разрушением раковых клеток. В комбинации с химиотерапией антитела huMab4D5-8 оказывают выраженный лечебный эффект (Hudis, 2007). Показано, что использование трастузумаба снижает риск развития отдаленных метастазов и увеличивает продолжительность жизни пациентов (Hudis, 2007). Однако способ лечения трастузумабом имеет ряд недостатков. Обычно MA получают в культуре животных клеток, а это чаще всего опухолевые клетки яичника китайского хомячка (Chinese hamster ovary, СНО). Вообще, продукция белка в животных клетках сопряжена с риском контаминации продуктами и патогенами животного происхождения, такие как ретровирусы и прионы. Другим существенным недостатком является высокая стоимость MA, которая включает инновационные издержки, а также затраты на оборудование, систему поддержания стерильности, а также системы сертификации и контроля сред, использующих продукты животного происхождения и увеличивающих риск загрязнения препарата MA прионами и вирусами. Этим объясняется высокая стоимость лечения HER2/neu-позитивного РМЖ с использованием MA. Она составляет не менее 70000 долларов США для лечения РМЖ с применением трастузумаба (Fleck, 2006)(Macedo et al., 2010).
Растение - это источник дешевого белка, имеющий ряд преимуществ по сравнению с клетками млекопитающих при использовании для продукции фармацевтических белков. Растения как «фабрики» (а) не содержат патогенных для человека вирусов и прионов, и (б) не требуют применения дорогостоящей аппаратуры (например, ферментеров), культуральных сред и поддержания стерильности. Стоимость выращивания исходных опытных растений несравнимо ниже стоимости культивирования клеток бактерий, дрожжей или животных. Технология «временной» продукции (transient expression) белков в растении позволяет наработать чужеродный белок в количестве, достигающем 10%-30% от общего растворимого белка растения в короткое время (5-10 дней) (Komarova et al., 2010). Эта система успешно используется для продукции антираковых антител (Giritch et al., 2006). При использовании способа, когда целевой ген включается в бинарный вектор с последующей доставкой его в клетки инфицируемого растения методом агроинокуляции или агроинфильтрации, удалось получить в растении MA против онкогена HER2/neu, получившее название фитотрастузумаб (Komarova et al., 2011). У трастузумаба помимо высокой цены есть еще один недостаток, это появление при лечении РМЖ устойчивых к нему клеточных форм (Peake and Nahta, 2014). Одним из способов преодоления этой проблемы является создание антитела, способного узнавать другой, отличный от сайта узнавания трастузумабом, участок экзоклеточной части HER2 (Hu et al., 2014, p. 2) (Rimawi et al., 2015). Если трастузумаб взаимодействует с IV субдоменом (аминокислоты с 480 по 620), то поступивший недавно в клиническую практику пертузумаб, взаимодействуя со II субдоменом димеризации (аминокислоты с 165 по 310), блокирует димеризацию HER2 и HER3 (Barthélémy et al., 2014). Поскольку пертузумаб и трастузумаб блокируют HER2 в разных участках, то совместное использование этих антител приводит к синергидному эффекту (Kawajiri et al., 2015). Кроме того, использование пертузумаба дает возможность лечения форм рака, резистентных к трастузумабу (Chung and Lam, 2013) (Rimawi et al., 2015).
Однако продукция пертузумаба имеет все те отмеченные выше недостатки, что и продукция трастузумаба.
Настоящее изобретения направлено на преодоление недостатков, присущих трастузумабу, фитотрастузумабу и пертузумабу, известным из уровня техники, путем продукции в клетке растения антитела, специфически, связывающего домен димеризации экзоклеточной части онкобелка HER2/neu.
Краткое описание изобретения
Первый аспект настоящего изобретения предусматривает рекомбинантный экспрессионный неамплифицирующийся вектор для получения в клетках растения легкой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, нуклеотидную последовательность SEQ ID NO: 1, кодирующую аминокислотную последовательность SEQ ID NO: 3, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и легкой цепи антитела, и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Второй аспект настоящего изобретения предусматривает рекомбинантный экспрессионный вирусный амплифицирующийся вектор для получения в клетках растения легкой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, 5'-нетранслирумый участок генома Х-вируса картофеля, ген полимеразы Х-вируса картофеля, второй промотор субгеномной РНК Х-вируса картофеля, нуклеотидную последовательность SEQ ID NO: 1, кодирующую аминокислотную последовательность SEQ ID NO: 3, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и легкой цепь антитела, 3'-нетранслируемый участок генома Х-вируса картофеля и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Третий аспект настоящего изобретения предусматривает рекомбинантный экспрессионный вирусный амплифицирующийся вектор для получения в клетках растения легкой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, 5'-нетранслирумый участок генома вируса табачной мозаики крестоцветных, ген полимеразы вируса табачной мозаики крестоцветных, включающий первый промотор субгеномной РНК вируса табачной мозаики крестоцветных, ген транспортного белка, включающий второй промотор субгеномной РНК вируса табачной мозаики крестоцветных, нуклеотидную последовательность SEQ ID NO: 1, кодирующую аминокислотную последовательность SEQ ID NO: 3, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и легкой цепи антитела, 3'-нетранслируемый участок генома вируса табачной мозаики крестоцветных и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор гена актин 2 Arabidopsis thaliana и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Четвертый аспект настоящего изобретения предусматривает рекомбинантный экспрессионный неамплифицирующийся вектор для получения в клетках растения тяжелой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, нуклеотидную последовательность SEQ ID NO: 2, кодирующую аминокислотную последовательность SEQ ID NO: 4, состоящую сигнального пептида, обеспечивающего секрецию антитела, и тяжелой цепи антитела, и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Пятый аспект настоящего изобретения предусматривает рекомбинантный экспрессионный вирусный амплифицирующийся вектор для получения в клетках растения тяжелой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, 5'-нетранслирумый участок генома Х-вируса картофеля, ген полимеразы Х-вируса картофеля, второй промотор субгеномной РНК Х-вируса картофеля, нуклеотидную последовательность SEQ ID NO: 2, кодирующую аминокислотную последовательность SEQ ID NO: 4, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и тяжелой цепи антитела, 3'-нетранслируемый участок генома Х-вируса картофеля и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Шестой аспект настоящего изобретения предусматривает рекомбинантный вирусный амплифицирующийся вектор для получения в клетках растения тяжелой цепи антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, содержащий последовательно расположенные элементы: функционально активный в клетках растения промотор, 5'-нетранслирумый участок генома вируса табачной мозаики крестоцветных, ген полимеразы вируса табачной мозаики крестоцветных, включающий первый промотор субгеномной РНК вируса табачной мозаики крестоцветных, ген транспортного белка, включающий второй промотор субгеномной РНК вируса табачной мозаики крестоцветных, нуклеотидная последовательность SEQ ID NO: 2, кодирующую аминокислотную последовательность SEQ ID NO: 4, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и тяжелой цепи антитела, 3'-нетранслируемый участок генома вируса табачной мозаики крестоцветных и терминатор транскрипции.
В предпочтительных вариантах воплощения промотор представляет собой промотор 35S РНК вируса мозаики цветной капусты, промотор гена нопалин-синтетазы (nos), промотор гена октопин-синтетазы (ocs), промотор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или промотор гена актин 2 Arabidopsis thaliana.
В предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты, терминатор гена нопалин-синтетазы (nos), терминатор гена октопин-синтетазы (ocs), терминатор гена маннопин-синтетазы (mas) Agrobacteruim tumefaciens или терминатор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения промотор представляет собой промотор гена актин 2 Arabidopsis thaliana.
В более предпочтительных вариантах воплощения терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
В наиболее предпочтительном варианте воплощения промотор представляет собой промотор гена актин 2 Arabidopsis thaliana и терминатор транскрипции представляет собой терминатор 35S РНК вируса мозаики цветной капусты.
Седьмой аспект настоящего изобретения предусматривает способ получения антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, в растении, включающий стадии:
- обеспечение первого экспрессионного вектора, содержащего нуклеотидную последовательность SEQ ID NO: 1, кодирующую аминокислотную последовательность SEQ ID NO: 3, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и легкой цепи антитела; где указанный экспрессионный вектор содержит следующие последовательно расположенные элементы: функционально активный в клетках растения промотор, нуклеотидная последовательность SEQ ID NO: 1 и терминатор транскрипции;
- обеспечение второго экспрессионного вектора, содержащего нуклеотидную последовательность SEQ ID NO: 2, кодирующую аминокислотную последовательность SEQ ID NO: 4, состоящую из сигнального пептида, обеспечивающего секрецию антитела, и тяжелой цепи антитела; где указанный экспрессионный вектор содержит следующие последовательно расположенные элементы: функционально активный в клетках растения промотор, нуклеотидная последовательность SEQ ID NO: 2 и терминатор транскрипции;
- получение штамма Agrobacterium tumefaciens. трансформированного первым экспрессионным вектором, и штамма Agrobacterium tumefaciens. трансформированного вторым экспрессионным вектором;
- совместное введение штамма Agrobacterium tumefaciens. трансформированного первым экспрессионным вектором, и штамма Agrobacterium tumefaciens, трансформированного вторым экспрессионным вектором, в клетки растения рода Nicotiana:
- культивирование полученного растения и сбор листьев;
- выделение и очистка антител из собранных листьев.
В предпочтительном варианте воплощения первый экспрессионный вектор представляет собой рекомбинантный экспрессионный неамплифицирующийся вектор согласно первому аспекту настоящего изобретения и второй экспрессионный вектор представляет собой рекомбинантный экспрессионный неамплифицирующийся вектор согласно четвертому аспекту настоящего изобретения.
В предпочтительном варианте воплощения первый экспрессионный вектор представляет собой рекомбинантный вирусный амплифицирующийся вектор на основе Х-вируса картофеля согласно второму аспекту настоящего изобретения и второй экспрессионный вектор представляет собой рекомбинантный вирусный амплифицирующийся вектор на основе вируса табачной мозаики крестоцветных согласно шестому аспекту настоящего изобретения.
В предпочтительном варианте воплощения первый экспрессионный вектор представляет собой рекомбинантный вирусный амплифицирующийся вектор на основе вируса табачной мозаики крестоцветных согласно третьему аспекту настоящего изобретения и второй экспрессионный вектор представляет собой рекомбинантный вирусный амплифицирующийся вектор на основе Х-вируса картофеля согласно пятому аспекту настоящего изобретения.
В предпочтительных вариантах воплощения растение выбирают из Nicotiana benthamiana, Nicotiana tabacum, Nicotiana excelsior.
В наиболее предпочтительном варианте воплощения растение представляет собой Nicotiana benthamiana.
В предпочтительных вариантах воплощения растения культивируют в почве в условиях теплицы или климатической камеры со световым режимом: день 16 часов, ночь 8 часов.
Восьмой аспект настоящего изобретения предусматривает антитело, специфически связывающее домен димеризации экзоклеточной части онкобелка HER2/neu, полученное заявленным способом.
Девятый аспект настоящего изобретения предусматривает применение заявленного антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, в качестве терапевтического агента для лечения HER2/neu-позитивного рака молочной железы.
В предпочтительных вариантах воплощения применение дополнительно включает введение второго терапевтического агента, ингибирующего активность HER2/neu.
В более предпочтительных вариантах воплощения вторым терапевтическим агентом является ингибитор тирозинкиназы.
В наиболее предпочтительном варианте воплощения ингибитор тирозинкиназы представляет собой лапатиниб.
В более предпочтительных вариантах воплощения второй терапевтический агент представляет собой антитело, взаимодействующее с экзоклеточной частью онкобелка HER2/neu.
В наиболее предпочтительном варианте воплощения второй терапевтический агент представляет собой антитело трастузумаб.
В наиболее предпочтительном варианте воплощения второй терапевтический агент представляет собой антитело фитотрастузумаб.
Десятый аспект настоящего изобретения предусматривает применение заявленного антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, при изготовлении лекарственного средства для лечения HER2/neu-позитивного рака молочной железы.
Перечень фигур
На Фиг. 1 представлена схему строения бинарного вектора рА16571, кодирующего легкую (L) цепь антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, где RB и LB - соответственно, правая и левая часть участка встраивания в геном растения бинарного вектора; 35S - транскрипционный промотор вируса мозаики цветной капусты (ВМЦК); Poly А/Т - полиаденилирующий сигнал ВМЦК/терминатор транскрипции геномной РНК ВМЦК. S1-лидер - 5'-нетранслируемая область геномной РНК ВМЦК.
На Фиг. 2 представлена схему строения бинарного вектора рА16671, кодирующего тяжелую (Н) цепь антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu. Условные обозначения те же, что и на Фиг. 1.
На Фиг. 3 приведены результаты электрофореза растительных экстрактов в невосстанавливающих условиях (в отсутствие β-меркаптоэтанола) в 7,5% полиакриламидном геле с последующей окраской Кумасси. Показано накопление собранных полноразмерных антител в листьях N.benthamiana после совместной инфильтрации вектором, содержащем ген легкой цепи, и вектором, содержащем ген тяжелой цепи. Использованы последовательности, кодирующие разные сигнальные пептиды (указаны названия конструкций), дорожки:
Инфильтрированные листья были собраны 5, 7 или 9 день (dpi). Дорожка U, неинфицированный лист; дорожка S, 1 μg hIgG; дорожка M, маркеры мол. веса. Область полноразмерных антител выделена стрелкой.
На Фиг. 4 представлена схема строения бинарного вектора рА16921, основанного на кДНК ХВК и кодирующего легкую (L) цепь антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, где (слева направо) LB - левая часть участка встраивания в геном растения бинарного вектора; Τ - нопалинсинтазный терминатор; ΝΡΤ - ген неомицинфосфотрансферазы; Ρ - нопалинсинтазный транскрипционный промотор; 35S - транскрипционный промотор ВМЦК; ген репликазы ХВК, L-цепь - легкая цепь; НТО - 3'нетранслируемая область геномной РНК ХВК; Τ - 35S терминатор ВМЦК; RB - правая часть участка встраивания в геном растения бинарного вектора. Стрелки показывают направление транскрипции.
На Фиг. 5 представлена схема строения бинарного вектора pA16722, основанного на кДНК крВТМ и кодирующего тяжелую (Н) цепь антитела, специфически связывающего домен димеризации экзоклеточной части онкобелка HER2/neu, где (слева направо) LB - левая часть участка встраивания в геном растения бинарного вектора; Τ - нопалинсинтазный терминатор; ΝΡΤ - ген неомицинфосфотрансферазы; Ρ - нопалинсинтазный транскрипционный промотор; Act2 - актиновый транскрипционный промотор 2 из арабидопсиса; ген репликазы крВТМ; ТБ - транспортный белок крВТМ, Н-цепь - тяжелая цепь; НТО - 3'нетранслируемая область геномной РНК крВТМ; Τ - нопалинсинтазный терминатор; RB - правая часть участка встраивания в геном растения бинарного вектора. Стрелки показывают направление транскрипции.
На Фиг. 6 приведены результаты анализа тотального растворимого белка листьев N. benthamiana, агроинъецированных бинарными векторами рА16571 и рА16671. Разделение в 7,5% ПААГ в невосстанавливающих условиях с последующей окраской Кумасси. Дорожки: 1 - интактный лист (отрицательный контроль); 2, 4, 6 - листья, инъецированные бинарными векторами, кодирующими легкую (рА11866) и тяжелую (рА11903) цепь антитела трастузумаб; 3, 5, 7 - листья, инъецированные бинарными векторами рА16571 и рА16671 (зона, соответствующая полноразмерному антителу, отмечена *); +K - 3 мкг трастузумаба (положительный контроль); MR -маркеры молекулярного веса.
На Фиг. 7 приведены результаты анализа фракций очищенного на колонке с протеин-A сефарозой моноклонального антитела, выделенного из листьев N.benthamiana, агроинъецированных бинарными векторами рА16571 и рА16671. Разделение в 12% ПААГ в восстанавливающих условиях с последующей окраской Кумасси. Дорожки: MR - маркеры молекулярного веса; +K - 3 мкг трастузумаба (положительный контроль); 1 - 2 мкг из фракции №3; 2 - 2 мкг из фракции №4. Отмечены зоны, соответствующие тяжелой (Н) и легкой (L) цепи антитела.
На Фиг. 8 приведены результаты вестерн-блот анализа растительных экстрактов из листьев N.benthamiana, агроинъецированных бинарными векторами рА16571 и рА16671. Разделение в 12% ПААГ. Дорожки: 1 - интактный лист (отрицательный контроль); 2 - листья, инъецированные бинарными векторами, кодирующими легкую (рА11866) и тяжелую цепь (рА11903) антитела трастузумаб под контролем 35S-промотора; 3 - листья, инъецированные бинарными векторами рА16571 и рА16671; +K - 120 нг трастузумаба в случае L цепи, 60 нг трастузумаба в случае H цепи (положительный контроль). Зоны, соответствующие легкой и тяжелой цепи, отмечены * Слева: вестерн-блот с антителами против легкой каппа-цепи иммуноглобулина G человека. Справа: вестерн-блот с антителами против тяжелой гамма-цепи иммуноглобулина G человека.
На Фиг. 9 приведены результаты анализа аффинности рекомбинантных моноклональных антител против домена димеризации HER2/neu, продуцированных в растении, к антигену HER2/neu на поверхности клеток SKBR-3 по данным проточной цитометрии. Клетки инкубировались с антителами в указанных по оси абсцисс концентрациях от 0,01 до 100 мкг/мл. По оси ординат - процент связавшихся с антителами клеток.
Подробное описание изобретения
Настоящее изобретение представляет собой способ продукции в клетках растения функционально активного моноклонального антитела против домена димеризации HER2/neu. Гены, кодирующие тяжелую и легкую цепи MA против домена димеризации онкогена HER2/neu, могут быть экспрессированы в клетке растения с получением полностью функционального антитела, специфически связывающегося с HER2/neu как in vitro, так и in vivo.
Описанный в изобретении способ предполагает создание экспрессионных векторов, направляющих в клетке растения синтез тяжелой (Н) и легкой (L) цепи антитела, введение указанных векторов в клетки растения с последующим культивированием в условиях, обеспечивающих совместную экспрессию в растительной клетке генов тяжелой и легкой цепи MA с последующей сборкой полноразмерного MA.
Для продукции MA в растительной клетке могут быть созданы как неамплифицирующиеся (см. Пример 2) экспрессионные векторы, так и амплифицирующиеся, на основе геномов вирусов растений (см. Пример 4). Экспрессионные векторы содержат транскрипционную кассету (промотор и терминатор транскрипции), узнаваемую ДНК-зависимой РНК полимеразой растительной клетки. В качестве промотора и терминатора могут быть использованы как последовательности из генома растений, так и из генома бактерий (например, агробактерий) или вирусов (например, ВМЦК) растений (см. Фиг. 1, 2 Примера 2, Фиг. 4, 5 Примера 4). При создании экспрессионных амплифицирующихся векторов - векторов на основе геномов вирусов растений - необходимо учитывать тот факт, что продукция легкой и тяжелой цепи MA в одной и той же клетке возможна при условии отсутствия конкуренции между вирусами, геномы которых использованы. Наши эксперименты показывают, что ВТМ и ХВК не только не конкурируют между собой, но ХВК даже стимулирует репродукцию ВТМ. Анализ механизмов репродукции синдбис-подобных фитовирусов показывает, что конкуренция между ними происходит на стадии формирования так называемых вирусных «фабрик», когда вирусная репликаза локализуется на мембранах эндоплазматического ретикулума. ВТМ и ХВК не конкурируют между собой на стадии формирования репликативного комплекса и вирусной «фабрики». Вирус желтой мозаики турнепса (ВЖМТ), формирующий вирусную «фабрику» на мембранах хлоропластов, также не конкурирует с ВТМ и ХВК и поэтому может быть использован в комбинации с ВТМ или ХВК для синтеза антитела.
Согласно изобретению, нуклеотидные последовательности, кодирующие легкую и тяжелую цепи MA, могут быть получены на основе аминокислотной последовательности с помощью инструмента «обратной трансляции» параллельно с проведением оптимизации кодонового состава с учетом частоты встречаемости тех или иных кодонов в тех растениях, которые в дальнейшем будут использованы для продукции MA.
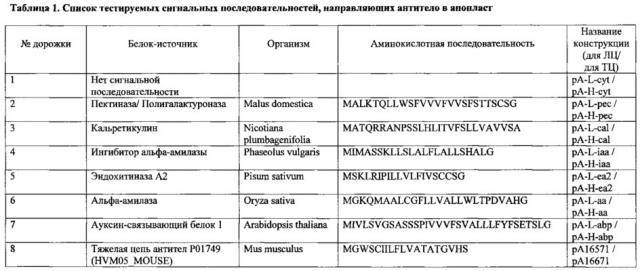
Для осуществления эффективного процессинга и сборки MA аминокислотная последовательность каждой из цепей антитела должна содержать сигнальный пептид, направляющий белки через эндоплазматический ретикулум в апопласт. В отсутствие сигнальных пептидов MA в растительной клетке собираться не будет. Можно использовать как одинаковые, так и разные сигнальные пептиды для легкой и тяжелой цепи с целью определения наиболее оптимального сочетания (см. Пример 3).
В контексте настоящего изобретения экспрессионные векторы, кодирующие легкую и тяжелую цепи антитела против домена димеризации онкогена HER2/neu, могут быть созданы на основе бинарного вектора pCambia1300 или pBIN19 (см. Пример 2 и 4). Эти плазмиды обеспечивают возможность использования Agrobacterium tumefaciens для доставки генетического материала в клетки растения.
Для экспрессии чужеродного гена в листовой ткани можно использовать метод агроинфильтрации и агроинокуляции. Трансформация растительных клеток может быть стабильной, сопровождающейся интеграцией вводимой ДНК в клеточный геном, или же временной, когда ДНК, содержащая целевой ген, находится в виде эписомы, т.е. интеграции ДНК в хозяйский геном не происходит. Временная, или транзиентная, экспрессия чужеродных генов в растительной клетке позволяет получить более высокий выход целевого белка в короткие сроки (3-14 дней). Более того, экспрессия целевых генов наблюдается через 3 часа после отправки ДНК, а уже между 18 и 48 часами достигает максимума и сохраняется на протяжении 10 дней. Очевидными преимуществами использования такой растительной «фабрики» являются простота в обращении, скорость, низкая себестоимость конечного продукта, высокий уровень продуцируемого белка, масштабируемость и возможность контроля процесса синтеза белка (Makhzoum et al., 2014).
Настоящее изобретение подразумевает предпочтительное использование транзиентной экспрессии генов легкой и тяжелой цепей MA и осуществление доставки экспрессионных векторов с помощью агроинокуляции или вакуумной агроинфильтрации.
Важным и решающим преимуществом настоящего изобретения, является то, что описываемая система синтеза антитела против онкогена HER2/neu в растении может обеспечивать высокий уровень продукции целевого белка при небольших затратах и в короткие сроки: уже на 3 день после агроинъекции нереплицирующимися векторами, содержащими ген легкой и тяжелой цепи MA, в листьях N.benthamiana накапливается до 50-80 мг/кг антител (см. Фиг. 6 Примера 6). Наши эксперименты показывают, что по результатам ИФА выход антител при использовании амплифицирующихся векторов в несколько раз больше - 250-500 мг/кг листовой массы (2.5-5% от суммарного растворимого белка клетки). С помощью аффинной хроматографии на колонке с протеином G или А можно получить чистый препарат MA против домена димеризации HER2/neu (Фиг. 7).
Выделенные из растительного материала MA обладают способностью связывать HER2/neu на поверхности клеток SK-BR-3, что показано с помощью проточной цитометрии (Фиг. 9).
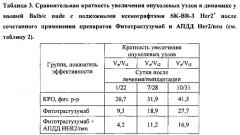
Продуцированные и выделенные из растений MA против домена димеризации HER2/neu являются полностью функционально активными. На мышах с перевитой опухолью РМЖ человека - клетки SK-BR-3 - была подтверждена эффективность полученных в растениях антител. Продемонстрировано подавление роста опухоли при использовании комбинации двух моноклональных антител, продуцированных в растении - фитотрастузумаб и MA против домена димеризации HER2/neu, причем эффективность этой комбинации, по крайней мере, в два раза выше, чем одного фитотрастузумаба. Сравнение с группой фитотрастузумаба показало достоверный почти двукратный терапевтический выигрыш. Таким образом, антираковое антитело против домена димеризации HER2/neu, полученное в растительной клетке, является функционально активным, что продемонстрировано как в системе in vitro, так и in vivo, при этом по нашим оценкам себестоимость препарата MA, полученного в клетке растения, может быть в 10-20 раз ниже стоимости аналогичного препарата, полученного из животных клеток.
Не менее существенным преимуществом данного изобретения является то, что на протяжении всего цикла получения MA из растительной клетки не используются какие-либо материалы животного происхождения, что гарантирует отсутствие вирусов или их генетического материала, прионов и прочих инфекционных агентов в получаемом продукте.
Сведения, подтверждающие возможность осуществления изобретения.
Данное изобретение подробно проиллюстрировано ниже со ссылками на конкретные примеры, представляющие собой его наиболее предпочтительные воплощения.
Пример 1. Получение нуклеотидной последовательности, кодирующей легкую и тяжелую антитела, направленного против домена димеризации экзоклеточной части онкобелка HER2/neu, предназначенной для экспрессии в клетках растения рода Nicotiana.
Нуклеотидную последовательность, кодирующую легкую и тяжелую антитела, направленного против домена димеризации экзоклеточной части онкобелка HER2/neu, предназначенной для экспрессии в клетках растения рода Nicotiana получали на основе опубликованной в драгбанке (DrugBank accession number DB06366) аминокислотной последовательности антитела, направленного против домена димеризации экзоклеточной части онкобелка HER2/ с помощью инструмента «обратной трансляции» с одновременной оптимизацией кодонового состава для экспрессии в растениях рода Nicotiana (http://www.entelechon.de/2008/10/backtranslation-tool/). К каждой последовательности с N-конца была добавлена аминокислотная последовательность сигнального пептида тяжелой цепи антител Р01749 (HVM05_MOUSE) Mus musculus. Аминокислотная последовательность тяжелой или легкой цепи вводилась в соответствующее поле сервиса «обратная трансляция», затем устанавливались следующие параметры: стандартный генетический код; таблица частоты использования кодонов для рода Nicotiana с включенным условием использования наиболее часто встречающихся кодонов; в качестве нежелательных мотивов были указаны сайты узнавания рестриктазами NcoI, XhoI, которые в дальнейшем использовались для получения генноинженерных конструкций. Выведенные нуклеотидные последовательности, кодирующие легкую и тяжелую цепь антитела, направленного против домена димеризации экзоклеточной части онкобелка HER2/neu, предназначенные для экспресии в клетках растения рода Nicotiana представлены в (SEQ ID NO: 1, SEQ ID NO: 2) соответственно. По заказу авторов эти последовательности были синтезированы ЗАО «Евроген», каждая из них была вставлена в вектор pAL-TA (Евроген, Россия), причем на 5'-конце каждой из последовательностей был добавлен сайт узнавания рестриктазой NcoI, а на 3'-конце - XhoI. В результате были получены конструкции pAL-L и pAL-H, содержащие нуклеотидную последовательность, кодирующую легкую и тяжелую цепь антитела против домена димеризации экзоклеточной части онкобелка HER2/neu, соответственно.
Пример 2. Создание экспрессионных неамплифицирующихся векторов для продукции антитела против домена димеризации экзоклеточной части онкобелка HER2/neu в растении Nicotiana.
Для получения экспрессионных неамплифицирующихся векторов для продукции антитела против домена димеризации экзоклеточной части онкобелка HER2/neu в растении Nicotiana испол