Штамм bacillus mojavensis lhv-97, обладающий фунгицидной и бактерицидной активностью
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Изобретение представляет собой штамм Bacillus mojavensis Lhv-97, выделенный из ризосферной почвы Черноморского побережья Кавказа, депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером В-8101. Штамм имеет широкий спектр действия против патогенных грибов и бактерий, в том числе против штаммов рода Candida, устойчивых к флуконазолу, повышает урожайность растений. Штамм нетоксичен для растений и животных и может быть использован для создания на его основе препаратов для защиты человека, животных и растений от болезней, вызываемых грибными и бактериальными патогенами. 4 табл., 8 пр.
Реферат
Изобретение относится к биотехнологии и касается нового бактериального штамма Bacillus mojavensis Lhv-97, обладающего способностью подавлять рост грибов и бактерий - возбудителей болезней человека, животных и растений. Штамм может быть использован для создания препаратов с фунгицидными и бактерицидными свойствами.
Повсеместное широкое использование антибиотических и в том числе антигрибных препаратов в медицине и сельском хозяйстве приводит к снижению эффективности их применения. Решение проблемы может быть достигнуто за счет поиска и селекции новых микроорганизмов-продуцентов и разработки на их основе новых эффективных продуктов.
Известен ряд штаммов бактерий рода Bacillus, являющихся антагонистами различных грибных возбудителей болезней сельскохозяйственных культур: штамм ИПМ-215 (патент РФ №1144377), штамм IC-5 (патент РФ №2086128), штамм BZR 517 (патент РФ №2621356). Однако эти штаммы имеют ограниченное действие на отдельные грибные патогены различных сельскохозяйственных культур.
Известен также ряд штаммов бактерий рода Bacillus, активных не только в отношении грибных, но и бактериальных патогенов растений: штамм В. subtilis Ч-13 (патент РФ №2259397), штамм В. subtilis ВНИИСХМ 128, на основе которого создан препарат фитоспорин (патент РФ №20999470). Однако эти штаммы также оказывают ограниченное действие, направленное на возбудителей болезней сельскохозяйственных культур.
Бактериальные штаммы Pseudomonas chlororaphis ssp. chlororaphis Vsk-26a3 (патент РФ №2603281) и В. subtilis JB 3, JB 3.6 и R1 (патент США №5344647) заявлены как антагонисты широкого круга грибных и бактериальных патогенов растений, человека и животных. Штамм P. chlororaphis ssp. chlororaphis Vsk-26a3 активен также против психрофильного возбудителя снежной плесени злаковых культур Microdochium nivale, однако эффективность этих штаммов для лечения животных не подтверждена.
Наиболее близким аналогом (прототипом) заявляемого изобретения является штамм бактерий Bacillus licheniformis и его варианты (патент РФ №2440413), обладающий антигрибной и антибактериальной активностью. Однако штамм-прототип и его варианты также обладают недостаточно широким спектром антагонистической активности. В частности, не показано их действие против бактериальных патогенов растений, а также против флуконазол-резистентных штаммов грибов рода Candida - патогенов человека и животных.
Техническим результатом является выделение нового штамма, обладающего способностью к подавлению патогенных грибов и бактерий, в том числе к подавлению фитопатогенных грибов при пониженных температурах, для борьбы с болезнями растений и повышения урожайности, а также для разработки препаратов против возбудителей болезней человека и животных.
Технический результат достигается тем, что предлагается штамм Bacillus mojavensis Lhv-97, выделенный из ризосферной почвы Черноморского побережья Кавказа в 2003 году. Основными критериями отбора служили подавление роста патогенных грибов и бактерий, безвредность для теплокровных и отсутствие фитотоксичности.
Предлагаемый штамм В. mojavensis Lhv-97 обладает способностью подавлять рост фитопатогенных грибов, в том числе фитопатогенного гриба Microdochium nivale при пониженных температурах, и бактериальных фитопатогенов, повышает урожайность растений. Кроме того, штамм эффективен против грибных и бактериальных патогенов человека и животных.
Предлагаемый штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» (п. Оболенск, Серпуховского р-на Московской обл.) под номером В-8101.
Штамм бактерий В. mojavensis Lhv-97 характеризуется следующими свойствами.
Культурально-морфологические признаки
Штамм - спорообразующая бацилла. Вегетативные клетки штамма в мазках, окрашенных по Граму - грамположительные палочки; при исследовании методом "висячая капля" - клетки подвижны. Споры овальные мелкие, наблюдаемые методом «фазового контраста» после 24-48 часов роста преимущественно на обедненных средах. На ГРМ-агаре (ФБУН ГНЦПМБ, п. Оболенск) через 24 часа культивирования при 37°С вырастают колонии с кремовой пигментацией диаметром 5-8 мм. Колонии бесформенные, с неровными краями, со складками, матовые. Штамм термотолерантный, хорошо растет при 28-40°С, способен к росту при 45-55°С.
Штамм хорошо растет на следующих средах: плотные питательные среды - ГРМ-агар + 2% глюкозы; жидкие питательные среды - ГРМ-бульон (ФБУН ГНЦПМБ, п. Оболенск) + 2% глюкозы; минимальная синтетическая среда (г/л): глюкоза - 50,0; (NH4)2HPO4 - 3,0; K2HPO4 - 1,5; дрожжевой экстракт - 1,0; MgSO4 - 0,4; NaCl - 3,0; раствор микроэлементов - 0,3 мл/л. Состав раствора микроэлементов (%): FeSO4×7H2O - 0,01; CuSO4×5H2O - 0,1; MnSO4×2H2O - 0,1; ZnSO4×7H2O - 0,01. Температура культивирования 28-37°C.
Физиолого-биохимические признаки
Факультативный аэроб, температурный оптимум роста 35-40°С; растет в пределах рН среды от 3,0 до 8.5.
Метаболизм глюкозы окислительный. Молекулярный азот не фиксирует. Крахмал гидролизует. Клетчатку не разлагает. Гидролизует аргинин, с помощью глюкозидаз и галактозидаз расщепляет некоторые олигосахариды, но не раффинозу и сорбозу. Окситест положительный.
Усваивает манит, сахарозу, мальтозу, салицин, мелибиозу. Использует аммиачные и нитратные соли азота в качестве единственного источника азота.
Сапрофит. Штамм не обладает фитопатогенной активностью, о чем свидетельствует отсутствие мацерации на ломтиках картофеля при нанесении на них уколом живых клеток штамма. У штамма B mojavensis Lhv-97 отсутствует фитотоксичность (таблица 1).
Штамм не патогенен для теплокровных: не вызывает гибели мышей линии СВА при подкожном введении 1010 КОЕ.
Штамм чувствителен к бензилпенициллину, тетрациклину, рифампицину, полимиксину, налидиксовой кислоте, норфлоксацину, пефлоксацину, цефтазидиму, цефоперазону, цефепиму, ломефлоксацину, офлоксацину, ципрофлоксацину, доксициклину.
Штамм бактерий В. mojavensis Lhv-97 хранят на чашках или косяках с ГРМ-агаром при 4-8°С. Пересевы на свежие среды - один раз в 3 месяца. Долгосрочное хранение - в лиофильно высушенном состоянии, в лактозно-полиглюкиновой защитной среде. Хранить при температуре 4-8°С, перезакладка через 5 лет.
Возможность осуществления изобретения иллюстрируется приведенными ниже примерами, но не ограничивается ими.
Пример 1. Получение культуры бактерий В. mojavensis Lhv-97
Культуру клеток штамма В. mojavensis Lhv-97 для испытаний готовят следующим образом: в колбу объемом 750 мл наливают 150 мл стерильной среды ГРМ-бульон (ФБУН ГНЦ ПМБ, Оболенск, Россия), добавляют 6 мл стерильного 50% раствора глюкозы и вносят 1-2 мл стационарной культуры штамма В mojavensis Lhv-97. Культивирование проводят с интенсивностью перемешивания 160-250 об/мин при 28°С в течение 24-48 ч до титра культуральнои жидкости 1-5×109 КОЕ/мл.
Пример 2. Получение сухого препарата на основе штамма В. mojavensis Lhv-97 для полевых испытаний на растениях
Полученную по примеру 1 культуральную жидкость смешивают с защитной средой, содержащей 2% полиглюкина и 7% лактозы, и высушивают на лиофилизаторе Virtis ВТ-4к (США). В результате получают сухой порошок с содержанием 2-5×1010 КОЕ/г.
Пример 3. Получение жидкого препарата на основе штамма В. mojavensis Lhv-97 для лабораторных испытаний
Культуральную жидкость, полученную по примеру 1, разделяют на центрифуге J2-21С (Beckman Coulter Instruments, США) при 7000 об/мин в течение 20 мин. Для полного отделения клеток штамма от фугата применяют стерильные фильтрующие системы Corning объемом 1 л (США) с диаметром пор 0,22 мм. Концентрирование бесклеточного фугата в 10-12 раз проводят на вакуум-выпарной установке Laborota 4000 (Heidolph, Германия) при температуре 65°С и вакууме 0,1 атм.
Полученный концентрат разделяют с помощью высокоэффективной жидкостной хроматографии на колонке Phenomenex Jupiter C18 и детектора Bio-Rad BioLogic LP (Bio-Rad Laboratories, USA), используя в качестве элюэнта деионизованную воду. Фракции отбирают коллектором фракций LKB Bromma 2112 Redirac. Активность фракций проверяют методом лунок (пример 6). Активные фракции объединяют и дополнительно очищают с помощью эксклюзионной хроматографии с использованием колонки ХК 16/40 Pharmacia Biotech, заполненной сорбентом Sephadex G-10 (SIGMA-ALDRICH, Германия). В качестве элюэнта также используют деионизованную воду и фракции отбирают коллектором фракций LKB Bromma 2112 Redirac. Активные фракции объединяют и в объединенном растворе определяют количество сухих веществ высушиванием до постоянного веса при 105°С. Полученный раствор с концентрацией сухих веществ 1 мг/мл используют для лабораторных испытаний.
Пример 4. Демонстрация отсутствия фитотоксичности у штамма Bacillus mojavensis Lhv-97
Из культуральной жидкости, полученной по примеру 1, готовят 1% (v/v) суспензию клеток в стерильной дистиллированной воде (0,5-1,0×108 КОЕ/мл). В полученной суспензии замачивают семена пшеницы сорта "Московская-56" в течение 2 ч. В контрольном опыте семена замачивают в дистиллированной воде. По 50 семян каждого варианта раскладывают на увлажненную дистиллированной водой фильтровальную бумагу, которую помещают в чашки Петри, и выдерживают в термостате при 28°С в течение 4 суток, постоянно увлажняя. Через сутки оценивают всхожесть семян (таблица 1), а через 4 суток проростки морфометрируют, измеряя длину всех корней и стебля.
Фитотоксическую активность штамма рассчитывают по формуле
А=(100-До/Дк×10())%,
где А - показатель фитотоксичности;
До - средний показатель параметра в опыте;
Дк - средний показатель параметра в контроле.
Отрицательные значения показателя А свидетельствуют о стимулирующем эффекте.
Пример 5. Демонстрация безвредности штамма Bacillus mojavensis Lhv-97
Вирулентные свойства штамма В. mojavensis Lhv-97 определяли на двадцати одной беспородной белой мыши (самцы/самки, 20±1 г) из питомника лабораторных животных "Столбовая" (ФГБУН НЦБМТ ФМБА). Животные прошли адаптацию в виварии ГНЦ ПМБ в соответствии с СП 2.2.1.3218-14 «Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)». Мыши содержались в стандартных условиях в соответствии с международными нормами и требованиями с ежедневным ветеринарным наблюдением, имели свободный доступ к воде и корму.
Для проверки штамма на вирулентность животные были разделены на 7 групп по 5 мышей. Заражение проводили подкожно в область верхней трети левого бедра по 0,2 мл бактериальной взвеси с концентрацией 10 ед. по стандарту мутности ГИСК им. Л.А. Тарасевича, что соответствует 1010 м.к./мл коклюшных бактерий. В течение 14 суток с момента заражения ежедневно проводили мониторинг здоровья зараженных животных.
В результате все мыши, зараженные в дозах 1×1010 КОЕ штамма В. mojavensis Lhv-97, остались живы, прибавляли в весе и не проявляли признаков интоксикации на протяжении всего срока наблюдения (14 суток), что позволяет сделать вывод о безвредности штамма Lhv-97 для теплокровных.
Пример 6. Демонстрация антагонизма штамма В. mojavensis Lhv-97 в отношении грибов и бактерий
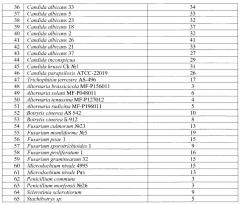
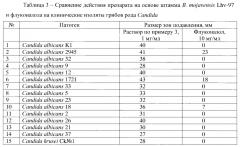
Для определения супрессивных свойств используют метод лунок. Суспензии фитопатогенных грибов (105 КОЕ/мл) готовят, смывая мицелиальную и споровую массу с газонов грибов на картофельно-глюкозном агаре (КГА), а суспензии бактерий (108 КОЕ/мл) - с газонов бактерий на ГРМ-агаре (Егоров Н.С. Руководство к практическим занятиям по микробиологии. - М.: Изд-во МГУ, 1995. - 217 с.) стерильным раствором 0,9% хлористого натрия. Полученные суспензии в количестве 0,1 мл засевают на поверхность КГА (в случае грибов) и ГРМ-агара (в случае бактерий) в чашках Петри и растирают шпателем. В центре засеянных патогенами чашек Петри с агаром делают лунки диаметром 5 мм, в которые вносят 0,1 мл культуральной жидкости В. mojavensis Lhv-97, полученной по примеру 1, или 0,1 мл раствора, полученного по примеру 3, или 0,1 мл раствора флуконазола (OZON Фармацевтика, Россия) в концентрации 10 мг/мл. Чашки инкубируют при 28°С в течение 2-4-х суток. В случае исследования антагонизма в отношении грибов Microdochium nivale (снежная плесень) чашки инкубируют в холодильнике при температуре 4-8°С в течение 7-10 суток. Результаты представлены в таблице 2.
Данные таблицы 2 демонстрируют подавление заявляемым штаммом 22 видов бактерий, в том числе 2 видов фитопатогенных бактерий (Erwinia carotovora и Xantomonas vasculorum), 5 видов грибных патогенов человека и животных и 16 видов фитопатогенных грибов, в том числе двух штаммов Microdochium nivale при пониженных температурах (4-8°С) и трех штаммов патогенов ягодных и плодовых культур (Botrytis cinerea и Sclerotinia sclerotiorum).
Данные таблицы 3 подтверждают антагонистическую активность заявляемого штамма в отношении клинических изолятов рода Candida, возбудителей кандидоза, устойчивых к флуконазолу. Флуконазол является одним из наиболее часто назначаемых препаратов для лечения кандидоза (Сергеев А.Ю., Сергеев Ю.В. Кандидоз. Природа инфекции, механизмы агрессии и защиты, лабораторная диагностика, клиника и лечение. М.: Триада - X. - 2001 г., 472 стр.).
Пример 7. Демонстрация повышения урожайности озимой пшеницы в результате применения штамма В. mojavensis Lhv-97
Тест-культура: озимая мягкая пшеница сорта Виола.
Закладку опыта осуществляют в селекционном севообороте на серой лесной тяжелосуглинистой почве со следующими агрохимическими показателями: рН солевой вытяжки - 5,13; содержание гумуса в слое 0-20 см (по Тюрину) - 3,1%, подвижного фосфора (по Кирсанову) -139 мг/ кг почвы, подвижного калия - 162 мг/ кг почвы. Дополнительно удобрений не вносят. В эксперименте используют основные методики и схемы, общепринятые в селекционных, научно-исследовательских учреждениях и Государственном сортоиспытании.
Посев осуществляют в оптимальные для агрозоны сроки по технологии, рекомендованной для возделывания озимой пшеницы, с учетом погодных условий. Учетная площадь делянки 5 м2, повторность трехкратная.
Используют сухой препарат на основе штамма В. mojavensis Lhv-97, приготовленный по примеру 2 с титром 2×1010. Способ внесения препарата: обработка семян перед посевом, а также обработка растений в фазе кущения. За 2 часа до посева увлажненные дистиллированной водой семена опудривают сухим препаратом на основе штамма В. mojavensis Lhv-97 в дозе 0,25 кг/т. Обработка растений в фазе кущения проводится с помощью ручного опрыскивателя водной суспензией сухого препарата на основе штамма В. mojavensis Lhv-97 в дозе 1,5 кг/га при норме расхода 200 л/га.
Инфекционный фон: искусственный. Для приготовления инокулюма с целью создания инфекционного фона зерно пшеницы помещают в колбы и увлажняют водой при соотношении вода:зерно (1:1). Далее колбы помещают в автоклав и стерилизуют при давление 1 атм в течение 40 мин. После автоклавирования инфицирование колб с зерном проводят по отдельности двумя штаммами Microdochium nivale, один из которых выделен с листьев пораженных растений озимой пшеницы в Рязанской области, а другой получен из РГАУ-МСХА имени К.А. Тимирязева. Засеянные колбы помещают в холодильную камеру на 3 месяца, поддерживая температуру не выше 10°С. В процессе выращивания патогена колбы периодически встряхивают. Для инфицирования готовый инокулюм вносят на делянки по 30 г зараженного зерна на 1 м2.
Результаты испытаний приведены в таблице 4.
Как следует из таблицы 4, инфицирование возбудителями снежной плесени достоверно снизило урожай по сравнению с неинфицированным контролем на 22,1%. При использовании штамма В. mojavensis Lhv-97 урожайность озимой пшеницы повысилась более чем в два с половиной раза по сравнению с инфицированным контролем. В варианте с применением штамма В. mojavensis Lhv-97 также отмечают лучшую перезимовку растений, большее число зерен с колоса и большую массу 1000 зерен по сравнению с инфицированным и неинфицированным контролями.
Пример 8. Демонстрация эффективности лечения кандидоза у мышей при использовании штамма В. mojavensis Lhv-97
Эффективность действия препарата на основе штамма В. mojavensis Lhv-97, полученного, как описано в примере 3, показана на модели кандидозной инфекции полости рта белых аутбредных мышей. Две группы по пять самок мышей были иммуносупрессированы и заражены суспензией штамма Candida albicans АТСС-9002. Для снижения иммунитета за 1 сутки до заражения и через 1 сутки после заражения культурой С.albicans мышам вводили подкожно по 0,1 мл гидрокортизона (ОАО «Гедеон-Рихтер», Венгрия) в дозе 110 мг/кг. Перед заражением опытных животных обездвиживали смесью рометара с золетилом (1:5) и укладывали на спину. Культуру С.albicans АТСС 90028 наносили на стерильную ватную турунду и помещали в полость рта спящих мышей из опытной и контрольной групп на 60 мин. Каждые 15 мин в течение часа на ватку наносили по 50 мкл культуры. В результате суммарный объем суспензии С.albicans АТСС 90028, внесенный в полость рта животных, составил 300 мкл (1×107 КОЕ/мышь).
Через сутки после заражения мышам из лечебной группы давали препарат, приготовленный по примеру 3, внесенный в поилку с водой (20 мл) в концентрации 1 мг/мл. Мыши из контрольной группы препарат не получали. Количество выпитой мышами воды в обеих группах в течение 24 часов составило приблизительно 5 мл.
Снижение веса животных обеих групп не происходило. Через 1 сут контрольная группа показала обсемененность ротоглотки С.albicans в концентрации 103 КОЕ/г, в то время как рост этого патогена у мышей, получавших препарат на основе штамма В. mojavensis Lhv-97, выявлен не был, что продемонстрировало эффективность препарата.
Таким образом, штамм В. mojavensis Lhv-97 имеет широкий спектр действия против патогенных грибов и бактерий. Продемонстрировано повышение урожайности озимой пшеницы при применении препарата на основе предлагаемого штамма. Показана также эффективность препарата на основе предлагаемого штамма против кандидоза ротовой полости у мышей. Штамм не токсичен и не патогенен для растений и животных и может быть использован для создания на его основе препаратов с фунгицидными и бактерицидными свойствами для защиты растений от болезней, а также для разработки антимикробных препаратов против грибных и бактериальных патогенов человека и животных.
Штамм бактерий Bacillus mojavensis Lhv-97, обладающий фунгицидной и бактерицидной активностью, для защиты от болезней человека, животных и растений депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» под номером В-8101.