Ферментный биокатализатор с антиоксидантной активностью для детоксификации фосфорорганических соединений
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к ферментным биокатализаторам для детоксификации фосфорорганических соединений (ФОС) и нейтрализации активных форм кислорода. Ферментный биокатализатор представляет собой лиофилизованный нековалентный комплекс между гексагистидинсодержащим полипептидом со свойствами органофосфатгидролазы и антиоксидантом, выбранным из флавоноидов: апигенина, икариина, катехина, мирицетрина, текторигенина, текторидина, или халконоидов: 2-гидроксихалкона, 2'-гидроксихалкона. Биокатализатор получают в результате смешивания растворов указанных компонентов так, чтобы мольное соотношение составляло от 1:1 до 100:1 между антиоксидантом и ферментом или фермент-полиэлектролитным комплексом на основе поли-L-глутаминовой кислоты или ее блок-сополимера с полиэтиленгликолем, замораживания полученной смеси при температуре не выше минус 40°С и ее последующей лиофилизации до остаточной влажности 2-4%. Изобретение позволяет получать биокатализатор с двойной активностью: органофосфатгидролазной и антиоксидантной, и осуществлять детоксификацию фосфорорганических соединений и нейтрализовать активные формы кислорода. При этом биокатализатор обладает повышенной стабильностью и увеличенным сроком хранения. 1 табл., 5 пр.
Реферат
Изобретение относится к биотехнологии, в частности, к ферментным биокатализаторам в виде наноразмерных частиц, предназначенных для детоксификации фосфорорганических соединений (ФОС) и нейтрализации активных форм кислорода, представляющих собой лиофилизованный нековалентный комплекс между антиоксидантом и гексагистидинсодержащим полипептидом со свойствами органофосфатгидролазы (His6-ОРН), получающийся в результате смешивания растворов указанных компонентов так, чтобы мольное соотношение составляло от 1:1 до 100:1 между антиоксидантом и ферментом или его полиэлектролитным комплексом, замораживания полученной смеси при температуре не выше минус 40°С и ее последующей лиофилизации до остаточной влажности 2-4%.
Такой биокатализатор обладает двойной активностью органофосфатгидролазной и антиоксидантной, то есть способен осуществлять детоксификацию фосфорорганических соединений и нейтрализацию активных форм кислорода, а также обладает повышенной стабильностью и длительным сроком хранения. Изобретение может быть использовано для детоксификации ФОС, попадающих в организм человека или животных трансдермально, ингаляторно или перорально с продуктами питания, питьевыми источниками или в результате чрезвычайных ситуаций (утечек ФОС при их производстве, применении, транспортировке, хранении или утилизации, в результате катастроф или террористических актов).
К числу ФОС, являющихся эфирами ортофосфорной и алкилфосфоновой кислот, относятся широко применяемые в сельском, приусадебном и домашнем хозяйстве фосфорорганические пестициды, а также ингибиторы коррозии и антинакипины, применяемые в теплоэнергетике, нефте- и газодобывающей промышленности, пластификаторы и стабилизаторы, используемые в строительной промышленности, в составе моющих и чистящих средств промышленного назначения, а также высокотоксичные боевые отравляющие вещества нервно-паралитического действия: зоман, зарин, Vx, вещества типа Vx и продукты их разложения (метилфосфоновая кислота и ее эфиры) [Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России) http://www.mcx.ru/documents/document/v7_show/20198.285.htm; Балабин Ю.В., Костенко Г.И. Антинакипины - органофосфонаты в энергетике. История и современная практика. // Энергоснабжение и водоподготовка, 2013, Т. 82 (№2), с. 2-8; Холстов В.И. Уничтожение запасов химического оружия в России на завершающем этапе. // Теоретическая и прикладная экология, 2014, №4, с. 8-11].
ФОС, обладающие свойствами нейротоксинов, мутагенов и канцерогенов, попадая в организм человека, индуцируют развитие процессов окислительного метаболизма токсинов, которые происходят через их окисление под действием вырабатываемых в организме активных форм кислорода, избыток которых и приводит к оксидативному стрессу, провоцирующему в свою очередь развитие различных заболеваний (болезни Альцгеймера, Паркинсона, атеросклероза, онкогенеза и т.д.). Применение антиоксидантов при попадании ФОС в организм человека и животных направлено на преодоление этих негативных последствий [Nurulain S.M., Szegi P., Tekes K., Naqvi S.N.H (2013) Antioxidants in organophosphorus compounds poisoning. Arh. Hig. Rada Toksikol, 64 p. 169-177].
Комбинирование природных антиоксидантов, снижающих последствия интоксикации ФОС, с биокатализаторами, способными осуществлять их гидролитическую детоксификацию и снижать, таким образом, их концентрацию в организме, является высокоэффективным решением задачи защиты организма человека как от воздействия самих ФОС, так и от последствий этого воздействия, то есть от активных форм кислорода, вырабатываемых в организме в ответ на проникновение в него ФОС. Однако сегодня не известен ни один ферментный биокатализатор, который бы одновременно обладал способностью осуществлять гидролиз ФОС и нейтрализовать действие активных форм кислорода. Известны лишь ферментные биокатализаторы, способные осуществлять только гидролитическую детоксификацию ФОС, и отдельно применяемые антиоксиданты, не способные осуществить детоксификацию ФОС, то есть не избавляющие организм от прямого негативного воздействия ФОС.
Ферментом, наиболее эффективно осуществляющим биодеструкцию самого широкого спектра ФОС, признана органофосфатгидролаза (ОРН, КФ 3.1.8.1), однако введение в молекулу ОРН полигистидинсодержащей последовательности позволяет получить полипептид с активностью ОРН, который характеризуется существенно улучшенными (по отношению к исходному ферменту) каталитическими характеристиками в реакциях детоксификации различных ФОС [Патент РФ 2255975, МПК7 C12N 1/21, C12N 15/52, C12N 15/70. Рекомбинантная плазмидная ДНК pTES-His-OPH и продуцент олигогистидинсодержащей органофосфатгидролазы; Вотчицева Ю.А., Ефременко Е.Н., Алиев Т.К., Варфоломеев С.Д. (2006) Свойства гексагистидинсодержащей органофосфатгидролазы. // Биохимия, Т. 76 (2), с. 216-222]. Наличие именно полигистидиновой последовательности в молекуле полипептида позволяет проводить его быструю очистку и выделение из клеток E.coli с использованием металл-хелатирующей хроматографии [Efremenko Е., Votchitseva Y., Plieva F., Galaev I., Mattiasson B. (2006) Purification of His6-organophosphate hydrolase using monolithic supermacroporous polyacrylamide cryogels developed for immobilized metal affinity chromatography. // Appl. Microb. Biotech., V. 70(5), p. 558-563], и, следовательно, масштабирование процесса его наработки с целью использования при получении заявляемого ферментного биокатализатора легко реализуемо. Именно использование гексагистидинсодержащего полипептида с ОРН-активностью (His6-OPH) для разработки ферментных биокатализаторов, осуществляющих гидролитическую детоксификацию ФОС in vivo, является наиболее рациональным.
Поскольку His6-OPH имеет оптимум действия при pH 10,5 [Вотчицева Ю.А., Ефременко Е.Н., Алиев Т.К., Варфоломеев С.Д. (2006) Свойства гексагистидинсодержащей органофосфатгидролазы. // Биохимия, Т. 76 (2), с. 216-222], а применение ферментного биокатализатора на его основе в физиологических условиях требует от него проявления максимальной активности при pH 7,3-7,5, то необходима стабилизация фермента в конформации, соответствующей его максимально активному состоянию. Для такой стабилизации и получения ферментного биокатализатора для детоксификации ФОС с высокой активностью наиболее целесообразным является формирование нековалентных комплексов His6-OPH с различными стабилизаторами фермента, то есть образующихся за счет слабых, но множественных химических взаимодействий без применения химических сшивающих агентов.
Сегодня известен ферментный биокатализатор для детоксификации ФОС на основе His6-OPH, получаемый путем смешивания растворов фермента и полимера, являющегося полианионом, с целью формирования между противоположно заряженными функциональными группами, находящимися на поверхности молекулы фермента и в составе выбранного полимера, множественных межмолекулярных ионных связей, стабилизирующих и поддерживающих каталитически активную конформацию фермента [Патент РФ 2525658 (2014), МПК7 C12N 11/02, C12N 11/08, C12N 9/16. Наноразмерный ферментный биокатализатор для детоксификации фосфорорганических соединений in vivo]. При этом в качестве полианиона используется блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты, имеющий разную степень полимеризации. Формирующийся при этом наноразмерный ферментный биокатализатор предполагает такое смешивание растворов фермента и полианиона, которое позволяет получить зарядовое соотношение между положительными и отрицательными группами на поверхности фермента и блок-сополимера из диапазона от 2:1 до 1:5 [Lyagin I.V., Andrianova M.S., Efremenko E.N. (2016) Extensive hydrolysis of phosphonates as unexpected behaviour of the known His6-organophosphorus hydrolase. // Appl. Microb. Biotech., V. 100 (13), p. 5829-5838; Efremenko E.N., Lyagin I.V., Klyachko N.L., Bronich Т., Zavialova N.V., Yuhang Jiang, Kabanov A.V. (2017) A simple and highly effective catalytic nanozyme scavenger for organophosphorus neurotoxins. // J. Control. Release, 2017, V. 247, p. 175-181]. Для этого используют 1 г/л раствора His6-OPH в буфере (pH 7,5-10,5) и 20 г/л водного раствора ПЭГ119-ПГК50 (Mw=13 кг/моль) или ПЭГ119-ПГК10 (Mw=6,5 кг/моль). Приготовленную смесь указанных растворов оставляют при температуре +8 ÷ +30°С для экспонирования в течение 20÷40 мин для формирования ферментного биокатализатора в виде нековалентного полиэлектролитного комплекса с размером наночастиц 27±4 ÷ 30±5 нм.
Каталитическая константа действия такого ферментного биокатализатора по фосфорорганическим пестицидам Параоксону, Хлорпирифосу, Паратиону, Диазинону, Метилпаратиону, Кумафосу составляет соответственно 5010±60 с-1, 482±25 с-1, 1040±80 с-1, 85,6±5,1 с-1, 309±15 с-1, 335±15 с-1; константа Михаэлиса - 16,7±0,9 мкМ, 150±10 мкМ, 20,1±1,7 мкМ, 202±13 мкМ, 34,5±1,9 мкМ, 350±20 мкМ; константа эффективности действия - (3,0±0,2)×108 М-1с-1 (3,2±0,4)×106 MV, 5,2±0,8)×107 MV, (4,2±0,5)×105 MV1, (9,0±0,9)×106 MV, (9,6±1,0)×105 М-1с-1. Снижение активности данного биокатализатора, выдержанного при 55°С в течение 15 мин, составляет 2-5%. Полученный ферментный биокатализатор функционирует в диапазоне pH 7,0-12,0 и температур 15-60°С. Расчетный период полуинактивации биокатализатора при 37°С составляет как минимум 500 ч.
Описанный ферментный биокатализатор обладает рядом недостатков, а именно:
- биокатализатор представляет собой водный раствор ферментного комплекса с полимером, длительное хранение которого, а также транспортировка составляют большую проблему из-за того, что данный раствор занимает определенный объем, который не может быть уменьшен, кроме того, хранение и транспортировка ферментного биокатализатора требуют строгого соблюдения определенных условий (допустимая температура +4÷30°С), из-за чего биокатализатор длительно не хранится и используется в свежеприготовленном виде;
- ферментный биокатализатор приготовлен в виде раствора со строго определенной концентрацией комплекса фермента с полианионом, которая может быть изменена (увеличена) только за счет увеличения объема вводимого раствора и, соответственно, увеличения времени введения нужной дозы для детоксификации ФОС, что может иметь негативные последствия для организма;
- ферментный биокатализатор предполагает использование для его получения строго определенного полианиона, представляющего собой дорогостоящий блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты со строго определенной молекулярной массой и соотношением мономерных звеньев, производство которого ограничено;
- приготовление ферментного биокатализатора предполагает получение комплекса между ферментом и блок-сополимером при четком соблюдении соотношения между зарядами на поверхности молекулы белка и в составе полимера в диапазоне от 2:1 до 1:5, однако любое изменение pH растворов, используемых для приготовления такого комплекса, ведет к изменению числа и соотношения между зарядами, что сильно усложняет процесс приготовления такого биокатализатора с требуемыми характеристиками;
- отсутствие среди свойств этого ферментного биокатализатора возможности его использования для нейтрализации активных форм кислорода, синтезируемых в организме при метаболически запрограммированной окислительной детоксификации ФОС.
Данное техническое решение как наиболее близкое к заявляемому по своему назначению и способу получения, а именно по получению ферментного биокатализатора для детоксификации ФОС в виде наноразмерных частиц с органофосфатгидролазной активностью, представляющего собой нековалентный комплекс His6-OPH со стабилизатором, принято за прототип.
Задачей данного изобретения является разработка ферментного биокатализатора для детоксификации ФОС в виде наноразмерных частиц на основе His6-OPH, который, в отличие от прототипа, представляет собой лиофилизованный нековалентный комплекс фермента с антиоксидантом, обеспечивающим биокатализатор одновременно высокой органофосфатгидролазной и антиоксидантной активностью с повышенной стабильностью и длительным сроком хранения.
Поставленная задача решается тем, что ферментный биокатализатор для детоксификации фосфорорганических соединений с ферментативной и антиоксидантной активностью в виде наноразмерных частиц лиофилизованного нековалентного комплекса фермента, представляющего собой His6-OPH, или его полиэлектролитного комплекса, со стабилизатором, в качестве которого используют антиоксидант, получают в результате смешивания растворов указанных компонентов так, чтобы мольное соотношение составляло от 1:1 до 100:1 между антиоксидантом и ферментом или его полиэлектролитным комплексом, замораживания полученной смеси при температуре не выше минус 40°С и ее последующей лиофилизации до остаточной влажности 2-4%.
Применение антиоксиданта для получения нековалентного комплекса с ферментом His6-OPH позволяет:
- заменить, в сравнении с прототипом, сложно производимый и потому дорогостоящий блок-сополимер в нековалетном комплексе с ферментом на относительно низкомолекулярное соединение, которое может быть выделено из разных растительных источников, что существенно упрощает получение целевого ферментного биокатализатора и делает его применение значительно более экономически привлекательным;
- использовать при формировании ферментного биокатализатора легко рассчитываемых мольных соотношений между ферментом и антиоксидантом вместо зарядовых соотношений, установленных в прототипе между ферментом и блок-сополимером, что существенно упрощает сам процесс получения биокатализатора, так как молекулярная масса и мольные концентрации веществ, взятых для получения комплекса, не изменяются, в отличие от зарядов, при варьировании pH среды;
- использовать различные вещества, обладающих антиоксидантной активностью, например катехин, икариин, текторидин, текторигенин, 2-гидроксихалкон, 2'-гидроксихалкон, апигенин, мирицетрин при формировании ферментного биокатализатора в виде нековалентного комплекса между антиоксидантом и ферментом, при этом не исчерпывая список антиоксидантов указанными примерами;
- широко варьировать мольное соотношение между компонентами в составе ферментного биокатализатора, увеличивая или уменьшая по необходимости его ферментативную или антиоксидантную активность, что позволяет потенциально расширить возможный спектр применения такого ферментного биокатализатора для профилактических (с большей антиоксидативной активностью) и антидотных (с большей органофосфатгидролазной активностью) целей;
- получить возможность перехода к лиофилизованным формам ферментного биокатализатора с длительным сроком хранения, так как применение низкомолекулярных стабилизаторов для фермента в виде антиоксидантов не приводит, в отличие от полимерного стабилизатора в виде блок-сополимера, используемого в прототипе, к получению нерастворимых форм после высушивания нековалентных комплексов;
- получить возможность формирования нековалентных комплексов не только с нативным ферментом, но и с его полиэлектролитными комплексами, дополнительно стабилизируя фермент и придавая получаемому ферментному биокатализатору добавочную антиоксидантную активность;
- значительно стабилизировать и увеличивать срок хранения ферментного биокатализатора благодаря нековалентной стабилизации активной конформации фермента антиоксидантом за счет возникающих между ними межмолекулярных взаимодействий, но и обеспечить антиоксидантную защиту самого фермента от воздействия активных форм кислорода при его хранении и функционировании в зоне детоксификации ФОС;
- удерживать антиоксидант за счет формируемого нековалентного комплекса с ферментом в месте локализации проводимых процессов детоксификации ФОС с использованием ферментного биокатализатора.
Простое смешивание растворов фермента и антиоксиданта позволяет первоначально получить нековалентное межмолекулярное взаимодействие между этими веществами, а потом за счет глубокого снижения температуры полученной биокаталитической системы до температуры не выше минус 40°С дополнительно зафиксировать активную конформацию молекулы фермента без применения каких-либо сшивающих химических агентов, формирующих ковалентные связи между функциональными группами.
Температура замораживания образующегося нековалентного комплекса (не выше минус 40°С) крайне важна для последующего получения ферментного биокатализатора в результате лиофилизации, поскольку сублимационная сушка, которая при этом происходит, приводит к нагреву высушиваемого образца на 60-70°С от его исходной температуры. Таким образом, конечная температура получаемого ферментного биокатализатора при его лиофилизации не должна превышать 30°С, чтобы максимально сохранить его органофосфатгидролазную и антиоксидантную активности.
В результате замораживания полученной смеси водных растворов фермента и антиоксиданта при их строгом мольном соотношении происходит увеличение концентрации антиоксиданта в приповерхностном слое молекулы фермента за счет того, что растворитель (вода) превращается в лед (вымораживается), число дополнительных образующихся межмолекулярных связей увеличивается, система значительно стабилизируется, что выражается в увеличении стабильности сформированного нековалентного комплекса при использовании (на примере сред с таким наиболее токсичным для фермента органическим растворителем как изопропанол) и хранении.
Мольное соотношение, которое используют при получении ферментного биокатализатора, варьируется в диапазоне от 1:1 до 100:1 между антиоксидантом и ферментом или его полиэлектролитным комплексом и определяется тем, что уменьшение соотношения 1:1 приводит к снижению доли антиоксиданта в смеси и к тому, что часть фермента остается в нативном состоянии, то есть в состоянии, не стабилизированном антиоксидантом, что приводит к потере таким ферментом или его полиэлектролитным комплексом активности при его последующем последовательном замораживании и лиофилизации. Максимальное соотношение 100:1 между антиоксидантом и ферментом или его полиэлектролитным комплексом определяется, с одной стороны, водорастворимостью антиоксиданта, которую необходимо учитывать при приготовлении его раствора для приготовления ферментного биокатализатора, а с другой стороны, использование сверхизбыточного количества антиоксиданта по отношению к ферменту приводит к тому, что часть антиоксиданта остается не вступившей в образование комплекса с ферментом, и снижается удельная активность ферментного биокатализатора.
Лиофилизация нековалентного фермент-оксидантного комплекса до остаточной влажности 2-4% обусловлена тем, что сублимационная сушка до меньшей остаточной влажности приводит к частичной денатурации белка в составе получаемого ферментного биокатализатора и к потере им как ферментативной, так и антиоксидантной активности, а сохранение большего процента остаточной влаги нецелесообразно из-за сокращения срока хранения ферментного биокатализатора вследствие его постепенной инактивации.
Лиофилизация нековалентного фермент-оксидантного комплекса с целью получения конечного ферментного биокатализатора позволяет:
- получить и сохранить в течение длительного времени сформированный комплекс антиоксиданта с ферментом или его полиэлектролитным комплексом в сухом, стабильном и активном состоянии при комнатной температуре;
- получить возможность последующей регидратации сухой формы ферментного биокатализатора с потенциалом приготовления растворов с разной концентрацией, а, следовательно, и с разной активностью (ферментативной и антиоксидантной) для проведения детоксификации ФОС. При этом становится возможным варьирование вводимых доз ферментного биокатализатора без изменения, в отличие от прототипа, общего объема вводимого в организм раствора и без увеличения времени его введения.
В отличие от прототипа при использовании в качестве стабилизатора очищенного фермента такого низкомолекулярного, в сравнении с блок-сополимером, вещества как антиоксидант, происходит формирование ферментного биокатализатора в виде нековалентного комплекса с существенно меньшим размером наночастиц - от 10±2 до 20±4 нм, тогда как в прототипе 27±4 ÷ 30±5 нм, что должно способствовать повышению проникающей способности заявляемого ферментного биокатализатора in vivo и делать его мишени более доступными при детоксификации ФОС и взаимодействии с активными формами кислорода. При этом сохраняется возможность получения нековалентного комплекса антиоксиданта с ферментом, когда фермент уже включен в состав полиэлектролитного комплекса, приготовленного на основе His6-OPH и полианиона, согласно различным известным методам [Лягин И.В., Ефременко Е.Н., Кабанов А.В. (2014) Каталитические характеристки фермент-полиэлектролитных комплексов на основе гексагистидинсодержащей органофосфатгидролазы // Вестник Моск. ун-та Серия 2: Химия, Т. 55 (3), с. 167-173; Maslova O.V., Stepanov N.A., Grigoryeva A.I., Bruyako M.G., Efremenko E.N. (2016) New effective enzymatic biopreparations based on application of mineral carriers treated by low-temperature plasma for destruction of organophosphates in soil // Int. J. Pharm. Technol., 2016, Vol. 8 (4), p. 22679-22694; Efremenko E.N., Lyagin I.V., Klyachko N.L., Bronich Т., Zavialova N.V., Yuhang Jiang, Kabanov A.V. (2017) A simple and highly effective catalytic nanozyme scavenger for organophosphorous neurotoxins. // J. Control. Release, V. 247, p. 175-181].
Такое сочетание основных компонентов ферментного биокатализатора с антиоксидантными свойствами для детоксификации ФОС, которое указано в заявляемом техническом решении, при заявляемых соотношениях антиоксиданта и фермента или его полиэлектролитного комплекса, эффективное взаимодействие между которыми в результате смешивания их водных растворов, приводящее к формированию нековалентных наноразмерных частиц с их последующим замораживанием и лиофилизацией, ранее известно не было и позволяет характеризовать предлагаемое техническое решение как новое.
Ниже приводятся конкретные примеры реализации заявляемого технического решения.
Пример 1. Ферментный биокатализатор, с антиоксидантной активностью для детоксификации фосфорорганических соединений, полученный при мольном соотношении 1:1 между антиоксидантом апигенином и ферментом His6-OPH
В водный раствор 5 мг/л апигенина (Mw=270,2 г/моль) вносят аликвоту 1 г/л раствора очищенного фермента His6-OPH [Efremenko Е., Lyagin I., Votchitseva Y., Sirotkina M., Varfolomeyev S. Polyhistidine-containing organophosphorus hydrolase with outstanding properties. // Biocat. Biotransform., 2007, V. 25 (1), p. 103-108] (Mw=36 кДа), приготовленного на основе 100 мМ карбонатного буфера (pH 10,5), так, чтобы мольное соотношение между антиоксидантом и ферментом составило 1:1. Приготовленную смесь перемешивают, помещают в сублиматор лиофильной установки и проводят замораживание препарата при температуре -40°С, а далее проводят лиофилизацию образца при остаточном давлении в камере сублиматора, не превышающем 10 Па, до остаточной влажности 2%.
Полученный образец при его регидратации до его исходного объема, который был перед лиофилизацией, представляет собой гомогенный раствор, содержащий частицы комплекса фермента с антиоксидантом, которые имеют размер 10±2 нм. Полученный ферментный биокатализатор проявляет органофосфатгидролазную активность в диапазоне температур 10-65°С при pH 6,5-12,5.
При гидролизе такого фосфорорганического пестицида как Параоксон полученный ферментный биокатализатор имеет каталитическую константу 5120±30 с-1; константу Михаэлиса - 16,5±0,6 мкМ и константу эффективности действия - (3,1±0,3)×108 М-1с-1. Антиоксидантная активность полученного ферментного биокатализатора при ее определении с применением стабильных радикалов + (АБТС) по стандартной методике [Seyoum A., Asres K., El-Fiky F.K. (2006) Structure-radical scavenging activity relationships of flavonoids. // Phytochemistry, V. 67, p. 2058-2070] составляет IC50=1,21±0,10 мкг/мл, что превышает эффективность действия контрольного антиоксиданта витамина С, испытанного в аналогичных условиях (IC50=7,48±0,52 мкг/мл), в 6,2 раза.
Полученный ферментный биокатализатор сохраняет 50% ферментативной активности после его экспонирования в течение 20 мин в среде с 5 об. % изопропанола, тогда как нативный фермент His6-OPH в аналогичных условиях теряет полностью свою активность через 3 мин.
Полученный лиофилизованный образец ферментного биокатализатора при его хранении в герметичных условиях при комнатной температуре сохраняет свои каталитические и антиоксидантные свойства на 95% в течение 300 сут.
Пример 2. Ферментный биокатализатор, с антиоксидантной активностью для детоксификации фосфорорганических соединений, полученный при мольном соотношении 10:1 между антиоксидантом катехином и ферментом His6-OPH
В водный раствор 0,05 г/л катехина (Mw=290 г/моль) вносят аликвоту 1 г/л раствора очищенного фермента His6-OPH, приготовленного на основе 50 мМ карбонатного буфера (pH 10,0), так, чтобы мольное соотношение между антиоксидантом и ферментом составило 10:1. Приготовленную смесь перемешивают, помещают в сублиматор лиофильной установки и проводят замораживание препарата при температуре -70°С, а далее проводят лиофилизацию образца при остаточном давлении в камере сублиматора, не превышающем 10 Па, до остаточной влажности 4%.
Полученный образец при его регидратации до его исходного объема, который был перед лиофилизацией, представляет собой гомогенный раствор, содержащий частицы комплекса фермента с антиоксидантом, которые имеют размер 12±3 нм. Полученный ферментный биокатализатор проявляет органофосфатгидролазную активность в диапазоне температур 10-65°С при pH 6,5-12,5. В реакции гидролиза такого фосфорорганического пестицида как Паратион полученный ферментный биокатализатор имеет каталитическую константу - 1150±50 с-1; константу Михаэлиса - 20,1±1,1 мкМ и константу эффективности действия - (5,7±0,5)×107 М-1с-1. Антиоксидантная активность полученного ферментного биокатализатора при ее определении с применением стабильных радикалов (АБТС) по стандартной методике составляет IC50=1,44±0,04 мкг/мл, что превышает эффективность действия контрольного антиоксиданта витамина С, испытанного в аналогичных условиях, в 5,2 раза. Полученный ферментный биокатализатор сохраняет 55% ферментативной активности после его экспонирования в течение 20 мин в среде с 5 об. % изопропанола.
Полученный лиофилизованный образец ферментного биокатализатора при его хранении в герметичных условиях при комнатной температуре сохраняет свои каталитические и антиоксидантные свойства на 95% в течение 320 сут.
Пример 3. Ферментный биокатализатор, с антиоксидантной активностью для детоксификации фосфорорганических соединений, полученный при мольном соотношении 100:1 между антиоксидантом икариином и ферментом His6-OPH
В водный раствор 0,1 г/л икариина (Mw=676 г/моль) вносят аликвоту 1 г/л раствора очищенного фермента His6-OPH, приготовленного на основе 100 мМ карбонатно-фосфатного буфера (pH 8,5), так, чтобы мольное соотношение между антиоксидантом и ферментом составило 100:1. Приготовленную смесь перемешивают, помещают в сублиматор лиофильной установки и проводят замораживание препарата при температуре -50°С, а далее проводят лиофилизацию образца при остаточном давлении в камере сублиматора, не превышающем 10 Па, до остаточной влажности 4%.
Полученный образец при его регидратации до его исходного объема представляет собой гомогенный раствор, содержащий частицы комплекса фермента с антиоксидантом, которые имеют размер 20±4 нм.
В реакции гидролиза фосфорорганического пестицида Диазинон полученный ферментный биокатализатор имеет каталитическую константу - 98,0±3,5 с-1; константу Михаэлиса - 210±7 мкМ и константу эффективности действия - (4,7±0,5)×105 M-1с-1. Антиоксидантная активность полученного ферментного биокатализатора при ее определении с применением стабильных радикалов (АБТС) по стандартной методике составляет IC50=6,71±0,01 мкг/мл, что превышает эффективность действия контрольного антиоксиданта витамина С, испытанного в аналогичных условиях в 1,2 раза.
Полученный ферментный биокатализатор сохраняет 59% ферментативной активности после его экспонирования в течение 20 мин в среде с 5 об. % изопропанола. Полученный лиофилизованный образец ферментного биокатализатора при его хранении в герметичных условиях при комнатной температуре сохраняет свои каталитические и антиоксидантные свойства на 95% в течение 350 сут.
Пример 4. Ферментный биокатализатор, с антиоксидантной активностью для детоксификации фосфорорганических соединений, полученный при мольном соотношении 10:1 между антиоксидантом 2-гидроксихалконом и ферментом His6-OPH, находящемся в составе полиэлектролитного комплекса
В водный раствор 0,05 г/л 2-гидроксихалкона (Mw=224 г/моль) вносят аликвоту 2 г/л раствора нековалентного комплекса фермента His6-OPH и блок-сополимера ПЭГ119-ПГК50 (Mw=13 кг/моль), полученного как описано в примере 1 прототипа при зарядовом соотношении фермента и блок-сополимера 2:1 [Патент РФ 2525658 (2014), МПК7 C12N 11/02, C12N 11/08, C12N 9/16. Наноразмерный ферментный биокатализатор для детоксификации фосфорорганических соединений in vivo], приготовленного на основе 100 мМ карбонатного буфера (pH 10,5), так, чтобы мольное соотношение между антиоксидантом и ферментом составило 1:1. Приготовленную смесь перемешивают, помещают в сублиматор лиофильной установки и проводят замораживание препарата при температуре -70°С, а далее проводят лиофилизацию образца до остаточной влажности 3%.
Полученный образец при его регидратации до его исходного объема, который был перед лиофилизацией, представляет собой гомогенный раствор, содержащий частицы комплекса фермента с антиоксидантом, которые имеют размер 29±2 нм.
Полученный ферментный биокатализатор проявляет органофосфатгидролазную активность в диапазоне температур 15-65°С при pH 7,0-12,5. При гидролизе такого фосфорорганического пестицида как Хлорпирифос полученный ферментный биокатализатор имеет каталитическую константу 510±20 с-1; константу Михаэлиса 145±12 мкМ и константу эффективности действия - (3,5±0,2)×106 М-1с-1. Антиоксидантная активность полученного ферментного биокатализатора при ее определении с применением стабильных радикалов (АБТС) по стандартной методике составляет IC50=5,28±0,32 мкг/мл, что превышает эффективность действия контрольного антиоксиданта витамина С, испытанного в аналогичных условиях в 1,4 раза.
Полученный ферментный биокатализатор сохраняет 35% ферментативной активности после его экспонирования в течение 20 мин в среде с 5 об. % изопропанола.
Полученный лиофилизованный образец ферментного биокатализатора при его хранении в герметичных условиях при комнатной температуре сохраняет свои каталитические и антиоксидантные свойства на 90% в течение 420 сут.
Пример 5. Ферментный биокатализатор, с антиоксидантной активностью для детоксификации фосфорорганических соединений, полученный при мольном соотношении 50:1 между антиоксидантом 2'-гидроксихалконом и ферментом His6-OPH, находящемся в составе полиэлектролитного комплекса
В водный раствор 0,1 г/л 2'-гидроксихалкона (Mw=224 г/моль) вносят аликвоту 5 г/л раствора нековалентного комплекса фермента His6-OPH и поли-L-глутаминовой кислоты (Mw=7,5 кг/моль), полученного по известному способу [Maslova O.V., Stepanov N.A., Grigoryeva A.I., Bruyako M.G., Efremenko E.N. (2016) New effective enzymatic biopreparations based on application of mineral carriers treated by low-temperature plasma for destruction of organophosphates in soil // Int. J. Pharm. Technol., 2016, Vol. 8 (4), p. 22679-22694] при зарядовом соотношении фермента и полимера 1:5, так, чтобы мольное соотношение между антиоксидантом и ферментом составило 1:1. Приготовленную смесь перемешивают, помещают в сублиматор лиофильной установки и проводят замораживание препарата при температуре -40°С, а далее проводят лиофилизацию образца до остаточной влажности 4%.
Полученный образец при его регидратации до его исходного объема, который был перед лиофилизацией, представляет собой гомогенный раствор, содержащий частицы комплекса фермента с антиоксидантом, которые имеют размер 36±6 нм.
Полученный ферментный биокатализатор при гидролизе такого фосфорорганического пестицида как Метилпаратион имеет каталитическую константу 360±24 с-1; константу Михаэлиса - 36±6 мкМ и константу эффективности действия - (10,0±0,4)×106 М-1с-1. Антиоксидантная активность полученного ферментного биокатализатора при ее определении с применением стабильных радикалов (АБТС) по стандартной методике составляет IC50=4,10±0,34 мкг/мл, что превышает эффективность действия контрольного антиоксиданта витамина С, испытанного в аналогичных условиях, в 1,8 раза.
Полученный ферментный биокатализатор сохраняет 40% ферментативной активности после его экспонирования в течение 20 мин в среде с 5 об. % изопропанола.
Полученный лиофилизованный образец ферментного биокатализатора при его хранении в герметичных условиях при комнатной температуре сохраняет свои каталитические и антиоксидантные свойства на 90% в течение 380 сут.
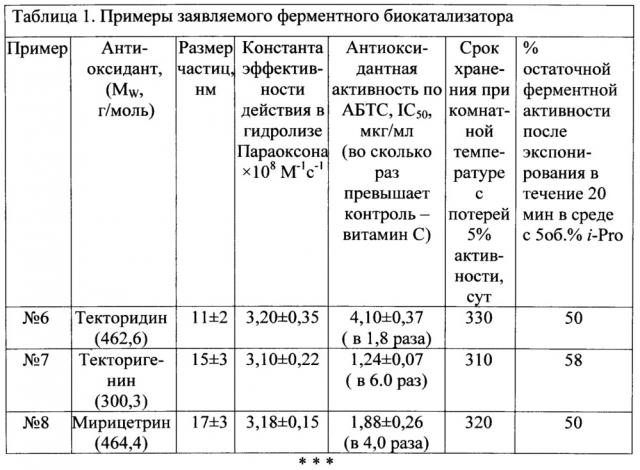
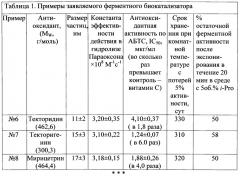
Далее для более полного раскрытия сути изобретения в таблице 1 приводятся дополнительные примеры ферментного биокатализатора, полученного в тех же условиях и при том же мольном соотношении антиоксиданта и фермента, как описано в примере 1, только вместо апигинина используют другие антиоксиданты.
Таким образом, данное техническое решение позволяет, в сравнении с прототипом, получить возможность формирования наноразмерных нековалентных комплексов не только с нативным ферментом, но и с его полиэлектролитными комплексами, дополнительно при этом существенно стабилизируя фермент, значительно увеличивая срок его хранения и придавая получаемому ферментному биокатализатору добавочную антиоксидантную активность, что позволяет использовать такой биокатализатор одновременно для детоксификации фосфорорганических соединений и нейтрализации активных форм кислорода.
Ферментный биокатализатор для детоксификации фосфорорганических соединений в виде наноразмерных частиц нековалентного комплекса фермента, представляющего собой гексагистидин-содержащий полипептид со свойствами органофосфатгидролазы, со стабилизатором, отличающийся тем, что представляет собой лиофилизованный нековалентный комплекс между гексагистидин-содержащим полипептидом со свойствами органофосфатгидролазы и антиоксидантом, выбранным из флавоноидов: апигенина, икариина, катехина, мирицетрина, текторигенина, текторидина, или халконоидов: 2-гидроксихалкона, 2'-гидроксихалкона, проявляющий одновременно ферментативную и антиоксидантную активность и получающийся в результате смешивания растворов указанных компонентов так, чтобы мольное соотношение составляло от 1:1 до 100:1 между антиоксидантом и ферментом или фермент-полиэлектролитным комплексом на основе поли-L-глутаминовой кислоты или ее блок-сополимера с полиэтиленгликолем, замораживания полученной смеси при температуре не выше минус 40°С и ее последующей лиофилизации до остаточной влажности 2-4%.